Introducción
En los hospitales de atención agudos de EE. UU., el 3.2 % de los pacientes desarrollan una o más infecciones asociadas a la atención médica (HAI), lo que provoca un aumento de la morbilidad, la mortalidad, la duración de la hospitalización y los costos de la atención médica.1 Las Catheter-related bloodstream infections, CRBSI (infecciones del torrente sanguíneo relacionadas con catéteres, CRBSI) son la etiología más frecuente de las HAI y pueden ocurrir con catéteres intravasculares centrales y periféricos.1 Cada año en EE. UU., hay cerca de 250,000 CRBSI de catéteres intravasculares de corto y largo plazo que resultan en una morbilidad significativa, incluyendo sepsis, otras complicaciones y mortalidad.1 En 2014, los hospitales de atención aguda de EE. UU. tuvieron más de 31,000 pacientes con central-line-associated bloodstream infections, CLABSI (infecciones del torrente sanguíneo asociadas a la vía central, CLABSI), con un costo anual calculado de $600 a $2700 millones y una tasa de mortalidad del 12 % al 25 %.1 Las tasas de CLABSI oscilaron por lo general entre 1.1 y 2.5/1000 días de catéter, y cada CLABSI aumenta de media la estancia hospitalaria en 10.4 días y añade más de $45,000 en costos.1 En una revisión de las CLABSI de peripheral intravenous catheter, PIVC (catéteres intravenosos periféricos, PIVC) a corto plazo entre 1980 y 2106, la incidencia de la infección (no informada por 1000 días-catéter) fue de 1.8 infecciones/1000 catéteres. La tasa de CRBSI de catéteres arteriales en un estudio de 2014 fue de 1.26/1000 días-catéter, con un riesgo de CRBSI para el sitio de función femoral 1.9 veces mayor que el del sitio de punción radial.1 La contaminación microbiana de los catéteres intravasculares puede producirse a partir de 1) una ruta extraluminal que implica la migración distal desde el sitio de inserción o 2) la contaminación intraluminal, que puede producirse cuando se accede y se usan estos catéteres, con fuentes menos frecuentes de propagación hematógena o sistemas de infución contaminados.
La canalización de accesos vasculares es rutinaria en anestesia y otros cuidados a los pacientes, pero ¿están los profesionales médicos usando métodos óptimos para reducir el riesgo de las HAI relacionadas con el acceso a los catéteres vasculares? Si no se usan el lavado de manos y la técnica aséptica cuando se canalizan accesos vasculares, puede producirse una contaminación intraluminal de los puertos de inyección (por ejemplo, las open lumen stopcocks, [DNCCs] [llaves de paso de lumen abierto, OLS] y los disinfectable needleless closed connectors, [OLSs] [conectores cerrados sin aguja desinfectables, DNCC]) con patógenos microbianos que pueden dar lugar a CRBSI y otras HAI.1-3 Por desgracia, se informaron de bajas tasas de cumplimiento de la higiene de manos por parte de los profesionales en anestesia, que oscilan entre el 2.9 % y el 18 %.1,4 Las jeringas y las infusiones pueden contaminarse durante la preparación de la medicación y el uso clínico, con la consiguiente inyección del contenido contaminado en el torrente sanguíneo, y también pueden contaminarse los puertos de acceso.1,2,5-7 La Fundación para la Seguridad del Paciente en Anestesia, la Asociación de Profesionales en Control de Infecciones y Epidemiología y el Instituto para la Seguridad en la Medicación recomiendan un mayor uso de jeringas e infusiones preparadas por el fabricante o la farmacia para disminuir la contaminación y los errores de medicamentos durante la preparación y la administración de estos.1,2,5,6 Los Centros para el Control y la Prevención de Enfermedades también ofrecen recomendaciones para las Prácticas Seguras de Inyección.7 En este artículo se comparan y contrastan los riesgos de contaminación e infección relacionados con el uso de las OLS frente a los DNCC, y se analizan las recomendaciones, así como las cuestiones no resueltas relativas a la desinfección de los DNCC.
Riesgos de contaminación e infección de las OLS y los DNCC desinfectados
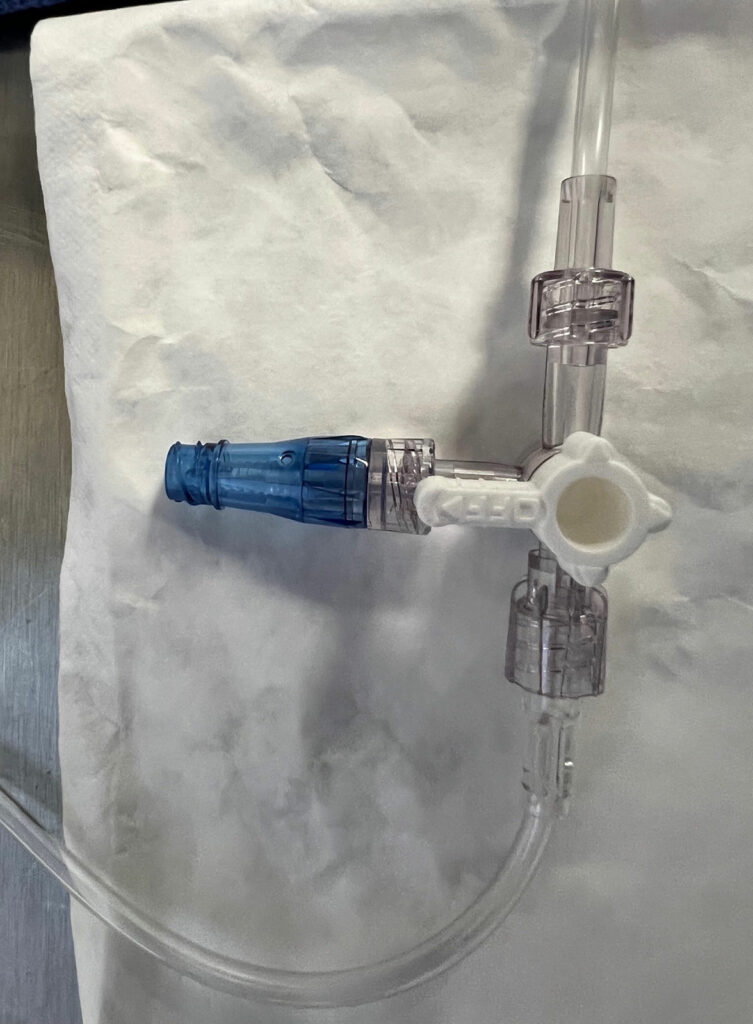
Las OLS se usan de forma habitual en la práctica de la anestesia; sin embargo, la contaminación de las superficies intraluminales puede producirse hasta en un 32 % a 38 % de los casos de anestesia8,9 Ni una almohadilla de isopropyl alcohol, IPA (alcohol isopropílico, IPA) al 70 %, ni un dispositivo de lavado de puertos desinfectan de forma eficaz una OLS.3,10 Una OLS es propensa a la contaminación debido a su diseño con una tapa extraíble que expone las superficies intraluminales (Figura 1). Mientras que más del 50 % de los DNCC se contaminan con bacterias en sus superficies de inyección antes de una desinfección adecuada,11,12 la superficie de inyección de un DNCC puede desinfectarse con un alto nivel de eficacia frotando con una almohadilla desinfectante que contenga alcohol o usando un tapón de IPA (Figura 2). 1,3,11-17 En una reciente revisión crítica de los puertos de inyección, en 8 de 10 estudios se presentaron tasas significativamente menores de contaminación intraluminal con los DNCC desinfectados en comparación con las OLS, y 2 de 7 estudios tuvieron tasas significativamente menores de CLABSI o CRBSI con los DNCC desinfectados en comparación con las OLS (en algunos estudios se evaluaron tanto las tasas de contaminación como las tasas de infección, mientras que otros estudios evaluaron sólo un único resultado: las tasas de contaminación o las tasas de infección). 1 Cuando se examinó el subgrupo de estos estudios en el que se desinfectaron tanto las OLS como los DNCC antes del acceso, en 7 de 9 estudios se encontraron tasas significativamente menores de contaminación intraluminal con los DNCC en comparación con las OLS, y en 1 de 4 estudios se tuvo una tasa significativamente menor de CLABSI con los DNCC.1 Ningún estudio encontró que las OLS fueran beneficiosas en comparación con los DNCC desinfectados (véase la tabla 1).1
Tabla 1: Comparación de los conectores cerrados sin aguja desinfectables (DNCC) con las llaves de paso de lumen abierto (OLS)
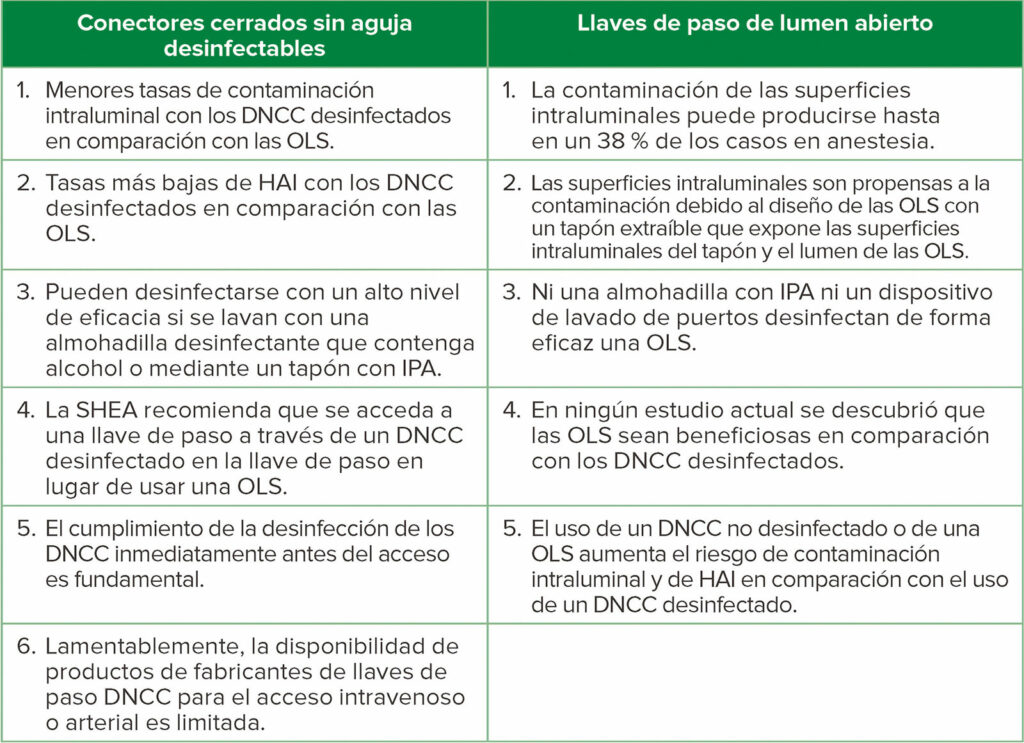
Abreviaturas: Llave de paso DNCC, llave de paso con un DNCC adherido (preferiblemente pegado) al lumen de inyección; HAI, infecciones asociadas a la atención sanitaria; IPA, alcohol isopropílico al 70 %; SHEA, la Sociedad Epidemiológica de Salud de los Estados Unidos.
Inyección microbiana y biopelícula
La falta de desinfección de los DNCC antes del acceso, o la contaminación de las OLS durante el uso clínico, puede conducir a la contaminación intraluminal1,15, lo que da lugar a la formación de biopelículas (microorganismos incrustados en una matriz de glicocálix extracelular) en las superficies del catéter que ocasiona un mayor riesgo de HAI.18,19
Incluso una sola omisión de la desinfección del DNCC antes del acceso puede dar lugar a la formación de una biopelícula.19 Lamentablemente, el cumplimiento de la desinfección del DNCC (incluyendo la higiene de las manos y la técnica aséptica) ha sido un reto para los profesionales sanitarios.1,15,20 Aunque la bibliografía actual no explica del todo los mecanismos de defensa de la biopelícula contra los agentes antimicrobianos, los exopolisacáridos impiden que los antibióticos penetren en la matriz de la biopelícula para llegar a las bacterias que la componen.21
La biopelícula también puede ser resistente al sistema inmunitario del huésped.22,23 Así pues, la biopelícula puede ser una fuente de bacteriemia e infecciones crónicas.21-23 Mientras que en los estudios in-vitro se sugiere que los leucocitos son capaces de penetrar de forma eficaz en las biopelículas, los estudios en animales indican que la formación de biopelículas da lugar a una “evasión” de la respuesta inmunitaria del huésped desde una “respuesta proinflamatoria y bactericida” hacia una “respuesta antiinflamatoria y profibrótica”.22 La formación de biopelículas en las superficies de los catéteres y otros dispositivos médicos implantados protege así a las bacterias, lo que fomenta la persistencia de la infección.22
Un mecanismo adicional de inyección microbiana puede explicar la asociación de la contaminación de las OLS y los DNCC con el subsiguiente aumento del riesgo de HAI.1,14 La inyección microbiana directa involuntaria en el torrente sanguíneo puede producirse durante el acceso vascular a través de una OLS contaminada o la falta de desinfección de una superficie de inyección de DNCC antes de la inyección. La inyección microbiana directa inadvertida también puede producirse si se usa una jeringa o un sistema de infusión contaminados.1,2,5-7 En un ensayo aleatorizado (randomized control trial, RCT)ex-vivo, que se hizo durante la anestesia clínica concurrente, entraron en el circuito de prueba aproximadamente 10,000 unidades formadoras de colonias de bacterias por inyección cuando los DNCC o las OLS no se desinfectaron antes del acceso.14 En este estudio, la incidencia de inyecciones bacterianas inadvertidas fue significativamente menor cuando se usaron llaves de paso DNCC desinfectadas (alcohol al 70 % [method unspecified] con 30 segundos de secado) en comparación con las OLS o las llaves de paso DNCC sin desinfectar.14
Recomendaciones recientes de la Sociedad Epidemiológica de Salud de los Estados Unidos.
La Sociedad Epidemiológica de Salud de los Estados Unidos (Society for Healthcare Epidemiology of America, SHEA) publicó recientemente unas directrices para la prevención de infecciones en el entorno de trabajo en anestesia.15 La SHEA recomienda usar DNCC desinfectados en llaves de paso para inyectar medicamentos como la opción preferida para uso clínico después de usar las OLS.24,25 La SHEA también señaló que “las llaves de paso de los transductores de presión se abren periódicamente al aire para calibrar el transductor” y que “estas llaves de paso pueden cubrirse razonablemente con tapones estériles en lugar de con puertos de inyección sin aguja” (DNCC), pero no comentó ningún método para mantener la esterilidad intraluminal cuando el transductor se abre al aire.25 Es importante que las llaves de paso usadas para poner a cero los transductores de presión mantengan la esterilidad intraluminal. Aunque algunos transductores incluyen un tapón con un “pequeño” orificio (mucho más pequeño que el lumen) que puede eliminar la necesidad de quitar el tapón durante la puesta a cero, se desconoce si se mantiene la esterilidad intraluminal ya que este “pequeño” lumen está continuamente abierto al entorno. Además, si este tapón no está unido a la llave de paso, el proveedor podría eludir cualquier ventaja potencial del diseño de este tapón quitando el tapón durante la puesta a cero, exponiendo así completamente las superficies intraluminales a la posible contaminación ambiental. Una opción alternativa puede ser una llave de paso con un filtro bacteriano adherido a la luz de puesta a cero.
Canalización con catéteres vasculares a través de DNCC desinfectados
La bibliografía actual respalda que el uso de los DNCC desinfectados en lugar de las OLS, basándose en las siguientes premisas: una menor contaminación general documentada y menores riesgos de infección de los DNCC desinfectados en comparación con las OLS, como se comentó arriba (Tabla 1), y las recientes recomendaciones de la SHEA de que «las llaves de paso usadas para la inyección de fármacos deberían cerrarse idealmente con puertos de inyección sin aguja».25 Para reducir el riesgo de infección del paciente, se debería acceder a los catéteres vasculares utilizados para la administración de medicamentos o fluidos, o para la extracción de sangre, de forma rutinaria a través de DNCC desinfectados (p. ej., en conjuntos de tubos intravenosos [IV]) o a través de llaves de paso de DNCC desinfectados. El cumplimiento de la desinfección es esencial. Para las llaves de paso DNCC, el DNCC debe estar preferiblemente unido al lumen de inyección de la llave de paso para eliminar pérdidas y eludir el DNCC.1 Aunque las recientes recomendaciones de la SHEA25 no tratan específicamente el uso de DNCC para obtener muestras de sangre de los sistemas arteriales, en los estudios actuales1 se respalda que las muestras de sangre extraídas de estos sistemas se obtengan mediante llaves de paso DNCC desinfectadas en lugar de las OLS. La única aplicación clínica en la que las OLS no tendrían un mayor riesgo de contaminación o infección en comparación con los DNCC desinfectados sería cuando las OLS están restringidos al uso en procedimientos desarrollados en condiciones estériles.1
Disponibilidad limitada de los fabricantes de llaves de paso DNCC
En la actualidad, los conjuntos de tubos de transductores IV y arteriales no suelen venir con llaves de paso DNCC.1 Los fabricantes deberían suministrar conjuntos de tubos de transductores IV y arteriales con llaves de paso DNCC en lugar de las OLS, y debería haber llaves de paso DNCC disponibles individualmente. Hay varias razones por las que las llaves de paso DNCC no se incluyen de forma rutinaria en los sistemas, que incluyen la falta de concienciación de los médicos y los fabricantes sobre la superioridad de las llaves DNCC, la inercia a la hora de cambiar los patrones de práctica existentes y el aumento del costo. No obstante, la necesidad de mejorar la seguridad mediante la adopción de las llaves DNCC es inevitable y el aumento del costo no debería ser un obstáculo. Por ejemplo, los dispositivos de seguridad para la prevención de heridas punzantes cuestan más que las que no lo son, pero ahora se usan como requisitos de seguridad estándar.1,26
Método de desinfección y tipo de desinfectante
El tipo de desinfectante y el método de desinfección usados en los DNCC son factores críticos para maximizar la eficacia del desinfectante y reducir las HAI no deseadas.1,27 Las variaciones en los resultados de varios estudios in-vitro y clínicos elegidos ponen de manifiesto las dificultades para determinar las recomendaciones de desinfección definitivas (Tabla 2). No es de extrañar que los expertos no lleguen a un consenso sobre el desinfectante recomendado, el método de desinfección (p. ej., lavar frente a “limpiar”), la duración de la desinfección y el tiempo de secado, y la conveniencia de usar tapones con IPA (ver Tabla 3).1 La SHEA recomienda que los DNCC se desinfecten de forma inmediata antes de cada acceso o antes de una serie rápida de inyecciones, como durante la inducción anestésica, ya sea lavando (no se especificó la duración) con una almohadilla desinfectante que contenga alcohol (p. ej., IPA o gluconato de clorhexidina [chlorhexidine gluconate, [CHG]/IPA), o usando adecuadamente un tapón con IPA.1,15 En numerosas directrices1 se recomienda el lavado con un desinfectante que contenga alcohol; sin embargo, las duraciones de lavado recomendadas varían de ≥5 a ≥15 segundos (Tabla 3).31-33 Dado que el cumplimiento de las duraciones de lavado más largas es bajo,15 la investigación adicional debe identificar la duración de lavado mínimamente eficaz.1 Además, se necesitan ensayos aleatorios para comparar los distintos métodos y desinfectantes usados, ya que las técnicas de desinfección de los DNCC que no son óptimas pueden aumentar el riesgo de HAI. Para complicar aún más la cuestión, el riesgo de infección de los DNCC desinfectados también puede estar relacionado con una variedad de topografías de la superficie de inyección y otras características de diseño que hay en diversos DNCC, que pueden influir en la eficacia de la desinfección.12,13,27,35
Tabla 2: a,bElegidos 1) Estudios In-Vitro de desinfección de superficies contaminadas de DNCC, y 2) Estudios clínicos de desinfección de DNCC
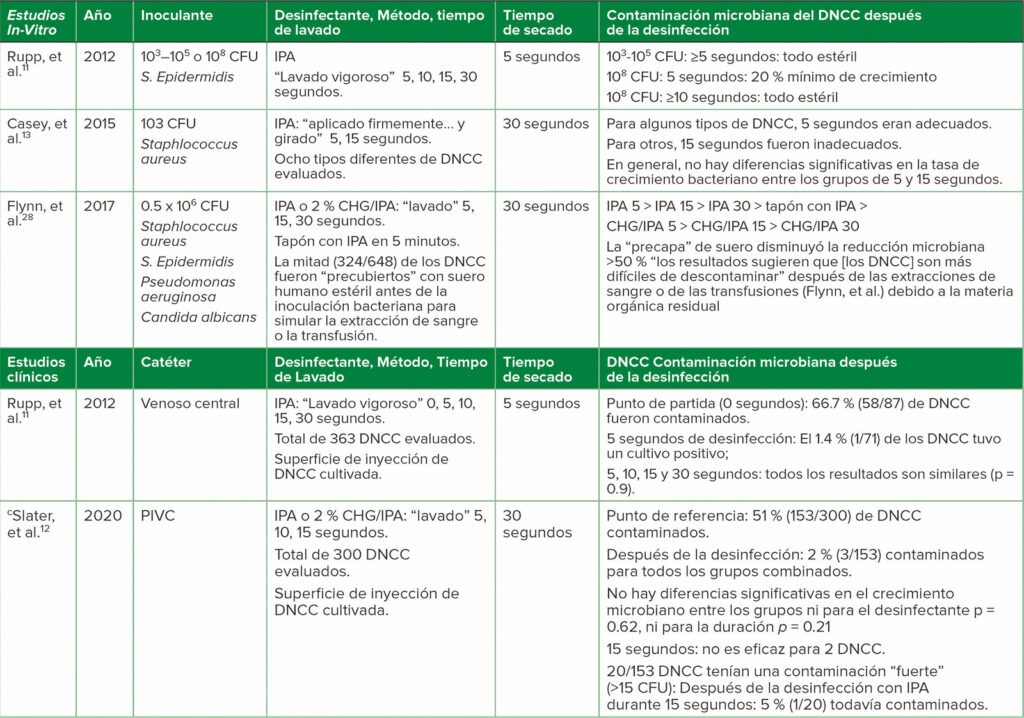 Abreviaturas: CFU, unidades formadoras de colonias de bacterias/mL de inoculante; CHG, gluconato de clorhexidina; DNCC, conectores cerrados sin aguja desinfectable; IPA, alcohol isopropílico al 70 %; PIVC, catéter intravenoso periférico.
Abreviaturas: CFU, unidades formadoras de colonias de bacterias/mL de inoculante; CHG, gluconato de clorhexidina; DNCC, conectores cerrados sin aguja desinfectable; IPA, alcohol isopropílico al 70 %; PIVC, catéter intravenoso periférico.
a Para estudios adicionales, ver la referencia Greene.1
b Los artículos entre comillas son la terminología que se usa en cada referencia.
c Primer RCT clínico de desinfección de PIVC DNCC.
Tabla 3: a,bRecomendaciones para la desinfección del DNCC de ciertas organizaciones nacionales e internacionales
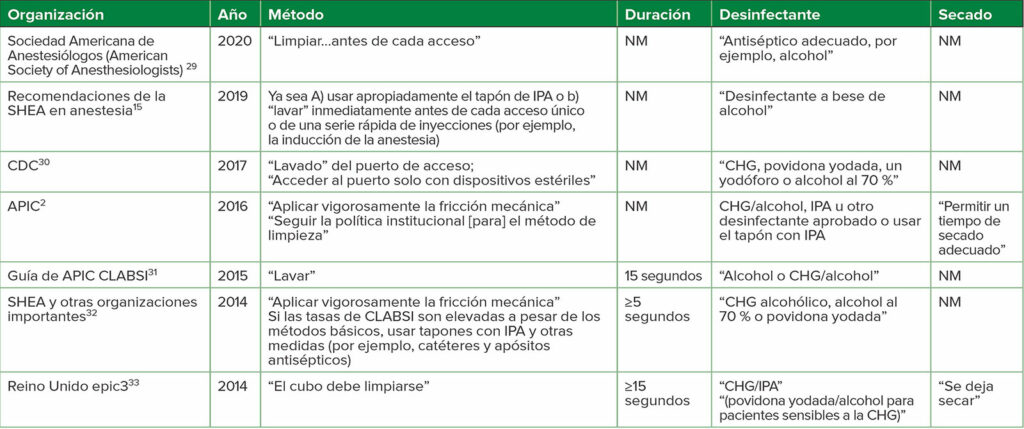 Abreviaturas: APIC, Asociación de Profesionales en Control de Infecciones y Epidemiología; CDC, Centros para el Control y la Prevención de Enfermedades de Estados Unidos; CHG, gluconato de clorhexidina; CLABSI, infección del torrente sanguíneo asociada a la vía central; IPA, alcohol isopropílico al 70 %; NM, no mencionado en la recomendación; SHEA, Sociedad Epidemiológica de Salud de los Estados Unidos
Abreviaturas: APIC, Asociación de Profesionales en Control de Infecciones y Epidemiología; CDC, Centros para el Control y la Prevención de Enfermedades de Estados Unidos; CHG, gluconato de clorhexidina; CLABSI, infección del torrente sanguíneo asociada a la vía central; IPA, alcohol isopropílico al 70 %; NM, no mencionado en la recomendación; SHEA, Sociedad Epidemiológica de Salud de los Estados Unidos
a Para más directrices, ver las referencias Greene1 Hallam34
b Los artículos entre comillas son la terminología que se usa en cada referencia; es decir, no todos indicaron “lavado” como el método usado
Tiempo de secado del desinfectante
En un estudio reciente se sugirió que el desinfectante usado en los DNCC debe secarse antes del acceso para reducir la carga microbiana y su potencial para entrar en el torrente sanguíneo.36 Los tiempos de secado del desinfectante varían después de lavar los DNCC: El IPA se seca en 5 segundos y la CHG/IPA se seca en 20 segundos, pero la povidona yodada no se seca hasta después de 6 minutos.36 Sin embargo, solo en unas pocas directrices nacionales e internacionales se menciona la necesidad de secar el desinfectante (Tabla 3).1 Lamentablemente, solo en algunos estudios clínicos e in vitro se indica el tiempo de secado después de la desinfección de los DNCC, y ninguno comparó el efecto de diferentes tiempos de secado, o de ningún tiempo de secado, sobre la eficacia de la desinfección.1 De los 21 estudios que evalúan la desinfección con DNCC evaluados en una reciente revisión crítica, en un estudio se especificó un tiempo de secado de 5 segundos, en 10 estudios se usó un secado de ≥30 segundos y en 10 estudios no se especificó si se usó el secado o no.1 Es necesario que otros ensayos traten el tiempo de secado óptimo en el entorno perioperatorio para que los profesionales tengan claro cómo reducir el riesgo de infección.
¿Es peligroso inyectar desinfectante en un DNCC?
Un estudio reciente recomendó que el DNCC se secara antes del acceso para evitar la inyección de desinfectante.36 Una pregunta sin respuesta es si la inyección de algún desinfectante en un DNCC es peligrosa. Esto es muy preocupante, ya que el IPA se metaboliza sobre todo en acetona, que es tóxica.16,37,38 En dos estudios in-vitro se compararon los DNCC lavados con IPA seguido de 15 segundos de secado37 o con CHG/etanol con 30 segundos de secado,38 seguidos de inyecciones salinas. En estos estudios se sugirió que los niveles de alcohol en los fluidos del circuito de prueba eran indetectables37 o “bajos”38 (el máximo de µg por inyección in-vitro era <8 % de lo que produciría el umbral de concentración sanguínea tóxica calculado en los neonatos, definido como superior a 0.25 mg/mL). Los estudios sobre la posible inyección intravenosa de alcohol o CHG a través de los DNCC antes del secado del desinfectante son limitados en la literatura actual y, por lo tanto, se necesitan más estudios.
Tapones con IPA
Varias recomendaciones nacionales e internacionales incluyen la opción de usar tapones con IPA en los DNCC, ya que dan una desinfección pasiva, eliminan el lavado manual (después de un tiempo mínimo de contacto), dan un indicador visible de la desinfección y una barrera contra la contaminación, y pueden aumentar el cumplimiento de la desinfección en comparación con la desinfección manual.1,15,17,39 El uso de tapones con IPA requiere al menos una duración mínima de contacto en el DNCC antes del acceso (el lavado manual es necesario para duraciones más cortas), lo que permite que el desinfectante se seque antes del acceso y desechando el tapón después de cada uso.
En un reciente RCT “piloto” no se encontraron diferencias significativas en las tasas de CLABSI en adultos al comparar el lavado con IPA o CHG/IPA, o el uso de tapones con IPA.27 Aunque las recomendaciones de la SHEA de 201915 se referían al uso de tapones con IPA como una “mejor práctica”, en este estudio “piloto” de 2021 se sugiere que deberían hacerse estudios más amplios y definitivos.27 En dos estudios in-vitro se advirtió sobre el uso de tapones con IPA en neonatos porque la inyección de suero salino después de haber quitado el tapón con IPA dio lugar a niveles “significativos” de IPA en los fluidos del circuito de prueba.16,37,38 En un estudio se halló que se produjeron niveles significativos de IPA en los fluidos del circuito de prueba después de 24 horas de uso del tapón de IPA, con niveles de IPA aún más altos cuando los DNCC se expusieron a los tapones con IPA durante 7 días38 El hallazgo de que el IPA se inyectó en el circuito de prueba también fue problemático, ya que en un estudio, después de haber quitado el tapón con IPA, se dejó secar el DNCC durante 30 segundos antes de la inyección.38 Se ha sugerido el uso de tapones desinfectantes que contienen etanol en lugar de IPA como alternativa para disminuir el riesgo de toxicidad en los neonatos.38
Conclusión
 Hay numerosas cuestiones que deben tenerse en cuenta para reducir los riesgos de infección cuando se accede a los catéteres vasculares. El diseño de una OLS da lugar a una alta tasa de contaminación microbiana intraluminal durante el uso clínico, y ni una almohadilla de IPA ni un dispositivo de lavado de puertos desinfectan de forma eficaz una OLS. En cambio, la superficie de inyección de un DNCC puede desinfectarse con un alto nivel de eficacia. Aunque siguen habiendo dudas sobre el desinfectante, los métodos de desinfección óptimos y del diseño óptimo del DNCC, en múltiples estudios hay tasas más bajas de contaminación intraluminal con los DNCC desinfectados en comparación con las OLS, y en algunos estudios hay tasas más bajas de HAI para los DNCC desinfectados en comparación con las OLS. En ningún estudio actual se descubrió que las OLS sean beneficiosas en comparación con los DNCC desinfectados. Los fabricantes deberían suministrar juegos de catéteres intravenosos con DNCC y llaves de paso de DNCC en lugar de las OLS, y las llaves de paso de DNCC también deberían estar disponibles como artículos individuales. Los juegos de catéteres arteriales deben incluir una llave de paso DNCC para la toma de muestras de sangre y un dispositivo para poner a cero el transductor que mantenga la esterilidad intraluminal. Las OLS deben limitarse a su uso en campos estériles. El cumplimiento de la desinfección del DNCC por parte del proveedor de atención sanitraria es fundamental para el uso seguro de los DNCC y debe incluir evaluaciones periódicas y reeducación sobre la higiene de las manos y la técnica aséptica. También se recomienda un mayor uso de medicamentos e infusiones preparados por el fabricante o la farmacia y el uso de prácticas de inyección seguras para reducir el riesgo de HAI relacionadas con el acceso vascular y los errores de relacionados con los medicamentos. Aunque no hay un consenso sobre el enfoque óptimo para la desinfección del DNCC y siguen existiendo muchos interrogantes, una síntesis de la literatura actual indica que inmediatamente antes del acceso (o de una serie rápida de inyecciones) el DNCC debe lavarse con un desinfectante que contenga alcohol durante al menos 5 segundos (algunas recomendaciones son usar ≥15 segundos), o usar de forma adecuada un tapón con IPA, seguido de un secado antes de la inyección. Los tapones con IPA tienen ventajas potenciales en comparación con el lavado manual; sin embargo, se necesitan estudios adicionales para determinar si los tapones de IPA son más eficaces para reducir las HAI que los métodos alternativos actuales, y si son seguros para su uso en neonatos.
Hay numerosas cuestiones que deben tenerse en cuenta para reducir los riesgos de infección cuando se accede a los catéteres vasculares. El diseño de una OLS da lugar a una alta tasa de contaminación microbiana intraluminal durante el uso clínico, y ni una almohadilla de IPA ni un dispositivo de lavado de puertos desinfectan de forma eficaz una OLS. En cambio, la superficie de inyección de un DNCC puede desinfectarse con un alto nivel de eficacia. Aunque siguen habiendo dudas sobre el desinfectante, los métodos de desinfección óptimos y del diseño óptimo del DNCC, en múltiples estudios hay tasas más bajas de contaminación intraluminal con los DNCC desinfectados en comparación con las OLS, y en algunos estudios hay tasas más bajas de HAI para los DNCC desinfectados en comparación con las OLS. En ningún estudio actual se descubrió que las OLS sean beneficiosas en comparación con los DNCC desinfectados. Los fabricantes deberían suministrar juegos de catéteres intravenosos con DNCC y llaves de paso de DNCC en lugar de las OLS, y las llaves de paso de DNCC también deberían estar disponibles como artículos individuales. Los juegos de catéteres arteriales deben incluir una llave de paso DNCC para la toma de muestras de sangre y un dispositivo para poner a cero el transductor que mantenga la esterilidad intraluminal. Las OLS deben limitarse a su uso en campos estériles. El cumplimiento de la desinfección del DNCC por parte del proveedor de atención sanitraria es fundamental para el uso seguro de los DNCC y debe incluir evaluaciones periódicas y reeducación sobre la higiene de las manos y la técnica aséptica. También se recomienda un mayor uso de medicamentos e infusiones preparados por el fabricante o la farmacia y el uso de prácticas de inyección seguras para reducir el riesgo de HAI relacionadas con el acceso vascular y los errores de relacionados con los medicamentos. Aunque no hay un consenso sobre el enfoque óptimo para la desinfección del DNCC y siguen existiendo muchos interrogantes, una síntesis de la literatura actual indica que inmediatamente antes del acceso (o de una serie rápida de inyecciones) el DNCC debe lavarse con un desinfectante que contenga alcohol durante al menos 5 segundos (algunas recomendaciones son usar ≥15 segundos), o usar de forma adecuada un tapón con IPA, seguido de un secado antes de la inyección. Los tapones con IPA tienen ventajas potenciales en comparación con el lavado manual; sin embargo, se necesitan estudios adicionales para determinar si los tapones de IPA son más eficaces para reducir las HAI que los métodos alternativos actuales, y si son seguros para su uso en neonatos.
Elliott S. Greene, MD, es profesor de anestesiología en el Departamento de Anestesiología del Albany Medical College, Albany, NY.
El autor no tiene conflictos de intereses.
Referencias
- Greene ES. Challenges in reducing the risk of infection when accessing vascular catheters. J Hosp Infect. 2021;113:130–144.
- Dolan SA, Arias KM, Felizardo G, et al. APIC position paper: Safe injection, infusion, and medication vial practices in health care. Am J Infect Control. 2016;44:750-757.
- Holroyd JL, Paulus DA, et al. Universal intravenous access cleaning device fails to sterilize stopcocks. Anesth Analg. 2014;118:333-343.
- Rowlands J, Yeager MP, Beach M, et al. Video observation to map hand contact and bacterial transmission in operating rooms. Am J Infect Control. 2014;42:698–701.
- Institute for Safe Medication Practices Safe Practice Guidelines for Adult IV Push Medications. https://www.ismp.org/sites/default/files/attachments/2017-11/ISMP97-Guidelines-071415-3.%20FINAL.pdf Last accessed October 10, 2021.
- Anesthesia Patient Safety Foundation. Recommendations for improving medication safety consensus from four work groups at the 2018 APSF Stoelting Conference on Medication Safety. Rochester, MN: APSF; 2018. https://www.apsf.org/medication-safety-recommendations Last accessed October 10, 2021.
- Centers for Disease Control and Prevention. Safe injection practices to prevent transmission of infections to patients. Atlanta, GA. https://www.cdc.gov/injectionsafety/ip07_standardprecaution.html Last accessed October 1, 2021.
- Mermel LA, Bert A, Chapin KC, LeBlanc L. Intraoperative stopcock and manifold colonization of newly inserted peripheral intravenous catheters. Infect Control Hosp Epidemiol. 2014;35:1187–1189.
- Loftus RW, Koff MD, Burchman CC, et al. Transmission of pathogenic bacterial organisms in the anesthesia work area. Anesthesiology. 2008;109:399–407.
- Loftus RW, Brindeiro BS, Kispert DP, et al. Reduction in intraoperative bacterial contamination of peripheral intravenous tubing through the use of a passive catheter care system. Anesth Analg. 2012;115:1315–1323.
- Rupp ME, Yu S, Huerta T, et al. Adequate disinfection of a split-septum needleless intravascular connector with a 5-second alcohol scrub. Infect Control Hosp Epidemiol. 2012;33:661–665.
- Slater K, Cooke M, Fullerton F, et al. Peripheral intravenous catheter needleless connector decontamination study – randomized controlled trial. Am J Infect Control. 2020;48:1013–1018.
- Casey A, Karpanen T, Nightingale P, Elliott T. An in vitro comparison of microbial ingress into 8 different needleless IV access devices. J Infus Nurs. 2015;38:18–25.
- Loftus RW, Patel HM, Huysman BC, et al. Prevention of intravenous bacterial injection from health care provider hands: the importance of catheter design and handling. Anesth Analg. 2012;115:1109–1119.
- Munoz-Price LS, Bowdle A, Johnston BL, et al. Infection prevention in the operating room anesthesia work area. Infect Control Hosp Epidemiol. 2019;40:1–17.
- Voor In’t Holt AF, Helder OK, Vos MC, et al. Antiseptic barrier cap effective in reducing central line-associated bloodstream infections: a systematic review and meta-analysis. Int J Nurs Stud. 2017;69:34–40.
- Merrill KC, Sumner S, Linford L, et al. Impact of universal disinfectant cap implementation on central line associated bloodstream infections. Am J Infect Control. 2014;42:1274–1277.
- Mermel LA. What is the predominant source of intravascular catheter infections? Clin Infect Dis. 2011;52:211–212.
- Moureau NL, Flynn J. Disinfection of needleless connector hubs: clinical evidence systematic review. Nurs Res Pract. 2015;2015:796762.
- Ryan AJ, Webster CS, Merry AF, Grieve DJ. A national survey of infection control practice by New Zealand anaesthetists. Anaesth Intensive Care. 2006;34:68e74
- Balikci E, Yilmaz B, Tahmasebifar A, et al. Surface modification strategies for hemodialysis catheters to prevent catheter-related infections: a review. J Biomed Mater Res B Appl Biomater. 2021;109:314-327.
- Arciola CR, Campoccia D, Montanaro L. Implant infections: adhesion, biofilm formation and immune evasion. Nat Rev Microbiol. 2018;16:397–409.
- Gominet M, Compain F, Beloin C, Lebeaux D. Central venous catheters and biofilms: where do we stand in 2017? Acta Pathol Microbiol Immunol Scand. 2017;125:365–375.
- Greene ES. New SHEA expert guidance for infection prevention in the anesthesia work area needs improvement. Infect Control Hosp Epidemiol. 2019;40:607–608.
- Deloney V, Bowdle A, Birnbach DJ, et al. Reply to Greene: New SHEA expert guidance for infection prevention in the anesthesia work area needs improvement. Infect Control Hosp Epidemiol. 2021;25:1.
- US Occupational Safety and Health Administration. Bloodborne pathogens and needlestick prevention. Washington, DC. https://www.osha.gov/SLTC/bloodbornepathogens/index.html. Last accessed October 1, 2021.
- Rickard CM, Flynn J, Larsen E, et al. Needleless connector decontamination for prevention of central venous access device infection: a pilot randomized controlled trial. Am J Infect Control. 2021;49:269–273.
- Flynn JM, Rickard CM, Keogh S, Zhang L. Alcohol caps or alcohol swabs with and without chlorhexidine: an in vitro study of 648 episodes of intravenous device needleless connector decontamination. Infect Control Hosp Epidemiol. 2017;38:617–619.
- Practice guidelines for central venous access 2020: an updated report by the American Society of Anesthesiologists Task Force on Central Venous Access. Anesthesiology. 2020;132:8–43.
- O’Grady NP, Alexander M, Burns LA, et al. Healthcare Infection Control Practices Advisory Committee. Guidelines for the prevention of intravascular catheter-related infections. Atlanta, GA: Centers for Disease Control and Prevention; updated October 2017. Available at: https://www.cdc.gov/infectioncontrol/pdf/guidelines/bsi-guidelines-H.pdf Last accessed November 23, 2021.
- Association for Professionals in Infection Control and Epidemiology. Guide to preventing central line-associated bloodstream infections. Washington, DC: APIC; 2015. http://apic.org/Resource_/TinyMceFileManager/2015/APIC_CLABSI_WEB.pdf. Last accessed October 1, 2021.
- Marschall J, Mermel LA, Fakih M, et al. Society for Healthcare Epidemiology of America. Strategies to prevent central line-associated bloodstream infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014;35:753–771.
- Loveday HP, Wilson JA, Pratt RJ, et al. UK Department of Health. epic3: National evidence based guidelines for preventing healthcare-associated infections in NHS hospitals in England. J Hosp Infect. 2014;86(Suppl. 1):S1–70.
- Hallam C. (2019) Right Hub Disinfection for Compliance. In: Moureau N. (eds) Vessel Health and Preservation: The Right Approach for Vascular Access. pp 235–241 Springer, Cham. https://doi.org/10.1007/978-3-030-03149-7_18. Online June 11, 2019. Last accessed November 22, 2021.
- Casey AL, Karpanen TJ, Nightingale P, Elliott TS. The risk of microbial contamination associated with six different needle-free connectors. Br J Nurs. 2018;27:S18–S26.
- Slater K, Fullerton F, Cooke M, et al. Needleless connector drying time – how long does it take? Am J Infect Control. 2018;46:1080–1081.
- Sauron C, Jouvet P, Pinard G, et al. Using isopropyl alcohol impregnated disinfection caps in the neonatal intensive care unit can cause isopropyl alcohol toxicity. Acta Paediatr. 2015;104:e489–493.
- Hjalmarsson LB, Hagberg J, Schollin J, Ohlin A. Leakage of isopropanol from port protectors used in neonatal care-Results from an in vitro study. PLoS One. 2020;15:e0235593.
- Bell T, O’Grady NP. Prevention of central line-associated bloodstream infections. Infect Dis Clin N Am. 2017;31:551–559.


 Issue PDF
Issue PDF