Introduction
Aux États-Unis, dans les hôpitaux de soins aigus, 3,2 % des patients développent une ou plusieurs infections associées aux soins (IAS), entraînant une hausse de la morbidité des patients, de leur mortalité, de leur durée d’hospitalisation et des coûts liés à leur prise en charge médicale.1 Les bactériémies associées à un cathéter (Catheter-related bloodstream infections, CRBSI) sont l’étiologie la plus courante des IAS, qui peuvent se produire aussi bien avec une voie centrale qu’avec un cathéter intravasculaire périphérique.1 Chaque année aux États-Unis, on compte environ 250 000 CRBSI causées par des cathéters intravasculaires à court et long terme, causant une morbidité importante, y compris des état septiques, d’autres complications et une plus grande mortalité.1 En 2014, les hôpitaux américains de soins aigus avaient plus de 31 000 patients présentant des bactériémies associées aux cathéters veineux centraux (central-line-associated bloodstream infections, CLABSI), représentant un coût annuel estimé de 0,6–2,7 milliards de dollars et un taux de mortalité de 12 à 25 %.1 Les taux de CLABSI atteignaient en règle générale entre 1,1 et 2,5/1000 cathéter-jour, et chaque CLABSI augmente en moyenne le séjour hospitalier de 10,4 jours, représentant une hausse des coûts de plus de 45 000 dollars.1 Dans une étude des CRBSI liées à des cathéters intraveineux périphériques à court terme (peripheral intravenous catheter, PIVC) entre 1980 et 2106, l’incidence des infections (non signalées par 1000 cathéter-jour) était de 1,8 infection/1000 cathéters. Dans une étude de 2014, le taux de CRBSI liées à un cathéter artériel était de 1,26/1000 cathéter-jour, le risque de CRBSI au site fémoral étant supérieur de 1,9 fois celui du site radial.1 La contamination microbienne des cathéters intravasculaires peut se produire par 1) voie extraluminale impliquant une migration distale depuis le point d’insertion, ou 2) contamination intraluminale, qui peut survenir lors de l’accès et de l’utilisation de ces cathéters. Les sources moins fréquentes proviennent d’une dissémination hématogène ou d’un perfusat contaminé.
L’accès aux cathéters vasculaires est courant lors de l’anesthésie ou des autres soins prodigués aux patients, cependant les médecins utilisent-ils des méthodes optimales pour réduire le risque d’IAS liées à cet accès ? Si l’hygiène des mains et les techniques aseptiques ne sont pas respectées lors de l’accès aux cathéters vasculaires, la contamination intraluminale des ports d’injection par des pathogènes peut se produire [par ex. robinets d’arrêt à lumière ouverte (OLS) ou fermée par connecteurs de sécurité sans aiguille désinfectables (DNCC)], causant des CRBSI et autres IAS.1-3 Malheureusement, le taux signalé de mauvais respect de l’hygiène des mains par les anesthésistes est compris entre 2,9 % et 18 %.1,4 Les seringues et les perfusions peuvent être contaminées pendant la préparation des médicaments et l’utilisation clinique, avec pour résultat l’injection de contenus contaminés dans le sang, ainsi que la contamination des ports d’accès.1,2,5-7 L’utilisation accrue de seringues et perfusions médicamenteuse préparées par le fabricant ou une pharmacie est recommandée par l’Anesthesia Patient Safety Foundation, l’Association for Professionals in Infection Control and Epidemiology et l’Institute for Safe Medication Practices, afin de réduire la contamination et les erreurs médicamenteuses pendant la préparation et l’administration des médicaments et fluides.1,2,5,6 Les Centres pour le contrôle et la prévention des maladies donnent également des recommandations pour la Sécurité des pratiques d’injection.7 Cet article mettra en lumière les similitudes et les différences en matière de risques de contamination et d’infection entre l’utilisation des OLS par rapport aux DNCC et discutera des recommandations et des problèmes irrésolus concernant la désinfection des DNCC.
Risques de contamination et d’infection des OLS et des DNCC désinfectés
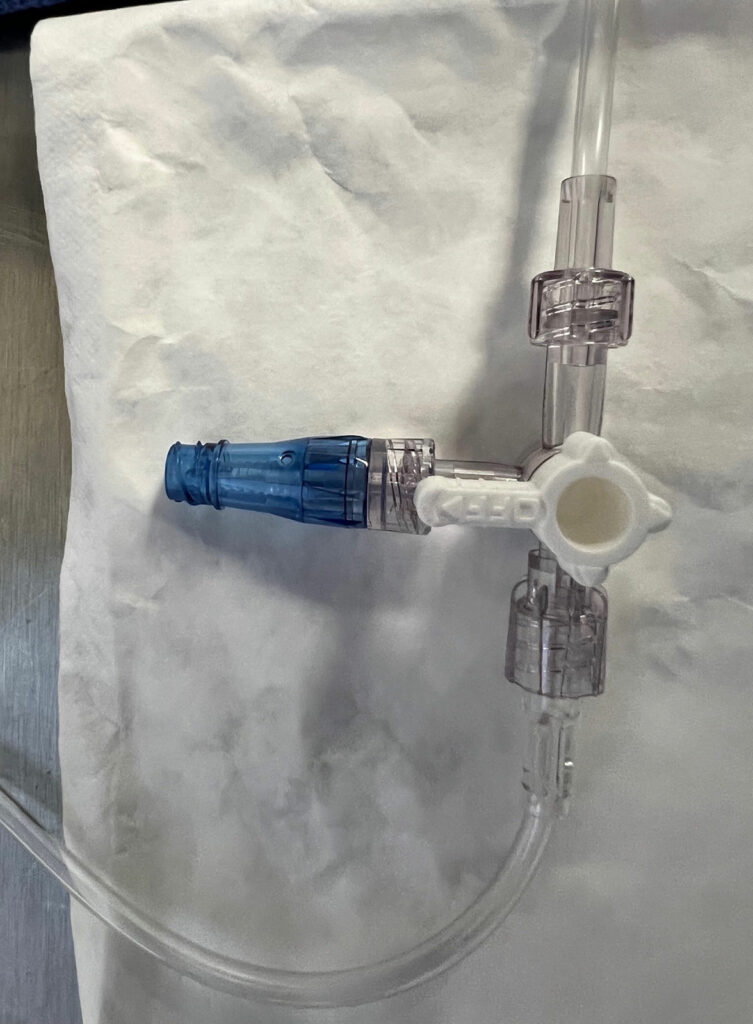
Les OLS sont couramment utilisés dans la pratique de l’anesthésie. Cependant, la contamination des surfaces intraluminales peut survenir dans 32 % à 38 % des cas d’anesthésie.8,9 Ni un tampon d’alcool isopropylique (IPA) à 70 %, ni un dispositif de nettoyage du port ne désinfecte efficacement un OLS.3,10 Un OLS est sujet à la contamination en raison de sa conception avec un capuchon amovible qui expose les surfaces intraluminales (Figure 1). Bien que plus de 50 % de DNCC soient contaminés par des bactéries sur leurs surfaces d’injection avant une désinfection appropriée,11,12 la surface d’injection d’un DNCC peut être désinfectée de manière extrêmement efficace en frottant à l’aide d’un tampon désinfectant imprégné d’alcool ou en utilisant un capuchon contenant de l’IPA (Figure 2).1,3,11-17 Dans une récente évaluation critique des ports d’injection, 8 études sur 10 présentaient des taux de contamination intraluminale considérablement plus faibles avec des DNCC désinfectés qu’avec des OLS et 2 études sur 7 présentaient des taux considérablement réduits de CLABSI ou de CRBSI avec des DNCC désinfectés par rapport aux OLS (certaines études évaluaient à la fois les taux de contamination et les taux d’infection).1 Lors de l’évaluation du sous-groupe des études où à la fois les OLS et les DNCC étaient désinfectés avant l’accès, 7 études sur 9 signalaient des taux considérablement plus faibles de contamination intraluminale avec les DNCC par rapport aux OLS et 1 étude sur 4 rapportait un taux considérablement plus faible de CLABSI avec les DNCC.1 Aucune étude n’a signalé que les OLS étaient bénéfiques par rapport aux DNCC désinfectés (voir Tableau 1).1
Tableau 1 : Comparaison entre les connecteurs de sécurité sans aiguille fermés désinfectables (DNCC) et des robinets de lumière ouverts (OLS)
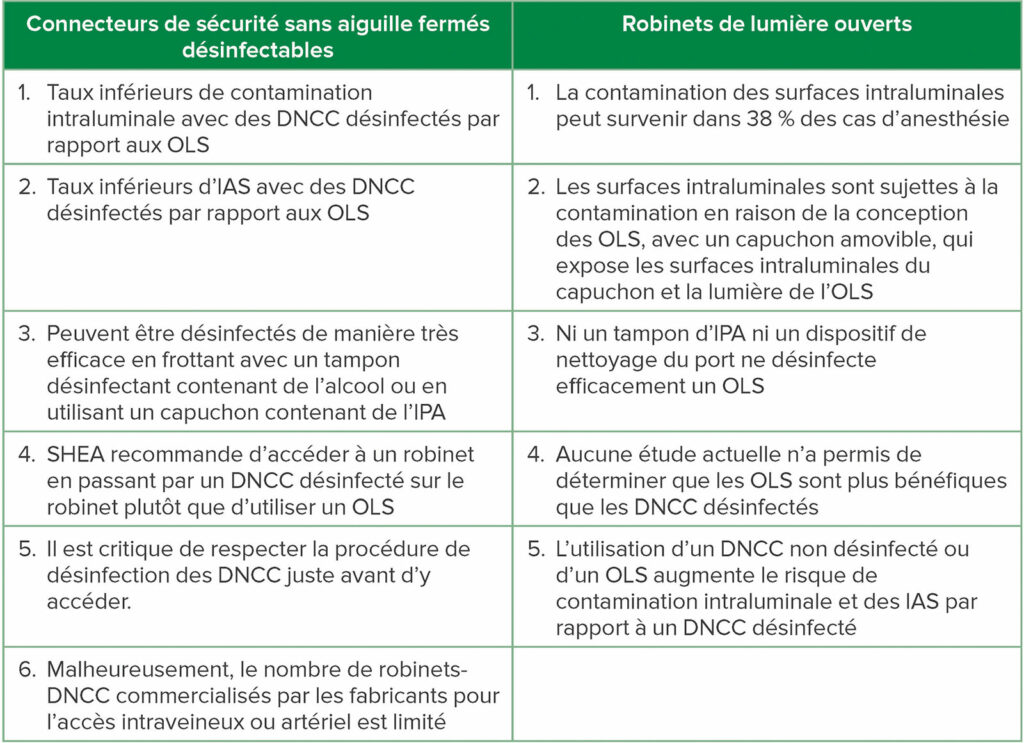
Abréviations : robinet-DNCC : robinet avec un connecteur de sécurité sans aiguille fermé désinfectable connecté (de préférence collé) à la lumière d’injection ; IAS : infections associées aux soins ; IPA : alcool isopropylique à 70 % ; SHEA : Society for Healthcare Epidemiology of America
Injection microbienne et biofilm
L’absence de désinfection des DNCC avant l’accès ou la contamination des OLS pendant l’utilisation clinique peut causer une contamination intraluminale1,15, avec pour résultat la formation d’un biofilm (micro-organismes intégrés à une matrice extracellulaire du glycocalyx) sur les surfaces du cathéter, associée à un risque accru d’IAS.18,19
Une seule omission de désinfection des DNCC avant l’accès peut causer la formation du biofilm.19 Malheureusement, le respect de la désinfection des DNCC (y compris l’hygiène des mains et la technique aseptique) est compliqué pour les professionnels de santé.1,15,20 Bien que les publications actuelles n’expliquent pas complètement les mécanismes de défense du biofilm contre les agents antimicrobiens, les exopolysaccharides empêchent les antibiotiques de pénétrer la matrice du biofilm pour atteindre les bactéries qu’il contient.21
Le biofilm peut également être résistant au système immunitaire de l’hôte.22,23 Par conséquent, le biofilm peut être une source de bactériémie et d’infections chroniques.21-23 Alors que des études in-vitro suggèrent que les leucocytes sont capables de pénétrer efficacement les biofilms, des études réalisées sur des animaux indiquent que la formation du biofilm entraîne un « échappement » à la réponse immunitaire de l’hôte d’une « réponse bactéricide pro-inflammatoire » en « réponse profibrotique anti-inflammatoire ».22 La formation de biofilm sur les surfaces des cathéters et autres dispositifs médicaux implantés protège ainsi les bactéries qui favorisent la persistance de l’infection.22
Un autre mécanisme de l’injection microbienne peut expliquer l’association de la contamination des OLS et des DNCC au risque accru connexe des IAS.1,14 L’injection microbienne accidentelle directement dans le sang peut survenir pendant un accès vasculaire par le biais d’un OLS contaminé ou en cas d’absence de désinfection d’une surface d’injection d’un DNCC avant injection. L’injection microbienne accidentelle directe peut aussi se produire en cas d’utilisation d’une seringue ou d’un perfusat contaminé.1,2,5-7 Un essai contrôlé randomisé (RCE) ex-vivo, réalisé dans le cadre de l’administration concomitante d’une anesthésie clinique, a permis de constater l’entrée d’environ 10.000 unités formant colonies dans le circuit d’essai par injection, lorsque les DNCC ou les OLS n’étaient pas désinfectés avant l’accès.14 Dans cette étude, l’incidence d’une injection microbienne accidentelle était considérablement plus faible en cas d’utilisation de robinets-DNCC désinfectés [alcool à 70 % (méthode non précisée) avec 30 secondes de séchage] par rapport aux OLS ou aux robinets-DNCC sans désinfection.14
Recommandations récentes de la Society for Healthcare Epidemiology of America
Récemment, la Society for Healthcare Epidemiology of America (SHEA) a publié des directives visant à la prévention des infections dans le cadre des travaux d’anesthésie.15 SHEA recommande d’utiliser de préférence, dans le cadre clinique, des DNCC désinfectés sur les robinets plutôt que des OLS.24,25 SHEA a également remarqué que « les robinets sur les capteurs de pression sont régulièrement ouverts à l’air libre à des fins d’étalonnage des capteurs » et que « ces robinets d’arrêt pourraient raisonnablement être protégés par un capuchon stérile plutôt que des ports d’injection sans aiguille » (DNCC), mais n’a pas proposé de méthode de maintien de la stérilité intraluminale lorsque le capteur est ouvert à l’air libre.25 Il est important que les robinets utilisés pour remettre à zéro les capteurs de pression maintiennent la stérilité intraluminale. Bien que certains capteurs soient dotés d’un capuchon avec un « petit » trou (beaucoup plus petit que la lumière) qui peut éliminer la nécessité du retrait du capuchon lors de la remise à zéro, le maintien de la stérilité intraluminale n’a pas été prouvé, car la « petite » lumière est continuellement ouverte à l’environnement extérieure. Par ailleurs, si ce capuchon n’est pas collé au robinet, le médecin pourrait contourner tous les avantages potentiels de la conception de ce capuchon en le retirant pendant la remise à zéro, exposant ainsi entièrement les surfaces intraluminales à une contamination environnementale potentielle. Un robinet doté d’un filtre bactérien collé à la lumière de remise à zéro peut être une option.
Accès aux cathéters vasculaires par des DNCC désinfectés
Les publications actuelles avancent qu’il est préférable d’utiliser des DNCC désinfectés plutôt que des OLS pour les raisons suivantes : les taux inférieurs généralement documentés de contamination et de risques d’infection des DNCC désinfectés par rapport aux OLS comme indiqué ci-dessus (Tableau 1) et les recommandations récentes de SHEA que « les robinets utilisés pour l’injection de médicaments devraient idéalement être fermés par des ports d’injection sans aiguille ».25 Afin de réduire le risque lié à l’infection pour le patient, il convient d’accéder systématiquement aux cathéters vasculaires utilisés pour administrer des médicaments ou des fluides ou pour tirer du sang via des DNCC désinfectés [par ex. dans des kits de tubulures de perfusion intraveineuse (IV)] ou via des robinets-DNCC désinfectés. Il est essentiel de respecter les pratiques de désinfection. Pour les robinets-DNCC, le DNCC doit, de préférence, être collé à la lumière d’injection du robinet afin d’éliminer le retrait et le contournement du DNCC.1 Bien que les recommandations récentes de SHEA25 n’indiquent pas spécifiquement l’utilisation des DNCC pour obtenir des prélèvements sanguins sur des tubulures de pression artérielle, des études récentes1 préconisent l’obtention de prélèvements sanguins sur des kits de tubulures de pression artérielle via des robinets-DNCC plutôt que des OLS. La seule application clinique dans le cadre de laquelle les OLS ne présenteraient pas un risque accru de contamination ou d’infection par rapport à des DNCC désinfectés serait lorsque les OLS sont restreints à une utilisation pour des procédures en champ stérile.1
Disponibilité limitée des robinets d’arrêt et DNCC auprès du fabricant
Actuellement, les kits de tubulures de pression artérielle et de capteurs de pression artérielle ne sont pas systématiquement équipés de robinets-DNCC.1 Les fabricants devraient fournir leurs kits de tubulures de pression artérielle et de capteurs de pression artérielle avec des robinets-DNCC plutôt que des OLS et les robinets-DNCC devraient être commercialisés à l’unité. Les robinets-DNCC ne sont pas systématiquement inclus dans les kits de tubulures pour plusieurs raisons, notamment le manque de sensibilisation des médecins et des fabricants à la supériorité des DNCC, l’inertie en matière d’évolution des pratiques existantes et le coût plus élevé. Néanmoins, la nécessité d’améliorer la sécurité par l’adoption de DNCC est inévitable et le coût accru ne devrait pas être un obstacle. Par exemple, les dispositifs de sécurité pour la prévention des blessures par des objets tranchants coûtent plus que les dispositifs sans sécurité, mais ils font désormais partie des obligations de sécurité standard.1,26
Méthode de désinfection et type de désinfectant
Le type de désinfectant et la méthode de désinfection utilisés sur les DNCC sont des facteurs fondamentaux pour optimiser l’efficacité du désinfectant et réduire les IAS indésirables.1,27 Les différences de résultats de plusieurs études in-vitro et cliniques choisies mettent en avant les difficultés liées à la définition de recommandations de désinfection (Tableau 2). Sans surprise, il n’existe pas de consensus parmi les experts concernant des recommandations pour un désinfectant, une méthode de désinfection (par ex. frottage plutôt que « nettoyage »), la durée de la désinfection et le temps de séchage, et l’utilisation ou pas de capuchons contenant de l’IPA (voir Tableau 3).1 SHEA recommande de désinfecter les DNCC immédiatement avant l’accès ou avant une série rapide d’injections, comme par exemple pendant l’induction de l’anesthésie, soit en frottant (la durée n’est pas précisée) avec un tampon désinfectant contenant de l’alcool [par ex. IPA ou gluconate de chlorhexidine [CHG]/IPA] ou en utilisant correctement un capuchon contenant de l’IPA.1,15 Plusieurs directives1 recommandent de frotter avec un désinfectant contenant de l’alcool, cependant les durées du frottage varient de plus de 5 secondes à plus de 15 secondes (Tableau 3).31-33 Étant donné que le respect des durées plus longues de frottage est faible,15 d’autres études devront identifier la durée minimale d’un frottage efficace.1 En outre, des essais randomisés sont nécessaires pour comparer les diverses méthodes et les différents désinfectants utilisés, car des techniques de désinfection des DNCC qui ne sont pas optimales peuvent augmenter le risque d’IAS. Une autre complication dans le cadre de ce problème est que le risque d’infection des DNCC désinfectés peut également être lié à la diversité topographique des surfaces d’injection et autres caractéristiques de conception retrouvées dans les différents DNCC, pouvant avoir une incidence sur l’efficacité de la désinfection.12,13,27,35
Tableau 2 : a,bÉtudes choisies 1) in-vitro de désinfection de surfaces de DNCC contaminées et 2) Études cliniques de désinfection des DNCC
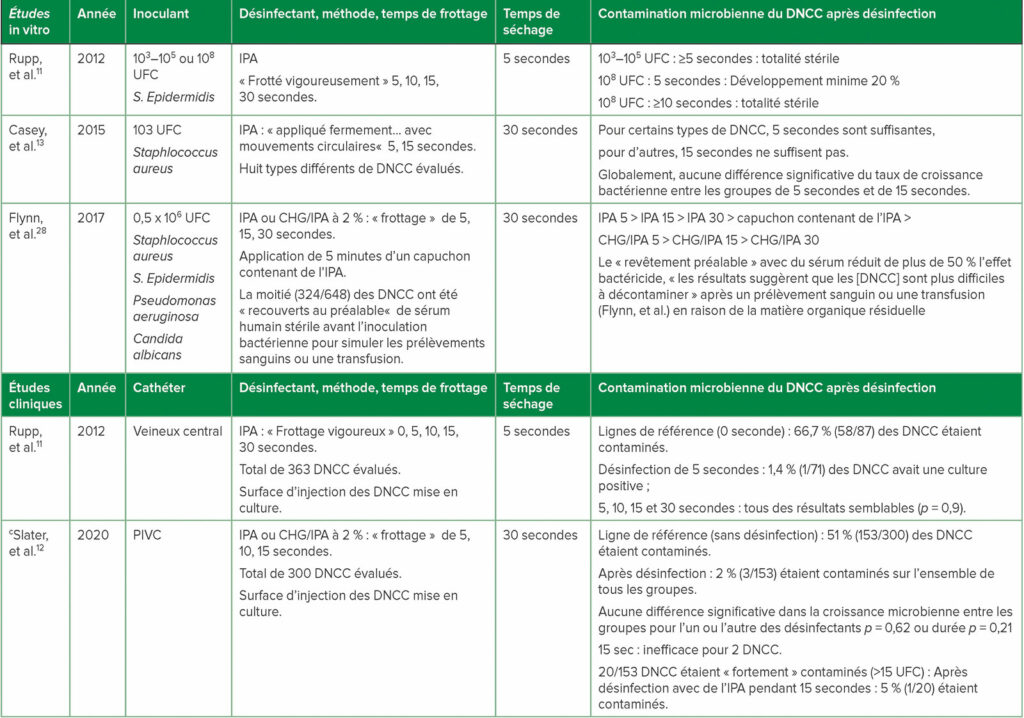
Abréviations : UFC : unités formant bactéries/ml d’inoculant ; CHG : gluconate de chlorhexidine ; DNCC : connecteurs de sécurité sans aiguille fermés désinfectables ; IPA : alcool isopropylique à 70 % ; PIVC : cathéter intraveineux périphérique.
a pour des études complémentaires, consulter le document de référence Greene1
b les termes entre guillemets sont ceux utilisés dans chaque document de référence
c première ECR clinique de la désinfection des DNCC de PIVC
Tableau 3 : a,bRecommandations pour la désinfection des DNCC publiées par des organismes nationaux et internationaux
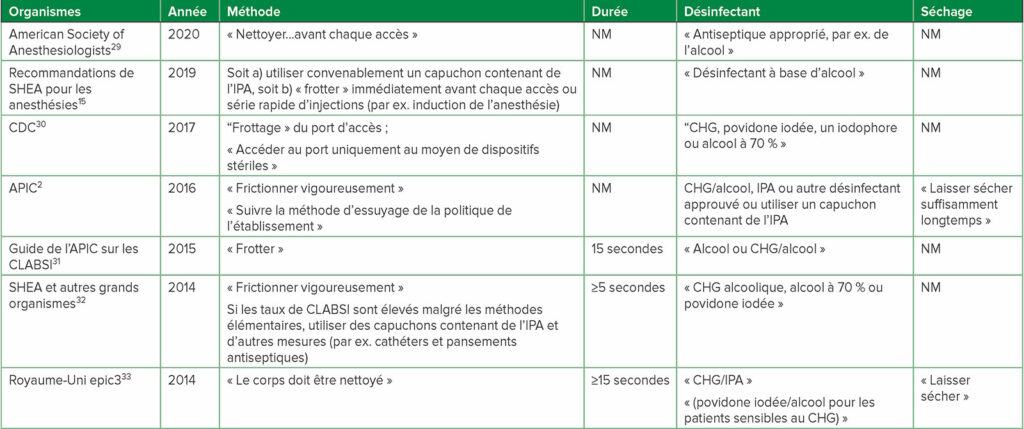
Abréviations : APIC : Association des professionnels du contrôle de l’infection et de l’épidémiologie ; CDC : U.S. Centres américains pour le contrôle et la prévention des maladies ; CHG : gluconate de chlorhexidine ; CLABSI : bactériémies associées au cathéter de voie centrale ; IPA : alcool isopropylique à 70 % ; NM : non mentionné dans les recommandations ; SHEA : Society for Healthcare Epidemiology of America
a pour des directives supplémentaires, consulter les documents de référence Greene,1 Hallam34
b les termes entre guillemets sont ceux utilisés dans chaque document de référence, c.-à-d. tous n’ont pas cité « frottage » comme méthode utilisée
Temps de séchage du désinfectant
Une étude récente suggérait que le désinfectant utilisé sur les DNCC devrait sécher avant l’accès afin de réduire la charge microbienne et son potentiel de pénétrer dans le flux sanguin.36 Les temps de séchage du désinfectant après le frottage des DNCC varient : l’IPA sèche en 5 secondes et le CHG/IPA sèche en 20 secondes, mais la povidone iodée n’est sèche qu’au bout de 6 minutes.36 Cependant, seulement quelques directives nationales et internationales mentionnent la nécessité d’un temps de séchage (Tableau 3).1 Malheureusement, uniquement quelques études cliniques et in-vitro précisent le temps de séchage après le désinfection des DNCC et aucune ne compare l’effet des différents temps de séchage, ou l’absence de séchage, sur l’efficacité de la désinfection.1 Sur les 21 études qui évaluent la désinfection des DNCC qui ont fait l’objet d’une revue critique récente, une étude indiquait un temps de séchage de 5 secondes, 10 études utilisaient un temps de séchage supérieur ou égal à 30 secondes et 10 études n’indiquaient pas si le séchage était utilisé ou pas.1 Des études complémentaires devront s’intéresser au temps de séchage optimal dans le cadre périopératoire afin que les professionnels de santé sachent clairement comment réduire le risque d’infection.
Est-il dangereux d’injecter un désinfectant dans un DNCC ?
Une étude récente recommandait de laisser sécher le DNCC avant l’accès afin d’éviter l’injection de désinfectant.36 Une question qui reste sans réponse est celle de savoir s’il est dangereux d’injecter du désinfectant dans un DNCC. Ce point est particulièrement inquiétant car l’IPA est métabolisé en acétone, qui est toxique.16,37,38 Deux études in-vitro ont comparé les DNCC frottés avec de l’IPA et un temps de séchage de 15 secondes37 et avec du CHG/éthanol et un temps de séchage de 30 secondes,38 avant de procéder à une injection de solution saline. Ces études suggéraient que les niveaux d’alcool dans les fluides dans les tubulures du circuit d’essai étaient soit indétectables37, soit « faibles »38 (le maximum en µg par injection in-vitro était inférieur à 8 % de ce qui produirait le seuil estimé de concentration sanguine toxique chez les nouveau-nés, défini comme étant supérieur à 0 25 mg/ml). Les études sur l’injection potentielle par intraveineuse d’alcool ou de CHG via les DNCC avant le séchage du désinfectant se limitent aux publications actuelles et par conséquent, des études complémentaires seront nécessaires.
Capuchons d’IPA
Plusieurs recommandations nationales et internationales comprennent l’option d’utiliser des capuchons d’IPA sur les DNCC car ils procurent une désinfection passive, éliminent le frottage manuel (après un temps de contact minimum), fournissent un indicateur visible de la désinfection, constituent une barrière contre la contamination et peuvent accroître le taux de respect des techniques de désinfection par rapport à la désinfection manuelle.1,15,17,39 L’utilisation des capuchons d’IPA exige une durée de contact minimale sur le DNCC avant l’accès (la durée de frottage manuel nécessaire est plus courte), permettant au désinfectant de sécher avant l’accès, et la mise au rebut du capuchon après chaque utilisation.
Un ECR « pilote » récent n’a trouvé aucune différence significative dans les taux de CLABSI chez les adultes en comparant le frottage avec de l’IPA ou du CHG/IPA, et l’utilisation de capuchons contenant de l’IPA.27 Bien que les recommandations de 2019 de SHEA15 citent l’utilisation des capuchons contenant de l’IPA comme une « bonne pratique », cette étude « pilote » de 2021 suggère qu’il faudrait réaliser des études plus larges et plus concluantes.27 Deux études in-vitro ont mis en garde contre l’utilisation de capuchons contenant de l’IPA chez les nouveau-nés, car l’injection de solution saline après le retrait du capuchon contenant de l’IPA entraînait des niveaux « importants » d’IPA dans les fluides des tubulures de l’essai.16,37,38 Une étude a permis de constater que des niveaux importants d’IPA dans les fluides des tubulures de l’essai survenaient après une utilisation de 24 heures des capuchons contenant de l’IPA, avec des niveaux d’IPA encore plus élevés si les DNCC étaient exposés aux capuchons contenant de l’IPA pendant 7 jours.38 La constatation de l’injection de l’IPA dans les tubulures de l’essai était également problématique puisque dans une étude, après le retrait du capuchon contenant de l’IPA, le DNCC avait séché pendant 30 secondes avant l’injection.38 Les capuchons de désinfectant contenant de l’éthanol à la place de l’IPA ont été suggérés comme alternative pour réduire le risque de toxicité chez les nouveau-nés.38
Conclusion
 Il existe de nombreux problèmes à prendre en compte pour réduire les risques d’infection lors de l’accès aux cathéters vasculaires. La conception des OLS entraîne un taux élevé de contamination microbienne intraluminale pendant l’utilisation clinique et ni un tampon d’IPA ni un dispositif de nettoyage du port ne désinfecte efficacement un OLS En revanche, la surface d’injection d’un DNCC peut être désinfectée de manière très efficace. Bien que de nombreuses questions restent sans réponse concernant le désinfectant et la méthode de désinfection optimaux, ainsi que la conception optimale du DNCC, de nombreuses études ont constaté que les taux de contamination intraluminale étaient plus faibles avec des DNCC désinfectés par rapport aux OLS, et quelques études ont constaté des taux d’IAS plus faibles pour les DNCC désinfectés par rapport aux OLS. Aucune étude actuelle n’a permis de déterminer que les OLS sont plus bénéfiques que les DNCC désinfectés Les fabricants devraient fournir des kits de tubulures de perfusion intraveineuse avec des DNCC et des robinets-DNCC plutôt que des OLS et les robinets-DNCC devraient également être commercialisés à l’unité. Les kits de tubulures artérielles devraient être dotés d’un robinet- DNCC pour les prélèvements sanguins et d’un dispositif de remise à zéro du capteur qui maintient la stérilité intraluminale. L’utilisation des OLS devrait se limiter aux champs stériles. Le respect par les soignants de la désinfection des DNCC est essentielle à l’utilisation correcte des DNCC et devrait inclure des évaluations régulières et des formations périodiques de rappel sur l’hygiène des mains et les techniques aseptiques. L’utilisation plus fréquente de médicaments et perfusions préparés par le fabricant ou le pharmacien et l’utilisation de pratiques d’injection sûres sont également recommandées pour réduire le risque d’IAS associées aux accès vasculaires et les erreurs médicamenteuses. Malgré l’absence d’un consensus sur l’approche optimale de la désinfection des DNCC et le fait qu’il reste encore de nombreuses questions, une synthèse des publications actuelles indique que juste avant l’accès (ou une série rapide d’injections), le DNCC doit être frotté à l’aide d’un désinfectant contenant de l’alcool pendant au moins 5 secondes (certaines recommandations préconisent plus de 15 secondes) ou l’utilisation correcte d’un capuchon contenant de l’IPA, suivie d’un temps de séchage avant l’injection. Les capuchons contenant de l’IPA présentent des avantages potentiels par rapport au frottage manuel. Cependant, des études complémentaires seront nécessaires pour déterminer si les capuchons contenant de l’IPA sont plus efficaces pour réduire les ISA que les autres méthodes actuelles, et s’ils peuvent être utilisés en toute sécurité chez les nouveau-nés.
Il existe de nombreux problèmes à prendre en compte pour réduire les risques d’infection lors de l’accès aux cathéters vasculaires. La conception des OLS entraîne un taux élevé de contamination microbienne intraluminale pendant l’utilisation clinique et ni un tampon d’IPA ni un dispositif de nettoyage du port ne désinfecte efficacement un OLS En revanche, la surface d’injection d’un DNCC peut être désinfectée de manière très efficace. Bien que de nombreuses questions restent sans réponse concernant le désinfectant et la méthode de désinfection optimaux, ainsi que la conception optimale du DNCC, de nombreuses études ont constaté que les taux de contamination intraluminale étaient plus faibles avec des DNCC désinfectés par rapport aux OLS, et quelques études ont constaté des taux d’IAS plus faibles pour les DNCC désinfectés par rapport aux OLS. Aucune étude actuelle n’a permis de déterminer que les OLS sont plus bénéfiques que les DNCC désinfectés Les fabricants devraient fournir des kits de tubulures de perfusion intraveineuse avec des DNCC et des robinets-DNCC plutôt que des OLS et les robinets-DNCC devraient également être commercialisés à l’unité. Les kits de tubulures artérielles devraient être dotés d’un robinet- DNCC pour les prélèvements sanguins et d’un dispositif de remise à zéro du capteur qui maintient la stérilité intraluminale. L’utilisation des OLS devrait se limiter aux champs stériles. Le respect par les soignants de la désinfection des DNCC est essentielle à l’utilisation correcte des DNCC et devrait inclure des évaluations régulières et des formations périodiques de rappel sur l’hygiène des mains et les techniques aseptiques. L’utilisation plus fréquente de médicaments et perfusions préparés par le fabricant ou le pharmacien et l’utilisation de pratiques d’injection sûres sont également recommandées pour réduire le risque d’IAS associées aux accès vasculaires et les erreurs médicamenteuses. Malgré l’absence d’un consensus sur l’approche optimale de la désinfection des DNCC et le fait qu’il reste encore de nombreuses questions, une synthèse des publications actuelles indique que juste avant l’accès (ou une série rapide d’injections), le DNCC doit être frotté à l’aide d’un désinfectant contenant de l’alcool pendant au moins 5 secondes (certaines recommandations préconisent plus de 15 secondes) ou l’utilisation correcte d’un capuchon contenant de l’IPA, suivie d’un temps de séchage avant l’injection. Les capuchons contenant de l’IPA présentent des avantages potentiels par rapport au frottage manuel. Cependant, des études complémentaires seront nécessaires pour déterminer si les capuchons contenant de l’IPA sont plus efficaces pour réduire les ISA que les autres méthodes actuelles, et s’ils peuvent être utilisés en toute sécurité chez les nouveau-nés.
Elliott S. Greene, MD, est professeur d’anesthésiologie du Département d’anesthésiologie de l’Albany Medical College, Albany, New York.
L’auteur ne signale aucun conflit d’intérêts.
Documents de référence
- Greene ES. Challenges in reducing the risk of infection when accessing vascular catheters. J Hosp Infect. 2021;113:130–144.
- Dolan SA, Arias KM, Felizardo G, et al. APIC position paper: Safe injection, infusion, and medication vial practices in health care. Am J Infect Control. 2016;44:750-757.
- Holroyd JL, Paulus DA, et al. Universal intravenous access cleaning device fails to sterilize stopcocks. Anesth Analg. 2014;118:333-343.
- Rowlands J, Yeager MP, Beach M, et al. Video observation to map hand contact and bacterial transmission in operating rooms. Am J Infect Control. 2014;42:698–701.
- Institute for Safe Medication Practices Safe Practice Guidelines for Adult IV Push Medications. https://www.ismp.org/sites/default/files/attachments/2017-11/ISMP97-Guidelines-071415-3.%20FINAL.pdf Last accessed October 10, 2021.
- Anesthesia Patient Safety Foundation. Recommendations for improving medication safety consensus from four work groups at the 2018 APSF Stoelting Conference on Medication Safety. Rochester, MN: APSF; 2018. https://www.apsf.org/medication-safety-recommendations Last accessed October 10, 2021.
- Centers for Disease Control and Prevention. Safe injection practices to prevent transmission of infections to patients. Atlanta, GA. https://www.cdc.gov/injectionsafety/ip07_standardprecaution.html Last accessed October 1, 2021.
- Mermel LA, Bert A, Chapin KC, LeBlanc L. Intraoperative stopcock and manifold colonization of newly inserted peripheral intravenous catheters. Infect Control Hosp Epidemiol. 2014;35:1187–1189.
- Loftus RW, Koff MD, Burchman CC, et al. Transmission of pathogenic bacterial organisms in the anesthesia work area. Anesthesiology. 2008;109:399–407.
- Loftus RW, Brindeiro BS, Kispert DP, et al. Reduction in intraoperative bacterial contamination of peripheral intravenous tubing through the use of a passive catheter care system. Anesth Analg. 2012;115:1315–1323.
- Rupp ME, Yu S, Huerta T, et al. Adequate disinfection of a split-septum needleless intravascular connector with a 5-second alcohol scrub. Infect Control Hosp Epidemiol. 2012;33:661–665.
- Slater K, Cooke M, Fullerton F, et al. Peripheral intravenous catheter needleless connector decontamination study – randomized controlled trial. Am J Infect Control. 2020;48:1013–1018.
- Casey A, Karpanen T, Nightingale P, Elliott T. An in vitro comparison of microbial ingress into 8 different needleless IV access devices. J Infus Nurs. 2015;38:18–25.
- Loftus RW, Patel HM, Huysman BC, et al. Prevention of intravenous bacterial injection from health care provider hands: the importance of catheter design and handling. Anesth Analg. 2012;115:1109–1119.
- Munoz-Price LS, Bowdle A, Johnston BL, et al. Infection prevention in the operating room anesthesia work area. Infect Control Hosp Epidemiol. 2019;40:1–17.
- Voor In’t Holt AF, Helder OK, Vos MC, et al. Antiseptic barrier cap effective in reducing central line-associated bloodstream infections: a systematic review and meta-analysis. Int J Nurs Stud. 2017;69:34–40.
- Merrill KC, Sumner S, Linford L, et al. Impact of universal disinfectant cap implementation on central line associated bloodstream infections. Am J Infect Control. 2014;42:1274–1277.
- Mermel LA. What is the predominant source of intravascular catheter infections? Clin Infect Dis. 2011;52:211–212.
- Moureau NL, Flynn J. Disinfection of needleless connector hubs: clinical evidence systematic review. Nurs Res Pract. 2015;2015:796762.
- Ryan AJ, Webster CS, Merry AF, Grieve DJ. A national survey of infection control practice by New Zealand anaesthetists. Anaesth Intensive Care. 2006;34:68e74
- Balikci E, Yilmaz B, Tahmasebifar A, et al. Surface modification strategies for hemodialysis catheters to prevent catheter-related infections: a review. J Biomed Mater Res B Appl Biomater. 2021;109:314-327.
- Arciola CR, Campoccia D, Montanaro L. Implant infections: adhesion, biofilm formation and immune evasion. Nat Rev Microbiol. 2018;16:397–409.
- Gominet M, Compain F, Beloin C, Lebeaux D. Central venous catheters and biofilms: where do we stand in 2017? Acta Pathol Microbiol Immunol Scand. 2017;125:365–375.
- Greene ES. New SHEA expert guidance for infection prevention in the anesthesia work area needs improvement. Infect Control Hosp Epidemiol. 2019;40:607–608.
- Deloney V, Bowdle A, Birnbach DJ, et al. Reply to Greene: New SHEA expert guidance for infection prevention in the anesthesia work area needs improvement. Infect Control Hosp Epidemiol. 2021;25:1.
- US Occupational Safety and Health Administration. Bloodborne pathogens and needlestick prevention. Washington, DC. https://www.osha.gov/SLTC/bloodbornepathogens/index.html. Last accessed October 1, 2021.
- Rickard CM, Flynn J, Larsen E, et al. Needleless connector decontamination for prevention of central venous access device infection: a pilot randomized controlled trial. Am J Infect Control. 2021;49:269–273.
- Flynn JM, Rickard CM, Keogh S, Zhang L. Alcohol caps or alcohol swabs with and without chlorhexidine: an in vitro study of 648 episodes of intravenous device needleless connector decontamination. Infect Control Hosp Epidemiol. 2017;38:617–619.
- Practice guidelines for central venous access 2020: an updated report by the American Society of Anesthesiologists Task Force on Central Venous Access. Anesthesiology. 2020;132:8–43.
- O’Grady NP, Alexander M, Burns LA, et al. Healthcare Infection Control Practices Advisory Committee. Guidelines for the prevention of intravascular catheter-related infections. Atlanta, GA: Centers for Disease Control and Prevention; updated October 2017. Available at: https://www.cdc.gov/infectioncontrol/pdf/guidelines/bsi-guidelines-H.pdf Last accessed November 23, 2021.
- Association for Professionals in Infection Control and Epidemiology. Guide to preventing central line-associated bloodstream infections. Washington, DC: APIC; 2015. http://apic.org/Resource_/TinyMceFileManager/2015/APIC_CLABSI_WEB.pdf. Last accessed October 1, 2021.
- Marschall J, Mermel LA, Fakih M, et al. Society for Healthcare Epidemiology of America. Strategies to prevent central line-associated bloodstream infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014;35:753–771.
- Loveday HP, Wilson JA, Pratt RJ, et al. UK Department of Health. epic3: National evidence based guidelines for preventing healthcare-associated infections in NHS hospitals in England. J Hosp Infect. 2014;86(Suppl. 1):S1–70.
- Hallam C. (2019) Right Hub Disinfection for Compliance. In: Moureau N. (eds) Vessel Health and Preservation: The Right Approach for Vascular Access. pp 235–241 Springer, Cham. https://doi.org/10.1007/978-3-030-03149-7_18. Online June 11, 2019. Last accessed November 22, 2021.
- Casey AL, Karpanen TJ, Nightingale P, Elliott TS. The risk of microbial contamination associated with six different needle-free connectors. Br J Nurs. 2018;27:S18–S26.
- Slater K, Fullerton F, Cooke M, et al. Needleless connector drying time – how long does it take? Am J Infect Control. 2018;46:1080–1081.
- Sauron C, Jouvet P, Pinard G, et al. Using isopropyl alcohol impregnated disinfection caps in the neonatal intensive care unit can cause isopropyl alcohol toxicity. Acta Paediatr. 2015;104:e489–493.
- Hjalmarsson LB, Hagberg J, Schollin J, Ohlin A. Leakage of isopropanol from port protectors used in neonatal care-Results from an in vitro study. PLoS One. 2020;15:e0235593.
- Bell T, O’Grady NP. Prevention of central line-associated bloodstream infections. Infect Dis Clin N Am. 2017;31:551–559.


 Issue PDF
Issue PDF