INTRODUCCIÓN
Los rápidos avances en los campos de la electrofisiología (electrophysiology, EP) y la cardiología intervencionista aumentaron la demanda de servicios de anestesia.1,2 Estos procedimientos crecieron en complejidad y a menudo implican el cuidado de pacientes gravemente enfermos con múltiples comorbilidades, incluyendo enfermedades cardíacas y pulmonares avanzadas. Proporcionar cuidados anestésicos a los pacientes que se someten a estos procedimientos en un lugar externo puede ser un desafío, ya que el entorno y el equipo pueden ser desconocidos, el espacio es limitado y hay barreras físicas entre el profesional de la anestesia y el paciente. En el análisis de la base de datos de quejas cerradas de la ASA se indica que un número significativo de lesiones se producen en la sala de cardiología (EP y laboratorio de cateterismo), solo superada por las salas de gastroenterología.3 Comprender y prepararse para los desafíos inherentes a la prestación de anestesia en estas áreas puede mejorar la seguridad del paciente.
EVALUACIÓN PREOPERATORIA
La evaluación preprocedimental debe incluir una anamnesis y un examen físico minuciosos; la revisión de las alergias, específicamente la alergia al contraste yodado; y la conciliación de la medicación. Debe prestarse especial atención a los anticoagulantes y a los regímenes de insuficiencia cardíaca. Con la excepción de los procedimientos de ablación, la administración de los betabloqueantes y los antiagregantes plaquetarios suelen continuar en el entorno periprocedimiento.2,4 Si se dispone de una clínica de anestesia preoperatoria, puede estar justificada la evaluación adicional de ciertos pacientes o procedimientos de alto riesgo (Tabla 1).
Tabla 1: Factores de los pacientes de alto riesgo que pueden justificar la evaluación de la anestesia antes de su procedimiento cardiológico fuera del centro
Dado que un cardiólogo suele atender a estos pacientes, es posible que ya se haya hecho un estudio exhaustivo. Es posible que se disponga de un electrocardiograma de 12 derivaciones, un ecocardiograma y un informe de monitorización cardíaca para su revisión. Si el paciente tiene un dispositivo electrónico cardiovascular implantable, el profesional de la anestesia debe revisar el fabricante, los ajustes actuales, la indicación de colocación y si el paciente es dependiente de marcapasos. La última recomendación de la Sociedad Americana de Anestesiólogos en 2020 no llegó a un consenso sobre el momento en que debe completarse un interrogatorio de un dispositivo antes de un procedimiento electivo, aunque el informe afirmaba que la mayoría de los miembros y consultores de la ASA recomienda hacerlo entre 3 y 6 meses antes del procedimiento planificado.5
Las pruebas de laboratorio preoperatorias varían en función del tipo de intervención y del riesgo de hemorragia. Las pruebas de laboratorio pueden incluir un recuento sanguíneo completo, tipo y cribado, estudios de coagulación y panel metabólico básico, sobre todo si se va a usar contraste.
LABORATORIO DE ELECTROFISIOLOGÍA
Más allá de la técnica de ablación empleada, pueden surgir complicaciones que deben tratarse de inmediato, ya que la descompensación puede ser rápida. La complicación más frecuente está relacionada con las lesiones del acceso vascular, seguidas de la perforación/taponamiento cardíaco.6 La perforación debe tratarse de forma urgente mediante la reversión inmediata de la anticoagulación y la pericardiocentesis. El profesional de la anestesia debe estar preparado para administrar rápidamente hermoderivados e iniciar la administración de infusiones de vasopresores cuando sea necesario. Si se produce un colapso hemodinámico y es necesario el transporte a la sala de operaciones para una intervención quirúrgica, la planificación previa al procedimiento entre los equipos de anestesia y electrofisiología sobre la logística del transporte de un paciente inestable ahorrará un tiempo valioso. Otras posibles complicaciones periprocedimiento son el accidente cerebrovascular, el bloqueo cardíaco, el edema pulmonar, la parálisis del nervio frénico, la perforación esofágica y, rara vez, la hemorragia pulmonar.6-8
Las vías intravenosas de gran calibre, los catéteres arteriales o los catéteres venosos centrales deben colocarse antes del inicio del procedimiento, ya que una vez que se cubre al paciente, puede ser imposible acceder a él si surge una emergencia. Se prefiere el acceso arterial en pacientes en los que se prevé una inestabilidad hemodinámica o en los que el procedimiento será de larga duración. A menudo, el electrofisiólogo obtiene la monitorización de la presión arterial como parte del procedimiento; sin embargo, debe tenerse en cuenta que la forma de onda puede amortiguarse y volverse inexacta si un dispositivo ocluye el lumen de la vaina arterial. Muchos profesionales pueden tener en cuenta la posibilidad de obtener su propia monitorización invasiva de la presión arterial para evitar este escollo y como forma de seguir la gasometría arterial durante todo el procedimiento. Un análisis previo al procedimiento con el electrofisiólogo sobre estas cuestiones es esencial para evitar dificultades en la monitorización.
Para complicar aún más los cuidados de anestesia, hay grandes equipos de cartografía cardíaca e imágenes fluoroscópicas que sirven de barrera física entre el equipo de anestesia y la vía aérea del paciente. Además, el electrofisiólogo controla la mesa de operaciones y el arco en C fluoroscópico, lo que puede provocar el desprendimiento accidental del circuito respiratorio, las vías intravenosas y los monitores. Hay que prever estas circunstancias y añadir extensiones a las líneas venosas o arteriales.
ABLACIONES CON CATÉTER
Las ablaciones con catéter son una opción de tratamiento fundamental para la supraventricular tachycardia, SVT (taquicardia supraventricular, SVT), el atrial flutter, AFL (flutter auricular, AFL), la atrial fibrillation, AF (fibrilación auricular, AF) y la ventricular tachycardia, VT (taquicardia ventricular, VT), con el objetivo de crear una lesión transmural que erradique de forma permanente el tejido cardíaco arritmogénico sin causar lesiones colaterales a las estructuras adyacentes. Los procedimientos de menor duración, como las ablaciones de taquicardia supraventricular y de fibrilación auricular, pueden hacerse sin un profesional de la anestesia mediante una sedación moderada por parte de un enfermero calificado bajo la supervisión del electrofisiólogo. Sin embargo, los procedimientos más complejos que requieren un tiempo considerable para el mapeo y la ablación pueden hacerse mejor con un profesional de la anestesia bajo atención anestésica monitorizada o anestesia general.
También hay que tener en cuenta que muchos de los fármacos anestésicos que se administran de forma frecuente pueden suprimir la inducibilidad de la arritmia; por lo tanto, el debate previo al procedimiento con el equipo de electrofisiología es importante para determinar el anestésico adecuado para el paciente (Tabla 2).9
Tabla 2: Los agentes anestésicos y sus efectos electrofisiológicos
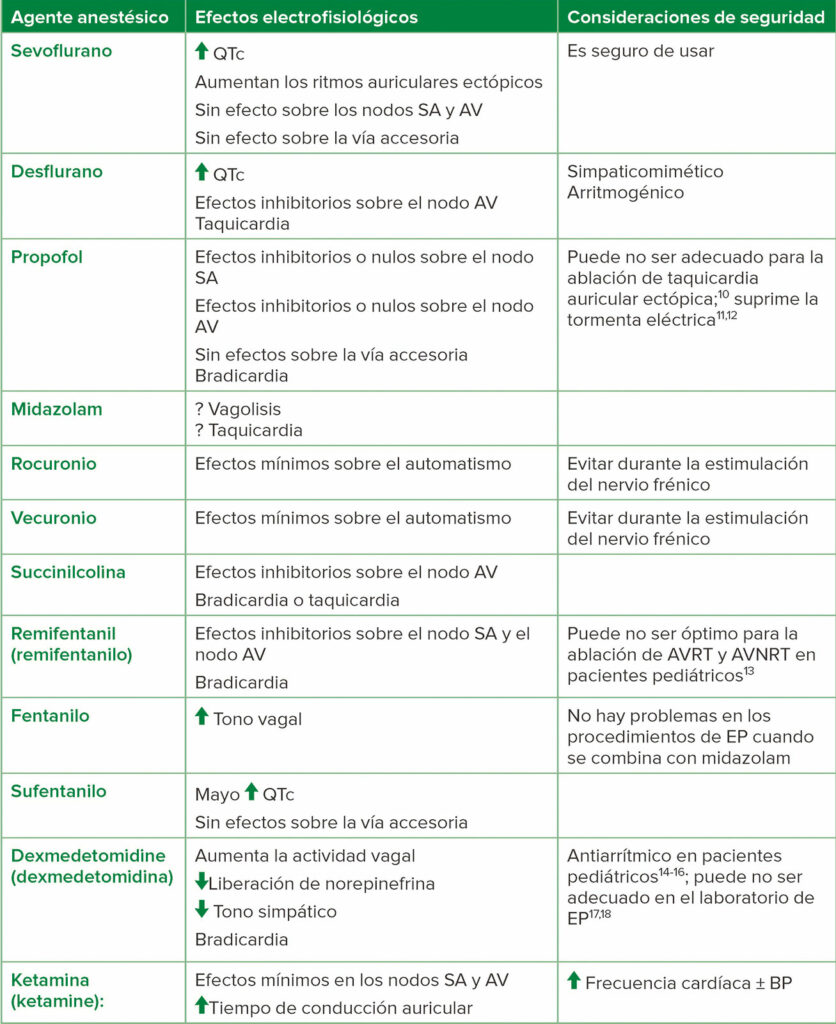
Abreviaturas: AV: auricular; AVNRT: taquicardia reentrante del nódulo auricular; AVRT: taquicardia reentrante auricular; BP: presión sanguínea; EP: electrofisiología; SA: sinoauricular. Adaptado del
Journal of Cardiothoracic and Vascular Anesthesia , Vol 32, Número 4. Satoru Fujii, Jian Ray Zhou, Achal Dhir, Anesthesia for Cardiac Ablation, Páginas 1892-1910, Copyright (2018), con permiso de Elsevier.
Ablación por radiofrequency, RF (radiofrecuencia RF)
La ablación por radiofrecuencia (RF) del endocardio es la técnica más usada para una serie de arritmias en las que la energía electromagnética se convierte en energía térmica, lo que provoca una lesión térmica irreversible en el tejido miocárdico. Por lo general, se hace un enfriamiento activo mediante la administración de suero fisiológico en la punta del catéter para evitar lesiones colaterales por exceso de temperatura en la interfaz electrodo-tejido.19 Una intervención útil cuando un procedimiento de radiofrecuencia afecta a la aurícula izquierda (es decir, la ablación de la AF) es la colocación de una sonda de temperatura esofágica que permite la vigilancia continua de la temperatura lo que minimiza este riesgo para estructuras adyacentes como el esófago. Mantener una temperatura esofágica ≤38.5°C puede asociarse a una disminución de las lesiones esofágicas, como la ulceración y la formación de fístulas aurículo-esofágicas izquierdas.20 Además, el enfriamiento activo puede dar lugar a la administración de varios litros de suero salino por parte del electrofisiólogo en el transcurso del procedimiento y debe tenerse en cuenta cuando se evalúa el balance hídrico. Esto es sobre todo cierto para los pacientes con una función ventricular deficiente.
Ablación con criobalón
La ablación con criobalón es una tecnología más reciente, usada sobre todo en el tratamiento de la AF, que congela el endocardio, lo que provoca un deterioro de la propagación de las señales eléctricas aberrantes. Se introduce un catéter con punta de balón en una vena pulmonar que, cuando se infla, congela el tejido circundante de forma cirunferencial. Una consideración técnica para el profesional de la anestesia es evitar los relajantes musculares, ya que a menudo se emplea la estimulación del nervio frénico. La parálisis del nervio frénico es una de las complicaciones más frecuentes después de la ablación con criobalón.21
Ablación epicárdica
Se puede emplear un enfoque epicárdico para la ablación de ciertas arritmias ventriculares y como parte de una técnica híbrida de cirugía y catéter para la AF. El enfoque híbrido es una técnica relativamente nueva en la que se tratan tanto el epicardio como el endocardio, lo que puede dar algún beneficio añadido en el tratamiento de la AF al combinar los enfoques quirúrgico (epicardio) y con catéter (endocardio).22 Estos procedimientos epicárdicos se hacen exclusivamente bajo anestesia general. Si se produce hipotensión durante un abordaje epicárdico, las únicas complicaciones que deben sospecharse son la lesión de una arteria coronaria y la hemorragia intraabdominal.7
LABORATORIO DE CATETERISMO
Reemplazo transcatéter de la válvula aórtica
En los últimos años, las indicaciones y las consideraciones anestésicas para el reemplazo de la Transcatheter Aortic Valve Replacement, TAVR (válvula aórtica por catéter, TAVR) han evolucionado. Aunque antes solo estaba indicada para pacientes con estenosis aórtica (aortic stenosis, AS) grave y sintomática para los que la sustitución quirúrgica de la válvula aórtica se consideraba de muy alto riesgo, recientemente se amplió su aprobación para su uso en pacientes sintomáticos de bajo riesgo con AS.23,24 Además, la TAVR se está evaluando para pacientes asintomáticos con AS grave.
En la actualidad se usan dos sistemas de TAVR en Estados Unidos: las válvulas Edwards Sapien y la familia de dispositivos Medtronic CoreValve. La válvula Sapien es una válvula de bajo perfil, expandible con balón, que no puede reposicionarse después de su implantación, mientras que la familia de válvulas CoreValve es autoexpandible, de perfil superior, y puede recapturarse y reposicionarse parcialmente para una colocación óptima.
El uso de la válvula Sapien o de una valvuloplastia aórtica con balón antes de la implantación de la válvula requiere una estimulación ventricular rápida (160-220 latidos/minuto) mediante un marcapasos transvenoso temporal. Esto minimiza el flujo sanguíneo en el tracto de salida del ventrículo izquierdo, lo que reduce el riesgo de migración de la válvula durante el despliegue.25 Puede que los pacientes con estenosis aórtica no toleren bien la estimulación rápida y la consiguiente hipotensión, pero esta situación suele ser transitoria; el uso de vasopresores, como la fenilefrina o la norepinefrina, debe considerarse para tratar la hipotensión solo si es persistente, ya que puede desarrollarse una hipertensión de rebote después del cese de la estimulación.
Aunque la mortalidad global del TAVR sigue siendo baja, entre el 1 % y el 4 %, las complicaciones pueden provocar una morbilidad significativa. La mayoría de las complicaciones se identifican de forma intraoperatoria e incluyen lesiones vasculares (4.2 %), disección aórtica (0.2 %), perforación ventricular que provoca taponamiento (1 %), malposición y mal funcionamiento de la válvula (0.3 %), rotura anular (0.4 %), infarto cerebral, infarto de miocardio y bloqueo nodal auriculoventricular de alto grado que requiere un marcapasos permanente (8.8 %)26
La vía de acceso más frecuente para la colocación del dispositivo es la transfemoral (95 %). Otros abordajes son el subclavio/axilar, el transaórtico, el transapical, el transcavo y el transcarotídeo. La vía transfemoral tiene la ventaja de que las molestias para el paciente son mínimas y los requisitos de sedación son mínimos. A medida que la tecnología se vuelve más sofisticada y los intervencionistas se vuelven más hábiles, el uso de una sedación leve-moderada para el TAVR aumentó su popularidad. En los datos recientes se muestra que los beneficios incluyen un menor uso de vasopresores, una modesta disminución de la mortalidad intrahospitalaria, una menor duración de la estancia hospitalaria y un alta más frecuente al domicilio.27 Cuando se usa la sedación con anestesia local, la colocación del dispositivo se confirma con fluoroscopia y transthoracic echocardiography, TTE (ecocardiografía transtorácica, TTE).
Si se prefiere la transesophageal echocardiography, TEE (ecocardiografía transesofágica, TEE) en lugar de la TTE o cuando no es posible un abordaje transfemoral percutáneo, a menudo debido a una vascularidad iliofemoral inadecuada, o se requiere un corte quirúrgico para la reparación vascular, se usa anestesia general con un tubo endotraqueal. Las ventajas de la anestesia general incluyen un campo quirúrgico tranquilo, un control completo de la vía aérea y un reconocimiento temprano de las complicaciones quirúrgicas con la TEE.
Más allá del tipo de anestesia, se recomienda la vigilancia invasiva de la presión arterial. Esto puede lograrse a través de una línea arterial radial o mediante la transducción de la vaina arterial usada por el intervencionista para la aortografía. También se recomienda un acceso intravenoso periférico de gran calibre y un acceso inmediato a sangre cruzada.
Reparación o reemplazo transcatéter de la válvula mitral
La reparación transcatéter de la válvula mitral (Transcatheter mitral valve repair, TMVr) puede considerarse para pacientes con regurgitación mitral sintomática, moderada-grave o grave, para los que la reparación quirúrgica de la válvula se considera de demasiado alto riesgo. El dispositivo MitraClip (Abbott Vascular-Structural Heart, Menlo Park, CA) es en la actualidad el único dispositivo aprobado por la FDA y se hace en un laboratorio de cateterismo cardíaco o en un quirófano híbrido. El dispositivo MitraClip es un dispositivo de reparación de la valva y sigue el modelo de la puntada quirúrgica Alfieri, que crea una reparación de borde a borde y una válvula mitral de doble orificio, lo que reduce el grado de regurgitación mitral.28
Cuando se hace la reparación transcatéter de las valvas, el cirujano obtiene la canulación venosa transfemoral. Mediante la guía fluoroscópica y de TEE en tiempo real, el dispositivo se dirige a través del tabique intraauricular, a través de la aurícula izquierda y a través de la válvula mitral hacia el ventrículo izquierdo. Las imágenes bidimensionales y tridimensionales de TEE son imprescindibles para colocar el dispositivo con precisión. Inmediatamente después de la liberación del MitraClip, el grado de regurgitación mitral y la estenosis iatrogénica se evalúan con TEE. Si la colocación no es óptima, el clip puede recuperarse, reposicionarse o quitarse. También se puede usar más de un clip para reducir la cantidad de regurgitación, si es necesario.29
Se recomienda la anestesia general con un tubo endotraqueal, dada la importancia de la TEE para la colocación del dispositivo. El profesional de la anestesia suele obtener un acceso arterial radial para hacer una estrecha monitorización hemodinámica y extracciones analíticas. Pueden ser necesarias frecuentes extracciones de sangre para lograr el nivel deseado de anticoagulación. Si el acceso arterial radial es difícil, se pueden usar otros puntos de acceso arterial. La colocación de una vía venosa central no suele ser necesaria, aunque se recomienda un acceso intravenoso de gran calibre debido al riesgo de conversión emergente a una reparación quirúrgica abierta. Debe haber sangre cruzada disponible en la sala de procedimientos.29
Las complicaciones de la TMVr incluyen el desprendimiento parcial del clip o la embolización, el taponamiento, la hemorragia en los puntos de acceso y la estenosis mitral iatrogénica. Es importante señalar que la TMVr puede dar lugar a una comunicación auricular iatrogénica en el lugar de la punción septal. Si se observa una derivación, todas las vías intravenosas deben evaluarse con detenimiento para detectar aire, para evitar un derrame cerebral.
Como alternativa, que se hace con menos frecuencia, la sustitución transcatéter de la válvula mitral (TMVR) está aprobada por la FDA para los pacientes de alto riesgo que tienen una válvula mitral defectuosa previamente sustituida o reparada con una válvula bioprotésica o un anillo de anuloplastia, respectivamente. Las válvulas Edwards Sapien 3 o Sapien 3 Ultra, diseñadas para la TAVR, se usan en estos pacientes para la sustitución de la válvula en la válvula o el anillo. Algunas instituciones también están usando las válvulas TAVR de forma no autorizada para tratar la valvulopatía mitral nativa refractaria en fase terminal. La tecnología de TMVR sigue evolucionando y su uso se vio limitado por los malos resultados obtenidos. Al igual que con la TMVr, se suele usar anestesia general para la TMVR debido al uso necesario de la TEE.
PROCEDIMIENTOS CARDIACOS ADICIONALES FUERA DEL CENTRO
Ecocardiografía transesofágica de diagnóstico
La TEE se usa para visualizar mejor las estructuras cardíacas que no se visualizan bien con la TTE. Aunque el uso rutinario de la TEE no es apropiado, ya que la TEE conlleva poco o ningún riesgo y a menudo es adecuada para el diagnóstico, hay varias situaciones clínicas en las que se prefiere la TEE. Las indicaciones clínicas para la TEE pueden incluir la patología valvular y la planificación quirúrgica, la evaluación urgente de la patología aórtica aguda (es decir, la disección aórtica), el diagnóstico de la endocarditis infecciosa y antes de la cardioversión de corriente directa (direct-current cardioversion, DCCV) no urgente o la ablación para evaluar la presencia de trombos intracardíacos.
La TEE diagnóstica suele hacerse con una sedación moderada. Debe evitarse la apnea. Para disminuir la cantidad de sedación necesaria, se puede usar con cuidado una instalación tópica de la faringe con lidocaína. La anestesia tópica con benzocaína cayó en desuso debido al riesgo de sufrir metahemoglobinemia. El glicopirrolato intravenoso también puede usarse para minimizar las secreciones orales.30 La estimulación asociada a la inserción de la sonda de TEE puede mitigarse con un bolo de propofol de 0.25 mg/kg-0.5 mg/kg. Tras la inserción, el grado de estimulación disminuye con rapidez y se puede conseguir una sedación moderada con una infusión de propofol de baja dosis o bolos de propofol incrementales. El propofol tiene la ventaja de un inicio y un metabolismo rápidos, y unos efectos residuales mínimos tras el procedimiento.28 De forma alternativa, se puede usar un bolo de dexmedetomidina de 0.5-1 mcg/kg durante diez minutos o una infusión de 0.2-1 mcg/kg/hora con una anestesia tópica adecuada de la vía aérea.
En ciertas poblaciones de pacientes de alto riesgo, como los que tienen una vía aérea difícil, un alto riesgo de aspiración, un estado neurológico deteriorado o aquellos con aislamientos aéreos, como el COVID-19, puede estar justificada la anestesia general con un tubo endotraqueal. Dado que la TEE es un procedimiento de aerosolización, debe evitarse su uso electivo en pacientes con el COVID-19 a menos que los hallazgos cambien el manejo clínico.
Aunque la TEE es un procedimiento que, por lo general, es seguro, se producen complicaciones como laringoespasmos, aspiraciones, lesiones faríngeas, vísceras perforadas y hemorragias. El tratamiento inicial para estos eventos adversos suele ser la intubación endotraqueal y la reanimación.
Cardioversión de corriente directa (DCCV)
La cardioversión de corriente directa (Direct-Current Cardioversion, DCCV) suele ser un procedimiento breve que requiere una acción de inicio y cese rápidos de la anestesia. Tras la aplicación de monitorización estándar según la ASA y capnografía, se administra un bolo de propofol de 0.25-0.5 mg/kg de forma que el paciente no responda a la estimulación táctil o verbal. Debe evitarse la apnea. Una vez confirmada la sedación profunda, se puede administrar la descarga eléctrica. Los pacientes que se someten a la DCCV pueden tener un bajo gasto cardíaco, un tiempo de circulación lento y un retraso en el inicio de la medicación de inducción, lo que puede provocar una sobresedación. Los medicamentos para tratar la hipotensión o la bradicardia, como la fenilefrina, la efedrina y el glicopirrolato o la atropina, deben estar fácilmente disponibles.28,31 Se deben colocar electrodos de desfibrilación externos previos al procedimiento si hay asistolia posterior a la DCCV y si se requiere estimulación extrínseca. Si un paciente tiene un dispositivo cardíaco electrónico implantable, como un marcapasos o un desfibrilador, se debe analizar el dispositivo de inmediato después de la cardioversión externa o la desfibrilación.8
CONCLUSIONES
A medida que las intervenciones cardíacas se vuelven más sofisticadas y menos invasivas, los profesionales de anestesia tienen la tarea de dar una atención médica segura en una amplia variedad de lugares, a menudo muy alejados del quirófano. Además, los pacientes que se someten a estos procedimientos tienen historias clínicas complejas y están más agudamente enfermos. Como componente integral del equipo de atención, es imperativo que el profesional de la anestesia esté familiarizado con los desafíos de los procedimientos fuera del quirófano, entienda el procedimiento en sí mismo y pueda anticiparse a los escollos para dar una atención segura al paciente.
Todd Novak, MD, es anestesiólogo en NorthShore University HealthSystem y profesor clínico asociado en la Facultad de Medicina Pritzker de University of Chicago.
Chelsea Zur , MD, es anestesiólogo en NorthShore University HealthSystem e instructora clínica en la Facultad de Medicina Pritzker de University of Chicago.
Los autores no tienen conflictos de intereses.
REFERENCIAS
- Gaitan BD, Trentman TL, Fassett SL, et al. Sedation and analgesia in the cardiac electrophysiology laboratory: a national survey of electrophysiologists investigating the who, how, and why? J Cardiothorac Vasc Anesth. 2011;25:647–659.
- Anderson R, Harukuni I, Sera V. Anesthetic considerations for electrophysiologic procedures. Anesthesiol Clin. 2013;31:479–489.
- Metzner J. Posner KL, Domino KB. The risk and safety of anesthesia at remote locations: the US closed claims analysis. Curr Opin Anaesthesiol. 2009;22:502–508.
- Shook D, Evangelista K. Anesthetic considerations for electrophysiology, interventional cardiology, and transesophageal echocardiography procedures. In: Post TW, ed. UpToDate. UpToDate; 2021. Accessed September 9, 2021.
- Practice Advisory for the Perioperative Management of Patients with Cardiac Implantable Electronic Devices: Pacemakers and Implantable Cardioverter–Defibrillators 2020: An Updated Report by the American Society of Anesthesiologists Task Force on Perioperative Management of Patients with Cardiac Implantable Electronic Devices. Anesthesiology. 2020;132:225–252.
- Gupta A, Perera T, Ganesan A, et al. Complications of catheter ablation of atrial fibrillation: a systematic review. Circ Arrhythm Electrophysiol. 2013;6:1082–1088.
- Kumareswaran R, Marchlinski FE. Practical guide to ablation for epicardial ventricular tachycardia: when to get access, how to deal with anticoagulation and how to prevent complications. Arrhythm Electrophysiol. Rev. 2018;7:159–164.
- Haines DE, Beheiry S, Akar JG, et al. Heart Rhythm Society expert consensus statement on electrophysiology laboratory standards: process, protocols, equipment, personnel, and safety. Heart Rhythm. 2014 Aug;11:e9–51.
- Fujii S, Zhou JR, Dhir A. Anesthesia for cardiac ablation. J Cardiothorac Vasc Anesth. 2018;32:1892–1910.
- Lai LP, Lin JL, Wu MH, et al. Usefulness of intravenous propofol anesthesia for radiofrequency catheter ablation in patients with tachyarrhythmias: infeasibility for pediatric patients with ectopic atrial tachycardia. Pacing Clin Electrophysiol. 1999;22:1358–1364.
- Burjorjee JE, Milne B. Propofol for electrical storm: a case report of cardioversion and suppression of ventricular tachycardia by propofol. Can J Anaesth. 2002;49:973–977.
- Mulpuru SK, Patel DV, Wilbur SL, et al. Electrical storm and termination with propofol therapy: a case report. Int J Cardiol. 2008;128:e6–8.
- Niksch A, Liberman L, Clapcich A, et al. Effects of remifentanil anesthesia on cardiac electrophysiologic properties in children undergoing catheter ablation of supraventricular tachycardia. Pediatr Cardiol. 2010;31:1079–1082.
- Hammer GB, Drover DR, Cao H, et al. The effects of dexmedetomidine on cardiac electrophysiology in children. Anesth Analg. 2008;106:79–83.
- Chrysostomou C, Sanchez-de-Toledo J, Wearden P, et al. Perioperative use of dexmedetomidine is associated with decreased incidence of ventricular and supraventricular tachyarrhythmias after congenital cardiac surgery. Ann Thorac Surg. 2011;92:964–972.
- Herr DL, Sum-Ping STJ, England M. ICU sedation after coronary artery bypass graft surgery: Dexmedetomidine-based versus propofol-based sedation regimens. J Cardiothorac Vasc Anesth. 2003;17:576–584.
- Mittnacht AJC, Dukkipati S, Mahajan A. Ventricular tachycardia ablation: a comprehensive review for anesthesiologists. Anesth Analg. 2015;120:737–748.
- Hayman M, Forrest P, Kam P. Anesthesia for interventional cardiology. J Cardiothorac Vasc Anesth. 2012;26:134–147.
- Houmsse M and Daoud EG (2012) Biophysics and clinical utility of irrigated-tip radiofrequency catheter ablation. Expert Review of Medical Devices. 9:1,59–70.
- Singh SM, d’Avila A, Doshi SK, et al. Esophageal injury and temperature monitoring during atrial fibrillation ablation. Circ Arrhythm Electrophysiol. 2008;1:162–168.
- Tokuda, M., Yamashita, S., Sato, H. et al. Long-term course of phrenic nerve injury after cryoballoon ablation of atrial fibrillation. Sci Rep 11, 6226 (2021).
- Driver K, Mangrum JM. Hybrid approaches in atrial fibrillation ablation: why, where and who? J Thorac Dis. 2015;7:159–164.
- Mack MJ, Leon MB, Thourani VH, et al. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients. N Engl J Med. 2019;380:1695–1705.
- Coylewright M, Forrest J, McCabe J, Nazif T. TAVR in low-risk patients: FDA approval, the new NCD and shared decision-making. JACC. 2020;75:1208–1211.
- Novak T, Parulkar S. The anesthesia professional’s role in patient safety during TAVR (transcatheter aortic valve replacement). APSF Newsletter. 2017;31:73–75.
- Dalby M, Panoulas V. Transcatheter aortic valve replacement: complications. In: Post TW, ed. UpToDate, UpToDate, 2021. Accessed October 1, 2021.
- Butala NM, Chung M, Secemsky EA, et al. Conscious sedation versus general anesthesia for transcatheter aortic valve replacement: variation in practice and outcomes. J Am Coll Cardiol Intv. 2020;13:1277–1287.
- Faillace R, Kaddaha R, Bikkina M, et al. The role of the out-of-operating room anesthesiologist in the care of the cardiac patient. Anesthesiology Clin. 2009;27:29–46.
- Gregory SH, Sodhi N, Zoller JK, et al. Anesthetic considerations for the transcatheter management of mitral valve disease. J Cardiothorac Vasc Anesth. 2019;33:796–807.
- Hahn R, Abraham T, Adams M, et al. Guidelines for performing a comprehensive transesophageal echocardiographic examination: recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiography. 2013;26:921–964.
- Lu F, Lin J, Benditt D. Conscious sedation and anesthesia in the cardiac electrophysiology laboratory. J Cardiovasc Electrophysiol. 2013;24:237–245.


 Issue PDF
Issue PDF