المقدمة
في مستشفيات الرعاية اليومية بالولايات المتحدة، يُصاب 3.2% من المرضى بواحدة أو أكثر من حالات العدوى المرتبطة بالرعاية الصحية (HAIs) ما يؤدي إلى زيادة الإصابة بالأمراض بين المرضى والوفيات ومدة الاستشفاء وتكاليف الرعاية الصحية.1 وتعد حالات عدوى مجرى الدم المرتبطة بالقسطرة (CRBSIs) من المسببات الأكثر شيوعًا لحالات العدوى المرتبطة بالرعاية الصحية (HAI) ويمكن أن تحدث هذه الحالات مع القسطرات المركزية وكذلك الطرفية الوعائية.1 وثمة ما يقرب من 250,000 حالة من حالات CRBSI كل عام في الولايات المتحدة ناجمة عن قسطرة الأوعية الدموية قصيرة وطويلة الأجل وما ينتج عنها اعتلالات خطيرة، تشمل تعفن الدم ومضاعفات أخرى والوفاة.1 وفي عام 2014، سجلت مستشفيات الرعاية اليومية في الولايات المتحدة أكثر من 31,000 مريض مصاب بعدوى مجرى الدم المرتبطة بالخط المركزي (CLABSI)، بتكلفة سنوية تقديرية تتراوح بين 0.6 و2.7 مليار دولار ومعدل وفيات يتراوح بين 12 و25%.1 وتتراوح معدلات الإصابة بعدوى مجرى الدم المرتبطة بالخط المركزي (CLABSI) بشكل عام بين 1.1 و2.5/1000 قسطرة يوميًا، كما تزيد كل حالة CLABSI في متوسط الإقامة في المستشفى بمقدار 10.4 أيام وتزيد التكاليف بأكثر من 45,000 دولار.1 وفي استعراض لحالات CRBSI الناجمة عن القسطرة الوريدية الطرفية (PIVC) من عام 1980 إلى 2106، بلغ معدل حدوث العدوى (الذي لم يتم الإبلاغ عنه لكل 1000 يوم قسطرة) 1.8 إصابة/ 1000 قسطرة. وفي دراسة عام 2014 بلغ معدل حالات CRBSI الناجمة عن القسطرة الشريانية 1.26/1000 يوم قسطرة، مع زيادة خطر CRBSI في منطقة الفخذ بمقدار 1.9 مرة أعلى من منطقة الساعد.1 وقد يحدث التلوث الجرثومي للقسطرات الوعائية إما من 1) المسار خارج التجويف الذي يتضمن النقل البعيد من موقع الإدخال أو 2) تلوثًا داخل التجويف، الذي قد يحدث عند إدخال هذه القسطرات واستخدامها، مع مصادر أقل تواترًا من الانتشار الدموي أو التسريب الملوث.
يعد إدخال القسطرات الوعائية أمرًا روتينيًا في أثناء تقديم خدمة التخدير والرعاية الأخرى إلى المرضى، ولكن هل يستخدم اختصاصيو الرعاية الصحية الأساليب المثلى لتقليل مخاطر حالات العدوى المرتبطة بالرعاية الصحية (HAIs) المتعلقة بإدخال القسطرة الوعائية؟ وإذا لم تستخدم تقنية التعقيم ونظافة اليدين عند إدخال القسطرات الوعائية، فقد يحدث تلوث داخل التجويف لمنافذ الحقن (مثل، صمامات التجويف المفتوح [OLSs] والموصلات المغلقة غير الإبرية القابلة للتعقيم [DNCCs]) مع احتمالية ظهور مسببات الأمراض الميكروبية الأمر الذي قد يؤدي إلى حالات CRBSI وغيرها من حالات العدوى المرتبطة بالرعاية الصحية (HAIs).1-3 وللأسف، تم الإبلاغ عن معدلات منخفضة للالتزام بنظافة الأيدي بين أخصائيي التخدير تتراوح بين 2.9% و18%.1,4 يمكن أن تتلوث المحاقن وسوائل الحقن في أثناء تحضير الدواء والاستخدام السريري ما ينتج عنه حقن محتويات ملوثة في مجرى الدم وكذلك تلوث منافذ الإدخال.1,2,5-7 وتوصي مؤسسة Anesthesia Patient Safety Foundation وجمعية Association for Professionals in Infection Control and Epidemiology ومعهد Institute for Safe Medication Practices بزيادة استخدام المحاقن والمحاليل الدوائية المعدة بواسطة الجهة المصنعة أو في الصيدلية، وذلك لتقليل التلوث وأخطاء الأدوية في أثناء تحضير الأدوية والسوائل وتناولها.1,2,5,6 وكذلك تقدم مراكز مكافحة الأمراض والوقاية منها توصيات لممارسات الحقن الآمن.7 وسنقدم في هذه المقالة مقارنة ومقابلة لمخاطر التلوث والعدوى المتعلقة باستخدام صمامات التجويف المفتوح (OLSs) مقابل الموصلات المغلقة غير الإبرية القابلة للتعقيم (DNCCs)، كما سنناقش التوصيات وكذلك القضايا العالقة إزاء تعقيم الموصلات المغلقة غير الإبرية القابلة للتعقيم (DNCC).
مخاطر التلوث والعدوى المتعلقة باستخدام صمامات التجويف المفتوح (OLSs) والموصلات المغلفة غير الإبرية القابلة للتعقيم (DNCCs) المعقمة
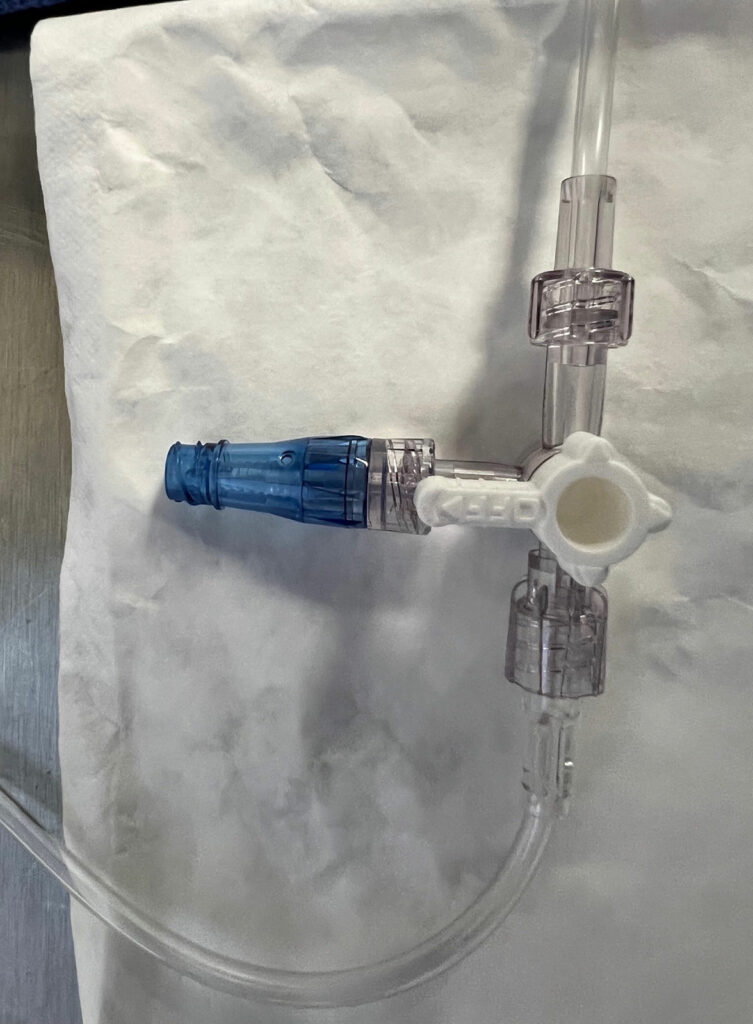
يشيع استخدام صمامات التجويف المفتوح (OLSs) في ممارسة التخدير؛ لكن، قد يحدث تلوث للأسطح داخل التجويف في نسبة تتراوح بين 32% و38% من حالات التخدير.8,9 فلا يمكن تعقيم صمام التجويف المفتوح (OLS) بشكل فعال باستخدام ضمادة كحول الأيزوبروبيل (IPA) المركز بنسبة 70% ولا جهاز تعقيم منفذ الحقن بالفرك.3,10 يعد صمام التجويف المفتوح (OLS) عرضة للتلوث نظرًا إلى تصميمه المزود بغطاء قابل للإزالة الذي يكشف أسطح التجويف الداخلية (الشكل 1). بينما أكثر من 50% من موصلات DNCC ملوثة بالبكتيريا الموجودة على أسطح الحقن قبل التعقيم المناسب،11,12 يمكن تعقيم سطح حقن موصل DNCC بمستوى عالٍ من الفعالية وذلك عبر التنظيف بضمادة معقمة تحتوي على الكحول أو باستخدام غطاء IPA (الشكل 2).1,3,11-17 وفي مراجعة نقدية حديثة لمنافذ الحقن، تضمنت 8 من 10 دراسات معدلات أقل بكثير من التلوث داخل التجويف مع موصلات DNCC المعقمة مقارنةً بصمامات OLS، كما تضمنت دراستان من 7 دراسات معدلات منخفضة بشكل كبير لإصابات CLABSI أو حالات CRBSI مع موصلات DNCC المعقمة مقارنة بصمامات OLS (قيمت بعض الدراسات كلاً من معدلات التلوث ومعدلات الإصابة، بينما قيمت دراسات أخرى نتيجة واحدة فقط: إما معدلات التلوث أو معدلات الإصابة).1 وعند استعراض المجموعة الفرعية لهذه الدراسات التي تم فيها تعقيم كل من صمامات OLS وموصلات DNCC قبل الإدخال، وجدت 7 من 9 دراسات معدلات أقل بكثير من التلوث داخل التجويف مع موصلات DNCC مقارنةً بصمامات OLS، بينما وجدت دراسة واحدة من 4 دراسات معدلاً أقل بكثير من حالات CLABSI مع موصّلات DNCC.1 في حين لم تجد أي دراسة أن صمامات OLS كانت مفيدة مقارنةً بموصلات DNCC (انظر الجدول 1).1
الجدول 1: مقارنة بين الموصلات المغلقة غير الإبرية القابلة للتعقيم (DNCCs) وصمامات التجويف المفتوح (OLSs)
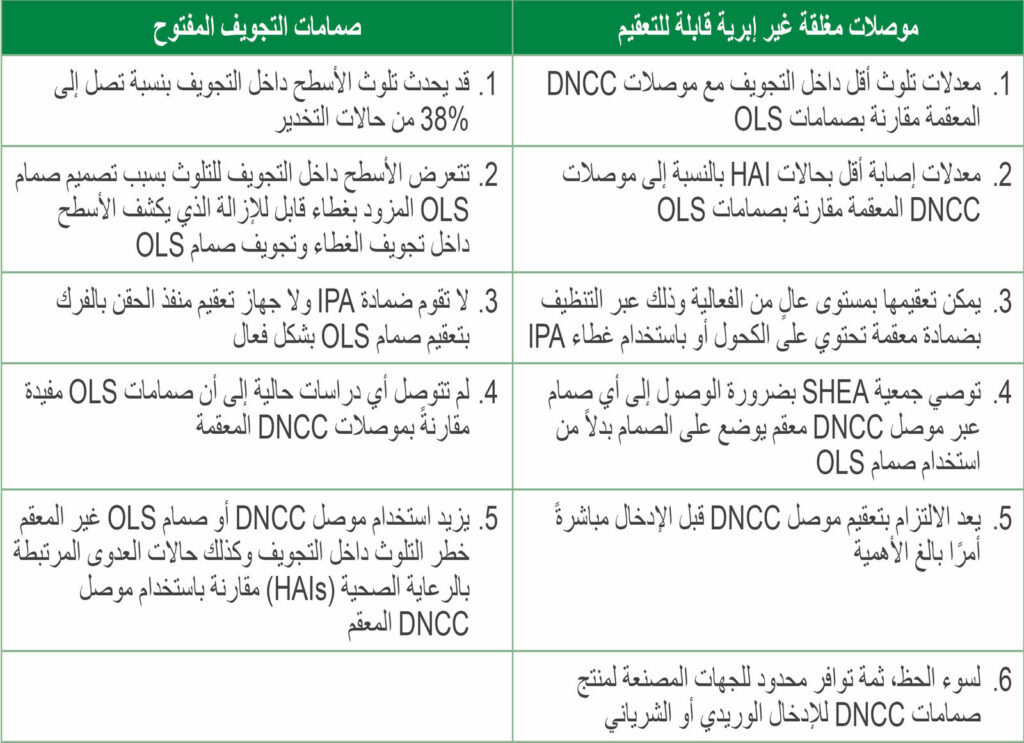
الاختصارات: صمام DNCC، صمام مزود بموصل DNCC متصل (يفضل أن يكون مربوطًا) بتجويف الحقن؛ HAIs، حالات العدوى المرتبطة بالرعاية الصحية؛ IPA، كحول الأيزوبروبيل بنسبة 70%؛ SHEA، جمعية Society for Healthcare Epidemiology of America
الحقن الميكروبي والغشاء الحيوي
يمكن أن يؤدي الفشل في تعقيم موصلات DNCC قبل الإدخال أو تلوث صمامات OLS في أثناء الاستخدام السريري إلى تلوث التجويف الداخلي1,15 ما ينتج عنه تكوين غشاء حيوي (كائنات دقيقة مكدسة في مصفوفة النسيج الغشائي المحيط بالخلية) على أسطح القسطرة ما يؤدي إلى زيادة خطر حالات العدوى المرتبطة بالرعاية الصحية (HAIs).18,19
حتى إن إغفال تعقيم DNCC ولو لمرة واحدة قبل الإدخال يمكن أن يتسبب في تكون الغشاء الحيوي.19 وللأسف، كان الالتزام بتعقيم موصلات DNCC (بما في ذلك نظافة اليدين وتقنية التعقيم) يمثل تحديًا لاختصاصيي الرعاية الصحية.1,15,20 وعلى الرغم من أن الأبحاث الحالية لا تشرح بشكل كامل آليات دفاع الأغشية الحيوية ضد العوامل المضادة للميكروبات، فإن السكريات المتعددة الخارجية تُعيق المضادات الحيوية بشأن اختراق مصفوفة الغشاء الحيوي للوصول إلى البكتيريا الموجودة في الغشاء الحيوي.21
قد يكون الغشاء الحيوي كذلك مقاومًا لجهاز المناعة لدى المضيف.22,23 ومن ثم، يمكن أن يكون الغشاء الحيوي مصدرًا لتجرثم الدم والالتهابات المزمنة.21-23 وبينما تشير الدراسات المختبرية إلى قدرة كريات الدم البيضاء على اختراق الأغشية الحيوية بشكل فعال، تشير دراسات أُجريت على الحيوانات إلى أن تكوين الأغشية الحيوية ينتج عنه “هروب” استجابة الجهاز المناعي للمُضيف من “الاستجابة المسببة للالتهابات والمبيدة للجراثيم” تجاه “استجابة مضادة للالتهاب مسببة للتليف”.22 ويعمل تكوين الغشاء الحيوي على أسطح القسطرات وغيرها من الأجهزة الطبية المزروعة على حماية البكتيريا ما يساعد على استمرار العدوى.22
وقد تفسر إحدى الآليات الإضافية للحقن الميكروبي ارتباط تلوث OLS وDNCC بزيادة مخاطر حالات العدوى المرتبطة بالرعاية الصحية (HAIs) اللاحقة.1,14 وقد يحدث الحقن الميكروبي المباشر العرضي في مجرى الدم في أثناء الإدخال الوعائي عبر صمام OLS ملوث أو الفشل في تعقيم سطح حقن موصل DNCC قبل الحقن. قد يحدث كذلك الحقن الميكروبي المباشر العرضي في حال استخدام حُقنة أو سائل مُلوث.1,2,5-7 وفي تجربة مراقبة عشوائية (RCT) خارج الجسم، أُجريت في أثناء التخدير السريري المتزامن، دخلت تقريبًا 10,000 وحدة تشكيل مستعمرة من البكتيريا دائرة الاختبار لكل عملية حقن عندما لم يتم تعقيم موصلات DNCC أو صمامات OLS قبل الإدخال.14 وفي هذه الدراسة، كان معدل حدوث الحقن البكتيري العرضي أقل بشكل ملحوظ عند استخدام صمامات DNCC المعقمة (70% كحول [الطريقة غير محددة] مع 30 ثانية تجفيف) مقارنة بصمامات OLS أو صمامات DNCC دون تعقيم.14
التوصيات الأخيرة من جمعية Society for Healthcare Epidemiology of America
نشرت جمعية Society for Healthcare Epidemiology of America (SHEA) مؤخرًا إرشادات للوقاية من العدوى في بيئة عمل التخدير.15 كما أوصت جمعية SHEA باستخدام موصلات DNCC المعقمة على الصمامات عند حقن الأدوية كخيار مفضل للاستخدام السريري بدلاً من استخدام صمامات OLS.24,25 كما أشارت جمعية SHEA كذلك إلى أن “الصمامات الموجودة على أجهزة قياس ضغط السوائل تفتح دوريًا للهواء لمعايرة جهاز قياس ضغط السوائل” وأنه “يمكن تغطية هذه الصمامات بشكل معقول بأغطية معقمة بدلاً من منافذ الحقن غير الإبرية” (DNCCs)، لكنها لم تعلق على طريقة الحفاظ على التعقيم في التجويف الداخلي عند فتح جهاز قياس ضغط السوائل وتعرضه للهواء.25 من المهم أن تحافظ الصمامات المستخدمة لتصفير أجهزة قياس ضغط السوائل على التعقيم الداخلي. في الوقت الذي تحتوي بعض أجهزة قياس ضغط السوائل على غطاء به فتحة “صغيرة” (أصغر بكثير من التجويف الداخلي) يمكن أن تغني عن الحاجة إلى إزالة الغطاء في أثناء التصفير، فإنه من غير المعروف ما إذا كان يتم الحفاظ على التعقيم داخل تجويف الأنبوب أم لا نظرًا إلى أن هذا التجويف “الصغير” معرض باستمرار للبيئة الخارجية. إضافة إلى ذلك، إذا لم يتم ربط هذا الغطاء بصمام الإغلاق، فقد يفسد المزود أي ميزة ممكنة لتصميم هذا الغطاء عن طريق إزالة الغطاء في أثناء التصفير، ومن ثم تعريض أسطح التجويف الداخلي للتلوث البيئي المحتمل. وقد يكون الصمام المزود بفلتر بكتيري مربوط بتجويف التصفير بمنزلة خيار بديل.
إدخال القسطرات الوعائية عبر موصلات DNCC المعقمة
تدعم المؤلفات الحالية وجوب استخدام موصلات DNCC المعقمة بدلاً من صمامات OLS بناءً على المعطيات الآتية: الانخفاض الإجمالي الموثق للتلوث ومخاطر العدوى لموصلات DNCC المعقمة مقارنةً بصمامات OLS كما هو موضح أعلاه (الجدول 1) وتوصيات جمعية SHEA الأخيرة “بضرورة إغلاق صمامات حقن الأدوية بشكل مثالي مع منافذ الحقن غير الإبرية “.25 ولتقليل مخاطر العدوى المرتبطة بالمريض، يجب إدخال القسطرات الوعائية المستخدمة لإعطاء الأدوية أو السوائل أو سحب الدم بشكل روتيني عن طريق موصلات DNCC المعقمة (على سبيل المثال، في مجموعات الأنابيب الوريدية [IV]) أو عبر صمامات DNCC المعَقَّمة. الالتزام بالتعقيم أمر أساسي. وبالنسبة إلى صمامات DNCC، فإنه يفضل ربط موصل DNCC بتجويف الحقن الموجود بالصمام لتجنب إزالة موصل DNCC وتجاوزه.1 وفي حين أن توصيات جمعية SHEA الأخيرة25 لا تتناول على وجه التحديد استخدام موصلات DNCC للحصول على عينات الدم من أنابيب الضغط الشرياني، فإن الدراسات الحالية1 تدعم الحصول على عينات الدم من مجموعات الأنابيب الشريانية عبر صمامات DNCC المعقمة بدلاً من صمامات OLS. سيكون الاستعمال السريري الوحيد الذي لا تمثل فيه صمامات OLS خطر كبير للتلوث أو العدوى مقارنةً بصمامات DNCC المعقمة عندما يكون استخدام صمامات OLS مقتصرًا على الإجراءات ذات الصلة بمجال التعقيم.1
التوفر المحدود للجهات المصنعة لصمامات DNCC
حاليًا، لا تتضمن مجموعات أنابيب جهاز قياس ضغط السوائل الوريدية (IV) والشريانية صمامات DNCC عادةً.1 ويجب على الجهات المصنعة تزويد مجموعات أنابيب جهاز قياس ضغط السوائل الوريدية (IV) والشريانية بصمامات موصلات DNCC بدلاً من صمامات OLS كما يجب أن تتوافر صمامات DNCC كعناصر في عبوات فردية. ثمة عدة أسباب لعدم تضمين صمامات DNCC بشكل روتيني في مجموعات الأنابيب، منها نقص وعي الطبيب والجهة المصنعة بتفوق موصلات DNCC، إلى جانب التقاعس بشأن تغيير أنماط الممارسة الحالية وزيادة التكلفة. ومع ذلك، فإن الحاجة إلى تحسين السلامة من خلال اعتماد موصلات DNCC أمرًا لا مفر منه ولا ينبغي أن تمثل التكلفة الزائدة عائقًا. على سبيل المثال، تكلف أجهزة السلامة الوقائية من الإصابات الحادة أكثر من الأجهزة غير المرتبطة بالسلامة، ولكنها تستخدم الآن كمتطلبات أمان قياسية.1,26
طريقة التعقيم ونوع المعقم
يعد نوع المعقم وطريقة التعقيم المستخدمة في موصلات DNCC من العوامل الأساسية لزيادة فعالية المعقم والحد من حالات HAI غير المرغوب فيها.1,27 تسلط الاختلافات في نتائج العديد من الدراسات المختبرية والسريرية المختارة الضوء على الصعوبات في تحديد التوصيات النهائية للتعقيم (الجدول 2). مما لا يدعو للدهشة، عدم وجود إجماع في الآراء بين الخبراء فيما يتعلق بالمعقم الموصي به وطريقة التعقيم (على سبيل المثال، الفرك مقابل “التنظيف”) ومدة التعقيم ووقت التجفيف وما إذا كان يجب استخدام أغطية كحول الأيزوبروبيل (IPA) (انظر الجدول 3).1 توصي جمعية SHEA بضرورة تعقيم موصلات DNCC مباشرةً قبل كل إدخال أو قبل سلسلة من عمليات الحقن السريعة، على سبيل المثال في أثناء حقن أدوية التخدير، إما عن طريق الفرك (لم يتم تحديد المدة) باستخدام ضمادة معقمة تحتوي على الكحول (على سبيل المثال، كحول الأيزوبروبيل (IPA) أو جلوكونات الكلورهيكسيدين [CHG]/كحول الأيزوبروبيل (IPA))، أو استخدام غطاء IPA بشكل مناسب.1,15 وتوصي العديد منالتوجيهات1 بالفرك بمعقم يحتوي علي الكحول؛ لكن، تختلف فترات الفرك الموصي بها من ≥ 5 إلى ≥ 15 ثانية (الجدول 3).31-33 ونظرًا لقلة الالتزام بفترات فرك أطول،15 يجب أن يحدد بحث إضافي الحد الأدنى لمدة الفرك الفعالة.1 إضافةً إلى ذلك، ثم حاجة إلى تجارب عشوائية لمقارنة الطرق والمعقمات المختلفة المستخدمة، نظرًا إلى أن تقنيات تعقيم موصلات DNCC دون المستوى الأمثل قد تزيد خطر الإصابة بحالات HAI. ما يزيد الأمر تعقيدًا أن خطر العدوى من خلال موصلات DNCC المعقمة قد يكون مرتبطًا كذلك بمجموعة متنوعة من سمات سطح الحقن وخصائص التصميم الأخرى الموجودة في مختلف موصلات DNCC، الأمر الذي يمكن أن يؤثر في فعالية التعقيم.12,13,27,35
الجدول 2: أ،ب1) الدراسات المختبرية المحددة لتعقيم أسطح موصل DNCC الملوث، و2) الدراسات السريرية المحددة لتعقيم موصل (DNCC)
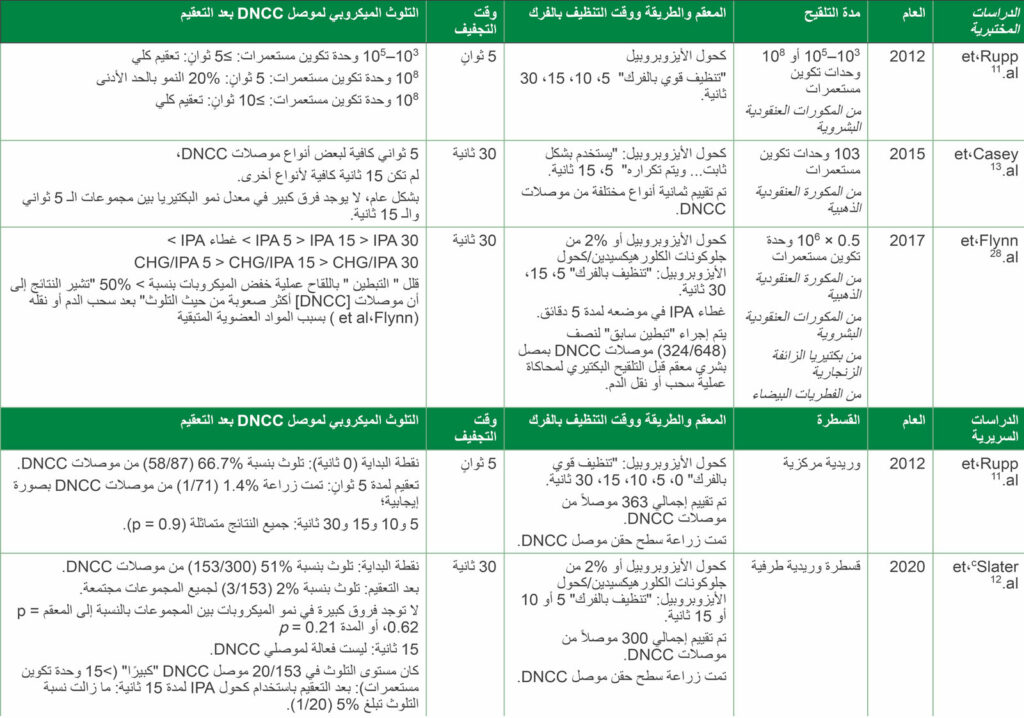
الاختصارات: CFU، عدد وحدات تكوين المستعمرات من البكتيريا/مل لقاح؛ CHG، جلوكونات الكلورهيكسيدين؛ DNCCs، موصلات مغلقة غير إبرية قابلة للتعقيم؛ IPA كحول الأيزوبروبيل 70%؛ PIVC، قسطرة وريدية طرفية.
أ لمزيد من الدراسات انظر المرجع Greene1
ب العناصر الموجودة بين علامتي اقتباس هي المصطلحات المستخدمة في كل مرجع
ج أول تجربة مراقبة عشوائية سريرية لتعقيم موصل DNCC الخاص بالقسطرة الوريدية الطرفية (PIVC)
الجدول 3: أ،بتوصيات لتعقيم موصل DNCC من منظمات وطنية ودولية محددة

الاختصارات: APIC، Association for Professionals in Infection Control and Epidemiology؛ CDC، U.S. Centers for Disease Control and Prevention؛ CHG، جلوكونات الكلورهيكسيدين؛ CLABSI، عدوى مجرى الدم المرتبطة بالخط المركزي، IPA، كحول الأيزوبروبيل 70%؛ NM، غير مذكور في التوصية؛ SHEA، Society for Healthcare Epidemiology of America
أ للحصول على إرشادات إضافية، انظر المرجع Greene،1 Hallam34
ب العناصر بين علامتي اقتباس هي المصطلحات المستخدمة في كل مرجع؛ على سبيل المثال، بمعنى لم تشر جميع المراجع إلى كلمة “فرك” مثل الطريقة المستخدمة
وقت تجفيف المعقم
أفادت دراسة حديثة أن المعقم المستخدم على موصلات DNCC يجب أن يجف قبل الإدخال لتقليل الحمل الميكروبي وإمكانية دخوله مجرى الدم.36 تختلف أوقات تجفيف المعقم بعد فرك موصلات DNCC: يجف كحول الأيزوبروبيل (IPA) خلال 5 ثواني بينما تجف جلوكونات الكلورهيكسيدين/كحول الأيزوبروبيل خلال 20 ثانية، لكن مادة بوفيدون أيودين لا تجف إلا بعد 6 دقائق.36 ومع ذلك، لا يذكر إلا عدد قليل من الإرشادات التوجيهية الوطنية والدولية الحاجة إلى تجفيف المعقم (الجدول 3).1 وللأسف، تشير فقط بعض الدراسات المختبرية والسريرية إلى وقت التجفيف بعد تعقيم موصلات DNCC، ولم تقارن أي منها تأثير أوقات التجفيف المختلفة، أو عدم التجفيف على الإطلاق، في فعالية التعقيم.1 من بين الدراسات البالغة 21 دراسة إزاء تقييم تعقيم موصلات DNCC التي تم تقييمها في مراجعة نقدية حديثة، حددت إحدى الدراسات وقت التجفيف بمدة 5 ثوانٍ و10 دراسات استخدمت ≥ 30 ثانية للتجفيف ولم تحدد 10 دراسات ما إذا كان التجفيف قد تم استخدامه أم لا.1 تحتاج المزيد من التجارب إلى تناول وقت التجفيف الأمثل في الفترة المحيطة بالجراحة بحيث يتكون لدى اختصاصيي الرعاية الصحية صورة واضحة إزاء كيفية تقليل خطر العدوى.
هل يعد حقن المعقم في موصلات DNCC أمرًا خطيرًا؟
أوصت دراسة حديثة بضرورة تجفيف موصلات DNCC قبل الإدخال لتجنب حقن المعقمات.36 والسؤال الذي لم تتم الإجابة عنه هو ما إذا كان حقن بعض المعقمات في موصلات DNCC أمرًا خطيرًا أم لا. يعد هذا الأمر مصدر قلق كبير حيث إن كحول الأيزوبروبيل (IPA) يتم استقلابه بشكل أساسي إلى الأسيتون، وهي مادة سامة.16,37,38 قارنت دراستان مختبريتان موصلات DNCC التي تم تنظيفها بالحك باستخدام كحول الأيزوبروبيل (IPA) متبوعًا بتجفيف لمدة 15 ثانية37 أو باستخدام جلوكونات الكلورهيكسيدين (CHG)/الإيثانول مع تجفيف لمدة 30 ثانية،38 متبوعًا بحقن محلول ملحي. اقترحت تلك الدراستان أن مستويات الكحول في سوائل دائرة الاختبار كانت غير قابلة للكشف37 أو “منخفضة”38 (بلغ الحد الأقصى بالميكروجرام لكل حقنة في المختبر < 8% من المقدار الذي ينبغي أن ينتج الحد المقدر لتركيز الدم السام في حديثي الولادة، الذي تم تحديده بأكثر من 0.25 مجم/مل). تعد الدراسات حول الحقن الوريدي (IV) المحتمل بالكحول أو جلوكونات الكلورهيكسيدين (CHG) عبر موصلات DNCC قبل تجفيف المعقم محدودة في الدوريات الحالية، ومن ثم هناك حاجة إلى مزيد من الدراسات.
أغطية كحول الأيزوبروبيل (IPA)
تتضمن العديد من التوصيات الوطنية والدولية خيار استخدام أغطية IPA على موصلات DNCC حيث إنها توفر التعقيم الخامل وتستبعد الحاجة إلى التنظيف اليدوي (بعد الحد الأدنى من وقت التلامس) وتوفر مؤشرًا واضحًا للتعقيم، كما توفر حاجزًا للتلوث، وقد تزيد مستوى الالتزام بالتعقيم مقارنةً بالتعقيم اليدوي.1,15,17,39 ويتطلب استخدام غطاء IPA على الأقل الحد الأدنى من مدة التلامس على موصلات DNCC قبل الإدخال (يتطلب الأمر الفرك اليدوي لفترات أقصر)، ما يسمح للمعقم بالتجفيف قبل الإدخال، والتخلص من الغطاء بعد كل استخدام.
توصلت تجربة مراقبة عشوائية (RCT) “تجريبية” حديثة إلى أنه لا توجد أي فروق كبيرة في معدلات حالات CLABSI لدى البالغين عند مقارنة التنظيف بالفرك باستخدام كحول IPA أو CHG/IPA، أو باستخدام أغطية IPA.27 وبالرغم من توصيات جمعية SHEA لعام 201915 التي أشارت إلى استخدام أغطية IPA بوصفها “أفضل ممارسة”، تشير هذه الدراسة “التجريبية” لعام 2021 تشير إلى أنه ينبغي إجراء دراسات أكبر وأكثر تحديدًا.27 كما حذرت دراستان مختبريتان من استخدام أغطية IPA لحديثي الولادة لأن حقن المحلول الملحي بعد إزالة غطاء IPA أدى إلى وجود مستويات “كبيرة” من كحول IPA في سوائل دائرة الاختبار.16,37,38 كما توصلت إحدى الدراسات إلى وجود مستويات كبيرة من كحول IPA في سوائل دائرة الاختبار بعد 24 ساعة من استخدام غطاء IPA، بجانب مستويات IPA أعلى عندما تعرضت موصلات DNCC لأغطية IPA لمدة 7 أيام.38 ومثّل وجود كحول IPA الذي تم حقنه في دائرة الاختبار مشكلة كذلك لأنه وفق إحدى الدراسات بعد إزالة غطاء IPA، تم السماح لموصل DNCC بالجفاف لمدة 30 ثانية قبل الحقن.38 كما تم اقتراح استخدام أغطية معقمة تحتوي على الإيثانول بدلاً من كحول IPA كبديل لتقليل خطر التسمم عند حديثي الولادة.38
الخلاصة
 ثمة العديد من القضايا التي تجب مراعاتها لتقليل مخاطر العدوى عند إدخال القسطرات الوعائية. ينتج عن تصميم صمام OLS معدل مرتفع من التلوث الميكروبي داخل التجويف في أثناء الاستخدام السريري، ولا تقوم ضمادة IPA ولا جهاز تعقيم منفذ الحقن بالفرك بتعقيم صمام OLS بفعالية. في المقابل، يمكن تعقيم سطح الحقن لموصلات DNCC بمستوى أعلى من الفعالية. على الرغم من أن الأسئلة لا تزال قائمة حول المعقم الأفضل وطريقة التعقيم والتصميم الأمثل لموصلات DNCC، فقد توصلت دراسات متعددة إلى وجود معدلات أقل من التلوث داخل التجويف مع موصلات DNCC المعقمة مقارنةً بصمامات OLS، كما وجدت بعض الدراسات معدلات أقل لحالات HAI عند استخدام موصلات DNCC مقارنة بصمامات OLS. لم تتوصل أي دراسات حالية إلى أن صمامات OLS مفيدة مقارنةً بموصلات DNCC المعقمة. يجب على الجهات المصنعة تزويد أطقم الأنابيب الوريدية (IV) بموصلات DNCC وصمامات DNCC بدلاً من صمامات OLS، ويجب كذلك أن تكون صمامات DNCC متاحة بصورة فردية. يجب أن تتضمن أطقم الأنابيب الشريانية صمام DNCC لأخذ عينات الدم وجهاز لتصفير جهاز قياس ضغط السوائل الذي يحافظ على التعقيم داخل التجويف. يجب أن يقتصر استخدام صمامات OLS على مناطق التعقيم. يعد التزام مقدم الرعاية الصحية بتعقيم موصلات DNCC أمرًا بالغ الأهمية للاستخدام الآمن لموصلات DNCC كما يجب أن يتضمن ذلك تقييمات دورية وإعادة التدريب بشأن نظافة اليدين وتقنية التعقيم. يوصى كذلك بزيادة استخدام الأدوية والمحاليل الدوائية المعدة بواسطة الجهة المصنعة أو في الصيدلية واتباع ممارسات الحقن الآمنة لتقليل مخاطر حالات العدوى المرتبطة بالرعاية الصحية (HAIs) المتعلقة بالإدخال الوعائي وكذلك الأخطاء العلاجية. على الرغم من عدم إجماع الآراء بشأن النهج الأمثل لتعقيم موصلات DNCC واستمرار وجود الكثير من الأسئلة، تشير مجموعة من المؤلفات الحالية إلى أنه قبل الإدخال (أو سلسلة من عمليات الحقن السريعة) مباشرة يجب تنظيف موصلات DNCC عبر الفرك بمعقم يحتوي على الكحول مدة 5 ثواني على الأقل (توصي بعض التوصيات بالاستخدام لمدة ≥15 ثانية)، أو استخدام غطاء IPA بشكل صحيح، متبوعًا بالتجفيف قبل الحقن. تتمتع أغطية IPA بمزايا فعالة مقارنةً بالتنظيف اليدوي بالفرك؛ لكن، ثمة حاجة إلى دراسات إضافية لتحديد ما إذا كانت أغطية IPA أكثر فعالية في تقليل حالات العدوى المرتبطة بالرعاية الصحية (HAIs) من الطرق البديلة الحالية، وما إذا كانت آمنة للاستخدام لحديثي الولادة.
ثمة العديد من القضايا التي تجب مراعاتها لتقليل مخاطر العدوى عند إدخال القسطرات الوعائية. ينتج عن تصميم صمام OLS معدل مرتفع من التلوث الميكروبي داخل التجويف في أثناء الاستخدام السريري، ولا تقوم ضمادة IPA ولا جهاز تعقيم منفذ الحقن بالفرك بتعقيم صمام OLS بفعالية. في المقابل، يمكن تعقيم سطح الحقن لموصلات DNCC بمستوى أعلى من الفعالية. على الرغم من أن الأسئلة لا تزال قائمة حول المعقم الأفضل وطريقة التعقيم والتصميم الأمثل لموصلات DNCC، فقد توصلت دراسات متعددة إلى وجود معدلات أقل من التلوث داخل التجويف مع موصلات DNCC المعقمة مقارنةً بصمامات OLS، كما وجدت بعض الدراسات معدلات أقل لحالات HAI عند استخدام موصلات DNCC مقارنة بصمامات OLS. لم تتوصل أي دراسات حالية إلى أن صمامات OLS مفيدة مقارنةً بموصلات DNCC المعقمة. يجب على الجهات المصنعة تزويد أطقم الأنابيب الوريدية (IV) بموصلات DNCC وصمامات DNCC بدلاً من صمامات OLS، ويجب كذلك أن تكون صمامات DNCC متاحة بصورة فردية. يجب أن تتضمن أطقم الأنابيب الشريانية صمام DNCC لأخذ عينات الدم وجهاز لتصفير جهاز قياس ضغط السوائل الذي يحافظ على التعقيم داخل التجويف. يجب أن يقتصر استخدام صمامات OLS على مناطق التعقيم. يعد التزام مقدم الرعاية الصحية بتعقيم موصلات DNCC أمرًا بالغ الأهمية للاستخدام الآمن لموصلات DNCC كما يجب أن يتضمن ذلك تقييمات دورية وإعادة التدريب بشأن نظافة اليدين وتقنية التعقيم. يوصى كذلك بزيادة استخدام الأدوية والمحاليل الدوائية المعدة بواسطة الجهة المصنعة أو في الصيدلية واتباع ممارسات الحقن الآمنة لتقليل مخاطر حالات العدوى المرتبطة بالرعاية الصحية (HAIs) المتعلقة بالإدخال الوعائي وكذلك الأخطاء العلاجية. على الرغم من عدم إجماع الآراء بشأن النهج الأمثل لتعقيم موصلات DNCC واستمرار وجود الكثير من الأسئلة، تشير مجموعة من المؤلفات الحالية إلى أنه قبل الإدخال (أو سلسلة من عمليات الحقن السريعة) مباشرة يجب تنظيف موصلات DNCC عبر الفرك بمعقم يحتوي على الكحول مدة 5 ثواني على الأقل (توصي بعض التوصيات بالاستخدام لمدة ≥15 ثانية)، أو استخدام غطاء IPA بشكل صحيح، متبوعًا بالتجفيف قبل الحقن. تتمتع أغطية IPA بمزايا فعالة مقارنةً بالتنظيف اليدوي بالفرك؛ لكن، ثمة حاجة إلى دراسات إضافية لتحديد ما إذا كانت أغطية IPA أكثر فعالية في تقليل حالات العدوى المرتبطة بالرعاية الصحية (HAIs) من الطرق البديلة الحالية، وما إذا كانت آمنة للاستخدام لحديثي الولادة.
Elliott S. Greene، MD، أستاذ التخدير في قسم التخدير بكلية ألباني الطبية، ألباني، نيويورك.
ليس لدى المؤلف تضارب في المصالح.
المراجع
- Greene ES. Challenges in reducing the risk of infection when accessing vascular catheters. J Hosp Infect. 2021;113:130–144.
- Dolan SA, Arias KM, Felizardo G, et al. APIC position paper: Safe injection, infusion, and medication vial practices in health care. Am J Infect Control. 2016;44:750-757.
- Holroyd JL, Paulus DA, et al. Universal intravenous access cleaning device fails to sterilize stopcocks. Anesth Analg. 2014;118:333-343.
- Rowlands J, Yeager MP, Beach M, et al. Video observation to map hand contact and bacterial transmission in operating rooms. Am J Infect Control. 2014;42:698–701.
- Institute for Safe Medication Practices Safe Practice Guidelines for Adult IV Push Medications. https://www.ismp.org/sites/default/files/attachments/2017-11/ISMP97-Guidelines-071415-3.%20FINAL.pdf Last accessed October 10, 2021.
- Anesthesia Patient Safety Foundation. Recommendations for improving medication safety consensus from four work groups at the 2018 APSF Stoelting Conference on Medication Safety. Rochester, MN: APSF; 2018. https://www.apsf.org/medication-safety-recommendations Last accessed October 10, 2021.
- Centers for Disease Control and Prevention. Safe injection practices to prevent transmission of infections to patients. Atlanta, GA. https://www.cdc.gov/injectionsafety/ip07_standardprecaution.html Last accessed October 1, 2021.
- Mermel LA, Bert A, Chapin KC, LeBlanc L. Intraoperative stopcock and manifold colonization of newly inserted peripheral intravenous catheters. Infect Control Hosp Epidemiol. 2014;35:1187–1189.
- Loftus RW, Koff MD, Burchman CC, et al. Transmission of pathogenic bacterial organisms in the anesthesia work area. Anesthesiology. 2008;109:399–407.
- Loftus RW, Brindeiro BS, Kispert DP, et al. Reduction in intraoperative bacterial contamination of peripheral intravenous tubing through the use of a passive catheter care system. Anesth Analg. 2012;115:1315–1323.
- Rupp ME, Yu S, Huerta T, et al. Adequate disinfection of a split-septum needleless intravascular connector with a 5-second alcohol scrub. Infect Control Hosp Epidemiol. 2012;33:661–665.
- Slater K, Cooke M, Fullerton F, et al. Peripheral intravenous catheter needleless connector decontamination study – randomized controlled trial. Am J Infect Control. 2020;48:1013–1018.
- Casey A, Karpanen T, Nightingale P, Elliott T. An in vitro comparison of microbial ingress into 8 different needleless IV access devices. J Infus Nurs. 2015;38:18–25.
- Loftus RW, Patel HM, Huysman BC, et al. Prevention of intravenous bacterial injection from health care provider hands: the importance of catheter design and handling. Anesth Analg. 2012;115:1109–1119.
- Munoz-Price LS, Bowdle A, Johnston BL, et al. Infection prevention in the operating room anesthesia work area. Infect Control Hosp Epidemiol. 2019;40:1–17.
- Voor In’t Holt AF, Helder OK, Vos MC, et al. Antiseptic barrier cap effective in reducing central line-associated bloodstream infections: a systematic review and meta-analysis. Int J Nurs Stud. 2017;69:34–40.
- Merrill KC, Sumner S, Linford L, et al. Impact of universal disinfectant cap implementation on central line associated bloodstream infections. Am J Infect Control. 2014;42:1274–1277.
- Mermel LA. What is the predominant source of intravascular catheter infections? Clin Infect Dis. 2011;52:211–212.
- Moureau NL, Flynn J. Disinfection of needleless connector hubs: clinical evidence systematic review. Nurs Res Pract. 2015;2015:796762.
- Ryan AJ, Webster CS, Merry AF, Grieve DJ. A national survey of infection control practice by New Zealand anaesthetists. Anaesth Intensive Care. 2006;34:68e74
- Balikci E, Yilmaz B, Tahmasebifar A, et al. Surface modification strategies for hemodialysis catheters to prevent catheter-related infections: a review. J Biomed Mater Res B Appl Biomater. 2021;109:314-327.
- Arciola CR, Campoccia D, Montanaro L. Implant infections: adhesion, biofilm formation and immune evasion. Nat Rev Microbiol. 2018;16:397–409.
- Gominet M, Compain F, Beloin C, Lebeaux D. Central venous catheters and biofilms: where do we stand in 2017? Acta Pathol Microbiol Immunol Scand. 2017;125:365–375.
- Greene ES. New SHEA expert guidance for infection prevention in the anesthesia work area needs improvement. Infect Control Hosp Epidemiol. 2019;40:607–608.
- Deloney V, Bowdle A, Birnbach DJ, et al. Reply to Greene: New SHEA expert guidance for infection prevention in the anesthesia work area needs improvement. Infect Control Hosp Epidemiol. 2021;25:1.
- US Occupational Safety and Health Administration. Bloodborne pathogens and needlestick prevention. Washington, DC. https://www.osha.gov/SLTC/bloodbornepathogens/index.html. Last accessed October 1, 2021.
- Rickard CM, Flynn J, Larsen E, et al. Needleless connector decontamination for prevention of central venous access device infection: a pilot randomized controlled trial. Am J Infect Control. 2021;49:269–273.
- Flynn JM, Rickard CM, Keogh S, Zhang L. Alcohol caps or alcohol swabs with and without chlorhexidine: an in vitro study of 648 episodes of intravenous device needleless connector decontamination. Infect Control Hosp Epidemiol. 2017;38:617–619.
- Practice guidelines for central venous access 2020: an updated report by the American Society of Anesthesiologists Task Force on Central Venous Access. Anesthesiology. 2020;132:8–43.
- O’Grady NP, Alexander M, Burns LA, et al. Healthcare Infection Control Practices Advisory Committee. Guidelines for the prevention of intravascular catheter-related infections. Atlanta, GA: Centers for Disease Control and Prevention; updated October 2017. Available at: https://www.cdc.gov/infectioncontrol/pdf/guidelines/bsi-guidelines-H.pdf Last accessed November 23, 2021.
- Association for Professionals in Infection Control and Epidemiology. Guide to preventing central line-associated bloodstream infections. Washington, DC: APIC; 2015. http://apic.org/Resource_/TinyMceFileManager/2015/APIC_CLABSI_WEB.pdf. Last accessed October 1, 2021.
- Marschall J, Mermel LA, Fakih M, et al. Society for Healthcare Epidemiology of America. Strategies to prevent central line-associated bloodstream infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014;35:753–771.
- Loveday HP, Wilson JA, Pratt RJ, et al. UK Department of Health. epic3: National evidence based guidelines for preventing healthcare-associated infections in NHS hospitals in England. J Hosp Infect. 2014;86(Suppl. 1):S1–70.
- Hallam C. (2019) Right Hub Disinfection for Compliance. In: Moureau N. (eds) Vessel Health and Preservation: The Right Approach for Vascular Access. pp 235–241 Springer, Cham. https://doi.org/10.1007/978-3-030-03149-7_18. Online June 11, 2019. Last accessed November 22, 2021.
- Casey AL, Karpanen TJ, Nightingale P, Elliott TS. The risk of microbial contamination associated with six different needle-free connectors. Br J Nurs. 2018;27:S18–S26.
- Slater K, Fullerton F, Cooke M, et al. Needleless connector drying time – how long does it take? Am J Infect Control. 2018;46:1080–1081.
- Sauron C, Jouvet P, Pinard G, et al. Using isopropyl alcohol impregnated disinfection caps in the neonatal intensive care unit can cause isopropyl alcohol toxicity. Acta Paediatr. 2015;104:e489–493.
- Hjalmarsson LB, Hagberg J, Schollin J, Ohlin A. Leakage of isopropanol from port protectors used in neonatal care-Results from an in vitro study. PLoS One. 2020;15:e0235593.
- Bell T, O’Grady NP. Prevention of central line-associated bloodstream infections. Infect Dis Clin N Am. 2017;31:551–559.


 Issue PDF
Issue PDF