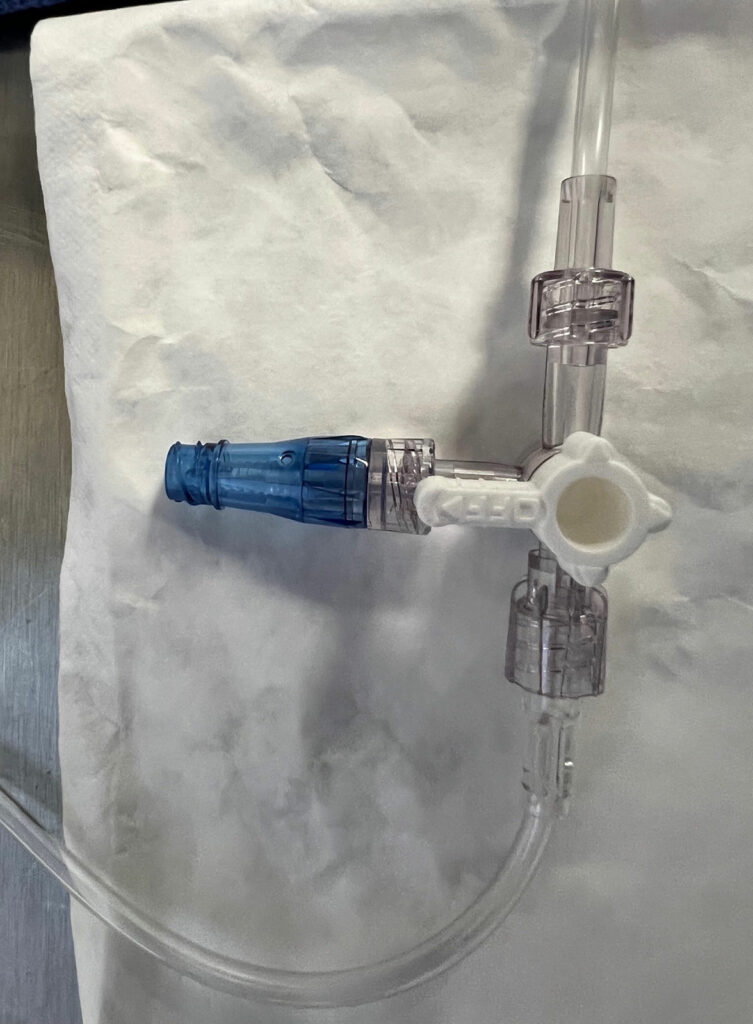
Введение
В больницах неотложной помощи США у 3,2% пациентов развивается одна или несколько инфекций, связанных с оказанием медицинской помощи (ИСМП), что приводит к увеличению заболеваемости, смертности, продолжительности госпитализации и расходов на медицинское обслуживание.1 Катетер-ассоциированные инфекции кровотока (КАИК), являются наиболее распространенной этиологией ИСМП, и они могут возникать при использовании центральных, а также периферических внутрисосудистых катетеров.1 Каждый год в США насчитывается приблизительно 250 000 случаев КАИК от краткосрочных и долгосрочных внутрисосудистых катетеров, приводящих к значительной заболеваемости, включая сепсис, другие осложнения и летальные исходы.1 В 2014 году в больницах неотложной помощи в США насчитывалось более 31 000 пациентов с инфекциями, связанными с центральной линией кровотока (CLABSI), с оценочной годовой стоимостью 0,6-2,7 млрд долл. США и уровнем смертности 12–25%.1 Показатели CLABSI, как правило, варьировались от 1,1 до 2,5/1000 катетеро-дней, и каждый CLABSI в среднем увеличивает пребывание в больнице на 10,4 дня и добавляет более 45 000 долл.1 В обзоре краткосрочных CLABSI периферических венозных катетеров (ПВК) от 1980 до 2016 года, частота инфекций составляла 1,8/1000 катетеров (не на 1000 катетеро-дней!). Частота КАИК артериального катетера в исследовании 2014 года составляла 1,26/1000 катетеро-дней, при этом риск КАИК для бедренной области был в 1,9 раза выше, чем для лучевой.1 Микробное загрязнение внутрисосудистых катетеров может происходить либо из 1) внепросветного пути, включающего дистальную миграцию из места введения, либо из 2) внутрипросветного загрязнения, которое может происходить при доступе и использовании этих катетеров, реже источником является гематогенное распространение или загрязненный инфузомат.
Доступ в виде сосудистого катетера является обычным делом при проведении анестезии и других видов лечения пациентов, но используют ли медицинские работники оптимальные методы для снижения риска ИСМП, связанных с катетерным сосудистым доступом ? Если при работе с сосудистыми катетерами не соблюдается гигиена рук и асептическая техника, происходит внутрипросветное заражение портов для инъекций (например, кранов с открытым просветом [OLS] и продезинфицированных закрытых безыгольных соединителей [DNCC]) микробными патогенами, которые могут привести к КАИК и другим ИСМП.1-3 К сожалению, низкий уровень соблюдения правил гигиены рук среди анестезиологов составляет от 2,9% до 18%.1,4 Шприцы и инфузоматы могут загрязняться во время приготовления лекарственных средств и клинического применения , что приводит к попаданию загрязненного содержимого в кровоток, а также к загрязнению портов доступа.1,2,5-7 Ассоциация безопасности пациентов во время анестезии, Ассоциация специалистов в области инфекционного контроля и эпидемиологии и Институт безопасной медицинской практики рекомендуют чаще использовать шприцы и инфузоматы, подготовленные производителем или аптекой, чтобы уменьшить загрязнение и ошибки при подготовке и введении лекарственных средств и жидкостей.1,2,5,6 Центры по контролю и профилактике заболеваний также дают рекомендации по безопасной практике инъекций.7 В этой статье мы сравним и сопоставим риски контаминации и инфицирования, связанные с использованием OLS и DNCC, а также обсудим рекомендации и нерешенные вопросы, касающиеся дезинфекции DNCC.
Риски контаминации и инфицирования OLS и продезинфицированных DNCC
OLS обычно используются в анестезиологической практике; тем не менее, частота загрязнения внутрипросветных поверхностей может достигать 32% — 38% случаев проведения анестезии.8,9 Ни 70% изопропиловый спирт (ИПС), ни устройство для чистки портов не дезинфицирует эффективно OLS.3,10 OLS подвержен загрязнению из-за своей конструкции со съемным колпачком, который обнажает внутрипросветные поверхности (рисунок 1). В то время как более 50% DNCC загрязнены бактериями на их инъекционных поверхностях до соответствующей дезинфекции,11,12 инъекционная поверхность DNCC может быть дезинфицирована с высоким уровнем эффективности путем очистки с помощью спиртосодержащего дезинфицирующего средства или с использованием колпачков с ИПС (рисунок 2). 1,3,11-17 В недавнем критическом обзоре портов для инъекций 8 из 10 исследований продемонстрировали значительно более низкие показатели внутрипросветного загрязнения продезинфицированных DNCC по сравнению с OLS, и 2 из 7 исследований показали значительно более низкие показатели CLABSI или КАИК с продезинфицированными DNCC по сравнению с OLS (в некоторых исследованиях оценивались как показатели контаминации, так и показатели инфицирования, в то время как в других исследованиях оценивался только один результат: либо показатели контаминации, либо показатели инфицирования).1 При изучении подгруппы этих исследований, где как OLS, так и DNCC были продезинфицированы перед использованием, 7 из 9 исследований обнаружили значительно более низкие показатели внутрипросветного загрязнения DNCC по сравнению с OLS, и 1 из 4 исследований имели значительно более низкий показатель CLABSI с DNCC.1 Ни одно исследование не обнаружило преимуществ OLS по сравнению с продезинфицированными DNCC (см. таблицу 1).1
Таблица 1: Сравнение продезинфицированных закрытых коннекторов без иглы (DNCC) с запорными кранами с открытым просветом (OLS)
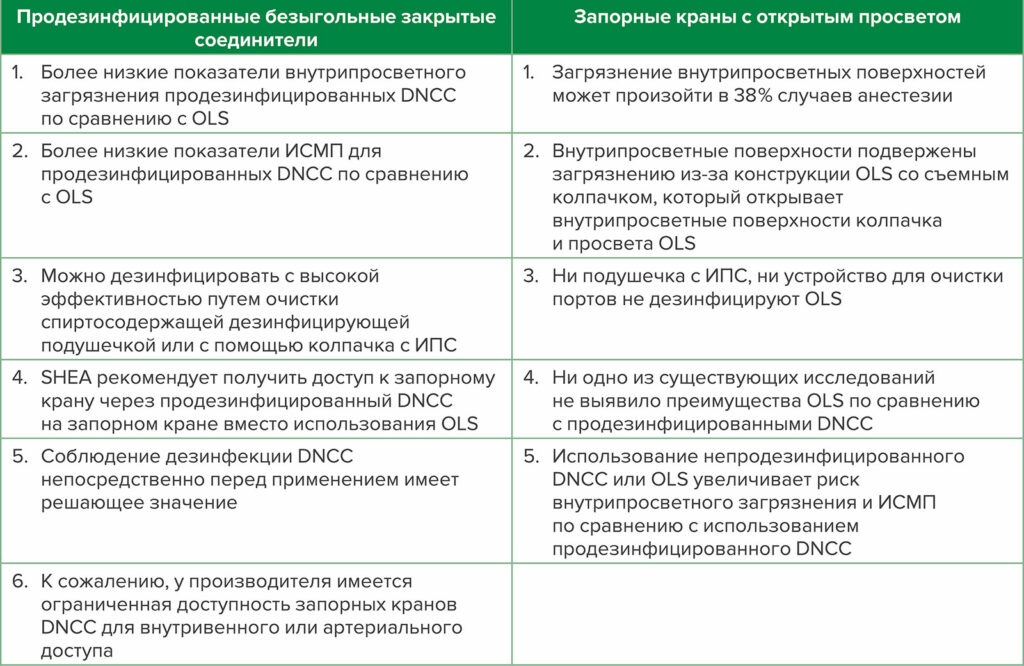
Сокращения: DNCC—стоп-кран, запорный кран с DNCC, прикрепленный (предпочтительно связанный) к просвету для инъекций; ИСМП— инфекции, связанные с оказанием медицинской помощи; ИПС — 70% изопропиловый спирт; SHEA — Общество эпидемиологии здравоохранения Америки
Микробная инвазия и биопленка
Неспособность дезинфицировать DNCC перед доступом или загрязнение OLS во время клинического использования может привести к внутрипросветному загрязнению1,15, что приведет к образованию биопленки (микроорганизмов, встроенных во внеклеточный матрикс гликокаликса) на поверхностях катетера, что приведет к повышенному риску развития ИСМП.18,19
Даже один пропуск процедуры дезинфекции DNCC перед применением может привести к образованию биопленки.19 К сожалению, соблюдение требований к дезинфекции DNCC (включая гигиену рук и асептическую технику) является сложной задачей для медицинских работников. 1,15,20Хотя в современной литературе нет полного объяснения защитных механизмов биопленки против антимикробных средств, экзополисахариды препятствуют проникновению антибиотиков в матрикс биопленки, чтобы добраться до бактерий в биопленке.21
Биопленка также может быть устойчива к иммунной системе хозяина.22,23 Таким образом, биопленка может быть источником бактериемии и хронических инфекций.21-23 Хотя исследования in vitroпоказывают, что лейкоциты способны эффективно проникать через биопленки, исследования на животных показывают, что образование биопленок приводит к «уклонению» иммунного ответа хозяина от «провоспалительного, бактерицидного ответа» в сторону «противовоспалительного, профибротического ответа».22 Таким образом, образование биопленки на поверхностях катетеров и других имплантированных медицинских устройств защищает бактерии, что способствует персистированию инфекции.22
Дополнительный механизм микробиологической инъекции может объяснить связь загрязнения OLS и DNCC с последующим повышенным риском ИСМП.1,14 Непреднамеренная прямая микробиологическая инъекция в кровоток может произойти во время сосудистого доступа через загрязненную OLS или невозможность дезинфекции поверхности инъекции DNCC перед инъекцией. Непреднамеренная прямая микробиологическая инъекция также может произойти, если используется загрязненный шприц или инфузомат. 1,2,5-7 В рандомизированном клиническом исследовании ex-vivo (РКИ), проведенном во время сопутствующей клинической анестезии, приблизительно 10.000 колониеобразующих единиц бактерий вошли в тестовый контур на инъекцию, когда DNCC или OLS не были продезинфицированы перед доступом.14 В этом исследовании частота непреднамеренной бактериальной инъекции была значительно ниже при использовании дезинфицированных DNCC-стоп-кранов (70% спирта [метод не указан] с 30-секундным просушиванием) по сравнению с OLS или DNCC-стоп-кранами без дезинфекции.14
Последние рекомендации Общества медицинской эпидемиологии Америки
Общество медицинской эпидемиологии Америки (SHEA) недавно опубликовало руководство по профилактике инфекций в рабочей среде анестезии.15 SHEA рекомендует использовать дезинфицированные DNCC на запорных кранах для инъекционных препаратов в качестве предпочтительного выбора для использования врачами, а не для использования OLS.24,25 SHEA также отметило, что «запорные краны на датчиках для инвазивного измерения давления периодически открываются на атмосферу для калибровки датчиков» и что «эти запорные краны могут быть разумно закрыты стерильными колпачками, а не безыгольными инъекционными портами» (DNCC), но не прокомментировало метод поддержания внутрипросветной стерильности, когда преобразователь открыт для воздуха.25 Важно, чтобы запорные краны, используемые для обнуления датчиков давления, сохраняли внутрипросветную стерильность. Хотя некоторые датчики оснащены колпачком с «маленьким» отверстием (гораздо меньшим, чем просвет), которое может устранить необходимость снятия колпачка во время обнуления, неизвестно, сохраняется ли внутрипросветная стерильность, поскольку этот «маленький» просвет постоянно открыт для окружающей средой. Кроме того, если этот колпачок не прикреплен к запорному крану, медицинский работник может обойти любое потенциальное преимущество конструкции этого колпачка, удалив колпачок во время обнуления, тем самым полностью подвергая внутрипросветные поверхности потенциальному загрязнению окружающей среды. Альтернативным вариантом может служить запорный кран с бактериальным фильтром, присоединенным к обнуляющему просвету.
Доступ к сосудистым катетерам через дезинфицированные DNCC
Современная литература подтверждает, что дезинфицированные DNCC должны использоваться вместо OLS на основании следующих предпосылок: документально подтвержденные общие более низкие риски контаминации и инфекции продезинфицированных DNCC по сравнению с OLS, как обсуждалось выше (таблица 1), и недавние рекомендации SHEA о том, что «стоп-краны, используемые для инъекционных препаратов, в идеале должны быть закрыты с помощью безыгольных инъекционных портов». 25 Для снижения риска, связанного с инфекцией, сосудистые катетеры, используемые для введения лекарств или жидкости, или забора крови, должны иметь доступ через дезинфицированные DNCC (например, в наборах внутривенных [в/в] трубок) или через дезинфицированные стоп-краны DNCC. Соблюдение требований к дезинфекции имеет важное значение. Для запорных кранов DNCC предпочтительно, чтобы DNCC был приклеен к инъекционному просвету стоп-крана, чтобы исключить удаление и обход DNCC.1 Хотя в недавних рекомендациях SHEA 25 конкретно не рассматривается использование DNCC для получения образцов крови из трубок артериального давления, текущие исследования1 подтверждают, что образцы крови из наборов артериальных трубок должны быть получены через продезинфицированные запорные краны DNCC вместо OLS. Единственное клиническое применение, при котором OLS не будет иметь большего риска контаминации или инфекции по сравнению с продезинфицированными DNCC, будет заключаться в том, что OLS будет использоваться только для процедур со стерильным операционным полем.1
Ограниченная производителем доступность запорных кранов DNCC
В настоящее время комплекты трубок для в/в и артериальных датчиков обычно не поставляются с запорными кранами DNCC.1 Производители должны поставлять комплекты трубок для в/в и артериальных датчиков с запорными кранами DNCC вместо OLS, и должны быть запорные краны DNCC, поставляемые в виде отдельно упакованных изделий. Существует несколько причин, по которым запорные краны DNCC обычно не включаются в комплекты трубок, включая недостаточную осведомленность врачей и производителей о преимуществах DNCC, инертность в изменении существующей практики и увеличение затрат. Тем не менее, необходимость повышения безопасности за счет внедрения DNCC неизбежна, и увеличение затрат не должно быть препятствием. Например, защитные устройства для предотвращения травмирования острыми предметами обойдутся дороже, чем устройства без защиты, но в настоящее время они используются в качестве стандартных требований безопасности.1,26
Метод дезинфекции и тип дезинфицирующего средства
Тип дезинфицирующего средства и метод дезинфекции, используемые в DNCC, являются критическими факторами для максимального повышения эффективности дезинфицирующего средства и снижения нежелательных ИСМП.1,27 Различия в результатах нескольких выбранных исследований in vitro и клинических исследований подчеркивают трудности в определении окончательных рекомендаций по дезинфекции (таблица 2). Неудивительно, что среди экспертов отсутствует консенсус относительно рекомендуемого дезинфицирующего средства, метода дезинфекции (например, очистка по сравнению с «мытьём»), продолжительности дезинфекции и времени просушивания, а также относительно того, следует ли использовать колпачки с ИПС (см. таблицу 3).1 SHEA рекомендует дезинфицировать DNCC непосредственно перед каждым применением или перед быстрой серией инъекций, например, во время индукции анестезии, либо путем очистки (продолжительность не указана) со спиртосодержащей дезинфицирующей подушечкой (например, с ИПС или хлоргексидина глюконата [ХГГ]/ИПС), либо правильного использования ИПС.1,15 Многочисленные рекомендации1 предлагают очистку с помощью спиртосодержащего дезинфицирующего средства; однако рекомендуемая продолжительность очистки варьирует от ≥ 5 до ≥ 15 секунд (таблица 3).31-33 Поскольку соблюдение более длительной продолжительности очистки является низким,15 дополнительных исследований должны выявить минимальную эффективную продолжительность очистки.1 Кроме того, для сравнения различных методов и дезинфицирующих средств необходимы рандомизированные исследования, поскольку методы дезинфекции DNCC могут увеличивать риск ИСМП. Дальнейшее осложнение проблемы заключается в том, что риск инфицирования продезинфицированных DNCC также может быть связан с различными топографиями инъекционной поверхности и другими конструктивными особенностями, обнаруженными в различных DNCC, которые могут влиять на эффективность дезинфекции.12,13,27,35
Таблица 2: a,bИзбранные 1) Исследования дезинфекции загрязненных поверхностей DNCC in vitro и 2) Клинические исследования дезинфекции DNCC
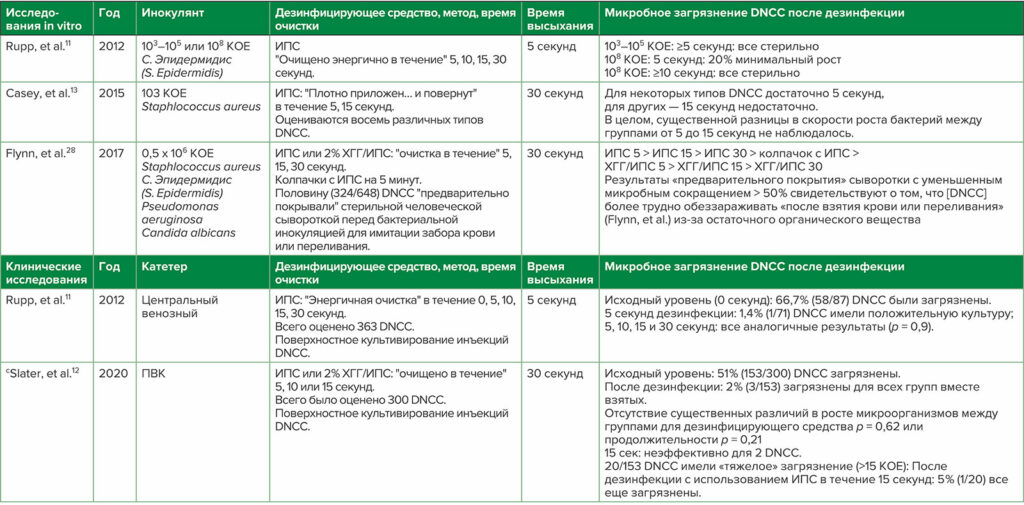
Сокращения: КОЕ — колониеобразующие единицы бактерий/мл инокулянта; ХГГ — хлоргексидина глюконат; DNCC — продезинфицированные безыгольные закрытые коннекторы; ИПС — 70% изопропиловый спирт; ПВК —периферический венозный катетер.
a Дополнительные рекомендации см. в Greene1
b термины в кавычках — это терминология, используемая в каждой ссылке
c первое РКИ по дезинфекции ПВК DNCC
Таблица 3: a,bРекомендации по дезинфекции DNCC от отдельных национальных и международных организаций
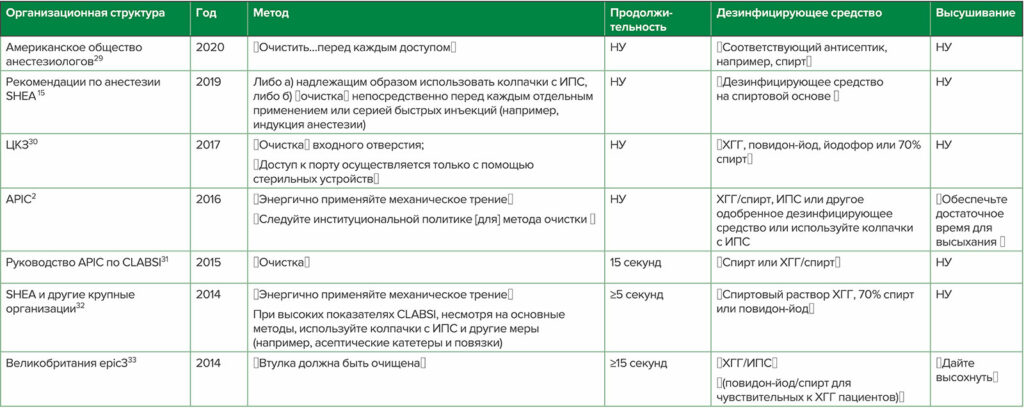
Сокращения: APIC, Ассоциация специалистов по инфекционному контролю и эпидемиологии; ЦКЗ, Центры США по контролю и профилактике заболеваний; ХГГ — хлоргексидина глюконат; CLABSI — инфекция, связанная с центральной линией кровотока; ИПС — 70% изопропиловый спирт; НУ — не упоминается в Рекомендации; SHEA — Общество медицинской эпидемиологии Америки
a Дополнительные рекомендации см. в Greene,1 Hallam34
b Пункты в кавычках являются терминологией, используемой в каждой ссылке; т.е. не все указанные ″очистка″ в качестве используемого метода
Время высыхания дезинфицирующего средства
Недавнее исследование показало, что дезинфицирующее средство, используемое на DNCC, должно высыхать перед доступом, чтобы уменьшить микробную нагрузку и ее потенциал для проникновения в кровоток.36 Время высыхания дезинфицирующего средства варьирует после очистки DNCC: ИПС высыхает через 5 секунд, а ХГГ/ИПС — через 20, но повидон-йод не высыхает даже через 6 минут.36 Однако только в нескольких национальных и международных руководствах упоминается необходимость высушивания дезинфицирующего средства (таблица 3).1 К сожалению, только в некоторых клинических исследованиях и исследованиях in vitro указано время высыхания после дезинфекции DNCC, и ни в одном из них не сравнивается влияние различного времени высыхания или вообще никакого высыхания на эффективность дезинфекции.1 Из 21 исследования по оценке дезинфекции DNCC, оцененной в недавнем критическом обзоре, в одном исследовании указано 5-секундное время высушивания, в 10 исследованиях использовано ≥ 30 секунд высушивания и в 10 исследованиях не указано, использовалось ли высушивание или нет.1 В дальнейших исследованиях необходимо рассмотреть оптимальное время высушивания в периоперационных условиях, чтобы медицинские работники имели четкое представление о том, как снизить риск инфекции.
Опасно ли введение дезинфицирующего средства в DNCC?
Недавнее исследование рекомендовало, чтобы DNCC высыхал перед использованием, чтобы избежать инъекции дезинфицирующего средства.36Вопрос, на который нет ответа, заключается в том, опасно ли введение некоторого количества дезинфицирующего средства в DNCC. Это вызывает большую озабоченность, поскольку ИПС в основном метаболизируется до ацетона, который является токсичным.16,37,38 Два исследования in vitro сравнивали DNCC, промытые либо ИПС, с последующей 15-секундным высушиванием37, либо ХГГ/этанолом с 30-секундным высушиванием,38 с последующими инъекциями физиологического раствора. Эти исследования показали, что уровни спирта в жидкостях тестового контура были либо не поддающимися обнаружению37, либо «низкими»38 (максимально мкг наинъекцию in vitro составлял < 8% от того, что могло бы привести к расчетному порогу токсической концентрации в крови у новорожденных, определяемому как более 0,25 мг/мл). Исследования потенциальной в/в инъекции алкоголя или ХГГ через DNCC до высушивания дезинфицирующего средства ограничены в современной литературе, и поэтому необходимы дальнейшие исследования.
Колпачки с ИПС
Некоторые национальные и международные рекомендации включают возможность использования колпачков с ИПС на DNCC, поскольку они обеспечивают пассивную дезинфекцию, устраняют ручную очистку (после минимального времени контакта), обеспечивают видимый индикатор дезинфекции, обеспечивают барьер загрязнения и могут повысить соответствие дезинфекции по сравнению с ручной дезинфекцией.1,15,17,39 Использование колпачков с ИПС требует, по крайней мере, минимальной продолжительности контакта на DNCC перед доступом (ручная очистка необходима для более короткой продолжительности), позволяя дезинфицирующему средству высохнуть перед доступом и выбрасывая колпачок после каждого однократного использования.
Недавнее «пилотное» РКИ не обнаружило существенных различий в показателях CLABSI у взрослых, сравнивая очистку с ИПС или ХГГ/ИПС, или используя колпачки с ИПС.27 Хотя в рекомендациях SHEA 15 2019 года использование колпачков с ИПС упоминается как «лучшая практика», это «пилотное» исследование 2021 года предполагает, что следует провести более крупные более определенные исследования.27 Два исследования in vitro предостерегали от использования колпачков с ИПС у новорожденных, потому что инъекция физиологического раствора после удаления колпачков с ИПС привела к «значительным» уровням ИПС в жидкостях испытательного контура. 16,37,38 Одно исследование показало, что значительные уровни ИПС в жидкостях испытательного контура возникали после 24 часов использования колпачков с ИПС, с еще более высокими уровнями ИПС, когда DNCC подвергались воздействию колпачков с ИПС в течение 7 дней.38 Вывод о том, что ИПС вводили в испытательный контур, также был проблематичным, поскольку в одном исследовании после удаления колпачков с ИПС DNCC давали высохнуть в течение 30 секунд перед инъекцией.38 Дезинфицирующие колпачки, содержащие этанол вместо ИПС, были предложены в качестве альтернативы для снижения риска токсичности у новорожденных.38
Заключение
 Существует множество вопросов, которые необходимо рассмотреть для снижения риска инфекции при доступе к сосудистым катетерам. Конструкция OLS приводит к высокой частоте внутрипросветного микробного загрязнения во время клинического использования, и ни подушечка с ИПС, ни устройство для очистки портов не обеспечивают эффективную дезинфекцию OLS. Напротив, инъекционная поверхность DNCC может быть продезинфицирована с высокой степенью эффективности. Хотя остаются вопросы относительно оптимального дезинфицирующего средства и метода дезинфекции, а также оптимальной конструкции DNCC, многочисленные исследования выявили более низкие показатели внутрипросветного загрязнения при использовании продезинфицированных DNCC по сравнению с OLS, а некоторые исследования обнаружили более низкие показатели ИСМП при использовании продезинфицированных DNCC по сравнению с OLS. Ни одно из существующих исследований не выявило преимущества OLS по сравнению с продезинфицированными DNCC. Производители должны поставлять наборы трубок для внутривенной инфузии с DNCC и запорными кранами DNCC вместо OLS, а запорные краны DNCC также должны быть доступны в виде отдельных изделий. Наборы артериальных трубок должны включать запорный кран DNCC для забора крови и устройство для обнуления датчика, которое поддерживает внутрипросветную стерильность. OLS должны быть ограничены для использования на стерильных полях. Соблюдение дезинфекции DNCC медицинскими работниками имеет решающее значение для безопасного использования DNCC и должно включать периодическую оценку и повторное обучение гигиене рук и асептической технике. Также рекомендуется более широкое использование лекарственных препаратов и инфузий, приготовленных производителем или в аптеке, а также безопасных методов инъекций для снижения риска возникновения ИСМП, связанных с сосудистым доступом, и ошибок при лечении. Хотя консенсус по оптимальному подходу к дезинфекции DNCC отсутствует и остается много вопросов, обобщение современной литературы показывает, что непосредственно перед доступом (или быстрой серией инъекций) DNCC следует промывать спиртосодержащим дезинфицирующим средством в течение не менее 5 секунд (некоторые рекомендации предлагают ≥15 секунд) или правильно использовать колпачок с ИПС с последующим просушиваем перед инъекцией. Колпачки с ИПС имеют потенциальные преимущества по сравнению с ручной очисткой; однако необходимы дополнительные исследования, чтобы определить, являются ли колпачки с ИПС более эффективными для снижения ИСМП, чем существующие альтернативные методы, и являются ли они безопасными для использования у новорожденных.
Существует множество вопросов, которые необходимо рассмотреть для снижения риска инфекции при доступе к сосудистым катетерам. Конструкция OLS приводит к высокой частоте внутрипросветного микробного загрязнения во время клинического использования, и ни подушечка с ИПС, ни устройство для очистки портов не обеспечивают эффективную дезинфекцию OLS. Напротив, инъекционная поверхность DNCC может быть продезинфицирована с высокой степенью эффективности. Хотя остаются вопросы относительно оптимального дезинфицирующего средства и метода дезинфекции, а также оптимальной конструкции DNCC, многочисленные исследования выявили более низкие показатели внутрипросветного загрязнения при использовании продезинфицированных DNCC по сравнению с OLS, а некоторые исследования обнаружили более низкие показатели ИСМП при использовании продезинфицированных DNCC по сравнению с OLS. Ни одно из существующих исследований не выявило преимущества OLS по сравнению с продезинфицированными DNCC. Производители должны поставлять наборы трубок для внутривенной инфузии с DNCC и запорными кранами DNCC вместо OLS, а запорные краны DNCC также должны быть доступны в виде отдельных изделий. Наборы артериальных трубок должны включать запорный кран DNCC для забора крови и устройство для обнуления датчика, которое поддерживает внутрипросветную стерильность. OLS должны быть ограничены для использования на стерильных полях. Соблюдение дезинфекции DNCC медицинскими работниками имеет решающее значение для безопасного использования DNCC и должно включать периодическую оценку и повторное обучение гигиене рук и асептической технике. Также рекомендуется более широкое использование лекарственных препаратов и инфузий, приготовленных производителем или в аптеке, а также безопасных методов инъекций для снижения риска возникновения ИСМП, связанных с сосудистым доступом, и ошибок при лечении. Хотя консенсус по оптимальному подходу к дезинфекции DNCC отсутствует и остается много вопросов, обобщение современной литературы показывает, что непосредственно перед доступом (или быстрой серией инъекций) DNCC следует промывать спиртосодержащим дезинфицирующим средством в течение не менее 5 секунд (некоторые рекомендации предлагают ≥15 секунд) или правильно использовать колпачок с ИПС с последующим просушиваем перед инъекцией. Колпачки с ИПС имеют потенциальные преимущества по сравнению с ручной очисткой; однако необходимы дополнительные исследования, чтобы определить, являются ли колпачки с ИПС более эффективными для снижения ИСМП, чем существующие альтернативные методы, и являются ли они безопасными для использования у новорожденных.
Эллиотт С. Грин (Elliott S. Greene), доктор медицины, профессор кафедры анестезиологии в Медицинском колледже Олбани, город Олбани, штат Нью-Йорк.
У автора нет конфликтов интересов.
Список литературы
- Greene ES. Challenges in reducing the risk of infection when accessing vascular catheters. J Hosp Infect. 2021;113:130–144.
- Dolan SA, Arias KM, Felizardo G, et al. APIC position paper: Safe injection, infusion, and medication vial practices in health care. Am J Infect Control. 2016;44:750-757.
- Holroyd JL, Paulus DA, et al. Universal intravenous access cleaning device fails to sterilize stopcocks. Anesth Analg. 2014;118:333-343.
- Rowlands J, Yeager MP, Beach M, et al. Video observation to map hand contact and bacterial transmission in operating rooms. Am J Infect Control. 2014;42:698–701.
- Institute for Safe Medication Practices Safe Practice Guidelines for Adult IV Push Medications. https://www.ismp.org/sites/default/files/attachments/2017-11/ISMP97-Guidelines-071415-3.%20FINAL.pdf Last accessed October 10, 2021.
- Anesthesia Patient Safety Foundation. Recommendations for improving medication safety consensus from four work groups at the 2018 APSF Stoelting Conference on Medication Safety. Rochester, MN: APSF; 2018. https://www.apsf.org/medication-safety-recommendations Last accessed October 10, 2021.
- Centers for Disease Control and Prevention. Safe injection practices to prevent transmission of infections to patients. Atlanta, GA. https://www.cdc.gov/injectionsafety/ip07_standardprecaution.html Last accessed October 1, 2021.
- Mermel LA, Bert A, Chapin KC, LeBlanc L. Intraoperative stopcock and manifold colonization of newly inserted peripheral intravenous catheters. Infect Control Hosp Epidemiol. 2014;35:1187–1189.
- Loftus RW, Koff MD, Burchman CC, et al. Transmission of pathogenic bacterial organisms in the anesthesia work area. Anesthesiology. 2008;109:399–407.
- Loftus RW, Brindeiro BS, Kispert DP, et al. Reduction in intraoperative bacterial contamination of peripheral intravenous tubing through the use of a passive catheter care system. Anesth Analg. 2012;115:1315–1323.
- Rupp ME, Yu S, Huerta T, et al. Adequate disinfection of a split-septum needleless intravascular connector with a 5-second alcohol scrub. Infect Control Hosp Epidemiol. 2012;33:661–665.
- Slater K, Cooke M, Fullerton F, et al. Peripheral intravenous catheter needleless connector decontamination study — randomized controlled trial. Am J Infect Control. 2020;48:1013–1018.
- Casey A, Karpanen T, Nightingale P, Elliott T. An in vitro comparison of microbial ingress into 8 different needleless IV access devices. J Infus Nurs. 2015;38:18–25.
- Loftus RW, Patel HM, Huysman BC, et al. Prevention of intravenous bacterial injection from health care provider hands: the importance of catheter design and handling. Anesth Analg. 2012;115:1109–1119.
- Munoz-Price LS, Bowdle A, Johnston BL, et al. Infection prevention in the operating room anesthesia work area. Infect Control Hosp Epidemiol. 2019;40:1–17.
- Voor In’t Holt AF, Helder OK, Vos MC, et al. Antiseptic barrier cap effective in reducing central line-associated bloodstream infections: a systematic review and meta-analysis. Int J Nurs Stud. 2017;69:34–40.
- Merrill KC, Sumner S, Linford L, et al. Impact of universal disinfectant cap implementation on central line associated bloodstream infections. Am J Infect Control. 2014;42:1274–1277.
- Mermel LA. What is the predominant source of intravascular catheter infections? Clin Infect Dis. 2011;52:211–212.
- Moureau NL, Flynn J. Disinfection of needleless connector hubs: clinical evidence systematic review. Nurs Res Pract. 2015;2015:796762.
- Ryan AJ, Webster CS, Merry AF, Grieve DJ. A national survey of infection control practice by New Zealand anaesthetists. Anaesth Intensive Care. 2006;34:68e74
- Balikci E, Yilmaz B, Tahmasebifar A, et al. Surface modification strategies for hemodialysis catheters to prevent catheter-related infections: a review. J Biomed Mater Res B Appl Biomater. 2021;109:314-327.
- Arciola CR, Campoccia D, Montanaro L. Implant infections: adhesion, biofilm formation and immune evasion. Nat Rev Microbiol. 2018;16:397–409.
- Gominet M, Compain F, Beloin C, Lebeaux D. Central venous catheters and biofilms: where do we stand in 2017? Acta Pathol Microbiol Immunol Scand. 2017;125:365–375.
- Greene ES. New SHEA expert guidance for infection prevention in the anesthesia work area needs improvement. Infect Control Hosp Epidemiol. 2019;40:607–608.
- Deloney V, Bowdle A, Birnbach DJ, et al. Reply to Greene: New SHEA expert guidance for infection prevention in the anesthesia work area needs improvement. Infect Control Hosp Epidemiol. 2021;25:1.
- US Occupational Safety and Health Administration. Bloodborne pathogens and needlestick prevention. Washington, DC. https://www.osha.gov/SLTC/bloodbornepathogens/index.html. Last accessed October 1, 2021.
- Rickard CM, Flynn J, Larsen E, et al. Needleless connector decontamination for prevention of central venous access device infection: a pilot randomized controlled trial. Am J Infect Control. 2021;49:269–273.
- Flynn JM, Rickard CM, Keogh S, Zhang L. Alcohol caps or alcohol swabs with and without chlorhexidine: an in vitro study of 648 episodes of intravenous device needleless connector decontamination. Infect Control Hosp Epidemiol. 2017;38:617–619.
- Practice guidelines for central venous access 2020: an updated report by the American Society of Anesthesiologists Task Force on Central Venous Access. Anesthesiology. 2020;132:8–43.
- O’Grady NP, Alexander M, Burns LA, et al. Healthcare Infection Control Practices Advisory Committee. Guidelines for the prevention of intravascular catheter-related infections. Atlanta, GA: Centers for Disease Control and Prevention; updated October 2017. Available at: https://www.cdc.gov/infectioncontrol/pdf/guidelines/bsi-guidelines-H.pdf Last accessed November 23, 2021.
- Association for Professionals in Infection Control and Epidemiology. Guide to preventing central line-associated bloodstream infections. Washington, DC: APIC; 2015. http://apic.org/Resource_/TinyMceFileManager/2015/APIC_CLABSI_WEB.pdf. Last accessed October 1, 2021.
- Marschall J, Mermel LA, Fakih M, et al. Society for Healthcare Epidemiology of America. Strategies to prevent central line-associated bloodstream infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014;35:753–771.
- Loveday HP, Wilson JA, Pratt RJ, et al. UK Department of Health. epic3: National evidence based guidelines for preventing healthcare-associated infections in NHS hospitals in England. J Hosp Infect. 2014;86(Suppl. 1):S1–70.
- Hallam C. (2019) Right Hub Disinfection for Compliance. In: Moureau N. (eds) Vessel Health and Preservation: The Right Approach for Vascular Access. pp 235–241 Springer, Cham. https://doi.org/10.1007/978-3-030-03149-7_18. Online June 11, 2019. Last accessed November 22, 2021.
- Casey AL, Karpanen TJ, Nightingale P, Elliott TS. The risk of microbial contamination associated with six different needle-free connectors. Br J Nurs. 2018;27:S18–S26.
- Slater K, Fullerton F, Cooke M, et al. Needleless connector drying time — how long does it take? Am J Infect Control. 2018;46:1080–1081.
- Sauron C, Jouvet P, Pinard G, et al. Using isopropyl alcohol impregnated disinfection caps in the neonatal intensive care unit can cause isopropyl alcohol toxicity. Acta Paediatr. 2015;104:e489–493.
- Hjalmarsson LB, Hagberg J, Schollin J, Ohlin A. Leakage of isopropanol from port protectors used in neonatal care-Results from an in vitro study. PLoS One. 2020;15:e0235593.
- Bell T, O’Grady NP. Prevention of central line-associated bloodstream infections. Infect Dis Clin N Am. 2017;31:551–559.


 Issue PDF
Issue PDF