介绍
在美国急诊医院中,3.2% 的患者会出现一种或多种医疗相关感染 (HAI),导致患者发病率、死亡率、住院时间和医疗费用增加。1 导管相关性血流感染 (CRBSI) 是 HAI 最常见的病因,可发生在中心和外周血管内导管中。1 在美国,每年约有 250,000 例患者因短期和长期血管内导管患上 CRBSI,从而导致严重病症(包括败血症)、其他并发症和死亡。1 2014 年,美国急诊医院有超过 31,000 例中心静脉导管相关性血流感染 (CLABSI) 患者,每年的医疗费用估计为 6-27 亿美元,死亡率为 12%-25%。1 CLABSI 的发生率一般在 1.1-2.5 例/1000 根导管-日范围内,每例 CLABSI 使住院时间平均增加 10.4 天,并使医疗费用增加超过 45,000 美元。1 在对 1980 年至 2016 年间短期外周静脉导管 (PIVC) CRBSI 进行的综述中,感染发生率(未按每 1000 根导管-日报告)为 1.8 例感染/1000 根导管。在 2014 年的一项研究中,动脉导管 CRBSI 的发生率为 1.26 例/1000 根导管-日,股骨部位的 CRBSI 风险是桡骨部位的 1.9 倍。1 导致血管内导管出现微生物污染原因包括:1) 涉及从插入部位向远端移动的管腔外途径,或 2) 可能发生在进入和使用这些导管时的管腔内污染,较不常见的污染源为血性播散或受污染的输注液。
尽管在提供麻醉和其他患者护理时使用血管导管是常规操作,但医护人员是否使用了最佳方法来降低血管导管相关 HAI 的风险?如果未在使用血管导管时执行手部清洁并采用无菌技术,注射口(如开放式管腔旋塞 [OLSs] 和可消毒的无针闭合连接器 [DNCCs])可能会出现管腔内微生物病原体污染,从而导致 CRBSI 和其他 HAI。1-3 然而,据报告,麻醉人员的手部清洁依从率较低,从 2.9% 到 18% 不等。1,4 注射器和输注液可能会在药物制备和临床使用过程中受到污染,导致污染内容物注入血液,并污染入口。1,2,5-7 麻醉患者安全基金会 (Anesthesia Patient Safety Foundation)、感染控制与流行病学专业协会 (Association for Professionals in Infection Control and Epidemiology) 和安全用药实践研究所 (Institute for Safe Medication Practices) 建议多使用生产商或药房提供的药品注射器和输注液,以减少药物及液体制备和给药过程中的污染和用药错误。1,2,5,6 疾病控制和预防中心 (Centers for Disease Control and Prevention) 还提供了安全注射实践的建议。7 本文将比较 OLS 与 DNCC 的使用相关污染和感染风险,并就 DNCC 消毒的建议和未解决问题进行讨论。
OLS和消毒 DNCC的污染和感染风险
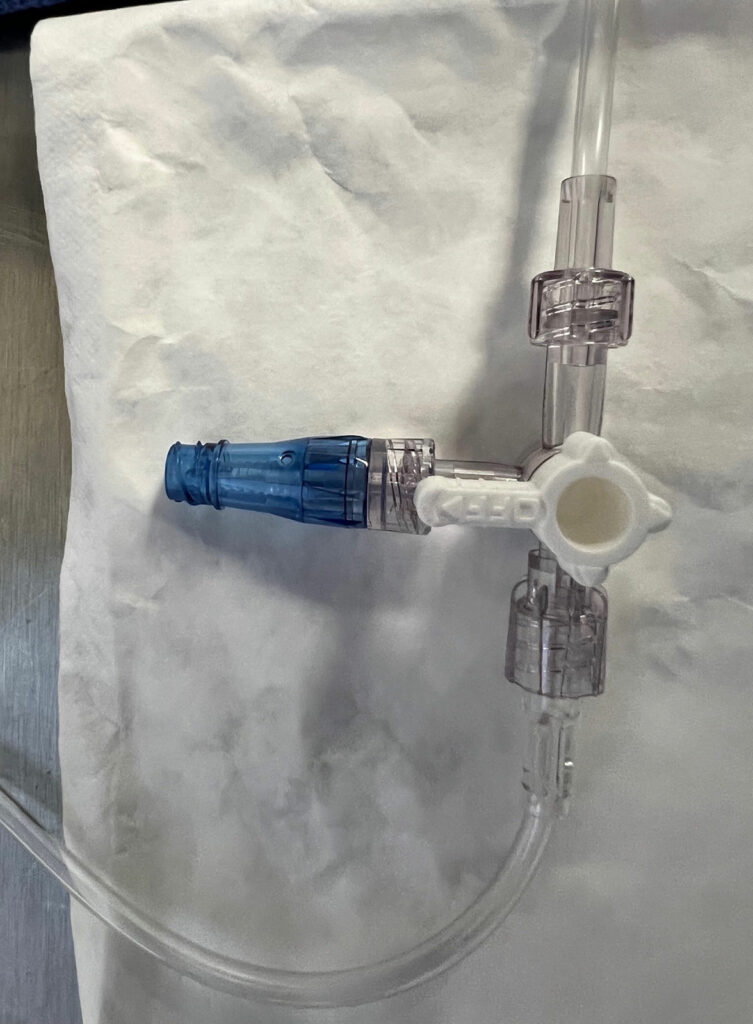
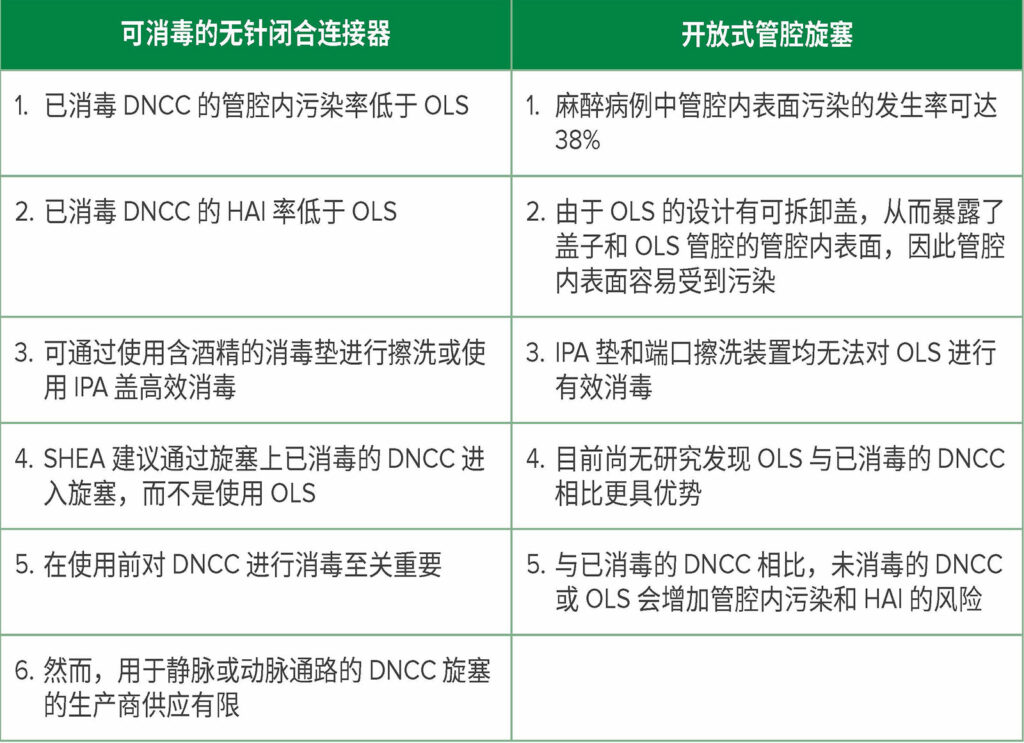
OLS 在麻醉实践中十分常见;然而,管腔内表面污染在麻醉病例中的发生率可达 32% 至 38%。8,9 70% 异丙醇 (IPA) 垫和端口擦洗装置均无法对 OLS 进行有效消毒。3,10 由于 OLS 设计有可拆卸盖,令管腔内表面暴露,因此 OLS 很容易受到污染(图 1)。尽管在进行适当消毒之前,超过 50% 的 DNCC 注射表面会受细菌污染,11,12 但 DNCC 的注射表面可通过使用含酒精的消毒垫擦洗或使用 IPA 盖(图 2)进行高效消毒。1,3,11-17 近期发表的一篇对注射口的评论性综述显示,8/10 项研究中已消毒 DNCC 的管腔内污染率显著低于 OLS,2/7 项研究中已消毒 DNCC 的 CLABSI 或 CRBSI 发生率显著低于 OLS(一些研究同时评估了污染率和感染率,而另一些研究仅评估了一项:污染率或感染率)。1 在检查这些研究中的亚组时(OLS 和 DNCC 在使用前均已消毒),7/9 项研究中 DNCC 的管腔内污染率显著低于 OLS。1 没有研究发现 OLS 与已消毒的 DNCC 相比存在优势(见表 1)。1
表 1:可消毒的无针闭合连接器 (DNCC) 与开放式管腔旋塞 (OLS) 的比较
微生物注射与生物膜
未在使用前对 DNCC 进行消毒或 OLS 在临床使用期间受到污染均可能导致管腔内的污染1,15,使导管表面形成生物膜(微生物嵌入细胞外的糖萼基质中),从而增加 HAI 的风险。18,19
即使是在使用前仅遗漏一次 DNCC 消毒也可能导致形成生物膜。19 然而,DNCC 消毒依从性(包括手部清洁和无菌技术)一直是医护人员所面临的一大挑战。1,15,20尽管现有文献尚未充分解释生物膜对抗微生物药的防御机制,但胞外多糖会阻碍抗生素穿透生物膜基质,从而抵达生物膜中细菌所在之处。21
生物膜也可能对宿主的免疫系统有抵抗。22,23 因此,生物膜可能是菌血症和慢性感染的疾病来源。21-23 虽然体外研究表明白细胞能够有效穿透生物膜,但动物研究显示,生物膜的形成导致宿主免疫反应从“促炎、杀菌反应”向“抗炎、促纤维化反应”“逃避”。22 因此,导管及其他植入医疗设备表面形成的生物膜可保护细菌,从而导致持续性感染。22
OLS 和 DNCC 污染与后续 HAI 风险增加的关联可通过微生物注射的另一种机制解释。1,14 在通过受污染的 OLS 进入血管的过程中,或未在注射前对 DNCC 注射表面进行消毒时,可能导致意外将微生物直接注入血液的情况。使用受污染的注射器或输注液也可能导致意外将微生物直接注入的情况。1,2,5-7 在一项与临床麻醉同时开展的离体随机对照试验 (RCT) 中,使用前未消毒的 DNCC 或 OLS 导致单次注射中约 10,000 个菌落形成单位的细菌进入检测管路。14 本研究中已消毒 DNCC 旋塞(使用 70% 酒精 [method unspecified],干燥 30 秒)的意外细菌注射发生率显著低于未消毒的 OLS 或 DNCC 旋塞。14
美国医疗照护流行病学研究协会的最新建议
美国医疗照护流行病学研究协会 (Society for Healthcare Epidemiology of America, SHEA) 最近发布了麻醉工作环境的感染预防指南。15 SHEA 建议在用于注射药物的旋塞上首选使用已消毒的 DNCC,而不是 OLS。24,25 SHEA 还指出,“定期打开压力传感器上的旋塞,以校准传感器”,以及“可使用无菌盖而非无针注射口盖住这些旋塞”(DNCC),但未就在打开传感器时保持管腔内无菌的方法给出建议。25 重要的是,用于调零压力传感器的旋塞要保持管腔内的无菌性。虽然一些传感器包含带“小”孔(比管腔小得多)的盖子,可消除调零期间取下盖子的需求,但由于该“小”管腔始终处于开放状态,因此尚不清楚管腔内的无菌性是否得以维持。此外,如果盖子未连接到旋塞上,医护人员可能会在调零期间取下盖子,使管腔内表面完全暴露于潜在环境污染,这就无法发挥该盖子设计的任何潜在优势。将带有细菌过滤器的旋塞连接到调零管腔可作为替代选项。
通过已消毒的 DNCC 进入血管导管
现有文献基于以下前提支持使用已消毒的 DNCC 而非 OLS:如前文所述(表 1),已消毒的 DNCC 的污染和感染风险总体低于 OLS,以及 SHEA 的最新建议,即,“无针注射口应尽可能使用于注射药物的旋塞闭合”。25 为降低感染相关患者风险,常规情况下,用于给药、输液或抽血的血管导管应通过已消毒的 DNCC(例如,静脉 [IV] 管路组件)或已消毒 DNCC 旋塞。遵循消毒要求至关重要。对于 DNCC 旋塞,建议将 DNCC 连接到旋塞注射管腔,以避免取下和绕过 DNCC。1 虽然 SHEA 的最新建议25 未专门指出使用 DNCC 从动脉压力管路采集血样,但现有研究1 支持通过已消毒的 DNCC 旋塞而非 OLS 从动脉压力管路采集血样。与已消毒的 DNCC 相比,OLS 不会有更大污染或感染风险的唯一临床应用是将 OLS 限制用于无菌区域的相关手术。1
DNCC 旋塞生产商供应有限
目前,IV 和动脉传感器管路组件通常不配备 DNCC 旋塞。1生产商应提供带 DNCC 旋塞而非 OLS 的 IV 和动脉传感器管路组件,且应将 DNCC 旋塞作为单独包装的产品提供。未将 DNCC 旋塞包含于常规组件之中的原因包括临床医生和生产商缺乏对 DNCC 优势的认识、改变现有实践模式动力不足以及成本增加。然而,通过 DNCC 提高安全性已是大势所趋,不应让成本增加成为阻碍。例如,预防锐器伤害的安全装置比非安全装置的费用更高,但现在这类装置已被作为标准的安全要求来使用。1,26
消毒方法和消毒剂类型
在 DNCC 上使用的消毒剂类型和消毒方法是最大限度地提高消毒剂效力和减少不必要的 HAI 的关键因素。1,27 多项选定的体外和临床研究结果的差异凸显了确定最终消毒建议的困难重重(表 2)。在意料之内的是,专家们对推荐的消毒剂、消毒方法(例如,擦洗与“清洁”)、消毒持续时间和干燥时间,以及是否使用 IPA 盖(见表 3)缺乏共识。1 SHEA 建议在每次使用或进行快速连续注射前对 DNCC 进行消毒,例如,在麻醉诱导期间,使用含酒精的消毒垫(如 IPA 或葡萄糖酸氯己定 [CHG]/IPA)进行擦洗(未指明持续时间),或适当使用 IPA 盖。1,15 许多指南1建议使用含酒精的消毒剂进行擦洗;但建议的擦洗持续时间各不相同,从 ≥ 5 秒到 ≥ 15 秒(表 3)。31-33 由于较长擦洗持续时间的依从率较低,15 应通过额外的研究确定最短有效擦洗持续时间。1 此外,还需开展随机试验,以对各种方法和消毒剂进行比较,因为不理想的 DNCC 消毒技术可能会增加 HAI 的风险。使问题进一步复杂的是,已消毒 DNCC 的感染风险还可能与不同 DNCC 的各种注射表面结构和其他设计特征有关,这可能会影响消毒效果。12,13,27,35
表2:a,b选定的 1) 受污染 DNCC 表面消毒的体外研究以及 2) DNCC 消毒的临床研究
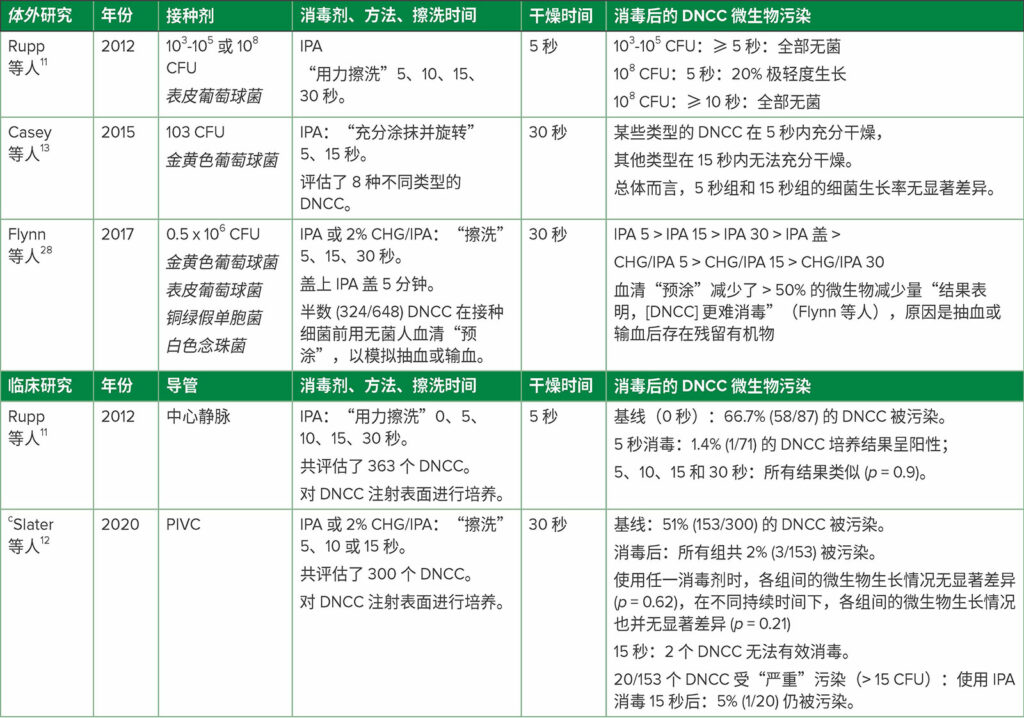
缩略词:CFU,菌落形成单位细菌/mL 接种剂;CHG,葡萄糖酸氯己定;DNCC,可消毒的无针闭合连接器;IPA,70% 异丙醇;PIVC,外周静脉导管。
a 更多研究见参考文献 Greene1
b 引号中的表述为各参考文献中使用的术语
c PIVC DNCC 消毒的首次临床 RCT
表 3:a,b选定国家和国际组织的 DNCC 消毒建议
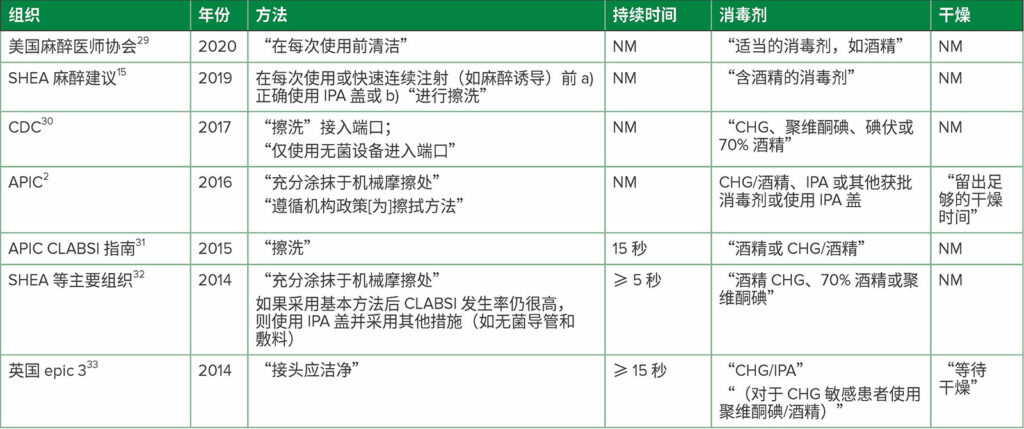
缩略词:APIC,感染控制与流行病学专业协会;CDC,疾病控制和预防中心; CHG,葡萄糖酸氯己定;CLABSI,中心管线相关血流感染;IPA,70% 异丙醇;NM,建议中未提及;SHEA,美国医疗照护流行病学研究协会
a 更多指南请见参考文献 Greene,1 Hallam34
b 引号中的表述为各参考文献中使用的术语;即,并非所有文献均将所用方法称为“擦洗”
消毒剂干燥时间
一项最新研究表明,应在使用 DNCC 前干燥消毒剂,以减小微生物负荷和进入血液的可能性。36 擦洗 DNCC 后的消毒剂干燥时间各异:IPA 在 5 秒内干燥,CHG/IPA 在 20 秒内干燥,但聚维酮碘在 6 分钟后仍未干燥。36 只有少数国家和国际指南提及需要对消毒剂进行干燥(表 3)。1 也只有部分临床和体外研究说明了 DNCC 消毒后的干燥时间,尚无研究比较不同干燥时间或完全不干燥对消毒效果的影响。1 在最近一篇针对 21 项评估 DNCC 消毒效果的研究的评论性综述中,1 项研究规定了 5 秒的干燥时间,10 项研究采用了 ≥ 30 秒的干燥时间,其余 10 项研究未指明是否进行干燥。1 还需进一步开展试验,以确定围手术期的最佳干燥时间,从而帮助医护人员明确如何降低感染风险。
在 DNCC 中注入消毒剂是否有害?
一项最新研究表明,应在使用 DNCC 前进行干燥,以避免注入消毒剂。36 在 DNCC 中注入部分消毒剂是否有害这一问题仍有待回答。由于 IPA 主要代谢为丙酮,且丙酮有毒,因此这一问题应引起高度重视。16,37,38 两项体外研究对用 IPA 擦洗后干燥 15 秒37或用 CHG/乙醇擦洗后干燥 30 秒的 DNCC 进行了比较38,然后注射生理盐水。这些研究表明,测试管路液体中的酒精水平要么检测不到,37 要么“较低”38(每次体外注射的最大值 (µg) 小于新生儿毒性血液浓度阈值估计值(规定为大于 0.25 mg/mL)的 8%。现有文献中关于在消毒剂干燥之前通过 DNCC 进行可能的酒精或 CHG IV 注射的研究有限,因此需进一步开展研究。
IPA 盖
一些国家和国际建议包括在 DNCC 上使用 IPA 盖,因为 IPA 盖可提供被动消毒、消除手动擦洗(在最短接触时间后)、提供可见消毒指示、提供污染屏障,且可能有助于增加消毒依从性(相较于手动消毒)。1,15,17,39使用 DNCC 前,IPA 盖与 DNCC 的接触必须达到最短接触时间要求(如接触时间过短,则需要进行手动擦洗),这可使消毒剂在使用 DNCC 前干燥,且 IPA 盖可在每次使用后丢弃。
最近一项“先导性”RCT 发现,用 IPA 或 CHG/IPA 进行擦洗或使用 IPA 盖时,成人的 CLABSI 无显著差异。27 尽管 2019 年的 SHEA 建议15 称使用 IPA 盖为“最佳实践”,但这项 2021 年的“先导性”研究提出,应针对这一问题开展规模更大且更具结论性的研究。27 两项体外研究警告称,IPA 盖不得用于新生儿,因为在取下 IPA 后注射生理盐水会导致检测回路液体中出现“显著”的 IPA 水平。16,37,38 一项研究发现,在使用 IPA 盖 24 小时后,检测回路液体中的 IPA 水平显著,DNCC 接触 IPA 盖 7 天后,IPA 水平甚至更高。38 另一项研究显示,IPA 被注入检测回路的发现也会引起问题,因为在取下 IPA 盖后,DNCC 在注射前干燥了 30 秒。38 因此建议将含乙醇而非 IPA 的消毒盖作为降低新生儿毒性风险的替代措施。38
结论
 在使用血管导管时,要降低感染风险,需考虑许多问题。OLS 的设计会导致临床使用期间较高的管腔内微生物污染率,而 IPA 垫和端口擦洗装置均无法对 OLS 进行有效消毒。相比之下,DNCC 的注射表面可高效消毒。尽管关于最佳消毒剂和消毒方法以及最佳 DNCC 设计的问题仍有待回答,但多项研究发现,已消毒 DNSS 的管腔内污染率低于 OLS,一些研究发现,已消毒 DNSS 的 HAI 率低于 OLS。目前尚无研究发现 OLS 与已消毒的 DNCC 相比更具优势。生产商应提供带有 DNCC 和 DNCC 旋塞的 IV 管路组件,而不是 OLS,还应将 DNCC 旋塞作为单独的产品提供。动脉管路组件应包括用于采集血样的 DNCC 旋塞和保持管腔内无菌性的传感器调零装置。OLS 应限制在无菌区域使用。医护人员对 DNCC 消毒的依从性对于安全使用 DNCC 而言至关重要,应对此进行定期评估并开展有关手部清洁和无菌技术的再教育。此外,还建议多使用生产商或药房制备的药物和输注液,并遵循安全注射实践,以降低血管通路相关 HAI 和用药错误的风险。尽管对最佳 DNCC 消毒方法缺乏共识,且仍有许多问题有待回答,但现有文献表明,在使用 DNCC (或进行快速连续注射)之前,应使用含酒精的消毒剂擦洗 DNCC 至少 5 秒(一些建议称,擦洗时间应 ≥ 15 秒)或正确使用 IPA 盖,待干燥后再进行注射。与手动擦洗相比,IPA 盖具有潜在优势;然而,还需开展更多研究,以确定 IPA 盖在减少 HAI 方面是否比现有替代方法更有效,以及 IPA 盖是否可安全用于新生儿。
在使用血管导管时,要降低感染风险,需考虑许多问题。OLS 的设计会导致临床使用期间较高的管腔内微生物污染率,而 IPA 垫和端口擦洗装置均无法对 OLS 进行有效消毒。相比之下,DNCC 的注射表面可高效消毒。尽管关于最佳消毒剂和消毒方法以及最佳 DNCC 设计的问题仍有待回答,但多项研究发现,已消毒 DNSS 的管腔内污染率低于 OLS,一些研究发现,已消毒 DNSS 的 HAI 率低于 OLS。目前尚无研究发现 OLS 与已消毒的 DNCC 相比更具优势。生产商应提供带有 DNCC 和 DNCC 旋塞的 IV 管路组件,而不是 OLS,还应将 DNCC 旋塞作为单独的产品提供。动脉管路组件应包括用于采集血样的 DNCC 旋塞和保持管腔内无菌性的传感器调零装置。OLS 应限制在无菌区域使用。医护人员对 DNCC 消毒的依从性对于安全使用 DNCC 而言至关重要,应对此进行定期评估并开展有关手部清洁和无菌技术的再教育。此外,还建议多使用生产商或药房制备的药物和输注液,并遵循安全注射实践,以降低血管通路相关 HAI 和用药错误的风险。尽管对最佳 DNCC 消毒方法缺乏共识,且仍有许多问题有待回答,但现有文献表明,在使用 DNCC (或进行快速连续注射)之前,应使用含酒精的消毒剂擦洗 DNCC 至少 5 秒(一些建议称,擦洗时间应 ≥ 15 秒)或正确使用 IPA 盖,待干燥后再进行注射。与手动擦洗相比,IPA 盖具有潜在优势;然而,还需开展更多研究,以确定 IPA 盖在减少 HAI 方面是否比现有替代方法更有效,以及 IPA 盖是否可安全用于新生儿。
Elliott S. Greene(医学博士)是奥尔巴尼医学院(纽约州奥尔巴尼)麻醉学系的麻醉学教授。
作者没有利益冲突。
参考文献
- Greene ES. Challenges in reducing the risk of infection when accessing vascular catheters. J Hosp Infect. 2021;113:130–144.
- Dolan SA, Arias KM, Felizardo G, et al. APIC position paper: Safe injection, infusion, and medication vial practices in health care. Am J Infect Control. 2016;44:750-757.
- Holroyd JL, Paulus DA, et al. Universal intravenous access cleaning device fails to sterilize stopcocks. Anesth Analg. 2014;118:333-343.
- Rowlands J, Yeager MP, Beach M, et al. Video observation to map hand contact and bacterial transmission in operating rooms. Am J Infect Control. 2014;42:698–701.
- Institute for Safe Medication Practices Safe Practice Guidelines for Adult IV Push Medications. https://www.ismp.org/sites/default/files/attachments/2017-11/ISMP97-Guidelines-071415-3.%20FINAL.pdf Last accessed October 10, 2021.
- Anesthesia Patient Safety Foundation. Recommendations for improving medication safety consensus from four work groups at the 2018 APSF Stoelting Conference on Medication Safety. Rochester, MN: APSF; 2018. https://www.apsf.org/medication-safety-recommendations Last accessed October 10, 2021.
- Centers for Disease Control and Prevention. Safe injection practices to prevent transmission of infections to patients. Atlanta, GA. https://www.cdc.gov/injectionsafety/ip07_standardprecaution.html Last accessed October 1, 2021.
- Mermel LA, Bert A, Chapin KC, LeBlanc L. Intraoperative stopcock and manifold colonization of newly inserted peripheral intravenous catheters. Infect Control Hosp Epidemiol. 2014;35:1187–1189.
- Loftus RW, Koff MD, Burchman CC, et al. Transmission of pathogenic bacterial organisms in the anesthesia work area. Anesthesiology. 2008;109:399–407.
- Loftus RW, Brindeiro BS, Kispert DP, et al. Reduction in intraoperative bacterial contamination of peripheral intravenous tubing through the use of a passive catheter care system. Anesth Analg. 2012;115:1315–1323.
- Rupp ME, Yu S, Huerta T, et al. Adequate disinfection of a split-septum needleless intravascular connector with a 5-second alcohol scrub. Infect Control Hosp Epidemiol. 2012;33:661–665.
- Slater K, Cooke M, Fullerton F, et al. Peripheral intravenous catheter needleless connector decontamination study – randomized controlled trial. Am J Infect Control. 2020;48:1013–1018.
- Casey A, Karpanen T, Nightingale P, Elliott T. An in vitro comparison of microbial ingress into 8 different needleless IV access devices. J Infus Nurs. 2015;38:18–25.
- Loftus RW, Patel HM, Huysman BC, et al. Prevention of intravenous bacterial injection from health care provider hands: the importance of catheter design and handling. Anesth Analg. 2012;115:1109–1119.
- Munoz-Price LS, Bowdle A, Johnston BL, et al. Infection prevention in the operating room anesthesia work area. Infect Control Hosp Epidemiol. 2019;40:1–17.
- Voor In’t Holt AF, Helder OK, Vos MC, et al. Antiseptic barrier cap effective in reducing central line-associated bloodstream infections: a systematic review and meta-analysis. Int J Nurs Stud. 2017;69:34–40.
- Merrill KC, Sumner S, Linford L, et al. Impact of universal disinfectant cap implementation on central line associated bloodstream infections. Am J Infect Control. 2014;42:1274–1277.
- Mermel LA. What is the predominant source of intravascular catheter infections? Clin Infect Dis. 2011;52:211–212.
- Moureau NL, Flynn J. Disinfection of needleless connector hubs: clinical evidence systematic review. Nurs Res Pract. 2015;2015:796762.
- Ryan AJ, Webster CS, Merry AF, Grieve DJ. A national survey of infection control practice by New Zealand anaesthetists. Anaesth Intensive Care. 2006;34:68e74
- Balikci E, Yilmaz B, Tahmasebifar A, et al. Surface modification strategies for hemodialysis catheters to prevent catheter-related infections: a review. J Biomed Mater Res B Appl Biomater. 2021;109:314-327.
- Arciola CR, Campoccia D, Montanaro L. Implant infections: adhesion, biofilm formation and immune evasion. Nat Rev Microbiol. 2018;16:397–409.
- Gominet M, Compain F, Beloin C, Lebeaux D. Central venous catheters and biofilms: where do we stand in 2017? Acta Pathol Microbiol Immunol Scand. 2017;125:365–375.
- Greene ES. New SHEA expert guidance for infection prevention in the anesthesia work area needs improvement. Infect Control Hosp Epidemiol. 2019;40:607–608.
- Deloney V, Bowdle A, Birnbach DJ, et al. Reply to Greene: New SHEA expert guidance for infection prevention in the anesthesia work area needs improvement. Infect Control Hosp Epidemiol. 2021;25:1.
- US Occupational Safety and Health Administration. Bloodborne pathogens and needlestick prevention. Washington, DC. https://www.osha.gov/SLTC/bloodbornepathogens/index.html. Last accessed October 1, 2021.
- Rickard CM, Flynn J, Larsen E, et al. Needleless connector decontamination for prevention of central venous access device infection: a pilot randomized controlled trial. Am J Infect Control. 2021;49:269–273.
- Flynn JM, Rickard CM, Keogh S, Zhang L. Alcohol caps or alcohol swabs with and without chlorhexidine: an in vitro study of 648 episodes of intravenous device needleless connector decontamination. Infect Control Hosp Epidemiol. 2017;38:617–619.
- Practice guidelines for central venous access 2020: an updated report by the American Society of Anesthesiologists Task Force on Central Venous Access. Anesthesiology. 2020;132:8–43.
- O’Grady NP, Alexander M, Burns LA, et al. Healthcare Infection Control Practices Advisory Committee. Guidelines for the prevention of intravascular catheter-related infections. Atlanta, GA: Centers for Disease Control and Prevention; updated October 2017. Available at: https://www.cdc.gov/infectioncontrol/pdf/guidelines/bsi-guidelines-H.pdf Last accessed November 23, 2021.
- Association for Professionals in Infection Control and Epidemiology. Guide to preventing central line-associated bloodstream infections. Washington, DC: APIC; 2015. http://apic.org/Resource_/TinyMceFileManager/2015/APIC_CLABSI_WEB.pdf. Last accessed October 1, 2021.
- Marschall J, Mermel LA, Fakih M, et al. Society for Healthcare Epidemiology of America. Strategies to prevent central line-associated bloodstream infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014;35:753–771.
- Loveday HP, Wilson JA, Pratt RJ, et al. UK Department of Health. epic3: National evidence based guidelines for preventing healthcare-associated infections in NHS hospitals in England. J Hosp Infect. 2014;86(Suppl. 1):S1–70.
- Hallam C. (2019) Right Hub Disinfection for Compliance. In: Moureau N. (eds) Vessel Health and Preservation: The Right Approach for Vascular Access. pp 235–241 Springer, Cham. https://doi.org/10.1007/978-3-030-03149-7_18. Online June 11, 2019. Last accessed November 22, 2021.
- Casey AL, Karpanen TJ, Nightingale P, Elliott TS. The risk of microbial contamination associated with six different needle-free connectors. Br J Nurs. 2018;27:S18–S26.
- Slater K, Fullerton F, Cooke M, et al. Needleless connector drying time – how long does it take? Am J Infect Control. 2018;46:1080–1081.
- Sauron C, Jouvet P, Pinard G, et al. Using isopropyl alcohol impregnated disinfection caps in the neonatal intensive care unit can cause isopropyl alcohol toxicity. Acta Paediatr. 2015;104:e489–493.
- Hjalmarsson LB, Hagberg J, Schollin J, Ohlin A. Leakage of isopropanol from port protectors used in neonatal care-Results from an in vitro study. PLoS One. 2020;15:e0235593.
- Bell T, O’Grady NP. Prevention of central line-associated bloodstream infections. Infect Dis Clin N Am. 2017;31:551–559.


 Issue PDF
Issue PDF