INTRODUÇÃO
Os rápidos avanços nas áreas de eletrofisiologia (EP) e cardiologia intervencionista aumentaram a demanda por serviços de anestesia.1,2 Esses procedimentos têm crescido em complexidade e muitas vezes envolvem o atendimento de pacientes com doença aguda com múltiplas comorbidades, incluindo doença cardíaca e pulmonar avançada. Fornecer anestesia para pacientes que passam por esses procedimentos fora do centro cirúrgico pode ser desafiador: o ambiente e o equipamento podem ser desconhecidos, o espaço é limitado e há barreiras físicas entre o profissional de anestesia e o paciente. A análise do banco de dados de processos julgados da ASA indica que um número significativo de lesões ocorre na sala de cardiologia (EP e laboratório de cateterismo), perdendo apenas para o laboratório de gastroenterologia.3 Compreender os desafios inerentes ao fornecimento de anestesia nessas áreas e preparar-se para lidar com eles pode aumentar a segurança do paciente.
AVALIAÇÃO PRÉ-OPERATÓRIA
A avaliação pré-procedimento deve incluir histórico e exame físico completos, revisão de alergias (especificamente alergia a contraste iodado) e conciliação medicamentosa. Atenção especial deve ser dada aos anticoagulantes e regimes de insuficiência cardíaca. Com exceção dos procedimentos de ablação, os betabloqueadores e os medicamentos antiplaquetários geralmente são continuados no ambiente periprocedimento.2,4 Se houver uma clínica de anestesia pré-operatória disponível, poderá ser feita a avaliação adicional de certos pacientes ou procedimentos de alto risco (Tabela 1).
Tabela 1: Fatores de alto risco do paciente que podem justificar a avaliação anestésica antes de procedimento cardíaco fora do centro cirúrgico
Como esses pacientes são comumente acompanhados por um cardiologista, talvez uma exaustiva propedêutica já tenha sido realizada. Um eletrocardiograma de 12 derivações, ecocardiograma e relatório de monitorização cardíaca podem estar disponíveis para análise. Se o paciente tiver um dispositivo cardiovascular eletrônico implantável, o profissional de anestesia deve pesquisar o fabricante, as configurações atuais, a indicação de colocação e se o paciente é dependente de marca-passo. O mais recente encontro do Comitê Consultivo de Prática da American Society of Anesthesiologists de 2020 não chegou a um consenso sobre o prazo em que uma interrogação do dispositivo deve ser concluída antes de um procedimento eletivo, embora o relatório tenha afirmado que a maioria dos membros e consultores da ASA recomendam a interrogação 3 a 6 meses antes do procedimento planejado.5
Os exames laboratoriais pré-operatórios variam de acordo com o tipo de intervenção e risco de sangramento. Os laboratórios podem incluir um hemograma completo, tipo e triagem, estudos de coagulação e painel metabólico básico, principalmente se for usado contraste.
LABORATÓRIO DE ELETROFISIOLOGIA
Independentemente da técnica de ablação empregada, pode haver complicações que precisarão ser tratadas imediatamente, pois a descompensação pode ser rápida. A complicação mais comum está relacionada às lesões do acesso vascular seguidas de perfuração/tamponamento cardíaco.6 A perfuração precisa ser tratada de modo emergencial por reversão imediata da anticoagulação e pericardiocentese. O anestesiologista deve estar preparado para administrar rapidamente hemoderivados e iniciar infusões de vasopressores quando necessário. Se ocorrer colapso hemodinâmico e for necessário transportar o paciente para a sala de cirurgia e realizar uma intervenção cirúrgica, o planejamento pré-procedimento entre as equipes de anestesia e eletrofisiologia sobre a logística de transporte de um paciente instável economizará tempo valioso. Outras complicações periprocedimento potenciais incluem acidente vascular cerebral, bloqueio cardíaco, edema pulmonar, paralisia do nervo frênico, perfuração esofágica e, raramente, hemorragia pulmonar.6-8
Linhas intravenosas de grande calibre, cateteres arteriais e/ou cateteres centrais devem ser colocados antes do início do procedimento, pois pode ser impossível acessar o paciente em caso de emergência depois que ele é coberto. O acesso arterial é preferido em pacientes em que a instabilidade hemodinâmica é prevista ou em procedimentos de longa duração. Muitas vezes, a monitorização da pressão arterial é obtida pelo eletrofisiologista como parte do procedimento; entretanto, deve-se observar que a forma de onda poderá ser atenuada e se tornar imprecisa se o lúmen da bainha arterial for ocluído por um dispositivo. Muitos anestesiologistas podem considerar usar a própria monitorização invasiva da pressão arterial para evitar essa armadilha e como forma de acompanhar a gasometria arterial durante todo o procedimento. Uma discussão pré-procedimento com o eletrofisiologista sobre essas questões é essencial para evitar a dificuldade de monitorização da pressão arterial.
Para complicar ainda mais os cuidados anestésicos, há equipamentos grandes para mapeamento cardíaco e imagens fluoroscópicas que são uma barreira física entre a equipe de anestesia e as vias aéreas do paciente. Além disso, a mesa de operação e o arco em C fluoroscópico são controlados pelo eletrofisiologista, o que pode resultar em deslocamento acidental do circuito respiratório, das linhas intravenosas e dos monitores. Essas circunstâncias devem ser previstas e extensões devem ser adicionadas às linhas.
ABLAÇÕES POR CATETER
As ablações por cateter são a principal opção de tratamento para taquicardia supraventricular (TSV), flutter atrial (FIA), fibrilação atrial (FA) e taquicardia ventricular (TV) com o objetivo de criar uma lesão transmural que erradique permanentemente o tecido cardíaco arritmogênico sem causar lesão colateral nas estruturas adjacentes. Procedimentos de duração mais curta, como ablações de TSV e FIA, podem ser realizados sem um anestesiologista usando sedação moderada por um enfermeiro qualificado sob a supervisão do eletrofisiologista. No entanto, procedimentos mais complexos que exigem um tempo significativo para mapeamento e ablação podem ser mais bem realizados por um anestesiologista com cuidados anestésicos monitorados ou anestesia geral.
Deve-se destacar que, como muitos medicamentos anestésicos comumente administrados podem suprimir a indutibilidade da arritmia, a discussão pré-procedimento com a equipe de eletrofisiologia é importante para determinar o anestésico adequado para o paciente (Tabela 2).9
Tabela 2: Agentes anestésicos e seus efeitos eletrofisiológicos
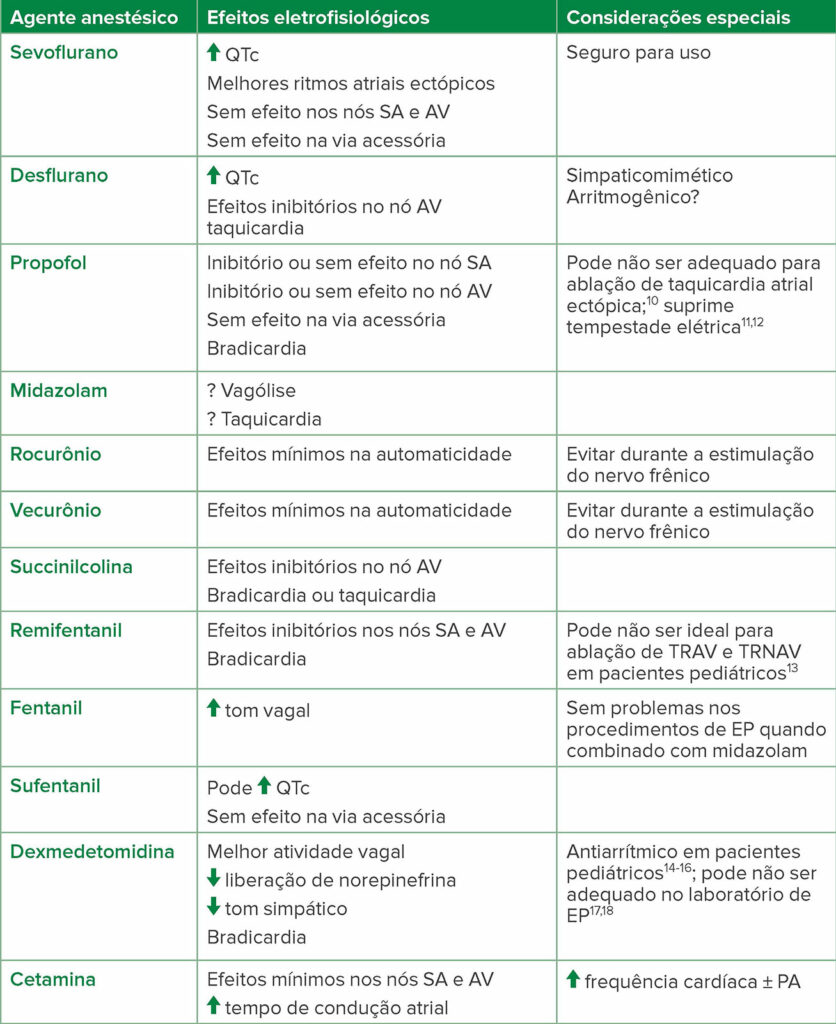
Abreviaturas: AV, atrioventricular; TRNAV, taquicardia por reentrada nodal atrioventricular; TRAV, taquicardia por reentrada atrioventricular; PA, pressão arterial; EP, eletrofisiologia; SA, sinoatrial.
Adaptado do Journal of Cardiothoracic and Vascular Anesthesia, Vol 32, Edição 4. Satoru Fujii, Jian Ray Zhou, Achal Dhir, Anesthesia for Cardiac Ablation, Páginas 1892–1910, Copyright (2018), com permissão de Elsevier.
Ablação por radiofrequência (RF)
A ablação do endocárdio por radiofrequência (RF) é a técnica mais utilizada para variadas arritmias em que a energia eletromagnética é convertida em energia térmica resultando em uma lesão térmica irreversível do tecido miocárdico. Normalmente, o resfriamento ativo por meio da administração de solução salina na ponta do cateter é realizado para evitar lesões colaterais decorrentes de temperaturas excessivas na interface eletrodo-tecido.19 Uma intervenção útil quando um procedimento de RF envolve o átrio esquerdo (ou seja, ablação de FA) é colocar uma sonda de temperatura esofágica que permite a monitorização contínua da temperatura, minimizando o risco para estruturas adjacentes, como o esôfago. A manutenção de uma temperatura esofágica ≤ 38,5 °C pode estar associada a uma diminuição das lesões esofágicas, como ulceração e formação de fístula átrio-esofágica esquerda.20 Além disso, o resfriamento ativo pode resultar na administração de vários litros de solução salina pelo eletrofisiologista ao longo do procedimento e deve ser levado em consideração ao avaliar o equilíbrio hídrico geral. Isso é especialmente válido para pacientes com função ventricular deficiente.
Ablação por criobalão
A ablação por criobalão é uma tecnologia mais recente, usada principalmente no tratamento da FA, que congela o endocárdio, resultando em propagação prejudicada de sinais elétricos aberrantes. Um cateter com ponta de balão é inserido em uma veia pulmonar e, quando inflado, congela circunferencialmente o tecido circundante. Uma consideração técnica para o anestesiologista é evitar o uso de relaxantes musculares porque a estimulação do nervo frênico é frequentemente empregada. A paralisia do nervo frênico é uma das complicações mais comuns após a ablação por criobalão.21
Ablação epicárdica
Uma abordagem epicárdica para ablação pode ser empregada para certas arritmias ventriculares e como parte de uma técnica híbrida de cateter cirúrgico para FA. A abordagem híbrida é uma técnica relativamente nova em que tanto o epicárdio quanto o endocárdio são tratados, o que pode trazer algum benefício adicional no tratamento da FA, combinando as abordagens cirúrgica (epicárdica) e por cateter (endocárdio).22 Esses procedimentos epicárdicos são realizados exclusivamente sob anestesia geral. Se for encontrada hipotensão durante uma abordagem epicárdica, complicações exclusivas que devem ser suspeitadas incluem lesão de uma artéria coronária e sangramento intra-abdominal.7
LABORATÓRIO DE CATETERIZAÇÃO
Substituição da válvula aórtica transcateter
Nos últimos anos, as indicações e considerações anestésicas para a substituição da válvula aórtica transcateter (TAVR) evoluíram. Uma vez indicado apenas para pacientes com estenose aórtica (EA) grave e sintomática, para os quais a substituição cirúrgica da válvula aórtica era considerada de alto risco, sua aprovação foi recentemente expandida para uso em pacientes sintomáticos de baixo risco com EA.23,24 Além disso, a TAVR está sendo avaliada para pacientes assintomáticos com EA grave.
Existem atualmente dois sistemas TAVR usados nos Estados Unidos; as válvulas Edwards Sapien e a família de dispositivos Medtronic CoreValve. A válvula Sapien é uma válvula expansível por balão de baixo perfil que não pode ser reposicionada após a implantação, enquanto a família de válvulas CoreValve é autoexpansível, de perfil superior e pode ser parcialmente recapturada e reajustada para um posicionamento ideal.
O uso da válvula Sapien ou a realização de valvoplastia aórtica com balão antes da implantação da válvula requer estimulação ventricular rápida (160-220 batimentos/minuto) por meio de um marca-passo transvenoso temporário. Isso minimiza o fluxo sanguíneo na via de saída do ventrículo esquerdo, reduzindo assim o risco de migração da válvula durante a implantação.25 A estimulação rápida e a hipotensão subsequente podem não ser bem toleradas por pacientes com estenose aórtica, mas essa situação geralmente é transitória. O uso de vasopressores, como fenilefrina ou norepinefrina, só deverá ser considerado para tratar uma hipotensão persistente, pois pode ocorrer hipertensão rebote após a interrupção do marca-passo.
Embora a mortalidade geral por TAVR permaneça baixa em 1-4%, complicações podem levar a uma morbidade significativa. A maioria das complicações são identificadas no intraoperatório e incluem lesão vascular (4,2%), dissecção da aorta (0,2%), perfuração ventricular levando a tamponamento (1%), mau posicionamento e mau funcionamento da válvula (0,3%), ruptura anular (0,4%), acidente vascular cerebral , infarto do miocárdio e bloqueio nodal atrioventricular de alto grau com necessidade de marca-passo permanente (8,8%).26
A abordagem mais comum para a colocação do dispositivo é a transfemoral (95%). Outras abordagens incluem subclávia/axilar, transaórtica, transapical, transcaval e transcarótida. A abordagem transfemoral tem o benefício de desconforto mínimo para o paciente e mínima necessidade de sedação. À medida que a tecnologia se tornou mais sofisticada e os intervencionistas mais habilidosos, o uso de sedação leve a moderada para TAVR cresceu em popularidade. Dados recentes mostram que os benefícios incluem menor uso de vasopressores, diminuição modesta da mortalidade intra-hospitalar, menor tempo de permanência hospitalar e alta mais frequente.27 Ao utilizar sedação com anestesia local, a colocação do dispositivo é confirmada com fluoroscopia e ecocardiograma transtorácico (ETT).
Se o ecocardiograma transesofágico (ETE) for preferido ao ETT ou quando uma abordagem transfemoral percutânea não for viável, muitas vezes devido à vasculatura iliofemoral inadequada, ou um corte cirúrgico para reparo vascular for necessário, a anestesia geral com um tubo endotraqueal será utilizada. Os benefícios da anestesia geral incluem um campo cirúrgico tranquilo, controle completo das vias aéreas e reconhecimento precoce de complicações cirúrgicas com ETE.
Independentemente do tipo de anestesia, recomenda-se a monitorização invasiva da pressão arterial. Isso pode ser feito por meio de uma linha arterial radial ou pela transdução da bainha arterial usada pelo intervencionista para a aortografia. Também são recomendados acesso IV periférico de grande calibre e acesso imediato a sangue com prova cruzada.
Reparo ou substituição da válvula mitral transcateter
O reparo da válvula mitral transcateter (TMVr) pode ser considerado para pacientes com regurgitação mitral sintomática, moderada-grave ou grave para os quais o reparo cirúrgico da válvula é considerado de alto risco. O dispositivo MitraClip (Abbott Vascular-Structural Heart, Menlo Park, CA, EUA) é atualmente o único com aprovação da FDA e o reparo é realizado em um laboratório de cateterismo cardíaco ou sala de cirurgia híbrida. O MitraClip é um dispositivo de reparo de folheto modelado a partir do ponto cirúrgico de Alfieri que cria um reparo de borda a borda e uma válvula mitral de duplo orifício, reduzindo assim o grau de regurgitação mitral.28
Ao realizar o reparo do folheto transcateter, a canulação venosa transfemoral é obtida pelo profissional responsável pelo procedimento. Usando orientação fluoroscópica e ETE em tempo real, o dispositivo é direcionado através do septo intra-atrial, do átrio esquerdo e da válvula mitral até o ventrículo esquerdo. As imagens de ETE bidimensionais e tridimensionais são essenciais para posicionar o dispositivo com precisão. Imediatamente após a liberação do MitraClip, os graus de regurgitação mitral e estenose iatrogênica são avaliados com ETE. Se o posicionamento não for ideal, o clipe poderá ser recuperado, reposicionado ou removido. Também será possível usar mais de um clipe para reduzir a regurgitação, se necessário.29
A anestesia geral com tubo endotraqueal é recomendada, dada a importância do ETE para a colocação do dispositivo. O acesso arterial radial é normalmente obtido pelo anestesiologista para monitorização hemodinâmica próxima e coleta de sangue. Extrações laboratoriais frequentes podem ser necessárias para atingir o nível desejado de anticoagulação. Se o acesso à artéria radial for difícil, outros locais de acesso arterial poderão ser utilizados. A colocação de cateter venoso central normalmente não é necessária, embora acesso IV de grande calibre seja recomendado devido ao risco de conversão emergente para reparo cirúrgico aberto. Deve haver sangue com prova cruzada disponível na sala de procedimentos.29
As complicações do TMVr incluem descolamento parcial do clipe ou embolização, tamponamento, sangramento nos locais de acesso e estenose mitral iatrogênica. É importante notar que o TMVr pode resultar em um defeito do septo atrial iatrogênico no local da punção septal. Se houver um shunt, todos os cateteres intravenosos deverão ser cuidadosamente avaliados quanto à presença de ar para evitar acidente vascular cerebral.
Alternativamente, e menos comumente realizada, a substituição da válvula mitral transcateter (TMVR) é aprovada pela FDA para pacientes de alto risco que têm uma válvula mitral com falha previamente substituída por uma válvula bioprotética ou reparada com um anel de anuloplastia. As válvulas Edwards Sapien 3 e Sapien 3 Ultra, projetadas para TAVR, são usadas nesses pacientes para substituições do tipo “valve-in-valve” ou “valve-in-ring”. Algumas instituições também estão usando a TAVR em procedimentos fora da indicação para tratar a doença da válvula mitral nativa refratária em estágio final. A tecnologia de TMVR ainda está evoluindo e seu uso tem sido limitado devido a resultados ruins. Semelhante ao TMVr, a anestesia geral é normalmente usada para TMVR devido ao uso necessário de ETE.
PROCEDIMENTOS CARDÍACOS ADICIONAIS FORA DO CENTRO CIRÚRGICO
Ecocardiograma transesofágico diagnóstico
O ETE é utilizado para visualizar melhor as estruturas cardíacas que não são bem visualizadas pelo ETT. Embora o uso rotineiro do ETE não seja apropriado, pois o ETT apresenta pouco ou nenhum risco e muitas vezes é adequado para o diagnóstico, existem várias situações clínicas em que o ETE é preferido. As indicações clínicas para ETE podem incluir patologia valvar e planejamento cirúrgico, avaliação urgente de patologia aórtica aguda (ou seja, dissecção aórtica), diagnóstico de endocardite infecciosa e antes de cardioversão por corrente direta (CCD) não emergente ou ablação para avaliar trombo intracardíaco.
O ETE diagnóstico é tipicamente realizado com sedação moderada. Deve-se evitar apneia. A aplicação tópica cuidadosa de lidocaína na faringe pode ser usada para diminuir a quantidade de sedação necessária. A aplicação tópica de benzocaína caiu em desuso devido ao risco de metemoglobinemia. Glicopirrolato intravenoso também pode ser usado para minimizar as secreções orais.30 A estimulação associada à inserção da sonda de ETE pode ser atenuada com um bolus de propofol de 0,25-0,5 mg/kg. Após a inserção, o grau de estimulação diminui rapidamente e a sedação moderada pode ser alcançada com uma infusão de propofol em baixa dose ou bolus incrementais de propofol. O propofol tem a vantagem de um início de efeito e metabolismo rápidos, além de efeitos residuais mínimos após o procedimento.28 Alternativamente, pode-se usar um bolus de dexmedetomidina de 0,5-1 mcg/kg durante 10 minutos e/ou uma infusão de 0,2-1 mcg/kg/hora em conjunto com a aplicação tópica adequada das vias aéreas.
Em certos grupos de pacientes de alto risco, como aqueles com via aérea difícil, alto risco de aspiração, estado neurológico prejudicado ou aqueles com precauções para partículas suspensas no ar, como COVID-19, a anestesia geral com tubo endotraqueal pode ser justificada. Como o ETE é um procedimento de aerossolização, seu uso eletivo deve ser evitado em pacientes com COVID-19, a menos que os achados alterem o manejo clínico.
Embora o ETE seja um procedimento geralmente seguro, ocorrem complicações como laringoespasmo, aspiração, lesão faríngea, víscera perfurada e hemorragia. O tratamento inicial para esses eventos adversos é tipicamente intubação endotraqueal e ressuscitação.
Cardioversão por corrente direta (CCD)
A CCD geralmente é um procedimento curto que requer um rápido início e término da anestesia. Após a aplicação de monitores e capnografia padrão ASA, um bolus de propofol de 0,25-0,5 mg/kg é administrado de modo que o paciente não responda à estimulação tátil ou verbal. Deve-se evitar apneia. Depois de confirmada a sedação profunda, o choque elétrico pode ser aplicado. Pacientes submetidos a CCD podem ter baixo débito cardíaco, tempo de circulação lento e atraso no início das medicações de indução, o que pode levar à sedação excessiva. Medicamentos para tratar hipotensão e/ou bradicardia, como fenilefrina, efedrina e glicopirrolato ou atropina, devem estar prontamente disponíveis.28,31 Pás de desfibrilação externa pré-procedimento devem estar disponíveis em caso de assistolia pós-cardioversão e se estimulação extrínseca for necessária. Se um paciente tiver um dispositivo cardíaco eletrônico implantável, como marca-passo ou desfibrilador, o dispositivo deverá ser avaliado imediatamente após a cardioversão externa ou desfibrilação.8
CONCLUSÕES
À medida que as intervenções cardíacas se tornam mais sofisticadas e menos invasivas, os anestesiologistas têm a tarefa de prestar cuidados seguros em uma ampla variedade de locais, muitas vezes distantes da sala de cirurgia. Além disso, os pacientes submetidos a esses procedimentos têm histórias clínicas complexas e estão mais gravemente doentes. Como componente integral da equipe assistencial, é imperativo que o anestesiologista esteja familiarizado com os desafios dos procedimentos fora do centro cirúrgico, compreenda o procedimento em si e possa prever dificuldades para proporcionar um atendimento seguro ao paciente.
Todd Novak, MD, é anestesista assistente no NorthShore University HealthSystem e professor assistente na University of Chicago Pritzker School of Medicine.
Chelsea Zur, MD, é anestesista assistente no NorthShore University HealthSystem e instrutora clínica na University of Chicago Pritzker School of Medicine.
Os autores não apresentam conflitos de interesse.
REFERÊNCIAS
- Gaitan BD, Trentman TL, Fassett SL, et al. Sedation and analgesia in the cardiac electrophysiology laboratory: a national survey of electrophysiologists investigating the who, how, and why? J Cardiothorac Vasc Anesth. 2011;25:647–659.
- Anderson R, Harukuni I, Sera V. Anesthetic considerations for electrophysiologic procedures. Anesthesiol Clin. 2013;31:479–489.
- Metzner J. Posner KL, Domino KB. The risk and safety of anesthesia at remote locations: the US closed claims analysis. Curr Opin Anaesthesiol. 2009;22:502–508.
- Shook D, Evangelista K. Anesthetic considerations for electrophysiology, interventional cardiology, and transesophageal echocardiography procedures. In: Post TW, ed. UpToDate. UpToDate; 2021. Accessed September 9, 2021.
- Practice Advisory for the Perioperative Management of Patients with Cardiac Implantable Electronic Devices: Pacemakers and Implantable Cardioverter–Defibrillators 2020: An Updated Report by the American Society of Anesthesiologists Task Force on Perioperative Management of Patients with Cardiac Implantable Electronic Devices. Anesthesiology. 2020;132:225–252.
- Gupta A, Perera T, Ganesan A, et al. Complications of catheter ablation of atrial fibrillation: a systematic review. Circ Arrhythm Electrophysiol. 2013;6:1082–1088.
- Kumareswaran R, Marchlinski FE. Practical guide to ablation for epicardial ventricular tachycardia: when to get access, how to deal with anticoagulation and how to prevent complications. Arrhythm Electrophysiol. Rev. 2018;7:159–164.
- Haines DE, Beheiry S, Akar JG, et al. Heart Rhythm Society expert consensus statement on electrophysiology laboratory standards: process, protocols, equipment, personnel, and safety. Heart Rhythm. 2014 Aug;11:e9–51.
- Fujii S, Zhou JR, Dhir A. Anesthesia for cardiac ablation. J Cardiothorac Vasc Anesth. 2018;32:1892–1910.
- Lai LP, Lin JL, Wu MH, et al. Usefulness of intravenous propofol anesthesia for radiofrequency catheter ablation in patients with tachyarrhythmias: infeasibility for pediatric patients with ectopic atrial tachycardia. Pacing Clin Electrophysiol. 1999;22:1358–1364.
- Burjorjee JE, Milne B. Propofol for electrical storm: a case report of cardioversion and suppression of ventricular tachycardia by propofol. Can J Anaesth. 2002;49:973–977.
- Mulpuru SK, Patel DV, Wilbur SL, et al. Electrical storm and termination with propofol therapy: a case report. Int J Cardiol. 2008;128:e6–8.
- Niksch A, Liberman L, Clapcich A, et al. Effects of remifentanil anesthesia on cardiac electrophysiologic properties in children undergoing catheter ablation of supraventricular tachycardia. Pediatr Cardiol. 2010;31:1079–1082.
- Hammer GB, Drover DR, Cao H, et al. The effects of dexmedetomidine on cardiac electrophysiology in children. Anesth Analg. 2008;106:79–83.
- Chrysostomou C, Sanchez-de-Toledo J, Wearden P, et al. Perioperative use of dexmedetomidine is associated with decreased incidence of ventricular and supraventricular tachyarrhythmias after congenital cardiac surgery. Ann Thorac Surg. 2011;92:964–972.
- Herr DL, Sum-Ping STJ, England M. ICU sedation after coronary artery bypass graft surgery: Dexmedetomidine-based versus propofol-based sedation regimens. J Cardiothorac Vasc Anesth. 2003;17:576–584.
- Mittnacht AJC, Dukkipati S, Mahajan A. Ventricular tachycardia ablation: a comprehensive review for anesthesiologists. Anesth Analg. 2015;120:737–748.
- Hayman M, Forrest P, Kam P. Anesthesia for interventional cardiology. J Cardiothorac Vasc Anesth. 2012;26:134–147.
- Houmsse M and Daoud EG (2012) Biophysics and clinical utility of irrigated-tip radiofrequency catheter ablation. Expert Review of Medical Devices. 9:1,59–70.
- Singh SM, d’Avila A, Doshi SK, et al. Esophageal injury and temperature monitoring during atrial fibrillation ablation. Circ Arrhythm Electrophysiol. 2008;1:162–168.
- Tokuda, M., Yamashita, S., Sato, H. et al. Long-term course of phrenic nerve injury after cryoballoon ablation of atrial fibrillation. Sci Rep 11, 6226 (2021).
- Driver K, Mangrum JM. Hybrid approaches in atrial fibrillation ablation: why, where and who? J Thorac Dis. 2015;7:159–164.
- Mack MJ, Leon MB, Thourani VH, et al. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients. N Engl J Med. 2019;380:1695–1705.
- Coylewright M, Forrest J, McCabe J, Nazif T. TAVR in low-risk patients: FDA approval, the new NCD and shared decision-making. JACC. 2020;75:1208–1211.
- Novak T, Parulkar S. The anesthesia professional’s role in patient safety during TAVR (transcatheter aortic valve replacement). APSF Newsletter. 2017;31:73–75.
- Dalby M, Panoulas V. Transcatheter aortic valve replacement: complications. In: Post TW, ed. UpToDate, UpToDate, 2021. Accessed October 1, 2021.
- Butala NM, Chung M, Secemsky EA, et al. Conscious sedation versus general anesthesia for transcatheter aortic valve replacement: variation in practice and outcomes. J Am Coll Cardiol Intv. 2020;13:1277–1287.
- Faillace R, Kaddaha R, Bikkina M, et al. The role of the out-of-operating room anesthesiologist in the care of the cardiac patient. Anesthesiology Clin. 2009;27:29–46.
- Gregory SH, Sodhi N, Zoller JK, et al. Anesthetic considerations for the transcatheter management of mitral valve disease. J Cardiothorac Vasc Anesth. 2019;33:796–807.
- Hahn R, Abraham T, Adams M, et al. Guidelines for performing a comprehensive transesophageal echocardiographic examination: recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiography. 2013;26:921–964.
- Lu F, Lin J, Benditt D. Conscious sedation and anesthesia in the cardiac electrophysiology laboratory. J Cardiovasc Electrophysiol. 2013;24:237–245.


 Issue PDF
Issue PDF