Las medidas básicas de control de infecciones basadas en evidencia implementadas de manera efectiva en el área de trabajo de anestesia pueden generar reducciones sustanciales en la transmisión de patógenos y el desarrollo de infecciones en el sitio quirúrgico. Estas medidas están indicadas para mejorar la seguridad del paciente. En esta breve revisión, caracterizamos las medidas preventivas básicas con pocas barreras percibidas para la implementación y destacamos las características clave de la implementación.
INTRODUCCIÓN
 La prevención de infecciones es de suma importancia para los profesionales de la anestesia en 2022 dadas las enfermedades infecciosas emergentes como el COVID-191 , la viruela símica2 , Cándida auris3 y la naturaleza persistente de las infecciones en el sitio quirúrgico (SSI) asociadas con una mayor morbilidad y mortalidad de los pacientes.4-6 Además, como cualquier infección puede conducir a la sepsis, la prevención de la infección es la prevención de la sepsis.7 Las medidas básicas de control de infecciones perioperatorias basadas en la evidencia para el área de trabajo de la anestesia tienen una eficacia comprobada para patógenos virales8 y bacterianos, lo que genera reducciones sustanciales en la transmisión de patógenos y la infección posterior.8-10 Es hora de que los profesionales de la anestesia, que siempre han sido líderes en seguridad del paciente, aprovechen la sólida plataforma de evidencia publicada para mejorar la seguridad de nuestros pacientes a través de la prevención de infecciones.11
La prevención de infecciones es de suma importancia para los profesionales de la anestesia en 2022 dadas las enfermedades infecciosas emergentes como el COVID-191 , la viruela símica2 , Cándida auris3 y la naturaleza persistente de las infecciones en el sitio quirúrgico (SSI) asociadas con una mayor morbilidad y mortalidad de los pacientes.4-6 Además, como cualquier infección puede conducir a la sepsis, la prevención de la infección es la prevención de la sepsis.7 Las medidas básicas de control de infecciones perioperatorias basadas en la evidencia para el área de trabajo de la anestesia tienen una eficacia comprobada para patógenos virales8 y bacterianos, lo que genera reducciones sustanciales en la transmisión de patógenos y la infección posterior.8-10 Es hora de que los profesionales de la anestesia, que siempre han sido líderes en seguridad del paciente, aprovechen la sólida plataforma de evidencia publicada para mejorar la seguridad de nuestros pacientes a través de la prevención de infecciones.11
En esta revisión destacamos importantes características de implementación para medidas preventivas básicas con pocas barreras percibidas para la implementación. Estos enfoques se basan tanto en la bibliografía actual como en las directrices de control de infecciones pertinentes (Sociedad Americana de Epidemiología para el Cuidado de la Salud [SHEA]12 , Asociación de Profesionales en Control de Infecciones [APIC]13 , Centros para el Control y la Prevención de Enfermedades [CDC]14 , Sociedad Americana de Anestesiólogos [ASA]15 , y la Asociación Americana de Enfermeros Anestesistas [AANA][AANA]16). Describimos cuatro pilares de las medidas de control de infecciones perioperatorias aplicables a todos los proveedores perioperatorios, incluyendo la descolonización del paciente, higiene de manos, atención vascular y desinfección ambiental optimizada mediante la vigilancia y feedback.8,12
Las intervenciones recomendadas representan las mejores prácticas diseñadas para tratar las rutas primarias de infección que incluyen 1) contaminación directa de la herida, 2) diseminación contigua después de la contaminación de la piel del paciente como resultado de la colonización existente o colonización resultante de la atención del paciente, 3) aerosolización de partículas contaminadas por patógenos que surgen de varios reservorios del área de trabajo de la anestesia, como superficies/equipos ambientales contaminados y 4) diseminación hematógena que ocurre como resultado de la inyección de patógenos bacterianos por el puerto de inyección, la punta de la jeringa o la contaminación del vial del medicamento.17 Es importante destacar que estas recomendaciones son rentables18, prácticas9 y con viabilidad de implementación confirmada.10
Aunque cada una de estas medidas preventivas puede sonar familiar, e inicialmente puede parecer que usted y sus colegas ya están empleando estas prácticas, considere atentamente las características de implementación de cada recomendación. Usar la “dosis” correcta de la intervención es importante para obtener los beneficios para sus pacientes.8-10,19 La Figura 1 es una infografía que se desarrolló para representar cómo la prevención de infecciones se extiende a lo largo del proceso perioperatorio. Un enfoque multifacético que involucra la descolonización del paciente, la higiene de manos, la atención vascular y los esfuerzos de mejora de la desinfección ambiental implementados en paralelo durante el proceso de atención al paciente y optimizado por comentarios está respaldado por un estudio riguroso de la epidemiología perioperatoria de la transmisión bacteriana20-24 y de eficacia comprobada.8-10 Sin embargo, las intervenciones individuales, como la higiene de manos25,26 , la descolonización del paciente,27 o la desinfección ambiental28 sin optimización de comentarios son propensas a fallar.
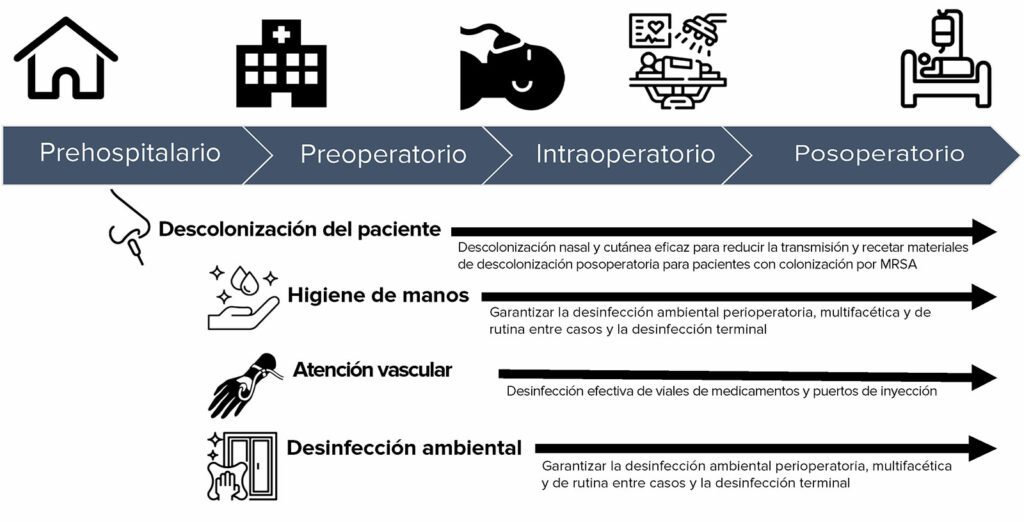
Figura 1: Oportunidades de alto valor basadas en evidencia para mitigar la transmisión de infecciones a lo largo del proceso perioperatorio.
DESCOLONIZACIÓN DEL PACIENTE:
Recomendaciones:
- Dos dosis de povidona yodada nasal al 5 % dentro de la primera hora de la incisión quirúrgica8,29 y uso de toallitas con gluconato de clorhexidina al 2 % en la mañana de la cirugía.8,10,30
O - Al menos 2 días de tratamiento (idealmente el día anterior y el día de la cirugía) con pomada nasal de mupirocina al 5 % con toallitas de gluconato de clorhexidina al 2 % o champú al 4 %.30-32
- Prescriba la descolonización posterior al alta para sus pacientes colonizados con Staphylococcus aureus resistente a la meticilina (MRSA) como resultado de la exposición a la atención médica.32
Justificación: La epidemiología de la transmisión perioperatoria de S. aureus involucra la colonización por patógenos de los sitios de la piel del paciente (narinas, axila o ingle). 8,10,33-35 El desarrollo de infecciones posoperatorias está fuertemente ligado a la colonización por S. aureus en estos sitios.20,34,35 Como se indicó en las recomendaciones 1 y 2 arriba, la descolonización de los sitios de la piel del paciente reduce las infecciones en el sitio quirúrgico.8,10,30-32 El momento óptimo de las intervenciones de descolonización aún requiere más investigación. La descolonización posoperatoria de pacientes colonizados con MRSA que se produce como resultado de la exposición a la atención médica puede disminuir significativamente el riesgo de desarrollo de una infección invasiva hasta un año después de la exposición a la atención médica.32 La prevención de la transmisión perioperatoria que da lugar a la colonización puede aumentar este último.8,10
Características clave de implementación: La elección del agente de descolonización es importante por el aumento de la resistencia a los antibióticos asociado con un aumento de la mortalidad en todo el mundo.36,37 Tanto el yodo como la mupirocina son eficaces para la prevención de la SSI.29-31 La mupirocina nasal se ha asociado hasta cierto punto con el aumento de la resistencia38 , mientras que el yodo no.39,40 El anestesista puede tratar el yodo antes de la operación con dos dosis administradas antes de la incisión8,29 , mientras que la mupirocina nasal requiere de 2 a 5 días de tratamiento.30,31
Es importante monitorear específicamente el cumplimiento del paciente y proveedor con los componentes de descolonización prescritos. Los comentarios dirigidos a los proveedores y la vigilancia de la utilización esperada de los suministros de descolonización también son importantes.8,10
HIGIENE DE MANOS
Recomendaciones:
- Aumente la frecuencia de la higiene de manos durante la atención anestésica. Practicar higiene de manos al menos 8 veces por hora41 durante la atención anestésica y al menos 4 veces por hora mientras da atención en entornos de cuidados intensivos.42
- Mejore la frecuencia y la calidad de la desinfección ambiental para ayudar en los esfuerzos de mejora de la higiene de manos.8-10,43,44
 Justificación: el contacto con el entorno del quirófano es frecuente y rápido durante el procedimiento de la atención anestésica, lo que a menudo implica el contacto simultáneo del paciente y el entorno/equipo.45 Dada la relación demostrada entre las manos y los reservorios ambientales41 , una mejor higiene de manos puede reducir el potencial de eventos ambientales de transmisión infecciosa.41,43,46 Idealmente, la higiene de manos se hace antes y después del contacto con el paciente, después de la exposición a fluidos corporales, después del contacto con el ambiente contaminado y antes de empezar una tarea de limpieza/aséptica:41,47 Estos son los “5 momentos de higiene de manos” descritos por la Organización Mundial de la Salud (OMS). Durante la atención anestésica, la higiene de manos debe hacerse con frecuencia y cuidado para aprovechar tantas oportunidades para reducir la transmisión de patógenos como sea posible. Aunque es probable que no sea posible hacer la higiene de manos después de cada evento identificado por las directrices de la OMS, los profesionales de la anestesia deben hacer más para reducir la transmisión de patógenos en el quirófano. Según los datos publicados, hacer la higiene de manos al menos ocho veces por hora reduciría significativamente los posibles eventos de transmisión.41 En un paso relacionado, una limpieza ambiental más frecuente y de mejor calidad puede reducir el potencial de eventos de transmisión asociados con la contaminación de las manos.8,10,41,43,46 El uso de guantes dobles durante la inducción puede aumentar los esfuerzos de higiene de manos basadosen la OMS, pero se indica un estudio clínico adicional antes de la adopción, dado que solo se hacen pruebas ambientales simuladas de este enfoque.45
Justificación: el contacto con el entorno del quirófano es frecuente y rápido durante el procedimiento de la atención anestésica, lo que a menudo implica el contacto simultáneo del paciente y el entorno/equipo.45 Dada la relación demostrada entre las manos y los reservorios ambientales41 , una mejor higiene de manos puede reducir el potencial de eventos ambientales de transmisión infecciosa.41,43,46 Idealmente, la higiene de manos se hace antes y después del contacto con el paciente, después de la exposición a fluidos corporales, después del contacto con el ambiente contaminado y antes de empezar una tarea de limpieza/aséptica:41,47 Estos son los “5 momentos de higiene de manos” descritos por la Organización Mundial de la Salud (OMS). Durante la atención anestésica, la higiene de manos debe hacerse con frecuencia y cuidado para aprovechar tantas oportunidades para reducir la transmisión de patógenos como sea posible. Aunque es probable que no sea posible hacer la higiene de manos después de cada evento identificado por las directrices de la OMS, los profesionales de la anestesia deben hacer más para reducir la transmisión de patógenos en el quirófano. Según los datos publicados, hacer la higiene de manos al menos ocho veces por hora reduciría significativamente los posibles eventos de transmisión.41 En un paso relacionado, una limpieza ambiental más frecuente y de mejor calidad puede reducir el potencial de eventos de transmisión asociados con la contaminación de las manos.8,10,41,43,46 El uso de guantes dobles durante la inducción puede aumentar los esfuerzos de higiene de manos basadosen la OMS, pero se indica un estudio clínico adicional antes de la adopción, dado que solo se hacen pruebas ambientales simuladas de este enfoque.45
Características clave de implementación: es importante tener desinfectantes para manos colocados al alcance de los proveedores intraoperatorios, incluyendo, idealmente, en varios lugares alrededor del área de trabajo de anestesia, para facilitar el uso durante la atención rápida del paciente.41,43,44 Considere colocar desinfectantes para manos a base de alcohol en la máquina de anestesia, montados en el poste intravenoso8,10 y en la cintura del proveedor.41 La importancia de la higiene de manos no se limita a los miembros del equipo de anestesia. Todos los miembros del equipo perioperatorio (es decir, enfermeros circulantes, tecnólogos instrumentistas, cirujanos, tecnólogos de anestesia clínica, pasantes y representantes de equipos) deben emplear las medidas recomendadas cuando presten atención perioperatoria al paciente.
ATENCIÓN VASCULAR
Recomendaciones:
- Desinfecte los puertos de inyección con alcohol isopropílico al 70 %–90 % antes del acceso. Sugerimos frotar con fuerza para crear fricción durante 5 a 30 segundos y luego secar.48-53 Si usa tapas diseñadas para limpiar conectores sin aguja, use productos que hayan demostrado ser efectivos y siga las recomendaciones del fabricante. Algunos de estos dispositivos requieren al menos 10 segundos de tiempo de contacto para ser efectivos.49
- Evite el uso de lúmenes abiertos (p. ej., llaves de paso descubiertas), ya que tienen un mayor riesgo de contaminación, no se pueden desinfectar bien una vez contaminados50 , y la contaminación se ha asociado repetidamente con una mayor mortalidad de pacientes.20,52
- Limpie todos los viales de medicamentos con una toallita con alcohol después de quitar la cubierta antipolvo del vial y antes de acceder a ellos para evitar la contaminación y la infección.53 Mantenga los puertos de inyección, las puntas de las jeringas y los tubos intravenosos alejados del suelo.49
Justificación: Los puertos de inyección y los viales de medicamento deben desinfectarse frotando con un hisopo con alcohol isopropílico al 70 %-90 % antes de cada conexión.8,10 Aunque no hay consenso sobre la duración del lavado del puerto de inyección con hisopos con etanol, recomendamos un tiempo total de 5 a 30 segundos con frotamiento fuerte para crear fricción seguido de secado al aire.48-53 Se demostró que frotar de esta manera seguido de 30 segundos de tiempo de secado elimina la inyección de bacterias de las manos del profesional de anestesia en un estudio aleatorizado ex vivo.48
La investigación ha demostrado que se inyectan hasta 50,000 unidades formadoras de colonias de bacterias vivas en la vía de fluidos intravenosos (IV) como resultado de incumplimientos en las buenas prácticas asépticas de acceso vascular, como se describió arriba.48 Esta es una ruta principal de desarrollo de infecciones en el sitio quirúrgico y el torrente sanguíneo54 que puede aumentar varias veces la mortalidad de los pacientes.55 Es importante destacar que la contaminación intraoperatoria de la llave de paso se ha asociado repetidamente con una mayor mortalidad de los pacientes y se ha relacionado directamente con la tipificación molecular avanzada con el desarrollo de infecciones posoperatorias.20,56 Los ensayos clínicos controlados aleatorios en varios centros41 han demostrado que la mejora de la atención vascular mediante el uso de puertos de inyección con tapas desinfectantes montadas en el portasueros puede generar reducciones sustanciales en la transmisión de patógenos y complicaciones infecciosas. Con la reciente confirmación de la contaminación intraoperatoria de la llave de paso intravenosa de un paciente con SARS-CoV-29 , la importancia de estas recomendaciones se extiende más allá de los patógenos bacterianos.
Características clave de implementación: tenga toallitas con alcohol y gorros desinfectantes con alcohol cerca de los proveedores, lo que permite un fácil acceso a las herramientas de desinfección.44 Use un tiempo de desinfección adecuado para cada método de desinfección.48-50
DESINFECCIÓN AMBIENTAL
Recomendaciones:
- Haga una limpieza posterior a la inducción/sedación mediante un enfoque doble con toallitas que contengan al menos un compuesto de alcohol y amonio cuaternario.43,46 Use un trapo de microfibra para aumentar la eliminación de la carga biológica.28
- Organice el entorno en espacios limpios/sucios.46
- Aumente la limpieza de desinfección de superficies con irradiación ultravioleta con eficacia, efectividad y factibilidad de implementación comprobadas.9 Use la vigilancia para la implementación específica de procedimientos de limpieza más avanzados.10,21,57
Justificación: la limpieza ambiental perioperatoria es multifacética e incluye limpieza de rutina, entre casos y terminal. La contaminación ambiental alcanza su punto máximo durante la inducción y la emergencia de la anestesia, períodos de atención al paciente que se correlacionan con los nadires en el cumplimiento de la higiene de manos.43 El entorno del área de trabajo de anestesia, representado por la válvula limitadora de presión ajustable y el dial de agente de la máquina de anestesia, es un potente vehículo de transmisión con eventos de transmisión directamente relacionados con el desarrollo de infecciones.20,53 Al menos el 50 % de las SSI por S aureus pueden vincularse a ≥1 reservorio del área de trabajo de anestesia en el momento de la cirugía.21 En un estudio del Centro Médico Dartmouth Hitchcock, la limpieza posterior a la inducción, la organización de espacios limpios/sucios, el uso de trapos de microfibra y el uso de toallitas desinfectantes de superficies multimodales se asoció con una reducción significativa en la cantidad de reservorios medidos que superan las 100 CFU por área de superficie muestreada46 , un umbral de contaminación asociado con eventos de transmisión de alto riesgo vinculados posteriormente a la infección.8,10,20,56 Estos resultados fueron similares a los de un ensayo cruzado bien diseñado en el entorno de la UCI donde la mayor frecuencia de limpieza y el uso de trapos de microfibra redujeron la contaminación bacteriana.28 Cuando la luz ultravioleta C (UV-C) se emplea como parte de un enfoque multifacético basado en evidencia (incluyendo una frecuencia y calidad mejoradas de la desinfección de superficies, limpieza ambiental y aumento con UV-C, descolonización del paciente, atención vascular e higiene de manos), se pueden lograr reducciones sustanciales en la transmisión de S. aureus , la transmisión de SARS-CoV-2 y las SSI.⁹
Características clave de implementación: emplee limpieza posterior a la inducción/sedación para tratar un pico importante en la contaminación ambiental, organice espacios limpios/sucios43,46 y aumente la limpieza de desinfección de superficies con el uso de UV-C basado en evidencia.8-10,58 Es importante que los dispositivos de UV-C elegidos tengan en cuenta la importancia del tiempo en el quirófano59 , que se han delineado estrategias de implementación y que son de eficacia comprobada para la prevención de la transmisión intraoperatoria de patógenos bacterianos y virales.
CONCLUSIÓN
Los equipos de anestesia están bien posicionados paratrabajar en colaboración con el equipo quirúrgico/de enfermería perioperatorio para atenuar al máximo la transmisión bacteriana perioperatoria y la infección posterior. Las medidas básicas de control de infecciones se han desarrollado y probado rigurosamente con eficacia, efectividad y factibilidad y practicidad de implementación comprobadas. Depende de los profesionales de la anestesia actuar sobre esta información para mejorar la seguridad perioperatoria del paciente.
Jonathan E. Charnin, MD, es profesor adjunto de Anestesiología en Mayo Clinic, Rochester, MN.
Melanie Hollidge, MD, PhD, es profesora asociada de Anestesiología en University of Rochester, Rochester, NY.
Raquel Bartz, MD, MMCi, es profesora asociada de Anestesiología en Brigham and Women’s Hospital, Boston, MA.
Desiree Chappell, CRNA, es la vicepresidente de Clinical Quality, NorthStar Anesthesia, Irving, TX.
Jonathan M. Tan, MD, MPH, MBI, FASA, es profesor asistente de Anestesiología y Ciencias Espaciales (Spatial Sciences), Children’s Hospital Los Angeles, Los Ángeles, CA; Keck School of Medicine y Spatial Sciences Institute, University of Southern California, Los Ángeles, CA.
Morgan Hellman, RN, BSN, es la directora de ventas clínicas de Pall Corporation, Port Washington, NY.
Sara McMannus, RN, BSN, MBA, es asesora clínica, Sepsis Alliance, San Diego, CA.
Richard A. Beers MD, es profesor de Anestesiología en Upstate Medical University, Syracuse, NY.
Michelle Beam, DO, MBA, FASA, es profesora asociada de Anestesia en Penn Medicine, West Chester, PA.
Randy Loftus, MD, es profesor asociado de Anestesiología en University of Iowa, Iowa City, IA.
Conflictos de intereses: Randy Loftus, MD, informa de la financiación actual de la investigación de NIH R01 AI155752-01A1 “BASIC trial: Improving implementation of evidence-based approaches and surveillance to prevent bacterial transmission and infection” y ha recibido financiamiento de la Fundación para la Seguridad del Paciente de Anestesia (Anesthesia Patient Safety Foundation), Sage Medical Inc., BBraun, Draeger, Surfacide y Kenall, tiene una o más patentes pendientes, es un socio de RDB Bioinformatics, LLC y 1055 N 115th St #301, Omaha, NE 68154, una empresa propietaria de OR PathTrac, y ha hablado en reuniones educativas patrocinadas por Kenall y BBraun. University of Iowa utiliza el sistema PathTrac de RDB Bioinformatics para medir la transmisión bacteriana.
Jonathan Tan, MD, MPH, MBI, FASA, recibe subvenciones para investigación de la Fundación para la Seguridad del Paciente de Anestesia (APSF) y la Fundación para la Educación e Investigación en Anestesia (FAER).
Desiree Chappell, CRNA, está en la Oficina de Oradores (Speakers Bureau) de Medtronic y Edwards LifeSciences, y en la Junta Asesora de ProVation.
Jonathan Charnin, Melanie Hollidge, Raquel Bartz, Morgan Hellman, Sarah McMannus, Richard Beers y Michelle Beam informan que no tienen conflictos de interés.
Referencias
- Dexter F, Parra MC, Brown JR, et al. Perioperative COVID-19 defense: an evidence-based approach for optimization of infection control and operating room management. Anesth Analg. 2020;131:37–42. PMID: 32217947.
- Centers for Disease Control and Infection Prevention. Guidance for Tecovirimat use under expanded access investigational new drug protocol during 2022 U.S. monkeypox cases. https://www.cdc.gov/poxvirus/monkeypox/clinicians/Tecovirimat.html. Published 2022. Accessed July 26, 2022.
- Centers for Disease Control and Infection Prevention. Candida auris. Published 2022. https://www.cdc.gov/fungal/candida-auris/index.html. Accessed July 26, 2022
- Magill SS, Hellinger W, Cohen J, et al. Prevalence of healthcare-associated infections in acute care hospitals in Jacksonville, Florida. Infect Control Hosp Epidemiol. 2012;33:283–291. PMID: 22314066.
- Vogel TR, Dombrovskiy VY, Lowry SF. Impact of infectious complications after elective surgery on hospital readmission and late deaths in the U.S. Medicare population. Surg Infect (Larchmt). 2012;13:307–311. PMID: 23082877.
- Awad SS. Adherence to surgical care improvement project measures and post-operative surgical site infections. Surg Infect (Larchmt). 2012;13(4):234-237. PMID: 22913334.
- Centers for Disease Control and Infection Prevention. How can I get ahead of sepsis? https://www.cdc.gov/sepsis/prevention/index.html. Published 2022. Accessed July 26, 2022.
- Loftus RW, Dexter F, Goodheart MJ, et al. The effect of improving basic preventive measures in the perioperative arena on Staphylococcus aureus transmission and surgical site infections: a randomized clinical trial. JAMA Netw Open. 2020;3:e201934. PMID: 32219407.
- Loftus RW, Dexter F, Evans L, et al. Evidence-based intraoperative infection control measures plus feedback are associated with attenuation of severe acute respiratory syndrome coronavirus-2 detection in operating rooms. Br J Anaesth. 2022;129:e29–e32. PMID: 35643533.
- Wall RT, Datta S, Dexter F, et al. Effectiveness and feasibility of an evidence-based intraoperative infection control program targeting improved basic measures: a post-implementation prospective case-cohort study. J Clin Anesth. 2022;77:110632. PMID: 34929497.
- Warner MA, Warner ME. The evolution of the anesthesia patient safety movement in america: lessons learned and considerations to promote further improvement in patient safety. Anesthesiology. 2021;135:963–974. PMID: 34666350.
- Munoz-Price LS, Bowdle A, Johnston BL, et al. Infection prevention in the operating room anesthesia work area. Infect Control Hosp Epidemiol. 2019;40:1–17. PMID: 30526699.
- Association for Professionals in Infection Control. Infection preventionist’s guide to the OR. https://apic.org/infection-preventionists-guide-to-the-or/. Published 2018. Accessed July 29, 2022.
- Berrios-Torres SI, Umscheid CA, Bratzler DW, et al. Centers for Disease Control and Prevention guideline for the prevention of surgical site infection, 2017. JAMA Surg. 2017;152:784–791. PMID: 28467526.
- American Society of Anesthesiologists. Infection control and prevention. https://www.asahq.org/shop-asa/e020s10w02. Published 2022. Accessed July 26, 2022.
- American Association of Nurse Anesthesiology. Infection prevention and control guidelines for anesthesia care. https://www.aana.com/docs/default-source/practice-aana-com-web-documents-(all)/professional-practice-manual/infection-prevention-and-control-guidelines-for-anesthesia-care.pdf?sfvrsn=850049b1. Published 2015. Accessed July 26, 2022.
- Menz BD, Charani E, Gordon DL, et al. Surgical antibiotic prophylaxis in an era of antibiotic resistance: common resistant bacteria and wider considerations for practice. Infect Drug Resist. 2021;14:5235–5252. PMID: 34908856.
- Dexter F, Epstein RH, Loftus RW. Quantifying and interpreting inequality of surgical site infections among operating rooms. Can J Anaesth. 2021;68:812–824. PMID: 33547628.
- Dexter F, Ledolter J, Wall RT, et al. Sample sizes for surveillance of S. aureus transmission to monitor effectiveness and provide feedback on intraoperative infection control including for COVID-19. Perioper Care Oper Room Manag. 2020;20:100115. PMID: 32501426.
- Loftus RW, Brown JR, Koff MD, et al. Multiple reservoirs contribute to intraoperative bacterial transmission. Anesth Analg. 2012;114:1236–1248. PMID: 22467892.
- Loftus RW, Dexter F, Robinson ADM, Horswill AR. Desiccation tolerance is associated with Staphylococcus aureus hypertransmissibility, resistance and infection development in the operating room. J Hosp Infect. 2018;100:299–308. PMID: 29966756.
- Loftus RW, Brown JR, Patel HM, et al. Transmission dynamics of gram-negative bacterial pathogens in the anesthesia work area. Anesth Analg. 2015;120:819–826. PMID: 25790209.
- Hadder B, Patel HM, Loftus RW. Dynamics of intraoperative Klebsiella, Acinetobacter, Pseudomonas, and Enterobacter transmission. Am J Infect Control. 2018;46:526–532. PMID: 29395508.
- Loftus RW, Muffly MK, Brown JR, et al. Hand contamination of anesthesia providers is an important risk factor for intraoperative bacterial transmission. Anesth Analg. 2011;112:98–105. PMID: 20686007.
- Rupp ME, Fitzgerald T, Puumala S, et al. Prospective, controlled, cross-over trial of alcohol-based hand gel in critical care units. Infect Control Hosp Epidemiol. 2008;29:8–15. PMID: 18171181.
- Koff MD, Brown JR, Marshall EJ, et al. Frequency of hand decontamination of intraoperative providers and reduction of postoperative healthcare-associated infections: a randomized clinical trial of a novel hand hygiene system. Infect Control Hosp Epidemiol. 2016;37:888–895. PMID: 27267310.
- Konvalinka A, Errett L, Fong IW. Impact of treating Staphylococcus aureus nasal carriers on wound infections in cardiac surgery. J Hosp Infect. 2006;64:162–168. PMID: 16930768.
- Wilson APR, Smyth D, Moore G, et al. The impact of enhanced cleaning within the intensive care unit on contamination of the near-patient environment with hospital pathogens: a randomized crossover study in critical care units in two hospitals. Crit Care Med. 2011;39:651–658. PMID: 21242793.
- Phillips M, Rosenberg A, Shopsin B, et al. Preventing surgical site infections: a randomized, open-label trial of nasal mupirocin ointment and nasal povidone-iodine solution. Infect Control Hosp Epidemiol. 2014;35:826–832. PMID: 24915210.
- Schweizer ML, Chiang HY, Septimus E, et al. Association of a bundled intervention with surgical site infections among patients undergoing cardiac, hip, or knee surgery. JAMA. 2015;313:2162–2171. PMID: 26034956.
- Bode LGM, Kluytmans JAJW, Wertheim HFL, et al. Preventing surgical-site infections in nasal carriers of Staphylococcus aureus. N Engl J Med. 2010;362:9–17. PMID: 20054045.
- Huang SS, Singh R, McKinnell JA, et al. Decolonization to reduce postdischarge infection risk among MRSA carriers. N Engl J Med. 2019;380:638–650. PMID: 30763195.
- von Eiff C, Becker K, Machka K, et al. Nasal carriage as a source of Staphylococcus aureus bacteremia. Study Group. N Engl J Med. 2001;344:11–16. PMID: 11136954.
- Kluytmans JA, Mouton JW, VandenBergh MF, et al. Reduction of surgical-site infections in cardiothoracic surgery by elimination of nasal carriage of Staphylococcus aureus. Infect Control Hosp Epidemiol. 1996;17:780–785. PMID: 8985763.
- Bhalla A, Aron DC, Donskey CJ. Staphylococcus aureus intestinal colonization is associated with increased frequency of S. aureus on skin of hospitalized patients. BMC Infect Dis. 2007;7:105. 17848192.
- Murray CJL, Ikuta KS, Sharara F, et al. Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 2022;399:629–655. PMID: 35065702.
- Laxminarayan R, Duse A, Wattal C, et al. Antibiotic resistance—the need for global solutions. Lancet Infect Dis. 2013;13:1057–1098. PMID: 24252483.
- Patel JB, Gorwitz RJ, Jernigan JA. Mupirocin resistance. Clin Infect Dis. 2009;49:935–941. PMID: 19673644.
- Houang ET, Gilmore OJ, Reid C, Shaw EJ. Absence of bacterial resistance to povidone iodine. J Clin Pathol. 1976;29:752–755. PMID: 821972.
- Bigliardi PL, Alsagoff SAL, El-Kafrawi HY, et al. Povidone iodine in wound healing: a review of current concepts and practices. Int J Surg. 2017;44:260–268. PMID: 28648795.
- Koff MD, Loftus RW, Burchman CC, et al. Reduction in intraoperative bacterial contamination of peripheral intravenous tubing through the use of a novel device. Anesthesiology. 2009;110:978–985. PMID: 19352154.
- Koff MD, Corwin HL, Beach ML, et al. Reduction in ventilator associated pneumonia in a mixed intensive care unit after initiation of a novel hand hygiene program. J Crit Care. 2011;26:489–495. PMID: 21439767.
- Rowlands J, Yeager MP, Beach M, et al. Video observation to map hand contact and bacterial transmission in operating rooms. Am J Infect Control. 2014;42:698–701. PMID: 24969122.
- Bischoff WE, Reynolds TM, Sessler CN, et al. Handwashing compliance by health care workers: The impact of introducing an accessible, alcohol-based hand antiseptic. Arch Intern Med. 2000;160:1017–1021. PMID: 10761968.
- Birnbach DJ, Rosen LF, Fitzpatrick M, et al. Double gloves: a randomized trial to evaluate a simple strategy to reduce contamination in the operating room. Anesth Analg. 2015;120:848–852. PMID: 24836472.
- Clark C, Taenzer A, Charette K, Whitty M. Decreasing contamination of the anesthesia environment. Am J Infect Control. 2014;42:1223–1225. PMID: 25444268.
- Boyce JM, Pittet D, Healthcare Infection Control Practices Advisory Committee. Society for Healthcare Epidemiology of America. Association for Professionals in Infection Control. Infectious Diseases Society of America. Hand Hygiene Task F. Guideline for hand hygiene in health-care settings: recommendations of the Healthcare Infection Control Practices Advisory Committee and the HICPAC/SHEA/APIC/IDSA Hand Hygiene Task Force. Infect Control Hosp Epidemiol. 2002;23:S3–40. PMID: 12515399.
- Loftus RW, Patel HM, Huysman BC, et al. Prevention of intravenous bacterial injection from health care provider hands: the importance of catheter design and handling. Anesth Analg. 2012;115:1109–1119. PMID: 23051883.
- Loftus RW, Brindeiro BS, Kispert DP, et al. Reduction in intraoperative bacterial contamination of peripheral intravenous tubing through the use of a passive catheter care system. Anesth Analg. 2012;115:1315–1323. PMID: 23144441.
- Greene ES. Challenges in reducing the risk of infection when accessing vascular catheters. J Hosp Infect. 2021;113:130–144. PMID: 33713758.
- Moureau NL, Flynn J. Disinfection of needleless connector hubs: clinical evidence systematic review. Nurs Res Pract. 2015;2015:796762. PMID: 26075093.
- Lamberg JJ YL. Swab all vials with alcohol. APSF Newsletter. https://www.apsf.org/article/swab-all-vials-with-alcohol/. Published 2012. Accessed July 26, 2022.
- Bennett SN, McNeil MM, Bland LA, et al. Postoperative infections traced to contamination of an intravenous anesthetic, propofol. N Engl J Med. 1995;333:147–154. PMID: 7791816.
- Centers for Disease Control and Infection Prevention. Checklist for prevention of central line associated blood stream infections. https://www.cdc.gov/HAI/pdfs/bsi/checklist-for-CLABSI.pdf. Published 2014. Accessed July 26, 2022.
- Agency for Healthcare Research and Quality. Central line-associated bloodstream infections (CLABSI). https://www.ahrq.gov/topics/central-line-associated-bloodstream-infections-clabsi.html. Published 2022. Accessed July 26, 2022.
- Loftus RW, Koff MD, Burchman CC, et al. Transmission of pathogenic bacterial organisms in the anesthesia work area. Anesthesiology. 2008;109:399–407. PMID: 18719437.
- Robinson ADM, Dexter F, Renkor V, et al. Operating room PathTrac analysis of current intraoperative Staphylococcus aureus transmission dynamics. Am J Infect Control. 2019;47:1240–1247. PMID: 31036398.
- Loftus RW, Dexter F, Evans LC, et al. An assessment of the impact of recommended anesthesia work area cleaning procedures on intraoperative SARS-CoV-2 contamination, a case-series analysis. J Clin Anesth. 2021;73:110350. PMID: 34098391.
- Birchansky B, Dexter F, Epstein RH, Loftus RW. Statistical design of overnight trials for the evaluation of the number of operating rooms that can be disinfected by an ultraviolet light disinfection robotic system. Cureus. 2021;13:e18861. PMID: 34804714.


 Issue PDF
Issue PDF