Medidas básicas de controle de infecção baseadas em evidências, implementadas efetivamente na área de trabalho de anestesia, podem gerar reduções substanciais na transmissão de patógenos e no desenvolvimento de infecções no local da cirurgia. Estas medidas são indicadas para melhorar a segurança do paciente. Nesta breve análise, caracterizamos medidas preventivas básicas com poucas barreiras conhecidas para implementação e destacamos as principais características de implementação.
INTRODUÇÃO
 A prevenção de infecções é de grande importância para os profissionais de anestesia em 2022 devido às doenças infecciosas emergentes, como COVID-19,1 Varíola do macaco,2 Candida auris,3 e à natureza persistente das infecções do local cirúrgico (SSIs) associadas ao aumento da morbidade e mortalidade dos pacientes.4-6 Além disso, como qualquer infecção pode levar à sepse, a prevenção da infecção é a prevenção da sepse.7 Medidas básicas de controle de infecção perioperatória baseadas em evidências para a área de trabalho de anestesia são de eficácia comprovada para patógenos virais8 e bacterianos, gerando reduções significativas na transmissão de patógenos e subsequente infecção.8-10 É hora de os profissionais de anestesia, que sempre foram líderes em segurança do paciente, aproveitarem a sólida plataforma de evidências publicadas para melhorar a segurança de nossos pacientes por meio da prevenção de infecções.11
A prevenção de infecções é de grande importância para os profissionais de anestesia em 2022 devido às doenças infecciosas emergentes, como COVID-19,1 Varíola do macaco,2 Candida auris,3 e à natureza persistente das infecções do local cirúrgico (SSIs) associadas ao aumento da morbidade e mortalidade dos pacientes.4-6 Além disso, como qualquer infecção pode levar à sepse, a prevenção da infecção é a prevenção da sepse.7 Medidas básicas de controle de infecção perioperatória baseadas em evidências para a área de trabalho de anestesia são de eficácia comprovada para patógenos virais8 e bacterianos, gerando reduções significativas na transmissão de patógenos e subsequente infecção.8-10 É hora de os profissionais de anestesia, que sempre foram líderes em segurança do paciente, aproveitarem a sólida plataforma de evidências publicadas para melhorar a segurança de nossos pacientes por meio da prevenção de infecções.11
Nesta análise, destacaremos importantes recursos de implementação para medidas básicas de prevenção com poucas barreiras conhecidas para implementação. Essas abordagens são baseadas na literatura atual e nas diretrizes de controle de infecção pertinentes (Society for Healthcare Epidemiology of America [SHEA], 12 Association for Professionals in Infection Control [APIC], 13 Centers for Disease Control and Infection Prevention [CDC],14 American Society of Anesthesiologists [ASA],15 e a American Association of Nurse Anesthesiology [AANA]16). Descrevemos quatro pilares das medidas de controle de infecção perioperatória aplicáveis a todos os profissionais perioperatórios, incluindo descolonização do paciente, higiene das mãos, cuidados vasculares e higiene do ambiente otimizada por monitoramento e feedback.8,12
As intervenções recomendadas representam as práticas recomendadas destinadas a abordar as vias primárias de infecção que incluem 1) contaminação direta da ferida, 2) disseminação contígua após contaminação da pele do paciente que ocorre como resultado de colonização existente ou colonização resultante do atendimento ao paciente, 3) aerossolização de partículas contaminadas por patógenos decorrentes de vários reservatórios da área de trabalho de anestesia, como superfícies/equipamentos ambientais contaminados e 4) disseminação hematogênica ocorrendo como resultado da injeção de patógenos bacterianos via porta de injeção, ponta de seringa e/ou contaminação do frasco de medicamento.17 É importante ressaltar que essas recomendações são econômicas,18práticas9 e com viabilidade de implementação confirmada.10
Embora cada uma dessas medidas preventivas possa parecer familiar, e inicialmente possa parecer que você e seus colegas já estão empregando essas práticas, considere cuidadosamente os recursos de implementação de cada recomendação. Usar a dose “certa” da intervenção é importante para oferecer os benefícios para seus pacientes.8-10,19 A Figura 1 é um infográfico desenvolvido para descrever como a prevenção de infecções se estende ao longo do período perioperatório. Uma abordagem diversificada envolvendo descolonização do paciente, higiene das mãos, cuidados vasculares e esforços de melhoria da limpeza ambiental implementados em paralelo durante o processo de atendimento ao paciente e otimizado por feedback é apoiado por um estudo rigoroso da epidemiologia perioperatória da transmissão bacteriana20-24 e de eficácia comprovada.8-10 No entanto, intervenções isoladas, como higiene das mãos,25,26 descolonização do paciente27 ou higiene do ambiente28 sem otimização do feedback, são propensas ao fracasso.
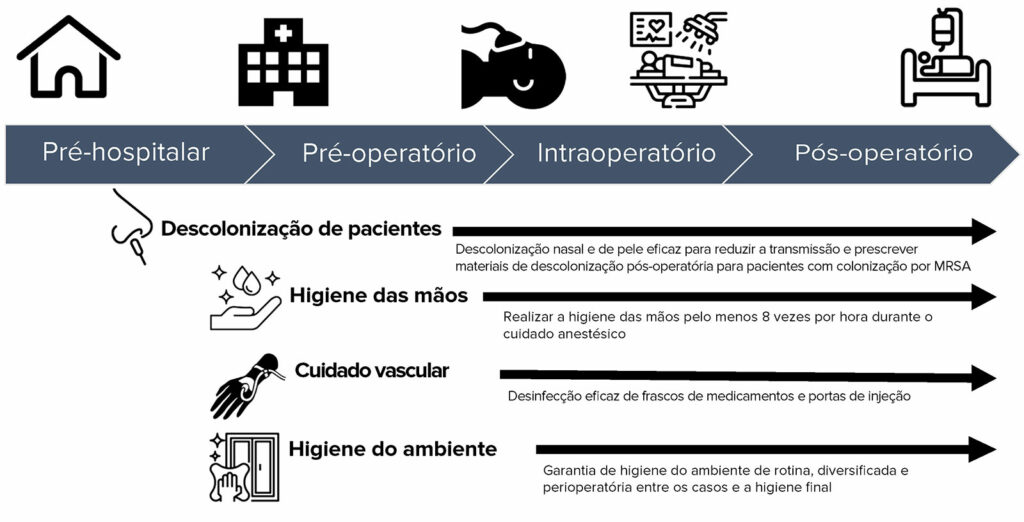
Figura 1: Oportunidades de alto valor baseadas em evidências para mitigar a transmissão de infecção em toda a sequência perioperatória.
DESCOLONIZAÇÃO DE PACIENTES:
Recomendações:
- Duas doses de iodopovidona nasal a 5% até uma hora após a incisão cirúrgica8,29 e uso de lenços umedecidos com gluconato de clorexidina a 2% na manhã da cirurgia.8,10,30
OU - Pelo menos 2 dias de tratamento (idealmente no dia anterior e no dia da cirurgia) com pomada nasal de mupirocina a 5% com lenços umedecidos com gluconato de clorexidina a 2% ou xampu a 4%.30-32
- Prescrever a descolonização pós-alta para os pacientes colonizados com Staphylococcus aureus resistente à meticilina (MRSA) como resultado da exposição aos cuidados de saúde.32
Justificativa: A epidemiologia da transmissão perioperatória de S. aureus envolve a colonização de patógenos nos locais da pele do paciente (narinas, axila e/ou virilha). 8,10,33-35 O desenvolvimento de infecção pós-operatória está fortemente ligado à colonização de S. aureus nesses locais.20,34,35 Conforme declarado nas recomendações 1 e 2 acima, a descolonização dos locais da pele do paciente reduz as infecções do local cirúrgico.8,10,30-32 O momento ideal das intervenções de descolonização ainda requer mais pesquisas. A descolonização pós-operatória de pacientes colonizados com MRSA que ocorre como resultado da exposição aos cuidados de saúde pode diminuir significativamente o risco de desenvolvimento de infecção invasiva até um ano após a exposição aos cuidados de saúde.32 A prevenção da transmissão perioperatória resultando em colonização pode aumentar a infecção.8,10
Principais recursos de implementação: A escolha do agente de descolonização é importante com o aumento da resistência a antibióticos associada a um aumento da mortalidade mundial.36,37 Tanto o iodo quanto a mupirocina são eficazes na prevenção de SSI.29-31 A mupirocina nasal tem sido associada até certo ponto ao aumento da resistência,38 enquanto o iodo não.39,40 O iodo pode ser administrado no pré-operatório pelo anestesista com duas doses administradas antes da incisão.8,29 enquanto a mupirocina nasal requer 2 a 5 dias de tratamento.30,31
O monitoramento específico do paciente e o cumprimento por parte do fornecedor dos componentes de descolonização prescritos são importantes. O feedback direcionado aos provedores e o monitoramento da utilização esperada dos suprimentos de descolonização também são importantes.8,10
HIGIENE DAS MÃOS
Recomendações:
- 1.Aumentar a frequência de higiene das mãos durante os cuidados anestésicos. Realizar a higiene das mãos pelo menos 8 vezes por hora41 durante os cuidados anestésicos e pelo menos 4 vezes por hora durante a prestação de cuidados em ambientes de cuidados intensivos.42
- Melhorar a frequência e a qualidade da higiene do ambiente para auxiliar nos esforços de melhoria da higiene das mãos.8-10,43,44
 Justificativa: o contato com o ambiente da sala de cirurgia é frequente e rápido durante a prestação de cuidados anestésicos, muitas vezes envolvendo o toque simultâneo do paciente e do ambiente/equipamento.45 Dada a ligação demonstrada entre as mãos e os reservatórios ambientais,41 uma melhor higiene das mãos pode reduzir potenciais eventos de transmissão infecciosa ambiental.41,43,46 Idealmente, a higiene das mãos é realizada antes e após o contato com o paciente, após exposição a fluidos corporais, após contato com o ambiente contaminado e antes de realizar uma tarefa limpa/asséptica:41,47 estes são os “5 Momentos de Higiene das Mãos” descritos pela Organização Mundial de Saúde (OMS). Durante os cuidados anestésicos, a higiene das mãos deve ser realizada com frequência e atenção para capturar o maior número possível de oportunidades para reduzir a transmissão de patógenos. Embora possa não ser possível realizar a higiene das mãos após cada evento identificado pelas diretrizes da OMS, os profissionais de anestesia devem fazer mais para reduzir a transmissão de patógenos na sala de cirurgia. Determinado a partir de dados publicados, realizar a higiene das mãos pelo menos oito vezes por hora reduziria significativamente os possíveis eventos de transmissão.41 Em uma etapa relacionada, a higiene do ambiente mais frequente e de melhor qualidade pode reduzir o potencial de eventos de transmissão associados à contaminação das mãos.8,10,41,43,46 O uso de luvas duplas durante a indução pode aumentar os esforços de higiene das mãos baseados na OMS, mas estudos clínicos adicionais são indicados antes da adoção, dado que há apenas testes ambientais simulados dessa abordagem.45
Justificativa: o contato com o ambiente da sala de cirurgia é frequente e rápido durante a prestação de cuidados anestésicos, muitas vezes envolvendo o toque simultâneo do paciente e do ambiente/equipamento.45 Dada a ligação demonstrada entre as mãos e os reservatórios ambientais,41 uma melhor higiene das mãos pode reduzir potenciais eventos de transmissão infecciosa ambiental.41,43,46 Idealmente, a higiene das mãos é realizada antes e após o contato com o paciente, após exposição a fluidos corporais, após contato com o ambiente contaminado e antes de realizar uma tarefa limpa/asséptica:41,47 estes são os “5 Momentos de Higiene das Mãos” descritos pela Organização Mundial de Saúde (OMS). Durante os cuidados anestésicos, a higiene das mãos deve ser realizada com frequência e atenção para capturar o maior número possível de oportunidades para reduzir a transmissão de patógenos. Embora possa não ser possível realizar a higiene das mãos após cada evento identificado pelas diretrizes da OMS, os profissionais de anestesia devem fazer mais para reduzir a transmissão de patógenos na sala de cirurgia. Determinado a partir de dados publicados, realizar a higiene das mãos pelo menos oito vezes por hora reduziria significativamente os possíveis eventos de transmissão.41 Em uma etapa relacionada, a higiene do ambiente mais frequente e de melhor qualidade pode reduzir o potencial de eventos de transmissão associados à contaminação das mãos.8,10,41,43,46 O uso de luvas duplas durante a indução pode aumentar os esforços de higiene das mãos baseados na OMS, mas estudos clínicos adicionais são indicados antes da adoção, dado que há apenas testes ambientais simulados dessa abordagem.45
Principais recursos de implementação: é importante ter desinfetantes para as mãos posicionados ao alcance dos profissionais, inclusive idealmente em vários locais ao redor da área de trabalho da anestesia, para facilitar o uso durante o atendimento rápido ao paciente.41,43,44 Considerar colocar desinfetantes para as mãos à base de álcool na máquina de anestesia, montados no suporte intravenoso8,10 e na cintura do profissional.41 A importância da higiene das mãos não se limita aos membros da equipe de anestesia. Todos os membros da equipe perioperatória (isto é, enfermeiros circulantes, técnicos de instrumentação, cirurgiões, técnicos de anestesia clínica, estagiários e representantes de equipamentos) devem adotar as medidas recomendadas ao fornecer cuidados perioperatórios ao paciente.
CUIDADO VASCULAR
Recomendações:
- 1.Desinfetar as portas de injeção, usando álcool isopropílico 70–90% antes do acesso. Sugerimos esfregar com força para criar fricção por 5 a 30 segundos, seguido de secagem.48-53 Se estiver usando tampas projetadas para limpar conectores sem agulha, usar produtos comprovadamente eficazes e seguir as recomendações do fabricante. Alguns desses dispositivos requerem pelo menos 10 segundos de tempo de contato para serem eficazes.49
- Evitar o uso de lúmens abertos (por exemplo, válvulas descobertas), pois eles correm maior risco de contaminação, não podem ser bem desinfetados depois de contaminados50 e a contaminação tem sido repetidamente associada ao aumento da mortalidade do paciente.20,52
- Limpar todos os frascos de medicamentos com um pano embebido em álcool após a remoção da tampa contra poeira e antes do acesso para evitar contaminação e infecção.53 Mantenha as portas de injeção, as pontas das seringas e os tubos IV afastados do chão.49
Justificativa: As portas de injeção e os frascos de medicamentos devem ser desinfetados esfregando um cotonete com álcool isopropílico 70–90% antes de cada conexão.8,10 Embora não haja consenso quanto à duração da limpeza da porta de injeção com álcool, recomendamos um tempo total de 5 a 30 segundos com fricção forte para criar atrito, seguido de secagem ao ar.48-53 Esfregar dessa maneira seguido de 30 segundos de secagem demonstrou eliminar a introdução de bactérias das mãos de profissionais de anestesia em um estudo ex vivo randomizado.48
A pesquisa mostrou que até 50.000 unidades formadoras de colônias de bactérias vivas são injetadas via fluido intravenoso (IV) como resultado de violações das práticas recomendadas de assepsia de acesso vascular, conforme descrito acima.48 Esta é uma via primária de desenvolvimento de infecção do local cirúrgico e da corrente sanguínea,54 que pode aumentar várias vezes a mortalidade do paciente.55 É importante ressaltar que a contaminação por válvula intraoperatória tem sido repetidamente associada ao aumento da mortalidade do paciente e diretamente ligada por tipagem molecular avançada ao desenvolvimento de infecção pós-operatória.20,56 Ensaios clínicos randomizados controlados em vários centros41 demonstraram que o cuidado vascular aprimorado por meio do uso de portas de injeção com tampas desinfetantes montadas no suporte IV pode gerar reduções significativas na transmissão de patógenos e complicações infecciosas. Com a recente confirmação da contaminação intraoperatória de uma válvula intravenosa do paciente com SARS-CoV-2,9 a importância dessas recomendações vai além dos patógenos bacterianos.
Principais recursos de implementação: ter compressas com álcool e tampas desinfetantes com álcool perto dos profissionais, permitindo fácil acesso às ferramentas de desinfecção.44 Usar o tempo de desinfecção adequado para cada método de desinfecção.48-50
HIGIENE DO AMBIENTE
Recomendações:
- Implementar a limpeza pós-indução/sedação usando uma abordagem de 2 toques envolvendo lenços umedecidos contendo pelo menos um álcool e um composto de amônio quaternário.43,46 Usar um pano de microfibra para aumentar a remoção da carga biológica.28
- 2.Organizar o ambiente em espaços limpos/sujos.46
- Aumentar a limpeza de desinfecção de superfícies com irradiação ultravioleta com eficácia, eficiência e viabilidade de implementação comprovadas.9 Usar o monitoramento para implementação direcionada de procedimentos de limpeza mais avançados.10,21,57
Justificativa: a higiene do ambiente perioperatório é diversificada, envolvendo rotina, limpeza entre casos e limpeza final. Picos de contaminação do ambiente durante a indução e emergência da anestesia, períodos de atendimento ao paciente que se correlacionam com nadirs na adesão à higiene das mãos.43 O ambiente da área de trabalho de anestesia, representado pela válvula limitadora de pressão ajustável e pelo mostrador do agente da máquina de anestesia, é um potente veículo de transmissão com eventos de transmissão diretamente ligados ao desenvolvimento de infecção.20,53 Pelo menos 50% das SSIs de S aureus podem ser ligadas a ≥1 reservatório da área de trabalho de anestesia no momento da cirurgia.21 Em um estudo realizado no Dartmouth Hitchcock Medical Center, a higiene pós-indução, a organização de espaços limpos/sujos, o uso de panos de microfibra e o uso de lenços umedecidos multimodais para desinfecção de superfícies foi associado a uma redução significativa no número de reservatórios medidos superiores a 100 CFU por área de superfície amostrada,46 um limiar de contaminação associado a eventos de transmissão de alto risco subsequentemente ligados à infecção.8,10,20,56 Esses resultados foram semelhantes a um estudo cruzado bem projetado no ambiente de UTI, onde o aumento da frequência de higiene e o uso de panos de microfibra reduziram a contaminação bacteriana.28 Quando a luz ultravioleta C (UV-C) é implementada como parte de uma abordagem diversificada baseada em evidências (incluindo maior frequência e qualidade da desinfecção da superfície, higiene do ambiente e aumento com UV-C, descolonização do paciente, cuidados vasculares e higiene das mãos), reduções significativas na transmissão de S. aureus, transmissão de SARS-CoV-2 e SSIs podem ser alcançadas.⁹
Principais recursos de implementação: implementar a higiene pós-indução/sedação para abordar um pico importante na contaminação ambiental, organizar espaços limpos/sujos,43,46 e aumentar a higiene de desinfecção de superfícies com o uso de UV-C baseado em evidências.8-10,58 É importante que os dispositivos UV-C selecionados levem em consideração a importância do tempo de sala de cirurgia,59 que estratégias de implementação tenham sido delineadas e que tenham eficácia comprovada na prevenção da transmissão intraoperatória de patógenos bacterianos e virais.
CONCLUSÃO
As equipes de anestesia estão bem posicionadas para trabalhar em colaboração com a equipe cirúrgica/de enfermagem perioperatória para reduzir ao máximo a transmissão bacteriana perioperatória e a infecção subsequente. As medidas básicas de controle de infecção foram desenvolvidas e rigorosamente testadas com eficácia, eficiência, viabilidade e praticidade de implementação comprovadas. Cabe aos profissionais de anestesia agir com base nessas informações para melhorar a segurança do paciente perioperatório.
Jonathan E. Charnin, MD, é professor assistente de Anestesiologia na Mayo Clinic, Rochester, MN.
Melanie Hollidge, MD, PhD, é professora associada de Anestesiologia na University of Rochester, Rochester, NY.
Raquel Bartz, MD, MMCi, é professora associada de Anestesiologia no Brigham and Women’s Hospital, Boston, MA.
Desiree Chappell, CRNA, é vice-presidente de Qualidade Clínica, NorthStar Anesthesia, Irving, TX.
Jonathan M. Tan, MD, MPH, MBI, FASA, é professor assistente de Anestesiologia e Ciências Espaciais, Children’s Hospital Los Angeles, Los Angeles, CA; Keck School of Medicine e Spatial Sciences Institute, University of Southern California, Los Angeles, CA.
Morgan Hellman, RN, BSN, é gerente de vendas hospitalares da Pall Corporation, Port Washington, NY.
Sara McMannus, RN, BSN, MBA, é consultora clínica, Sepsis Alliance, San Diego, CA.
Richard A. Beers MD, é professor de Anestesiologia na Upstate Medical University, Syracuse, NY.
Michelle Beam, DO, MBA, FASA, é professora associada de Anestesia na Penn Medicine, West Chester, PA.
Randy Loftus, MD, é professor associado de Anestesiologia na University of Iowa, Iowa City, IA.
Conflitos de interesse: Randy Loftus, MD, relata o financiamento atual de sua pesquisa proveniente de NIH R01 AI155752-01A1, “Estudo BASIC: Melhoria da implementação de abordagens baseadas em evidências e vigilância para prevenir a transmissão e infecção bacteriana” e recebeu financiamento da Anesthesia Patient Safety Foundation, Sage Medical Inc., BBraun, Draeger, Surfacide e Kenall, tem uma ou mais patentes pendentes, é sócio da RDB Bioinformatics, LLC, 1055 N 115th St #301, Omaha, NE 68154, uma empresa proprietária da OR PathTrac, e palestrou em congressos educacionais patrocinados pela Kenall e BBraun. A University of Iowa usa o sistema da RDB Bioinformatics PathTrac para medir a transmissão bacteriana.
Jonathan Tan, MD, MPH, MBI, FASA, recebe financiamento para bolsas de pesquisa da Anesthesia Patient Safety Foundation (APSF) e Foundation for Anesthesia Education and Research (FAER).
Desiree Chappell, CRNA, está no Banco de Palestrantes da Medtronic e Edwards LifeSciences e no Conselho Consultivo da ProVation.
Jonathan Charnin, Melanie Hollidge, Raquel Bartz, Morgan Hellman, Sarah McMannus, Richard Beers e Michelle Beam não relataram conflitos de interesse.
REFERÊNCIAS
- Dexter F, Parra MC, Brown JR, et al. Perioperative COVID-19 defense: an evidence-based approach for optimization of infection control and operating room management. Anesth Analg. 2020;131:37–42. PMID: 32217947.
- Centers for Disease Control and Infection Prevention. Guidance for Tecovirimat use under expanded access investigational new drug protocol during 2022 U.S. monkeypox cases. https://www.cdc.gov/poxvirus/monkeypox/clinicians/Tecovirimat.html. Published 2022. Accessed July 26, 2022.
- Centers for Disease Control and Infection Prevention. Candida auris. Published 2022. https://www.cdc.gov/fungal/candida-auris/index.html. Accessed July 26, 2022
- Magill SS, Hellinger W, Cohen J, et al. Prevalence of healthcare-associated infections in acute care hospitals in Jacksonville, Florida. Infect Control Hosp Epidemiol. 2012;33:283–291. PMID: 22314066.
- Vogel TR, Dombrovskiy VY, Lowry SF. Impact of infectious complications after elective surgery on hospital readmission and late deaths in the U.S. Medicare population. Surg Infect (Larchmt). 2012;13:307–311. PMID: 23082877.
- Awad SS. Adherence to surgical care improvement project measures and post-operative surgical site infections. Surg Infect (Larchmt). 2012;13(4):234-237. PMID: 22913334.
- Centers for Disease Control and Infection Prevention. How can I get ahead of sepsis? https://www.cdc.gov/sepsis/prevention/index.html. Published 2022. Accessed July 26, 2022.
- Loftus RW, Dexter F, Goodheart MJ, et al. The effect of improving basic preventive measures in the perioperative arena on Staphylococcus aureus transmission and surgical site infections: a randomized clinical trial. JAMA Netw Open. 2020;3:e201934. PMID: 32219407.
- Loftus RW, Dexter F, Evans L, et al. Evidence-based intraoperative infection control measures plus feedback are associated with attenuation of severe acute respiratory syndrome coronavirus-2 detection in operating rooms. Br J Anaesth. 2022;129:e29–e32. PMID: 35643533.
- Wall RT, Datta S, Dexter F, et al. Effectiveness and feasibility of an evidence-based intraoperative infection control program targeting improved basic measures: a post-implementation prospective case-cohort study. J Clin Anesth. 2022;77:110632. PMID: 34929497.
- Warner MA, Warner ME. The evolution of the anesthesia patient safety movement in america: lessons learned and considerations to promote further improvement in patient safety. Anesthesiology. 2021;135:963–974. PMID: 34666350.
- Munoz-Price LS, Bowdle A, Johnston BL, et al. Infection prevention in the operating room anesthesia work area. Infect Control Hosp Epidemiol. 2019;40:1–17. PMID: 30526699.
- Association for Professionals in Infection Control. Infection preventionist’s guide to the OR. https://apic.org/infection-preventionists-guide-to-the-or/. Published 2018. Accessed July 29, 2022.
- Berrios-Torres SI, Umscheid CA, Bratzler DW, et al. Centers for Disease Control and Prevention guideline for the prevention of surgical site infection, 2017. JAMA Surg. 2017;152:784–791. PMID: 28467526.
- American Society of Anesthesiologists. Infection control and prevention. https://www.asahq.org/shop-asa/e020s10w02. Published 2022. Accessed July 26, 2022.
- American Association of Nurse Anesthesiology. Infection prevention and control guidelines for anesthesia care. https://www.aana.com/docs/default-source/practice-aana-com-web-documents-(all)/professional-practice-manual/infection-prevention-and-control-guidelines-for-anesthesia-care.pdf?sfvrsn=850049b1. Published 2015. Accessed July 26, 2022.
- Menz BD, Charani E, Gordon DL, et al. Surgical antibiotic prophylaxis in an era of antibiotic resistance: common resistant bacteria and wider considerations for practice. Infect Drug Resist. 2021;14:5235–5252. PMID: 34908856.
- Dexter F, Epstein RH, Loftus RW. Quantifying and interpreting inequality of surgical site infections among operating rooms. Can J Anaesth. 2021;68:812–824. PMID: 33547628.
- Dexter F, Ledolter J, Wall RT, et al. Sample sizes for surveillance of S. aureus transmission to monitor effectiveness and provide feedback on intraoperative infection control including for COVID-19. Perioper Care Oper Room Manag. 2020;20:100115. PMID: 32501426.
- Loftus RW, Brown JR, Koff MD, et al. Multiple reservoirs contribute to intraoperative bacterial transmission. Anesth Analg. 2012;114:1236–1248. PMID: 22467892.
- Loftus RW, Dexter F, Robinson ADM, Horswill AR. Desiccation tolerance is associated with Staphylococcus aureus hypertransmissibility, resistance and infection development in the operating room. J Hosp Infect. 2018;100:299–308. PMID: 29966756.
- Loftus RW, Brown JR, Patel HM, et al. Transmission dynamics of gram-negative bacterial pathogens in the anesthesia work area. Anesth Analg. 2015;120:819–826. PMID: 25790209.
- Hadder B, Patel HM, Loftus RW. Dynamics of intraoperative Klebsiella, Acinetobacter, Pseudomonas, and Enterobacter transmission. Am J Infect Control. 2018;46:526–532. PMID: 29395508.
- Loftus RW, Muffly MK, Brown JR, et al. Hand contamination of anesthesia providers is an important risk factor for intraoperative bacterial transmission. Anesth Analg. 2011;112:98–105. PMID: 20686007.
- Rupp ME, Fitzgerald T, Puumala S, et al. Prospective, controlled, cross-over trial of alcohol-based hand gel in critical care units. Infect Control Hosp Epidemiol. 2008;29:8–15. PMID: 18171181.
- Koff MD, Brown JR, Marshall EJ, et al. Frequency of hand decontamination of intraoperative providers and reduction of postoperative healthcare-associated infections: a randomized clinical trial of a novel hand hygiene system. Infect Control Hosp Epidemiol. 2016;37:888–895. PMID: 27267310.
- Konvalinka A, Errett L, Fong IW. Impact of treating Staphylococcus aureus nasal carriers on wound infections in cardiac surgery. J Hosp Infect. 2006;64:162–168. PMID: 16930768.
- Wilson APR, Smyth D, Moore G, et al. The impact of enhanced cleaning within the intensive care unit on contamination of the near-patient environment with hospital pathogens: a randomized crossover study in critical care units in two hospitals. Crit Care Med. 2011;39:651–658. PMID: 21242793.
- Phillips M, Rosenberg A, Shopsin B, et al. Preventing surgical site infections: a randomized, open-label trial of nasal mupirocin ointment and nasal povidone-iodine solution. Infect Control Hosp Epidemiol. 2014;35:826–832. PMID: 24915210.
- Schweizer ML, Chiang HY, Septimus E, et al. Association of a bundled intervention with surgical site infections among patients undergoing cardiac, hip, or knee surgery. JAMA. 2015;313:2162–2171. PMID: 26034956.
- Bode LGM, Kluytmans JAJW, Wertheim HFL, et al. Preventing surgical-site infections in nasal carriers of Staphylococcus aureus. N Engl J Med. 2010;362:9–17. PMID: 20054045.
- Huang SS, Singh R, McKinnell JA, et al. Decolonization to reduce postdischarge infection risk among MRSA carriers. N Engl J Med. 2019;380:638–650. PMID: 30763195.
- von Eiff C, Becker K, Machka K, et al. Nasal carriage as a source of Staphylococcus aureus bacteremia. Study Group. N Engl J Med. 2001;344:11–16. PMID: 11136954.
- Kluytmans JA, Mouton JW, VandenBergh MF, et al. Reduction of surgical-site infections in cardiothoracic surgery by elimination of nasal carriage of Staphylococcus aureus. Infect Control Hosp Epidemiol. 1996;17:780–785. PMID: 8985763.
- Bhalla A, Aron DC, Donskey CJ. Staphylococcus aureus intestinal colonization is associated with increased frequency of S. aureus on skin of hospitalized patients. BMC Infect Dis. 2007;7:105. 17848192.
- Murray CJL, Ikuta KS, Sharara F, et al. Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 2022;399:629–655. PMID: 35065702.
- Laxminarayan R, Duse A, Wattal C, et al. Antibiotic resistance—the need for global solutions. Lancet Infect Dis. 2013;13:1057–1098. PMID: 24252483.
- Patel JB, Gorwitz RJ, Jernigan JA. Mupirocin resistance. Clin Infect Dis. 2009;49:935–941. PMID: 19673644.
- Houang ET, Gilmore OJ, Reid C, Shaw EJ. Absence of bacterial resistance to povidone iodine. J Clin Pathol. 1976;29:752–755. PMID: 821972.
- Bigliardi PL, Alsagoff SAL, El-Kafrawi HY, et al. Povidone iodine in wound healing: a review of current concepts and practices. Int J Surg. 2017;44:260–268. PMID: 28648795.
- Koff MD, Loftus RW, Burchman CC, et al. Reduction in intraoperative bacterial contamination of peripheral intravenous tubing through the use of a novel device. Anesthesiology. 2009;110:978–985. PMID: 19352154.
- Koff MD, Corwin HL, Beach ML, et al. Reduction in ventilator associated pneumonia in a mixed intensive care unit after initiation of a novel hand hygiene program. J Crit Care. 2011;26:489–495. PMID: 21439767.
- Rowlands J, Yeager MP, Beach M, et al. Video observation to map hand contact and bacterial transmission in operating rooms. Am J Infect Control. 2014;42:698–701. PMID: 24969122.
- Bischoff WE, Reynolds TM, Sessler CN, et al. Handwashing compliance by health care workers: The impact of introducing an accessible, alcohol-based hand antiseptic. Arch Intern Med. 2000;160:1017–1021. PMID: 10761968.
- Birnbach DJ, Rosen LF, Fitzpatrick M, et al. Double gloves: a randomized trial to evaluate a simple strategy to reduce contamination in the operating room. Anesth Analg. 2015;120:848–852. PMID: 24836472.
- Clark C, Taenzer A, Charette K, Whitty M. Decreasing contamination of the anesthesia environment. Am J Infect Control. 2014;42:1223–1225. PMID: 25444268.
- Boyce JM, Pittet D, Healthcare Infection Control Practices Advisory Committee. Society for Healthcare Epidemiology of America. Association for Professionals in Infection Control. Infectious Diseases Society of America. Hand Hygiene Task F. Guideline for hand hygiene in health-care settings: recommendations of the Healthcare Infection Control Practices Advisory Committee and the HICPAC/SHEA/APIC/IDSA Hand Hygiene Task Force. Infect Control Hosp Epidemiol. 2002;23:S3–40. PMID: 12515399.
- Loftus RW, Patel HM, Huysman BC, et al. Prevention of intravenous bacterial injection from health care provider hands: the importance of catheter design and handling. Anesth Analg. 2012;115:1109–1119. PMID: 23051883.
- Loftus RW, Brindeiro BS, Kispert DP, et al. Reduction in intraoperative bacterial contamination of peripheral intravenous tubing through the use of a passive catheter care system. Anesth Analg. 2012;115:1315–1323. PMID: 23144441.
- Greene ES. Challenges in reducing the risk of infection when accessing vascular catheters. J Hosp Infect. 2021;113:130–144. PMID: 33713758.
- Moureau NL, Flynn J. Disinfection of needleless connector hubs: clinical evidence systematic review. Nurs Res Pract. 2015;2015:796762. PMID: 26075093.
- Lamberg JJ YL. Swab all vials with alcohol. APSF Newsletter. https://www.apsf.org/article/swab-all-vials-with-alcohol/. Published 2012. Accessed July 26, 2022.
- Bennett SN, McNeil MM, Bland LA, et al. Postoperative infections traced to contamination of an intravenous anesthetic, propofol. N Engl J Med. 1995;333:147–154. PMID: 7791816.
- Centers for Disease Control and Infection Prevention. Checklist for prevention of central line associated blood stream infections. https://www.cdc.gov/HAI/pdfs/bsi/checklist-for-CLABSI.pdf. Published 2014. Accessed July 26, 2022.
- Agency for Healthcare Research and Quality. Central line-associated bloodstream infections (CLABSI). https://www.ahrq.gov/topics/central-line-associated-bloodstream-infections-clabsi.html. Published 2022. Accessed July 26, 2022.
- Loftus RW, Koff MD, Burchman CC, et al. Transmission of pathogenic bacterial organisms in the anesthesia work area. Anesthesiology. 2008;109:399–407. PMID: 18719437.
- Robinson ADM, Dexter F, Renkor V, et al. Operating room PathTrac analysis of current intraoperative Staphylococcus aureus transmission dynamics. Am J Infect Control. 2019;47:1240–1247. PMID: 31036398.
- Loftus RW, Dexter F, Evans LC, et al. An assessment of the impact of recommended anesthesia work area cleaning procedures on intraoperative SARS-CoV-2 contamination, a case-series analysis. J Clin Anesth. 2021;73:110350. PMID: 34098391.
- Birchansky B, Dexter F, Epstein RH, Loftus RW. Statistical design of overnight trials for the evaluation of the number of operating rooms that can be disinfected by an ultraviolet light disinfection robotic system. Cureus. 2021;13:e18861. PMID: 34804714.


 Issue PDF
Issue PDF