INTRODUCCIÓN
 En la segunda mitad del siglo pasado, los antagonistas del receptor de la dopamina D2 fueron un pilar del tratamiento de las náuseas y los vómitos posoperatorios (PONV).1 Sin embargo, a principios del siglo XXI, su popularidad disminuyó drásticamente, principalmente como resultado de las crecientes preocupaciones de seguridad, una de las que fue la imposición de la Administración de Medicamentos y Alimentos de los EE. UU. (FDA) de una advertencia de recuadro negro sobre el agente más utilizado en su clase, el droperidol.1
En la segunda mitad del siglo pasado, los antagonistas del receptor de la dopamina D2 fueron un pilar del tratamiento de las náuseas y los vómitos posoperatorios (PONV).1 Sin embargo, a principios del siglo XXI, su popularidad disminuyó drásticamente, principalmente como resultado de las crecientes preocupaciones de seguridad, una de las que fue la imposición de la Administración de Medicamentos y Alimentos de los EE. UU. (FDA) de una advertencia de recuadro negro sobre el agente más utilizado en su clase, el droperidol.1
Actualmente, existe un interés renovado en esta clase de medicamentos relacionado, en parte, con la introducción de un nuevo agente, amisulprida, que fue aprobado por la FDA para la prevención y el tratamiento de PONV en 2020 y es el único agente aprobado para el tratamiento de rescate después de profilaxis fallida.
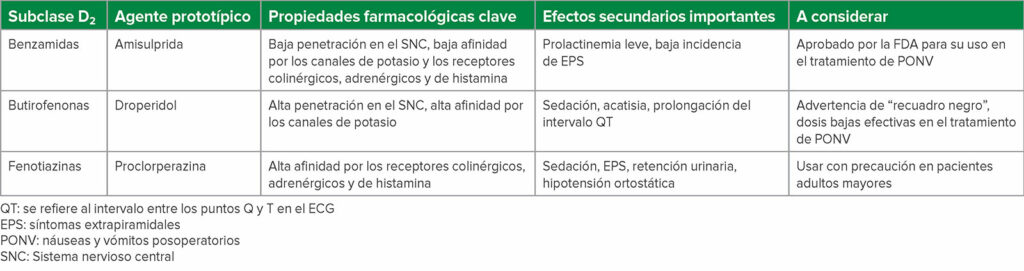
La reevaluación de la evidencia sobre los antagonistas D2 sugiere que no son intercambiables en términos de seguridad o eficacia, ya que se trata de una clase de fármacos inusualmente heterogénea. Hay al menos tres subclases estructurales distintas: butirofenonas, fenotiazinas y benzamidas sustituidas, con una amplia gama de propiedades farmacológicas y perfiles de efectos secundarios (Tabla 1).
Tabla 1: Subclase de antieméticos D2
SEGURIDAD
Los antagonistasD2utilizados originalmente como antieméticos eran los neurolépticos clásicos y los antipsicóticos de primera generación (FGA).2 La penetración de los antieméticos antagonistas D2en el sistema nervioso central (SNC) produce una amplia gama de efectos. Se pueden producir efectos de sedación y neuropsiquiátricos, como disforia o deterioro cognitivo2 . Los síntomas extrapiramidales (EPS) incluyen discinesia tardía, distonía y acatisia2 . El síndrome neuroléptico maligno (NMS) se presenta con fiebre, cambios en el estado mental, rigidez muscular e inestabilidad autonómica, y el antagonismo de los receptores D2 en la hipófisis produce hiperprolactinemia2 . Además, la unión a los canales iónicos de potasio puede provocar una prolongación del intervalo QT y torsade de pointes2 . La amisulprida es un antipsicótico “atípico” o de segunda generación con menor penetración en el cerebro que los FGA3 , resultando en una menor incidencia de estos efectos adversos2.
Aunque algunos de los efectos secundarios de los antagonistas D2 dependen de la dosis, existe toxicidad y falta evidencia sobre el impacto de la reducción de la dosis en la eficacia. Además, a pesar de una reducción en la frecuencia, las reacciones adversas como la discinesia tardía, la disforia o la torsade de pointes pueden tener un alto impacto en los pacientes. La tasa bruta de incidencia puede no reflejar adecuadamente la carga clínica. Por lo tanto, es esencial comprender los riesgos relativos de los antagonistas D2disponibles para que los proveedores tomen decisiones de prescripción óptimas.
BENZAMIDAS
La amisulprida es un antagonista D2 de la benzamida sustituido y un antagonista de la serotonina 5-HT2B y 5-HT7A con baja penetración en la barrera hematoencefálica y menor afinidad por los receptores adrenérgicos, histamínicos y colinérgicos, lo que resulta en una menor incidencia de efectos anticolinérgicos y sedantes4 . La amisulprida también tiene una unión preferencial en el sistema límbico, lo que resulta en una menor incidencia de EPS4 . Un metaanálisis de la red Cochrane de 2020 reportó que la amisulprida tuvo una incidencia comparable de eventos adversos en comparación con el placebo5 . Los niveles elevados de prolactina de la amisulprida no superan la norma para las mujeres no embarazadas6 , y la amisulprida no prolonga significativamente el intervalo QT en las dosis utilizadas para el tratamiento de PONV debido a su afinidad más débil por los canales de potasio7 . Estudios recientes han demostrado que la amisulprida es eficaz tanto para prevenir PONV8 como para el tratamiento de rescate de PONV9 . Otro antagonista de benzamida D2 es la metoclopramida, que es un antagonista débil de D2 y 5-HT3 con efectos secundarios dependientes de la dosis que incluyen sedación, EPS y molestias GI debido a la estimulación de las células del músculo liso gástrico10 . En la litertura, la metoclopramida puede ser útil en instituciones donde otros antagonistas D2 no están disponibles, pero de lo contrario puede no ser muy eficaz en el manejo de PONV1.
BUTIROFENONAS
El droperidol es un antagonista D2 de la butirofenona y se usó como agente de primera línea para la profilaxis de PONV en dosis bajas en el pasado1 . Produce sedación, disforia, ansiedad, acatisia y, sobre todo, prolongación del intervalo QT11 . Aunque los casos de muerte cardíaca condujeron a una advertencia de recuadro negro de la FDA en 2001 y una disminución significativa en su uso1 , el metaanálisis de la red Cochrane de 2020 reportó que las dosis antieméticas de droperidol tenían una incidencia de eventos adversos comparable a la del placebo5 . Siguiendo la advertencia de recuadro negro de la FDA en droperidol, hubo un mayor interés en el haloperidol, otra butirofenona, en el tratamiento de PONV1 . El haloperidol produce sedación, EPS, neurotoxicidad y prolongación del intervalo QT, y en 2007, la FDA actualizó la etiqueta para advertir a los proveedores que las torsades de pointes y la prolongación del intervalo QT se han observado en pacientes que reciben haloperidol, sobre todo cuando se administra por vía IV o en dosis más altas que las recomendadas, enfatizando que el haloperidol no está aprobado para la administración IV para el tratamiento de PONV12 . Sin embargo, la evidencia sugiere que las dosis bajas de haloperidol intravenoso parecen ser seguras y eficaces cuando se administran como dosis única para la profilaxis de PONV12.
FENOTIAZINAS
La proclorperazina es el antagonista de la fenotiazina D2 y FGA más utilizado, y produce sedación, EPS, efectos anticolinérgicos (como anorexia, visión borrosa, estreñimiento, sequedad de las mucosas y retención urinaria), efectos antiadrenérgicos que provocan hipotensión ortostática y una disminución del umbral de convulsiones13 . La prometazina es otro antagonista de la fenotiazina D2 y antihistamínico que produce sedación, pero las formulaciones IV son irritantes y corrosivas, y causan daño tisular grave tras la extravasación de una vena14.
EFECTOS SECUNDARIOS DEL ANTAGONISTA D2
Los antagonistas D2 pueden tener interacciones medicamentosas notables y no se recomiendan en pacientes con síndrome de QT prolongado o que toman medicamentos que prolongan el intervalo QT, dado el riesgo de una mayor prolongación15 . El ondansetrón, un antiemético de uso frecuente, también puede prolongar el intervalo QT, pero la prolongación del intervalo QT inducida por la combinación de ondansetrón y droperidol no es diferente de la inducida por cada fármaco solo1 . Los antagonistas D2 pueden potenciar la prolongación del intervalo QT en pacientes que toman fármacos que reducen la frecuencia cardíaca o inducen hipopotasemia, y la combinación de antagonistas D2 con antipsicóticos crea un riesgo aditivo de discinesia tardía y NMS15 . Además, los pacientes que toman agonistas de la dopamina como levodopa para el Parkinson o cabergolina para la hiperprolactinemia deben evitar los antagonistas D215 . Finalmente, los antagonistas D2 no deben administrarse con inhibidores de la monoaminooxidasa (MAO), ya que la norepinefrina se descompone por la MAO, y el antagonismo D2 crea una acumulación de norepinefrina, lo que conduce a una respuesta exagerada de órgano blanco16.
Las mejores prácticas para la salud cerebral posoperatoria sugieren que los antieméticos antagonistas D2 deben usarse con precaución o evitarse en pacientes mayores de 65 años, ya que pueden producir efectos anticolinérgicos centrales (fenotiazinas), EPS (benzamidas) y discinesia tardía, delirio y NMS (butirofenonas)17 . Además, los pacientes adultos mayores con demencia pueden tener un mayor riesgo de accidente cerebrovascular y una mayor tasa de deterioro cognitivo y mortalidad con estos medicamentos17 . Al igual que los pacientes adultos, los pacientes pediátricos pueden experimentar prolongación del intervalo QT y EPS con antagonistas D218.
DIRECTRICES PARA LA PRÁCTICA CLÍNICA Y PONV
PONV contribuye a la estadía prolongada en la unidad de cuidados posanestésicos (PACU), el ingreso al hospital no anticipado y el aumento de los costos de la atención médica1 . La cuarta directriz de consenso para el manejo de PONV publicada en 2020 describe la identificación de pacientes de alto riesgo, el manejo de los riesgos de PONV, elecciones de profilaxis y tratamientos de rescate de PONV1 . Se deben destacar aquí dos conclusiones importantes de las directrices. La prevención de PONV debe considerarse un aspecto integral de la anestesia y, por lo tanto, los pacientes con uno o dos factores de riesgo de PONV deben recibir profilaxis multimodal para PONV1 . Además, el tratamiento de PONV debe consistir en un antiemético de una clase farmacológica diferente del fármaco profiláctico administrado inicialmente1 , ya que no hay beneficio de redosificar ondansetrón, a pesar de su práctica frecuente1.
Se ha demostrado en la bibliografía que varios antagonistas D2 desempeñan un papel beneficioso en la profilaxis y en el tratamiento de PONV. Numerosos ensayos controlados aleatorios y exámenes retrospectivos de bases de datos demuestran que los regímenes combinados de antieméticos que no son antagonistas D2 con varios antagonistas2más antiguos, como droperidol, haloperidol y prometazina, son más efectivos que cualquiera de los agentes solos5,19-21 . Sin embargo, el uso de estos agentes ha disminuido19 . Hasta la fecha, la amisulprida se ha evaluado para el tratamiento de PONV en seis ensayos clínicos19,20 . Mientras que cinco de los ensayos evaluaron la monoterapia y demostraron que la amisulprida es superior al placebo en la prevención y el tratamiento de PONV6,8,22,23 , Kranke et al. demostró que la combinación de amisulprida con ondansetrón o dexametasona fue más eficaz que ondansetrón o dexametasona solo para reducir PONV y para el tratamiento de PONV de rescate8.
CONCLUSIÓN
La prevención y el manejo multimodal de PONV son fundamentales, sobre todo en la recuperación mejorada después de la cirugía (ERAS), pacientes que se someten a cirugía ambulatoria y el tratamiento de pacientes de alto riesgo que tienen mayor agudeza y fragilidad. Los antagonistas D2 pueden desempeñar un papel eficaz dada la evidencia en la literatura, pero también tienen una amplia gama de efectos secundarios, lo que limita su uso24 . Sin embargo, la amisulprida es un antagonista D2 con un perfil de seguridad favorable, y tiene la aprobación de la FDA para uso en la prevención y manejo de PONV. Por lo tanto, más estudios garantizan comparar amisulprida con otros antieméticos como agente único y su uso en terapia combinada, así como su análisis de costo-beneficio.
Connie Chung, MD, es profesor adjunto en el Departamento de Anestesiología, University of Southern California Keck School of Medicine, Los Ángeles, CA.
Joseph W. Szokol, MD, JD, MBA, es profesor en el Departamento de Anestesiología, University of Southern California Keck School of Medicine, Los Ángeles, CA.
Los autores no tienen ningún conflicto de interés.
REFERENCIAS
- Gan TJ, Belani KG, Bergese S, et al. Fourth consensus guidelines for the management of postoperative nausea and vomiting. Anesth Analg. 2020;131:411–448. PMID: 32467512.
- Solmi M, Murru A, Pacchiarotti I, et al. Safety, tolerability, and risks associated with first- and second-generation antipsychotics: a state-of-the-art clinical review. Ther Clin Risk Manag. 2017;13:757–777. PMID: 28721057.
- Natesan S, Reckless GE, Barlow KB, et al. Amisulpride the ‘atypical’ atypical antipsychotic—comparison to haloperidol, risperidone and clozapine. Schizophr Res. 2008;105:224–35. PMID: 18710798.
- Smyla N, Koch T, Eberhart LH, Gehling M. An overview of intravenous amisulpride as a new therapeutic option for the prophylaxis and treatment of postoperative nausea and vomiting. Expert Opin Pharmacother. 2020;21:517–522 PMID: 31971450.
- Weibel S, Rucker G, Eberhart LH, et. al. Drugs for preventing postoperative nausea and vomiting in adults after general anaesthesia: a network meta-analysis. Cochrane Database Syst Rev.2020;10:CD012859. PMID: 33170514.
- Gan TJ, Kranke P, Minkowitz HS, et al. Intravenous amisulpride for the prevention of postoperative nausea and vomiting: two concurrent, randomized, double-blind, placebo-controlled trials. Anesthesiology. 2017;126:268–275. PMID: 27902493.
- Fox GM, Albayaty M, Walker JL, et al. Intravenous amisulpride does not meaningfully prolong the QTc interval at doses effective for the management of postoperative nausea and vomiting. Anesth Analg. 2021;132:150–159. PMID: 31913911.
- Kranke P, Bergese SD, Minkowitz HS, et al. Amisulpride prevents postoperative nausea and vomiting in patients at high risk: a randomized, double-blind, placebo-controlled trial. Anesthesiology. 2018;128:1099–1106. PMID: 29543631.
- Habib AS, Kranke P, Bergese SD, et al. Amisulpride for the rescue treatment of postoperative nausea or vomiting in patients failing prophylaxis: a randomized, placebo-controlled phase III trial. Anesthesiology. 2019;130:203–212. PMID: 30475232.
- Harrington RA, Hamilton CW, Brogden RN, et al. Metoclopramide. An updated review of its pharmacological properties and clinical use. Drugs. 1983;25:451–494. PMID: 6345129.
- Lim BS, Pavy TJ, Lumsden G. The antiemetic and dysphoric effects of droperidol in the day surgery patient. Anaesth Intensive Care. 1999;27:371–374. PMID: 10470391.
- Habib AS, Gan TJ. Haloperidol for postoperative nausea and vomiting: are we reinventing the wheel? Anesth Analg. 2008;106:1343–1345. PMID: 18420842.
- Din L, Preuss CV. Prochlorperazine. In: StatPearls. Treasure Island (FL) 2022. PMID: 30725768.
- Southard BT, Al Khalili Y. Promethazine. In: StatPearls. Treasure Island (FL) 2022. PMID: 31335081.
- Chokhawala K, Stevens L. Antipsychotic Medications. In: StatPearls. Treasure Island (FL) 2022. PMID: 30137788.
- Sub Laban T, Saadabadi A. Monoamine Oxidase Inhibitors (MAOI). In: StatPearls. Treasure Island (FL) 2022. PMID: 30969670.
- Berger M, Schenning KJ, Brown CH 4th, et al. Best practices for postoperative brain health: recommendations from the fifth International Perioperative Neurotoxicity Working Group. Anesth Analg. 2018;127:1406–1413. PMID: 30303868.
- Kovac AL. Management of postoperative nausea and vomiting in children. Paediatr Drugs. 2007;9:47–69. PMID: 17291136.
- Haber SL, Graybill A, Minasian A. Amisulpride: a new drug for management of postoperative nausea and vomiting. Ann Pharmacother. 2021;55:1276–1282. PMID: 33412897.
- Habib AS, Gan TJ. The effectiveness of rescue antiemetics after failure of prophylaxis with ondansetron or droperidol: a preliminary report. J Clin Anesth. 2005;17:62–65. PMID: 15721732.
- Habib AS, Reuveni J, Taguchi A, et al. A comparison of ondansetron with promethazine for treating postoperative nausea and vomiting in patients who received prophylaxis with ondansetron: a retrospective database analysis. Anesth Analg. 2007;104:548–551. PMID: 17312206.
- Kranke P, Eberhart L, Motsch J, et al. I.V. APD421 (amisulpride) prevents postoperative nausea and vomiting: a randomized, double-blind, placebo-controlled, multicentre trial. Br J Anaesth. 2013;111:938–945. PMID: 23872464.
- Candiotti KA, Kranke P, Bergese SD, et al. Randomized, double-blind, placebo-controlled study of intravenous amisulpride as treatment of established postoperative nausea and vomiting in patients who have had no prior prophylaxis. Anesth Analg. 2019;128:1098–1105. PMID: 31094774.
- Tan HS, Dewinter G, Habib AS. The next generation of antiemetics for the management of postoperative nausea and vomiting. Best Pract Res Clin Anaesthesiol. 2020;34:759–769. PMID: 33288125.


 Issue PDF
Issue PDF