INTRODUÇÃO
 Na segunda metade do século passado, os antagonistas dos receptores de dopamina D2 foram a base do tratamento de náuseas e vômitos pós-operatórios (NVPO).1 No entanto, no início do século 21, eles tiveram uma queda drástica de popularidade, principalmente como resultado de preocupações crescentes com a segurança, entre as quais a imposição pela Food and Drug Administration (FDA) dos EUA de uma tarja preta de advertência sobre o agente mais usado na classe, o droperidol.1
Na segunda metade do século passado, os antagonistas dos receptores de dopamina D2 foram a base do tratamento de náuseas e vômitos pós-operatórios (NVPO).1 No entanto, no início do século 21, eles tiveram uma queda drástica de popularidade, principalmente como resultado de preocupações crescentes com a segurança, entre as quais a imposição pela Food and Drug Administration (FDA) dos EUA de uma tarja preta de advertência sobre o agente mais usado na classe, o droperidol.1
Atualmente há um interesse renovado nesta classe de medicamentos relacionado, em parte, à introdução de um novo agente, a amissulprida, que foi aprovada pela FDA para a prevenção e tratamento de NVPO em 2020 e é o único agente aprovado para tratamento de resgate após falha de profilaxia.
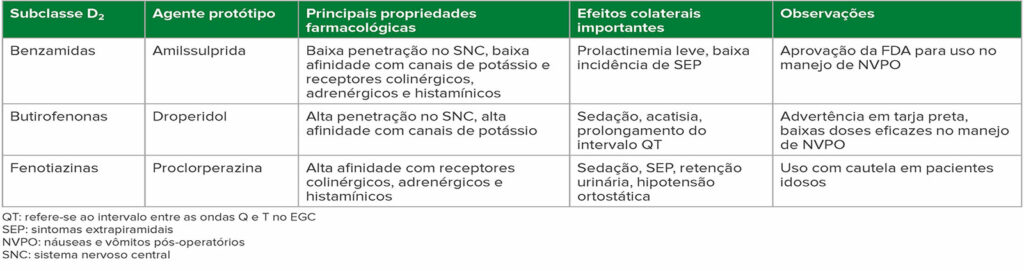
A reavaliação das evidências em torno dos antagonistas de receptores D2 sugere que eles não são intercambiáveis em termos de segurança ou eficácia, já que essa é uma classe de fármacos excepcionalmente heterogênea. Há pelo menos três subclasses estruturais distintas – benzamidas, butirofenonas e fenotiazinas – com uma ampla gama de propriedades farmacológicas e perfis de efeitos colaterais (Tabela 1).
Tabela 1: Antieméticos da subclasse D2
SEGURANÇA
Antagonistas de receptores D2 originalmente usados como antieméticos eram neurolépticos clássicos e antipsicóticos de primeira geração (APG).2 A penetração no sistema nervoso central (SNC) pelos antieméticos antagonistas de receptores D2 resulta em uma ampla gama de efeitos. Podem ocorrer efeitos sedativos e neuropsiquiátricos como disforia ou comprometimento cognitivo.2 Sintomas extrapiramidais (SEP) incluem a discinesia tardia, distonia e acatisia.2 A síndrome neuroléptica maligna (SNM) apresenta febre, alterações do estado mental, rigidez muscular e instabilidade autonômica, e o antagonismo dos receptores D2 na hipófise resulta em hiperprolactinemia.2 Além disso, a ativação dos canais iônicos de potássio pode resultar em prolongamento do intervalo QT e torsade de pointes.2 A amissulprida é um antipsicótico “atípico” ou de segunda geração com menor penetração cerebral do que os APGs,3 resultando em uma menor incidência desses efeitos adversos.2
Embora alguns dos efeitos colaterais dos antagonistas de receptores D2 sejam dose-dependentes, há toxicidade e faltam evidências sobre o impacto da redução da dose na eficácia. Além disso, apesar de redução na frequência, reações adversas como discinesia tardia, disforia ou torsade de pointes podem ter um alto impacto nos pacientes. A taxa de incidência bruta pode não refletir adequadamente a carga clínica. Portanto, é essencial compreender os riscos relativos dos antagonistas de receptores D2 disponíveis para que os profissionais possam tomar as melhores decisões de prescrição.
BENZAMIDAS
A amissulprida é uma benzamida substituída antagonista de receptores D2 e antagonista de receptores de serotonina 5-HT2B e 5-HT7A com baixa penetração da barreira hematoencefálica e menor afinidade por receptores adrenérgicos, histamínicos e colinérgicos, resultando em menor incidência de efeitos anticolinérgicos e sedativos.4 A amissulprida também tem uma ativação preferencial do sistema límbico, resultando em menor incidência de SEP.4 Uma metanálise Cochrane de rede em 2020 relatou que a amissulprida teve uma incidência de eventos adversos comparável ao placebo.5 Os níveis elevados de prolactina da amissulprida não excedem a norma para mulheres não grávidas,6 e a amissulprida não prolonga significativamente o intervalo QT em doses utilizadas para o manejo de NVPO devido a sua afinidade mais fraca com os canais de potássio.7 Estudos recentes mostraram que a amissulprida é eficaz tanto na prevenção de NVPO8 como no tratamento de resgate de NVPO.9 Outra benzamida antagonista de receptores D2 é a metoclopramida, que é um antagonista fraco de D2 e 5-HT3 com efeitos colaterais dose-dependentes que incluem sedação, SEP e perturbação gastrointestinal devido ao estímulo das células musculares lisas gástricas.10 Na literatura, a metoclopramida pode ser útil em instituições onde outros antagonistas de receptores D2 não estão disponíveis, mas, em outros casos, pode não ser muito eficaz no manejo de NVPO.1
BUTIROFENONAS
O droperidol, do grupo das butirofenonas, é um antagonista de receptores D2 usado como agente de primeira linha para a profilaxia de NVPO em baixas doses no passado.1 Provoca sedação, disforia, ansiedade, acatisia e, principalmente, prolongamento do intervalo QT.11 Embora os casos de morte súbita cardíaca tenham levado à colocação de uma tarja preta de advertência da FDA em 2001 e um declínio significativo em seu uso,1 a metanálise Cochrane de rede de 2020 relatou que doses antieméticas de droperidol tiveram uma incidência de eventos adversos comparável ao placebo.5 Após a advertência em tarja preta da FDA sobre o droperidol, houve um aumento do interesse pelo haloperidol, outra butirofenona, no manejo de NVPO.1 O haloperidol causa sedação, SEP, neurotoxicidade e prolongamento do intervalo QT e, em 2007, o FDA atualizou a rotulagem para alertar os profissionais para o fato de que foram observados torsades de pointes e prolongamento do intervalo QT em pacientes que receberam haloperidol, especialmente quando administrado por via intravenosa ou em doses maiores do que as recomendadas, enfatizando que o haloperidol não é aprovado para administração intravenosa no tratamento de NVPO.12 No entanto, as evidências sugerem que doses baixas de haloperidol intravenoso parecem ser seguras e eficazes quando administradas em dose única para profilaxia de NVPO.12
FENOTIAZINAS
A proclorperazina é a fenotiazina antagonista de receptores D2 e APG mais comumente usada e causa sedação, SEP, efeitos anticolinérgicos (como anorexia, visão turva, constipação intestinal, mucosa seca e retenção urinária), efeitos antiadrenérgicos que levam à hipotensão ortostática e à redução do limiar de convulsão.13 A prometazina é outra fenotiazina antagonista de receptores D2 e anti-histamínica que causa sedação, mas as formulações intravenosas são irritantes e corrosivas, causando danos severos aos tecidos por extravasamento de uma veia.14
EFEITOS COLATERAIS DE ANTAGONISTAS DE D2
Os antagonistas de D2 podem ter interações medicamentosas notáveis e não são recomendados em pacientes com síndrome do QT longo ou que estão tomando medicamentos que prolongam o intervalo QT, dado o risco de prolongamento adicional.15 A ondansetrona, um antiemético monolítico comumente usado, também pode prolongar o intervalo QT, mas o prolongamento do QT induzido pela combinação de ondansetrona e droperidol não é diferente daquele induzido apenas por cada medicamento.1 Os antagonistas de D2 podem potencializar o prolongamento do intervalo QT em pacientes que tomam medicamentos que reduzem a frequência cardíaca ou induzem hipocalemia, e a combinação de antagonistas de D2 com antipsicóticos cria um risco aditivo de discinesia tardia e SNM.15 Além disso, pacientes que tomam antagonistas de dopamina como levodopa para Parkinson ou cabergolina para hiperprolactinemia devem evitar antagonistas de D2.15 Por fim, os antagonistas de D2 não devem ser administrados com inibidores da monoamina oxidase (IMAOs), pois a norepinefrina é decomposta pela monoamina oxidase, e o antagonismo de D2 cria um acúmulo de norepinefrina, levando a uma resposta exagerada.16
As práticas recomendadas para a saúde cerebral pós-operatória sugerem que os antieméticos antagonistas de receptores D2 devem ser usados com cautela ou evitados em pacientes com mais de 65 anos, pois podem produzir efeitos anticolinérgicos centrais (fenotiazinas), SEP (benzamidas) e discinesia tardia, delírio e SNM (butirofenonas).17 Além disso, pacientes idosos com demência podem ter um risco aumentado de acidente vascular cerebral e uma maior taxa de declínio cognitivo e mortalidade com esses medicamentos.17 Assim como os pacientes adultos, os pacientes pediátricos podem apresentar SEP e prolongamento do intervalo QT com antagonistas de receptores D2.18
NVPO E DIRETRIZES PARA A PRÁTICA CLÍNICA
A NVPO contribui para a permanência prolongada na sala de recuperação pós-anestésica (SRPA), admissões hospitalares imprevistas e aumento dos custos dos cuidados de saúde.1 O quarto consenso de diretrizes para o manejo de NVPO, publicado em 2020, abrange a identificação de pacientes de alto risco, gestão dos riscos de NVPO de base, opções de profilaxia e tratamentos de resgate de NVPO.1 Duas importantes conclusões das diretrizes devem ser destacadas aqui. A prevenção de NVPO deve ser considerada um aspecto integral da anestesia e, portanto, pacientes com até mesmo um ou dois fatores de risco para NVPO devem receber profilaxia multimodal de NVPO.1 Além disso, o tratamento de NVPO deve conter um antiemético de classe farmacológica diferente do medicamento profilático administrado inicialmente1 pois não há benefício em administrar doses repetidas de ondansetrona, mesmo sendo essa uma prática comum.1
Vários antagonistas de D2 têm sido mostrados na literatura como tendo um papel benéfico tanto na profilaxia quanto no tratamento de NVPO. Vários ensaios controlados randomizados e análises retrospectivas de bancos de dados demonstram que os regimes de combinação de antieméticos não antagonistas de D2 com vários antieméticos antagonistas de D2 mais antigos, como droperidol, haloperidol e prometazina, são mais eficazes do que qualquer um dos agentes usados isoladamente.5,19-21 No entanto, o uso desses agentes diminuiu.19 Até agora, a amissulprida foi avaliada para o tratamento de NVPO em seis ensaios clínicos.19,20 Enquanto cinco dos ensaios avaliaram a monoterapia e demonstraram que a amissulprida é superior ao placebo na prevenção e tratamento de NVPO,6,8,22,23 Kranke et al. demonstraram que a combinação da amilssuprida com ondansetrona ou dexametasona foi mais eficaz do que somente ondansetrona ou dexametasona tanto na redução como no tratamento de resgate de NVPO.8
CONCLUSÃO
Uma abordagem multimodal para prevenção e manejo de NVPO é fundamental, especialmente em caminhos de recuperação otimizada após cirurgia (ERAS), para pacientes submetidos à cirurgia ambulatorial e no tratamento de pacientes de alto risco com maior acuidade e fragilidade. Os antagonistas de D2 podem desempenhar um papel eficaz, dadas as evidências na literatura, mas também têm uma ampla gama de efeitos colaterais, limitando seu uso.24 No entanto, a amissulprida é um antagonista de D2 com um perfil de segurança favorável, bem como a aprovação da FDA para uso na prevenção e manejo de NVPO. Portanto, são necessários mais estudos para comparar a amissulprida com outros antieméticos de agente único e seu uso em terapia combinada, bem como análises de custo-benefício.
Connie Chung, MD, é professora assistente no Departamento de Anestesiologia, University of Southern California – Keck School of Medicine, Los Angeles, CA.
Joseph W. Szokol, MD, JD, MBA, é professor no Departamento de Anestesiologia, University of Southern California – Keck School of Medicine, Los Angeles, CA.
Os autores não apresentam conflitos de interesse.
REFERÊNCIAS
- Gan TJ, Belani KG, Bergese S, et al. Fourth consensus guidelines for the management of postoperative nausea and vomiting. Anesth Analg. 2020;131:411–448. PMID: 32467512.
- Solmi M, Murru A, Pacchiarotti I, et al. Safety, tolerability, and risks associated with first- and second-generation antipsychotics: a state-of-the-art clinical review. Ther Clin Risk Manag. 2017;13:757–777. PMID: 28721057.
- Natesan S, Reckless GE, Barlow KB, et al. Amisulpride the ‘atypical’ atypical antipsychotic—comparison to haloperidol, risperidone and clozapine. Schizophr Res. 2008;105:224–35. PMID: 18710798.
- Smyla N, Koch T, Eberhart LH, Gehling M. An overview of intravenous amisulpride as a new therapeutic option for the prophylaxis and treatment of postoperative nausea and vomiting. Expert Opin Pharmacother. 2020;21:517–522 PMID: 31971450.
- Weibel S, Rucker G, Eberhart LH, et. al. Drugs for preventing postoperative nausea and vomiting in adults after general anaesthesia: a network meta-analysis. Cochrane Database Syst Rev.2020;10:CD012859. PMID: 33170514.
- Gan TJ, Kranke P, Minkowitz HS, et al. Intravenous amisulpride for the prevention of postoperative nausea and vomiting: two concurrent, randomized, double-blind, placebo-controlled trials. Anesthesiology. 2017;126:268–275. PMID: 27902493.
- Fox GM, Albayaty M, Walker JL, et al. Intravenous amisulpride does not meaningfully prolong the QTc interval at doses effective for the management of postoperative nausea and vomiting. Anesth Analg. 2021;132:150–159. PMID: 31913911.
- Kranke P, Bergese SD, Minkowitz HS, et al. Amisulpride prevents postoperative nausea and vomiting in patients at high risk: a randomized, double-blind, placebo-controlled trial. Anesthesiology. 2018;128:1099–1106. PMID: 29543631.
- Habib AS, Kranke P, Bergese SD, et al. Amisulpride for the rescue treatment of postoperative nausea or vomiting in patients failing prophylaxis: a randomized, placebo-controlled phase III trial. Anesthesiology. 2019;130:203–212. PMID: 30475232.
- Harrington RA, Hamilton CW, Brogden RN, et al. Metoclopramide. An updated review of its pharmacological properties and clinical use. Drugs. 1983;25:451–494. PMID: 6345129.
- Lim BS, Pavy TJ, Lumsden G. The antiemetic and dysphoric effects of droperidol in the day surgery patient. Anaesth Intensive Care. 1999;27:371–374. PMID: 10470391.
- Habib AS, Gan TJ. Haloperidol for postoperative nausea and vomiting: are we reinventing the wheel? Anesth Analg. 2008;106:1343–1345. PMID: 18420842.
- Din L, Preuss CV. Prochlorperazine. In: StatPearls. Treasure Island (FL) 2022. PMID: 30725768.
- Southard BT, Al Khalili Y. Promethazine. In: StatPearls. Treasure Island (FL) 2022. PMID: 31335081.
- Chokhawala K, Stevens L. Antipsychotic Medications. In: StatPearls. Treasure Island (FL) 2022. PMID: 30137788.
- Sub Laban T, Saadabadi A. Monoamine Oxidase Inhibitors (MAOI). In: StatPearls. Treasure Island (FL) 2022. PMID: 30969670.
- Berger M, Schenning KJ, Brown CH 4th, et al. Best practices for postoperative brain health: recommendations from the fifth International Perioperative Neurotoxicity Working Group. Anesth Analg. 2018;127:1406–1413. PMID: 30303868.
- Kovac AL. Management of postoperative nausea and vomiting in children. Paediatr Drugs. 2007;9:47–69. PMID: 17291136.
- Haber SL, Graybill A, Minasian A. Amisulpride: a new drug for management of postoperative nausea and vomiting. Ann Pharmacother. 2021;55:1276–1282. PMID: 33412897.
- Habib AS, Gan TJ. The effectiveness of rescue antiemetics after failure of prophylaxis with ondansetron or droperidol: a preliminary report. J Clin Anesth. 2005;17:62–65. PMID: 15721732.
- Habib AS, Reuveni J, Taguchi A, et al. A comparison of ondansetron with promethazine for treating postoperative nausea and vomiting in patients who received prophylaxis with ondansetron: a retrospective database analysis. Anesth Analg. 2007;104:548–551. PMID: 17312206.
- Kranke P, Eberhart L, Motsch J, et al. I.V. APD421 (amisulpride) prevents postoperative nausea and vomiting: a randomized, double-blind, placebo-controlled, multicentre trial. Br J Anaesth. 2013;111:938–945. PMID: 23872464.
- Candiotti KA, Kranke P, Bergese SD, et al. Randomized, double-blind, placebo-controlled study of intravenous amisulpride as treatment of established postoperative nausea and vomiting in patients who have had no prior prophylaxis. Anesth Analg. 2019;128:1098–1105. PMID: 31094774.
- Tan HS, Dewinter G, Habib AS. The next generation of antiemetics for the management of postoperative nausea and vomiting. Best Pract Res Clin Anaesthesiol. 2020;34:759–769. PMID: 33288125.


 Issue PDF
Issue PDF