ВВЕДЕНИЕ
 Во второй половине прошлого века антагонисты дофаминовых D2-рецепторов были основой лечения послеоперационной тошноты и рвоты (ПОТР).1 Однако в начале XXI века их популярность резко упала, в первую очередь в результате растущих проблем безопасности, среди которых не последнюю роль сыграло введение Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) предупреждения в черной рамке в отношении наиболее широко используемого препарата в данном классе — дроперидола.1
Во второй половине прошлого века антагонисты дофаминовых D2-рецепторов были основой лечения послеоперационной тошноты и рвоты (ПОТР).1 Однако в начале XXI века их популярность резко упала, в первую очередь в результате растущих проблем безопасности, среди которых не последнюю роль сыграло введение Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) предупреждения в черной рамке в отношении наиболее широко используемого препарата в данном классе — дроперидола.1
В настоящее время снова появился интерес к этому классу препаратов, частично связанный с представлением нового препарата, амисульприда, который был одобрен FDA для профилактики и лечения ПОТР в 2020 году и является единственным зарегистрированным препаратом резервной терапии после неэффективной профилактики.
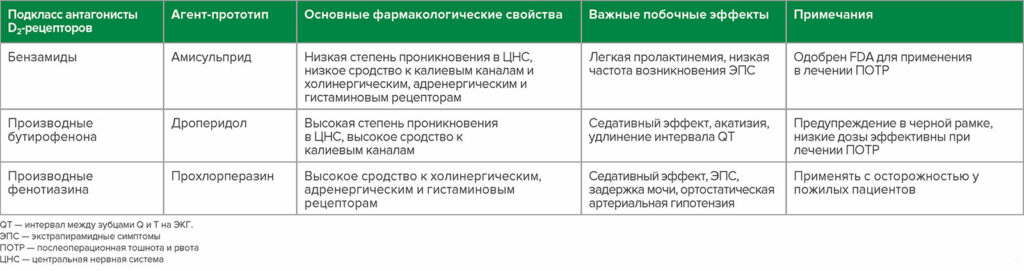
По результатам повторной оценки доказательств, касающихся антагонистов D2-рецепторов, они не являются взаимозаменяемыми с точки зрения безопасности или эффективности, поскольку это необычно разнородный класс препаратов. Существует по меньшей мере три отдельных структурных подкласса: замещенные бензамиды, производные бутирофенона и производные фенотиазина, с широким спектром фармакологических свойств и профилей побочных эффектов (таблица 1).
Таблица 1. Подкласс противорвотных средств антагонисты D2рецепторов
БЕЗОПАСНОСТЬ
Изначально в качестве противорвотных средств использовались такие антагонисты D2-рецепторов, как классические нейролептики и антипсихотики первого поколения (АПП).2 Проникновение противорвотных препаратов, представляющих собой антагонисты D2-рецепторов, в центральную нервную систему (ЦНС) приводит к широкому спектру эффектов. Возможны седация и нейропсихиатрические эффекты, такие как дисфория или когнитивные нарушения.2 Экстрапирамидные симптомы (ЭПС) включают позднюю дискинезию, дистонию и акатизию.2 Злокачественный нейролептический синдром (ЗНС) проявляется лихорадкой, изменениями психического статуса, ригидностью мышц и вегетативной нестабильностью, а антагонизм D2 -рецепторов в гипофизе приводит к гиперпролактинемии.2 Кроме того, связывание с калиевыми ионными каналом может привести к удлинению интервала QT и развитию тахикардии типа пируэт.2 Амисульприд — это «атипичный» антипсихотик второго поколения с более низкой степенью проникновения в головной мозг, чем у АПП,3 что приводит к более низкой частоте развития этих нежелательных явлений.2
Хотя некоторые побочные эффекты антагонистов D2-рецепторов дозозависимы, эти препараты могут проявлять токсичность, а данные о влиянии снижения дозы на эффективность отсутствуют. Более того, несмотря на снижение частоты, такие нежелательные реакции, как поздняя дискинезия, дисфория или пируэтная тахикардия, могут оказывать сильное влияние на пациентов. Общий коэффициент заболеваемости может не отражать клиническую нагрузку должным образом. Поэтому важно понимать относительные риски доступных антагонистов D2-рецепторов, чтобы врачи могли принимать оптимальные решения при назначении препаратов.
БЕНЗАМИДЫ
Амисульприд — это замещенный бензамидный антагонист D2-рецепторов и антагонист серотониновых 5-HT2B-рецепторов и 5-HT 7A-рецепторов с низкой степенью проникновением через гематоэнцефалический барьер и более низким сродством к адренергическим, гистаминовым и холинергическим рецепторам, что связано с более низкой частотой возникновения антихолинергических и седативных эффектов.4 Амисульприд также преимущественно связывается в лимбической системой, что приводит к снижению частоты развития ЭПС.4 Кокрановский сетевой метаанализ от 2020 года показал, что при применении амисульприда отмечалась сопоставимая частота развития нежелательных явлений, что и при применении плацебо.5 Повышенные уровни пролактина на фоне применения амисульприда не превышают нормы для небеременных женщин,6 и амисульприд не вызывает значимого удлинения интервала QT в тех дозах, которые применяются для лечения ПОТР, из-за его более слабого сродства к калиевым каналам.7 Согласно данным недавних исследований, амисульприд эффективен как в профилактике ПОТР8, так и в качестве препарата экстренной терапии при ПОТР.9 Другим бензамидным антагонистом D2-рецепторов является метоклопрамид, который является более слабым антагонистом D2 и 5-HT 3-рецепторов с дозозависимыми побочными эффектами, которые включают седативный эффект, ЭПС и расстройство ЖКТ вследствие стимуляции гладкомышечных клеток желудка.10 Согласно литературным данным, метоклопрамид может быть полезен в учреждениях, в которых отсутствуют другие антагонисты D2-рецепторов, но в противном случае он может быть не очень эффективен при лечении ПОТР.1
ПРОИЗВОДНЫЕ БУТИРОФЕНОНА
Дроперидол — это производное бутирофенона и антагонист D2-рецепторов, который ранее применялся в низких дозах в качестве препарата первой линии для профилактики ПОТР.1 Он вызывает седацию, дисфорию, тревогу, акатизию и, что особенно важно, удлинение интервала QT.11 Несмотря на то, что случаи внезапной сердечной смерти привели к размещению предупреждения в черной рамке по требованию FDA в 2001 году и значительному снижению его использования,1 Кохрейновский сетевой метаанализ 2020 года показал, что при применении дроперидола в дозах, необходимых для достижения противорвотного эффекта, отмечалась сопоставимая частота нежелательных явлений, что и при применении плацебо.5 После размещения по предписанию FDA предупреждения в черной рамке на дроперидоле при лечении ПОТР наблюдался повышенный интерес к галоперидолу, другому производному бутирофенона.1 Галоперидол вызывает седативный эффект, ЭПС, нейротоксичность и удлинение интервала QT, и в 2007 году FDA обновило маркировку, чтобы предупредить врачей о том, что у пациентов, применявших галоперидол, отмечалась пируэтная тахикардия и удлинение интервала QT, особенно при внутривенном введении препарата или в более высоких дозах, чем рекомендовано, подчеркивая, что галоперидол не одобрен для внутривенного введения для лечения ПОТР.12 Однако данные свидетельствуют о том, что низкие дозы в/в вводимого галоперидола, по-видимому, безопасны и эффективны при введении его в виде однократной дозы для профилактики ПОТР.12
ПРОИЗВОДНЫЕ ФЕНОТИАЗИНА
Прохлорперазин — это наиболее часто применяемый антагонист D2-рецепторов из группы фенотиазиновых нейролептиков, вызывающий седативный эффект, ЭПС, антихолинергические эффекты (такие как отсутствие аппетита, нечеткость зрения, запор, сухость слизистой оболочки и задержка мочи), антиадренергические эффекты, приводящие к ортостатической артериальной гипотензии и снижению судорожного порога.13 Прометазин — еще один антагонист D2-рецепторов из группы фенотиазиновых нейролептиков и антигистаминный препарат, который вызывает седативный эффект, но лекарственные формы для внутривенного введения оказывают раздражающее и разъедающее действие, вызывая тяжелое повреждение тканей при экстравазации из вены.14
ПОБОЧНЫЕ ЭФФЕКТЫ АНТАГОНИСТОВ D2-РЕЦЕПТОРОВ
Антагонисты D2-рецепторов могут вступать в заметные лекарственные взаимодействия и не рекомендованы пациентам с синдромом удлиненного интервала QT или принимающим препараты, которые вызывают удлинение интервал QT, учитывая риск дальнейшего удлинения этого интервала.15 Ондансетрон, широко применяемый противорвотный препарат, также может удлинять интервал QT, но удлинение интервала QT, вызванное комбинацией ондансетрона и дроперидола, не отличается от удлинения, вызванного каждым препаратом по отдельности.1 Антагонисты D2-рецепторов могут потенцировать удлинение интервала QT у пациентов, принимающих препараты, снижающие частоту сердечных сокращений или вызывающие гипокалиемию, а комбинация антагонистов D2-рецепторов с антипсихотиками создает дополнительный риск развития поздней дискинезии и ЗНС.15 Кроме того, пациенты, принимающие агонисты дофамина, такие как леводопа при болезни Паркинсона или каберголин при гиперпролактинемии, должны избегать применения антагонистов D2-рецепторов.15 И наконец, антагонисты D2-рецепторов не следует назначать с ингибиторами моноаминоксидазы (МАО), поскольку норадреналин расщепляется под действием МАО, а антагонизм D2-рецепторов вызывает накопление норадреналина, что приводит к усилению ответа со стороны органов-мишеней.16
Наилучшие методы послеоперационной терапии головного мозга предполагают, что противорвотные средства в виде с антагонистов D2-рецепторов следует применять с осторожностью или избегать их применения у пациентов старше 65 лет, так как они могут вызывать центральные антихолинергические эффекты (производные фенотиазина), ЭПС (бензамиды), позднюю дискинезию, делирий и ЗНС (производные бутирофенона).17 Кроме того, у пожилых пациентов с деменцией может наблюдаться повышенный риск нарушения мозгового кровообращения и повышенная частота снижения когнитивных функций и смертности при применении этих препаратов.17 Как и у взрослых пациентов, у детей при применении антагонистов D2-рецепторов может наблюдаться удлинение интервала QT и ЭПС.18
ПОТР И КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПОТР способствует более длительному пребыванию в палате послеоперационного наблюдения (ППН), непредвиденной госпитализации и увеличению расходов на здравоохранение.1 В четвертом согласованном руководстве по ведению ПОТР, опубликованном в 2020 году, описаны выявление пациентов с высоким риском, управление исходными рисками развития ПОТР, выбор методов профилактики и резервной терапии ПОТР.1 Здесь следует выделить два важных вывода из этого руководства. Профилактика ПОТР должна рассматриваться как неотъемлемый аспект анестезии, и поэтому пациенты, имеющие хотя бы один или два фактора риска развития ПОТР, должны получать комплексную профилактику ПОТР.1 Кроме того, лечение ПОТР должно включать противорвотные препараты, относящиеся к фармакологическому классу, который отличается от класса первоначального профилактического препарата,1 поскольку повторный прием ондансетрона не дает преимуществ, несмотря его частое применение в практике.1
В литературе отмечалось, что различные антагонисты D2-рецепторов играют положительную роль как в профилактике, так и в лечении ПОТР. Многочисленные рандомизированные контролируемые исследования и ретроспективные анализы баз данных свидетельствуют о том, что комбинированные схемы применения противорвотных средств, не являющихся антагонистами D2-рецепторов, с различными более старыми антагонистами D2-рецепторов, такими как дроперидол, галоперидол и прометазин, являются более эффективными, чем каждый из этих препаратов по отдельности.5,19-21 Однако частота применения этих препаратов снизилась.19 К настоящему времени амисульприд оценили как препарат для лечения ПОТР в шести клинических исследованиях.19,20 В то время как в пяти из исследований оценивали монотерапию и показали, что амисульприд эффективнее, чем плацебо в профилактике и лечении ПОТР,6,8,22,23 Kranke и соавт. показали, что комбинация амисульприда с ондансетроном или дексаметазоном была более эффективной в отношении снижения выраженности и купирования ПОТР, чем монотерапия ондансетроном или дексаметазоном.8
ЗАКЛЮЧЕНИЕ
Комплексная профилактика и лечение ПОТР имеют решающее значение, особенно при ускоренном восстановлении после операции (УВПО), у пациентов, перенесших амбулаторное хирургическое вмешательство, и в лечении пациентов из группы высокого риска с повышенной чувствительностью и уязвимостью. Учитывая данные литературы, антагонисты D2-рецепторов могут вполне эффективны, но они также имеют широкий спектр побочных эффектов, что ограничивает их применение.24 Тем не менее, амисульприд является антагонистом D2-рецепторов с благоприятным профилем безопасности, который одобрен FDA для применения в профилактике и лечении ПОТР. Таким образом, требуется проведение большего количества исследований для сравнения амисульприда с другими отдельными противорвотными средствами и его применения в составе комбинированной терапии, а также необходимы анализы затрат и результатов.
Конни Чанг (Connie Chung), врач, доцент кафедры анестезиологии в Медицинской школе Кека при Университете Южной Калифорнии в г. Лос-Анджелес, шт. Калифорния, США
Джозеф В. Сокол (Joseph W. Szokol), врач, доктор юриспруденции, магистр делового администрирования, доцент кафедры анестезиологии в Медицинской школе Кека при Университете Южной Калифорнии в г. Лос-Анджелес, шт. Калифорния, США.
У авторов нет конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
- Gan TJ, Belani KG, Bergese S, et al. Fourth consensus guidelines for the management of postoperative nausea and vomiting. Anesth Analg. 2020;131:411–448. PMID: 32467512.
- Solmi M, Murru A, Pacchiarotti I, et al. Safety, tolerability, and risks associated with first- and second-generation antipsychotics: a state-of-the-art clinical review. Ther Clin Risk Manag. 2017;13:757–777. PMID: 28721057.
- Natesan S, Reckless GE, Barlow KB, et al. Amisulpride the ‘atypical’ atypical antipsychotic—comparison to haloperidol, risperidone and clozapine. Schizophr Res. 2008;105:224–35. PMID: 18710798.
- Smyla N, Koch T, Eberhart LH, Gehling M. An overview of intravenous amisulpride as a new therapeutic option for the prophylaxis and treatment of postoperative nausea and vomiting. Expert Opin Pharmacother. 2020;21:517–522 PMID: 31971450.
- Weibel S, Rucker G, Eberhart LH, et. al. Drugs for preventing postoperative nausea and vomiting in adults after general anaesthesia: a network meta-analysis. Cochrane Database Syst Rev.2020;10:CD012859. PMID: 33170514.
- Gan TJ, Kranke P, Minkowitz HS, et al. Intravenous amisulpride for the prevention of postoperative nausea and vomiting: two concurrent, randomized, double-blind, placebo-controlled trials. Anesthesiology. 2017;126:268–275. PMID: 27902493.
- Fox GM, Albayaty M, Walker JL, et al. Intravenous amisulpride does not meaningfully prolong the QTc interval at doses effective for the management of postoperative nausea and vomiting. Anesth Analg. 2021;132:150–159. PMID: 31913911.
- Kranke P, Bergese SD, Minkowitz HS, et al. Amisulpride prevents postoperative nausea and vomiting in patients at high risk: a randomized, double-blind, placebo-controlled trial. Anesthesiology. 2018;128:1099–1106. PMID: 29543631.
- Habib AS, Kranke P, Bergese SD, et al. Amisulpride for the rescue treatment of postoperative nausea or vomiting in patients failing prophylaxis: a randomized, placebo-controlled phase III trial. Anesthesiology. 2019;130:203–212. PMID: 30475232.
- Harrington RA, Hamilton CW, Brogden RN, et al. Metoclopramide. An updated review of its pharmacological properties and clinical use. Drugs. 1983;25:451–494. PMID: 6345129.
- Lim BS, Pavy TJ, Lumsden G. The antiemetic and dysphoric effects of droperidol in the day surgery patient. Anaesth Intensive Care. 1999;27:371–374. PMID: 10470391.
- Habib AS, Gan TJ. Haloperidol for postoperative nausea and vomiting: are we reinventing the wheel? Anesth Analg. 2008;106:1343–1345. PMID: 18420842.
- Din L, Preuss CV. Prochlorperazine. In: StatPearls. Treasure Island (FL) 2022. PMID: 30725768.
- Southard BT, Al Khalili Y. Promethazine. In: StatPearls. Treasure Island (FL) 2022. PMID: 31335081.
- Chokhawala K, Stevens L. Antipsychotic Medications. In: StatPearls. Treasure Island (FL) 2022. PMID: 30137788.
- Sub Laban T, Saadabadi A. Monoamine Oxidase Inhibitors (MAOI). In: StatPearls. Treasure Island (FL) 2022. PMID: 30969670.
- Berger M, Schenning KJ, Brown CH 4th, et al. Best practices for postoperative brain health: recommendations from the fifth International Perioperative Neurotoxicity Working Group. Anesth Analg. 2018;127:1406–1413. PMID: 30303868.
- Kovac AL. Management of postoperative nausea and vomiting in children. Paediatr Drugs. 2007;9:47–69. PMID: 17291136.
- Haber SL, Graybill A, Minasian A. Amisulpride: a new drug for management of postoperative nausea and vomiting. Ann Pharmacother. 2021;55:1276–1282. PMID: 33412897.
- Habib AS, Gan TJ. The effectiveness of rescue antiemetics after failure of prophylaxis with ondansetron or droperidol: a preliminary report. J Clin Anesth. 2005;17:62–65. PMID: 15721732.
- Habib AS, Reuveni J, Taguchi A, et al. A comparison of ondansetron with promethazine for treating postoperative nausea and vomiting in patients who received prophylaxis with ondansetron: a retrospective database analysis. Anesth Analg. 2007;104:548–551. PMID: 17312206.
- Kranke P, Eberhart L, Motsch J, et al. I.V. APD421 (amisulpride) prevents postoperative nausea and vomiting: a randomized, double-blind, placebo-controlled, multicentre trial. Br J Anaesth. 2013;111:938–945. PMID: 23872464.
- Candiotti KA, Kranke P, Bergese SD, et al. Randomized, double-blind, placebo-controlled study of intravenous amisulpride as treatment of established postoperative nausea and vomiting in patients who have had no prior prophylaxis. Anesth Analg. 2019;128:1098–1105. PMID: 31094774.
- Tan HS, Dewinter G, Habib AS. The next generation of antiemetics for the management of postoperative nausea and vomiting. Best Pract Res Clin Anaesthesiol. 2020;34:759–769. PMID: 33288125.


 Issue PDF
Issue PDF