Nos pacientes anestesiados para a realização de cirurgia na posição de cadeira de praia, a pressão sanguínea do cérebro pode chegar a níveis abaixo da capacidade de autorregulação do cérebro. Isso pode causar lesão cerebral, por isso é essencial entender a autorregulação cerebral para evitar essa ocorrência. O fluxo sanguíneo cerebral corre risco quando a pressão sanguínea do cérebro fica abaixo de aproximadamente 70 a 80 mmHg. O reconhecimento e a reversão imediatos da hipotensão cerebral deve eliminar uma possível lesão cerebral nesses pacientes.
Veja o artigo original no link a seguir: https://www.apsf.org/article/beach-chair-position-may-decrease-cerebral-perfusion/
 Muitos fatores reduziram a incidência de complicações relacionadas à anestesia. O desenvolvimento de uma conscientização cultural e da ênfase especial na segurança do paciente começou com a aceitação dos padrões de cuidados de monitorização1 e evoluiu desde 1985 de muitas formas. Antes de 1985, a taxa de mortalidade relacionada à anestesia era de cerca de 1:10.000 casos. Após a publicação dos padrões na JAMA, que eram aplicáveis apenas aos hospitais afiliados à Harvard, a pressão pública fez com que a American Society of Anesthesiologists (ASA) adotasse integralmente os padrões em alguns meses.
Muitos fatores reduziram a incidência de complicações relacionadas à anestesia. O desenvolvimento de uma conscientização cultural e da ênfase especial na segurança do paciente começou com a aceitação dos padrões de cuidados de monitorização1 e evoluiu desde 1985 de muitas formas. Antes de 1985, a taxa de mortalidade relacionada à anestesia era de cerca de 1:10.000 casos. Após a publicação dos padrões na JAMA, que eram aplicáveis apenas aos hospitais afiliados à Harvard, a pressão pública fez com que a American Society of Anesthesiologists (ASA) adotasse integralmente os padrões em alguns meses.
A introdução da nova tecnologia, começando com a oximetria de pulso, seguida pela capnografia, pelas melhorias constantes nas máquinas de anestesia e nos equipamentos de monitorização e pelos medicamentos mais seguros etc., reduziu drasticamente os prêmios de seguro saúde por negligência anestésica e as taxas de mortalidade por anestesia caíram para um entre várias centenas de milhares de pacientes saudáveis ASA I e II.2-4
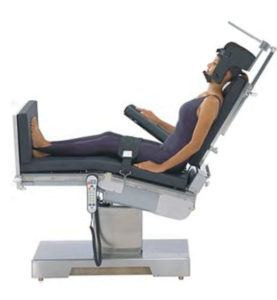
Entretanto, conforme exemplificado em nosso artigo original,5 novos problemas sempre surgem, como lesão cerebral em pacientes saudáveis que passam por cirurgia no ombro na Posição de Cadeira de Praia (BCP). Quatro casos chamaram a minha atenção em 2000.5 Nenhum dos médicos envolvidos diretamente no atendimento desses quatro pacientes entendia por que os pacientes tinham AVC devido ao fato de os próprios profissionais de anestesia, cirurgiões e consultores de neurologia, cardiologia e radiologia admitirem que não sabiam dos efeitos gravitacionais e do mecanismo hidráulico da posição vertical ou BCP na perfusão cerebral. Resumindo, a pressão da perfusão cerebral (CPP) ficava no limite ou abaixo dos limiares que garantiam uma perfusão cerebral adequada.
Por vários motivos conhecidos, a pressão sanguínea (BP) quase sempre é reduzida durante as primeiras fases da anestesia geral na BCP e geralmente é revertida de forma segura com bolus de fluido e/ou infusão vasopressora. Quando a anestesia regional no ombro é realizada antes da operação, o estímulo cirúrgico será silenciado ou desaparecerá, eliminando uma via poderosa para compensar a redução da BP durante a cirurgia. Finalmente, muitos cirurgiões exigem/preferem que um grau leve de hipotensão ou até mesmo uma hipotensão intencional seja mantida para reduzir o inchaço do tecido, limitar a hemorragia e melhorar a visualização no campo cirúrgico.6,7 Isso gera pressões arteriais médias (MAP) que podem ser insuficientes para manter um fluxo sanguíneo cerebral (CBF) adequado porque, dependendo do ângulo da BCP e da altura do paciente, a BP no nível do tronco cerebral será aproximadamente 20–40 mmHg menor que a BP medida pelo cuff no braço, que está no nível do coração.
Conforme descrito inicialmente por Enderby et al. em 1954, em relação às craniotomias na posição sentada, para cada polegada na altura vertical da colocação do cuff de BP no braço até o tronco cerebral, usando o canal auditivo externo (EAM), um substituto para o nível do tronco cerebral, é preciso subtrair 2 mmHg da BP (ou 1 mmHg por 1,25 cm) para aproximar a pressão de perfusão cerebral (CPP).8 Em 3 a cada 4 casos relatados, e quanto mais eu analiso, as BPs sistólica e diastólica do cuff costumam ficar em 80s–90s/50s–60s, medidas no nível do braço/coração e às vezes mais baixo. Portanto, as MAPs no tronco cerebral ficariam aproximadamente 20–40 mmHg mais baixas, e no nível do córtex cerebral, mais 6–9 mmHg abaixo disso. Assim, as MAPs no cérebro quase sempre ficariam no ou abaixo do Limite Inferior da Autorregulação (LLA) aceitável definido anteriormente, ou seja, uma MAP de aproximadamente 50 mmHg.9
Na década de 1990, estudos realizados por Drummond9 e outros10 (Tabela 1) analisaram a elevação do LLA para explicar a vasculatura variável mas incompleta no círculo de Willis (encontrado em 40 a 45% dos casos), o fluxo sanguíneo colateral não previsto e as variações na distribuição regional de fluxo sanguíneo e oxigenação cerebral. Desde o final da década de 1990, a faixa do LLA foi ajustada para cima e varia de 70 a 93 mmHg, com um valor médio de 80 ± 8 mmHg.9,10 Recentemente, Brady et al. informou que a MAP com a autorregulação mais robusta durante o bypass cardiopulmonar em adultos, obviamente na posição supina, era de 78 ± 11 mm Hg, enquanto o LLA médio era de 65 ± 12 mm Hg.11
Tabela 1: Limite inferior da autorregulação em estudos com humanos10
| Pesquisadores | LLA médio (mm Hg) |
| Strandgaard S. Br Med J. 1973;1:507–510. | 70 |
| Strandgaard S. Circulation. 1976;53:720-727. | 73 |
| Ohsumi H, et al. Resuscitation. 1985;13:41–45. | 81 |
| Waldemar G, et al. J Hypertens. 1989;7:229-235. | 93 |
| Schmidt JFG, et al. J Cardiovasc Pharmacol. 1990;15:983-988. | 85 |
| Larsen FS, et al. Stroke. 1994;25:1985-1988. | 79 |
| Olsen KS, et al. Br J Anaesth. 1995;75:51-54. | 88 |
| Olsen KS, et al. J Neurosurg Anesth. 1996;8:280-285. | 73 |
| LLA médio para oito estudos de 1973 a 1996 | 80 ± 8 |
LLA = Limite Inferior da Autorregulação
Os profissionais de saúde entenderam completamente os princípios físicos e hidráulicos envolvidos na diferença gravitacional da MAP durante décadas. Quando as craniotomias na posição sentada estavam na moda, a prática comum era zerar o transdutor na altura do EAM se houvesse a monitorização da BP intra-arterial. Se apenas um cuff de BP fosse usado para monitorizar a BP, a correção em relação à altura vertical a partir do cuff do EAM era aplicada. Quando os cirurgiões pararam de realizar craniotomias na posição sentada, parece que esse princípio acabou sendo esquecido ou deixou de ser ensinado aos novos anestesiologistas.
Em 2009, o APSF Symposium on Cerebral Perfusion in the Management of BCP Surgeries (Simpósio da APSF sobre perfusão cerebral no gerenciamento de cirurgias na BCP), organizado por Robert Stoelting, MD, fez com que a maioria dos participantes concordasse que o mecanismo da isquemia global (e eu adicionaria isquemia regional) não tinha sido comprovado, mas como o LLA havia sido ajustado para cima ao longo dos anos, era preciso ser cauteloso ao usar a hipotensão intencional ou permitir que os pacientes ficassem hipotensos até a obtenção de informações melhores.6 É óbvio que essa recomendação deveria ser corrigida para eliminar o uso da hipotensão intencional.
Os anestesiologistas não conseguem saber a adequação da circulação dentro do cérebro porque não existe um monitor clínico de rotina que monitorize o CBF, a pressão da perfusão cerebral (CPP) ou a oxigenação do tecido cerebral durante a anestesia na BCP. Por outro lado, imagine uma pessoa acordada sentada em uma cadeira na posição vertical. Por algum motivo, devido ao medo ou a um evento repentino, a BP da pessoa cai. A primeira reclamação seria tontura, talvez um pouco de náusea ou sensação de desmaio. A primeira reação seria deitar a pessoa na posição supina. Isso garantiria que pelo menos a CPP ficasse igual à BP no coração e costuma ser suficiente para aliviar a dificuldade. Infelizmente, o paciente anestesiado não consegue avisar sobre esses sintomas iniciais enquanto a hipotensão afeta o cérebro, portanto, parece que a anestesia não causou nenhum evento adverso. O anestesiologista é responsável por garantir da melhor forma que a CPP e a oxigenação do cérebro sejam suficientes por meio de métodos indiretos. Durante a anestesia, para garantir a oxigenação, primeiro precisamos saber que a concentração de oxigênio inspirado e o fornecimento de oxigênio pela máquina de anestesia são suficientes. Em seguida, para garantir que o sangue esteja bem oxigenado, usamos o oxímetro de pulso para monitorizar a saturação de oxigênio e, portanto, saber que o sangue que chega ao cérebro está bem saturado. Depois, ao monitorizar o CO2 expirado, podemos manter níveis normais de CO2 para garantir que não ocorra hipocapnia, o que causaria vasoconstrição cerebral. Por último, usamos a BP medida no braço para pressupor que a CPP esteja alta o suficiente para movimentar o sangue bem oxigenado pelo cérebro. Se o paciente estiver na posição supina, essa suposição é confiável.
Nos documentos do Simpósio de 2009, publicados no Boletim da APSF,6 as recomendações das melhores práticas atuais de gerenciamento de BP na BCP incluíam o seguinte: 1) Ajustar a BP na BCP para considerar o gradiente hidrostático; 2) A hipotensão intencional deve ser evitada na BCP; 3) A redução máxima da BP de referência deve ser de no máximo 30% com ajuste conforme o gradiente hidrostático na BCP. Na minha opinião e na opinião de outras pessoas, essa recomendação deve ser alterada. A BP do cuff deve ser igual ou próxima à BP de referência da pessoa acordada quando a cirurgia é feita na BCP para manter o LLA.12,13 Se necessário, a BP deve ser restaurada para a referência ao titular fluidos e vasopressores conforme adequado.10
Foram exigidas pesquisas científicas e, até agora, foram apresentados muitos estudos sobre as maneiras de monitorizar a oxigenação cerebral, o fluxo sanguíneo cerebral regional e a oxigenação do bulbo venoso jugular em relação às mudanças na BP. Em um artigo da APSF de 2013, Shear e Murphy analisaram os estudos disponíveis sobre o impacto da BCP na perfusão cerebral.12 Eles afirmaram que até sabermos mais sobre a oxigenação e a perfusão regional dentro do cérebro, os médicos precisam ficar atentos ao perigo da hipoperfusão cerebral nesse grupo de pacientes. Em 2019, a mesma equipe analisou amplamente esses estudos e vários outros mais recentes.13 No total, 22 estudos usaram várias ferramentas de pesquisa para medir a saturação regional de oxigênio no cérebro, o fluxo sanguíneo cerebral e a oxigenação venosa jugular, e 68 estudos analisaram o manejo e os resultados intraoperatórios. Os autores resumiram que era frequente o desequilíbrio entre o fornecimento e a demanda de oxigênio ou CBF durante a cirurgia na BCP. No entanto, eles não demonstraram claramente uma associação entre essas variáveis de oxigenação cerebral e fluxo sanguíneo regional cerebral. Eles concluíram que na falta de dados gerados no cérebro do paciente, a abordagem mais segura para o gerenciamento da BP no perioperatório é manter as MAPs próximas dos valores de referência ao longo do procedimento, o que é um conselho sábio. Contudo, mesmo esses estudos sobre oxigenação cerebral e CBF regional demonstrando uma relação verdadeira de causa e efeito entre BP baixa e hipoperfusão cerebral ou hipóxia cerebral regional, essas ferramentas de pesquisa ainda não estão disponíveis para a monitorização clínica de rotina. Talvez no futuro vejamos o desenvolvimento de monitores econômicos e não invasivos de CPP, CBF e oxigenação usando equipamentos derivados da oximetria cerebral, espectroscopia no infravermelho próximo, monitores de CBF, EEGs processados ou outras tecnologias novas. Até lá, a CPP deverá ser mantida em níveis mais que seguros conforme o que sabemos atualmente sobre o LLA versus o pouco que sabemos sobre a adequação da perfusão cerebral ao cérebro de cada pessoa durante a anestesia.
Dois estudos grandes sobre a hipotensão intraoperatória (IOH) em pacientes que passam por várias operações evidenciam o risco possível de a BCP reduzir a perfusão cerebral. Monk et al. demonstraram que cerca de 5 minutos de BP abaixo dos limiares para BP sistólica de 70 mmHg, para MAP de 55 mmHg e para BP diastólica de 35 mmHg, com o ajuste adequado ao risco, foram altamente associados à maior mortalidade pós-operatória em 30 dias dentre todas as causas.14 Do mesmo modo, Staplefeldt et al. aprofundou essa observação e descobriu que quando as MAPs reduzem progressivamente de 75 mmHg para 45 mmHg, juntamente com o tempo de exposição à IOH, o aumento da mortalidade pós-operatória em 30 dias também foi bastante significativo.15 Um terceiro estudo por Ahuja et al.16 analisou a lesão no miocárdio e a lesão aguda nos rins em 23.140 pacientes que passaram por cirurgia não cardíaca, sendo que todos tiveram suas BPs intra-arteriais registradas a cada 1 minuto. Quando a BP sistólica ficava abaixo de 90 mm Hg e a BP média reduzia para menos de 65 mm Hg, mantidas por 5 minutos, apareceram associações significativas e clinicamente importantes em relação à lesão no miocárdio e nos rins. Esses três estudos reforçam a preocupação de que o risco de lesão cerebral também poderia ser aumentado durante a operação de pacientes na BCP sem manter BPs de referência no nível do cérebro. Por quê? Porque a MAP no tronco cerebral (30–50 mmHg) e no córtex (20–40 mmHg) é mais baixa e o tempo de exposição a essas BPs muito baixas durante a cirurgia na BCP geralmente é muito maior do que o relatado nesses três estudos.14-16 Portanto, se uma redução das MAPs até 45 mmHg por alguns minutos pode aumentar a mortalidade pós-operatória em 30 dias e 5 minutos de redução das MAPs para menos de 65 mmHg pode aumentar a lesão no miocárdio e nos rins, é plausível se preocupar com o risco de lesão cerebral quando a CPP fica abaixo de 30–50 mmHg, juntamente com uma hipotensão cerebral de uma ou duas horas, como é comum nas cirurgias de ombro. Enquanto isso, o registro anestésico mostrará uma anestesia tranquila e estável, já que as BPs do cuff registradas no nível do braço/coração parecem relativamente normais e não foram ajustadas para a posição vertical e BCP.
É importante ressaltar que a lesão cerebral é rara, bem como vários outros resultados catastróficos de complicações anestésicas. Por exemplo, a hipertermia maligna ou a encefalopatia hipóxica ou o óbito após uma intubação falha são resultados raros, mas as pesquisas continuam analisando profundamente esses e outros assuntos. Conforme Drummond et al., “Não podemos confiar na convicção de que uma parte do cérebro não possa apresentar isquemia a qualquer momento. Não seria um grande consolo para os pacientes ou seus familiares arrasados saber que o fluxo sanguíneo continuou em algumas partes do sistema nervoso enquanto danos incapacitantes aconteciam em outras partes.”17
Saber como a autorregulação afeta o fluxo sanguíneo cerebral é crucial para a prática clínica, pois nos faz reagir cuidadosamente a leves reduções na BP para preservar a perfusão cerebral. Porém, ao saber quando o LLA (70–80 mmHg) está próximo, aumentando o risco de isquemia cerebral conforme o CBF é reduzido juntamente com a piora da hipotensão, é preciso considerar os gradientes hidrostáticos e retornar agressivamente a BP do paciente para a referência no nível do braço/coração. Parafraseando o alerta de Lanier, isso corresponde à nossa função histórica como a última defesa homeostática do paciente vulnerável para evitar a lesão cerebral durante a anestesia e a cirurgia.18
David Cullen, MD, foi presidente do Departamento de Anestesia e Medicina da Dor, St. Elizabeth’s Medical Center (Aposentado), professor de Anestesiologia na Tufts University School of Medicine (Aposentado), ex-professor de Anestesia e Medicina Intensiva, Harvard Medical School no Massachusetts General Hospital (Aposentado), Boston, Massachusetts
O autor não apresenta conflitos de interesse.
Referências
- Eichhorn JH, Cooper JB, Cullen DJ, et al. Standards for patient monitoring during anesthesia at Harvard Medical School. JAMA. 1986; 256:1017–1020.
- Eichhorn JH. Prevention of intraoperative anesthesia accidents and related severe injury through safety monitoring. Anesthesiology. 1989:70;572–577.
- Eichhorn JH, Hassan ZU. Anesthesia perioperative mortality and predictors of adverse outcomes. In: Lobato EB, Gravenstein N, and Kirby RR. (editors) Complications in Anesthesiology. 2007. 3rd ed. Philadelphia, Lippincott, Williams and Wilkins. pp 3–14.
- Eichhorn JH, Cooper JB, Cullen DJ et al. Anesthesia practice standards at Harvard: A review. J. Clin Anesth. 1988.1:55–65.
- Pohl A, Cullen DJ. Cerebral ischemia during shoulder surgery in the upright position: a case series. J Clin Anesth. 2005;17:463–469.
- Lee L, Caplan R. APSF Workshop: Cerebral perfusion experts share views on management of head up cases. APSF Newsletter. 2009;24:45–48. https://www.apsf.org/article/apsf-workshop-cerebral-perfusion-experts-share-views-on-management-of-head-up-cases/ Accessed August 12, 2020.
- Papadonikolakis A, Wiesler ER, Olympio MA, et al. Avoiding catastrophic complications of stroke and death related to shoulder surgery in the sitting position. J. Arthroscopic and Related Surgery. 2008;24:481–482.
- Enderby GEH. Postural ischaemia and blood pressure. Lancet. 1954;Jan 23: 185–187.
- Drummond JC. The lower limit of autoregulation: time to revise our thinking? Anesthesiology. 1997;86:1431–1433.
- Kirby RR, Cullen DJ. Complications of the beach chair position. In: Lobato EB, Gravenstein N, and Kirby RR. (editors) Complications in Anesthesiology. 2007 3rd ed. Philadelphia, Lippincott, Williams and Wilkins. 844–853.
- Brady KM, Hudson A, Hood R, et al. Personalizing the definition of hypotension to protect the brain. Anesthesiology. 2020;132:170–179.
- Shear T, Murphy G. Impact of the beach chair position on cerebral perfusion: what do we know so far? APSF Newsletter. 2013;28:18–20. https://www.apsf.org/article/impact-of-the-beach-chair-position-on-cerebral-perfusion-what-do-we-know-so-far/ Accessed August 12, 2020.
- Murphy G, Greenberg S, Szokol J. Safety of beach chair position shoulder surgery: a review of the current literature. Anesth Analg. 129:101–118.
- Monk TG, Bronsert MB, Henderson WG, et al. Association between intraoperative hypotension and 30 -day postoperative mortality in noncardiac surgery. Anesthesiology. 2015;123:307–319.
- Staplefeldt WH, Yuan H, Dryden DO, et al. The SLUS Score: A novel method for detecting hazardous hypotension in adult patients undergoing noncardiac surgical procedures. Anesth Analg. 2017;124:1135–1152.
- Ahuja S, Mascha EJ, Yang D. et al. Associations of intraoperative radial arterial systolic, diastolic, and pulse pressures with myocardial and acute kidney injury after noncardiac surgery. Anesthesiology. 2020;132:291–306.
- Drummond JC, Hargens AR, Patel TM. Hydrostatic gradient is important: Blood pressure should be corrected. APSF Newsletter. 2009;24:6. https://www.apsf.org/article/hydrostatic-gradient-is-important-blood-pressure-should-be-corrected/ Accessed August 25, 2020.
- Lanier W. Cerebral perfusion: err on the side of caution. APSF Newsletter. 2009 24:1–4. https://www.apsf.org/article/cerebral-perfusion-err-on-the-side-of-caution/ Accessed August 25, 2020.


 Issue PDF
Issue PDF