以沙滩椅位接受手术的麻醉患者,脑部血压可能会降低至低于脑部自动调节能力的水平。这可能会导致脑损伤,但了解脑部自动调节能力对于防止该事件的发生至关重要。当脑部血压降低到大约 70-80 mmHg 以下时,脑供血就会存在风险。及时识别和治疗脑性低血压将消除这些患者脑损伤的可能性。
请在线查阅原文:https://www.apsf.org/article/beach-chair-position-may-decrease-cerebral-perfusion/
 许多因素已降低了麻醉相关并发症的发生率。文化意识的发展和对患者安全的特别重视始于对照护监测标准的接受1,并自 1985 年以来以多种方式进行了演化。1985 年之前的麻醉相关性死亡率约为 1:10,000 个病例。在 JAMA 上公布标准以后(我们强调,其仅适用于哈佛大学附属医院),迫于公众压力,美国麻醉医师协会 (ASA) 在几个月内逐字采用了这些标准。
许多因素已降低了麻醉相关并发症的发生率。文化意识的发展和对患者安全的特别重视始于对照护监测标准的接受1,并自 1985 年以来以多种方式进行了演化。1985 年之前的麻醉相关性死亡率约为 1:10,000 个病例。在 JAMA 上公布标准以后(我们强调,其仅适用于哈佛大学附属医院),迫于公众压力,美国麻醉医师协会 (ASA) 在几个月内逐字采用了这些标准。
新技术的引进,开始使用脉搏血氧饱和度监测仪、接着是二氧化碳监测仪的使用、麻醉机和监测设备的持续改进,以及更安全的药物等,极大地降低了麻醉事故的保险费和与麻醉相关的死亡率 – 数十万名健康的 ASA I 和II 患者中只有一例。2-4
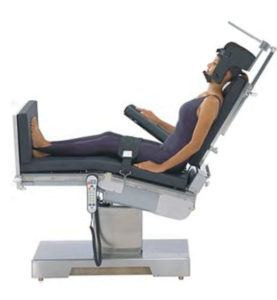
然而,正如我们的原文所展示的,5 新的问题也会不断出现,比如健康患者以躺椅体位 (BCP) 接受肩部手术时出现的脑损伤等。大约在 2000 年,有四个病例进入我们的视线。5 这四名患者的案例中涉及到的医生都不能理解为何会发生“中风”,由于是患者自己入院,所以麻醉专业人员、外科医师和后续的神经病学、心脏病学和放射学顾问都没有意识到直立位或 BCP 对于脑部血液灌注的重力影响和液压机制。简言之,脑部灌注压力 (CPP) 下降至临界限或低于确保充分脑部灌注的阈值水平。
由于许多广为熟知的原因,在以 BCP 体位进行全麻的早期阶段,血压 (BP) 基本上都会下降,通过液体推注和/或输注血管升压药,通常可以安全逆转。当在手术前对肩部成功实施了局部麻醉时,手术刺激将会减弱或消失,从而消除了对抗术中 BP 下降的一种有效方式。最后,许多外科医生要求/偏好维持轻度低血压,甚至是故意的低血压以减少组织肿胀、限制出血,提高术野的可视化。6,7这导致平均动脉压 (MAP) 可能不足以维持足够的脑血流量 (CBF),因为,视 BCP 的角度和患者身高的不同,脑干平面上的 BP 将大约为 20–40 mmHg,低于在心脏水平面的手臂上、通过袖套血压计实际测量的 BP。
正如 Enderby 等在 1954 年首次对坐姿体位颅骨切开术所描述的,对于从手臂上放置 BP 袖套处到脑干部之间垂直高度的每一英寸(使用外耳道 (EAM) 代替脑干水平),必须从近似的脑灌注压 (CPP) 中减去 2 mmHg 的 Bp(或 1 mmHg/1.25 cm)。8在我报告的 3/4 个病例中,我回顾得更多的是,在手臂/心脏水平面上,袖套血压计测量的收缩和舒张 BP 通常在 80s – 90s /50s – 60s 之间,通常更低。因此,在脑干水平面上,MAP 大约降低了 20–40 mmHg, 同时,在大脑皮层水平面上,还要降低 6–9 mmHg。因此,脑中的 MAP 几乎总是等于或低于早期确立的、可接受的自动调整下限水平 (LLA) – 大约 50 mmHg 的 MAP。9
在 20 世纪 90 年代,Drummond9 和其他人10 开展的研究(表 1)对 LLA 进行了向上修正,以容纳韦利斯氏动脉环中可变而不完整的血管丛(在 40–45% 的病例中发现的)、无法预测的旁系血管血流量,以及血流量和脑氧合作用的局部分布变化。自 20 世纪 90 年代后期以来,已对 LLA 的范围进行了向上修正,其波动范围在 70–93 mmHg 之间,均值为 80 ± 8 mmHg。9,10最近,Brady 等报告称,在成人体外循环过程中(以俯卧位明显),最具耐久自动调节作用的 MAP 为 78 ± 11 mm Hg,而平均 LLA 则为 65 ± 12 mm Hg。11
表 1:人体研究中的自我调节下限10
| 研究者 | LLA 均值 (mm Hg) |
| Strandgaard S. Br Med J. 1973;1:507–510. | 19 |
| Strandgaard S. Circulation. 1976;53:720–727. | 73 |
| Ohsumi H, et al. Resuscitation. 1985;13:41–45. | 81 |
| Waldemar G, et al. J Hypertens. 1989;7:229–235. | 93 |
| Schmidt JFG, et al. J Cardiovasc Pharmacol. 1990;15:983–988. | 85 |
| Larsen FS, et al. Stroke. 1994;25:1985–1988. | 79 |
| Olsen KS, et al. Br J Anaesth. 1995;75:51–54. | 88 |
| Olsen KS, et al. J Neurosurg Anesth. 1996;8:280–285. | 73 |
| 1973 – 1996 年间开展的八项研究的平均 LLA | 80 ± 8 |
LLA = 自我调节的下限
当使用直立或坐姿体位时,MAP重力差异中涉及到的物理和液压原理已经被深入研究了几十年。当坐姿体位开颅手术流行时,如果监测动脉内血压,将传感器在 EAM 高度上归零是标准做法。如果仅使用 BP 袖套测量计来监测 BP,则应用袖套与 EAM 之间的垂直高度校正值。当坐姿位开颅术停止实施时,这一原则似乎已经被遗忘或没有被传授给新的麻醉专业人员。
2009 年,在 Robert Stoelting(医学博士)组织的、有关 BCP 管理中脑灌注的 APSF 研讨会上,多数与会者一致同意,眼球缺血(我还要加上局部缺血)的机制还没有被证实,但由于数年来已对 LLA 进行了向上修正,在我们有更好的信息之前,我们应该慎用故意低血压或允许患者出现低血压。6 很明显,这一建议应予以纠正,以排除故意低血压的使用。
由于 BCP 手术麻醉期间没有可以监测 CBF、脑灌注压 (CPP) 或脑组织氧合作用的常规临床监测仪,因此麻醉专业人员无法了解脑内循环的充分性。相比之下,例如想象一个清醒的人笔直地坐在椅子上。不管出于什么原因,由于恐惧或害怕、突发事件等等,他们的 BP 会下降。他们的第一主诉可能是头晕,可能还有一定程度的恶心,或感觉虚脱。第一反应是让患者平躺、仰卧。这至少可以确保,CPP 与心脏水平面的 BP 相同,通常足以减轻痛苦。不幸的是,在出现低血压并影响大脑时,麻醉患者并不能说出这些早些症状,因此麻醉过程看似很顺利。麻醉专业人员有责任使用间接的方法尽可能确保 CPP 和脑氧合作用是充分的。在麻醉过程中,为确保氧合作用,我们首先要知道从麻醉机吸入的氧气浓度和氧气供应是否充足。其次,为确保血液被很好氧合,我们依赖于脉搏氧饱和度监测仪来监测氧饱和度,并因此知道流向大脑的血液是否被很好饱和。再次,通过监测潮气末 CO2,我们可以维持正常的 CO2 浓度水平,以确保不会发生导致大脑血管收缩的低碳酸血症。最后,我们使用在手臂上测量的血压来推断 CPP 足够高,可以让氧合良好的血液通过大脑。如果患者仰卧,则这种假设是可靠的。
在发表于《APSF 新闻通讯》的 2009 研讨会论文集中,6 BCP 手术中 BP 管理的当前最佳实践建议包括以下几个方面:1)调整 BCP 手术中的 BP,以容纳静压梯度;2) 在 BCP 手术中,应避免故意的低血压;3) 通过调整 BCP 手术中的任何静压梯度,与基线 BP 相比的最大降低幅度应不超过 30%。在我和其他人看来,这个建议应该改变。实际的做法应当是,在以 BCP 体位施行手术时,袖套 BP 应维持在等于或非常接近于基线清醒 BP 水平,以保护 LLA。12,13如有必要,应通过滴定液体并在必要时给予血管升压药,使 BP 恢复至基线水平。10
呼吁进行科学研究,目前已经有很多考察 BP 变化相关性脑氧合作用、局部脑血流、颈静脉球氧合作用监测方法的研究。在一篇 2013 年 APSF 文章中,Shear 和 Murphy 综述了已有的、考察 BCP 对脑灌注影响的研究。12 他们写到,在我们知道更多关于脑内氧合作用和局部灌注的知识之前,临床医生应该意识到这类患者脑灌注不足的危险。2019 年,同一个研究团队综述了这些和许多较新的研究。13 三十二项研究使用了多种研究工具来测定局部脑氧饱和度、脑血流量以及颈静脉氧合作用,同时有 68 项研究考察了术中管理和结局。作者总结认为,在 BCP 手术过程中,氧气或 CBF 供应与需求之间经常存在不平衡的情况。不过,尚未明确显示脑氧合作用和局部脑血流量的这些变量之间有相关性。他们得出结论认为,由于缺乏患者大脑中产生的数据,因此,与围术期 BP 管理有关的最安全方法是在整个手术过程中,使 MAP 维持在接近于基线值的水平;(这是一个)明智建议。但是,即便有关脑氧合作用和局部 CBF 的这些研究发现了真实原因,并影响到了低 BP 与脑灌注不足或局部脑低氧症之间的关系,这类研究工具也不能用于常规临床监测。未来我们也许会看到开发出费效比高的、用于分析 CPP、CBF 和使用源自脑氧饱和度监测的设备监测氧合作用、近红外光谱法、CBF 监测仪、经处理的 EEG 或其他新技术。在此之前,CPP 必须维持在额外的安全水平,因为相对于我们目前对 LLA 的了解,我们对麻醉期间每个人大脑的脑灌注充足性了解还很少。
在接受多种手术的患者术中开展的两项术中低血压 (IOH) 大型研究阐明了 BCP 降低脑灌注的潜在风险。Monk 等发现,如执行合适的风险调整,BP 低于收缩压的临界限(收缩压为 70 mmHg,MAP 为 55 mmHg,舒张压为 35 mmHg )持续大约 5 分钟与术后 30 天全因死亡率增高有强相关性。14 同样,Staplefeldt 等进一步考察发现,随着暴露在 IOH 中的时间增加,当 MAP 逐渐从 75 mmHg 降至 45 mmHg 时,术后 30 天全因死亡率增高也很明显。15 Ahuja 等开展的第三项研究16 在接受非心脏手术的 23,140 例患者中(所有患者均有按 1 分钟间隔记录了动脉内 BP 测量结果)考察了心肌和肾脏损伤。当收缩 BP 降低至 90 mm Hg 以下,且平均 BP 低于 65 mm Hg 时,持续 5 分钟,发现心肌和肾脏损伤之间存在显著而有临床意义的相关性。这三项研究加强了人们的担忧,即当患者采用 BCP 体位进行手术,但脑水平面上的 BP 未维持在基线水平时,脑损伤的风险也可能会增加。为什么?由于脑干 (30–50 mmHg) 和皮质 (20–40 mmHg) 水平面上的 MAP 较低,同时,BCP 手术过程中暴露于这些很低 BP 的时间通常远远长于在这 3 项研究中报告的时间。14-16 因此,如果 MAP 降低至接近 45 mmHg 持续数分钟后就可以增加术后 30 天死亡率,MAP 降低至低于 65 mmHg 持续 5 分钟就可以增加心肌和肾脏损伤,当 CPP 降低至低于 30–50 mmHg,再加上一小时或两小时的脑低血压(这在肩部手术中是常见的)时,担心出现脑损伤风险是合理的。同时,麻醉记录将显示麻醉平稳,因为在手臂/心水平面上记录的袖套 BP 相对正常未调整为直立、BCP 体位。
与麻醉并发症引起的许多其他灾难性结果一样,认定的脑损伤结果很罕见。例如,恶性高热或低氧性脑病,或插管失败后的死亡是罕见的结果,但大量的关注和资源已合理而持续地投入到这些问题和其他问题上。正如 Drummond 等提出的,“我们不能从这样一种概念中得到保证,即在任何特定时间,大脑的“某些”部分不是缺血的。对于那些遭受重创的患者或他们的家人来说,如果他们知道神经系统的某些部分仍有血液流动,而其他部分则正在发生致残性损伤,这对他们来说也许是一点微不足道的安慰。”17
在临床实践中,知道自我调节如何影响脑血流量至关重要,因为它使我们对 BP 的轻微下降做出温和反应,以保持脑灌注。但是,通过了解 LLA (70–80 mmHg) 何时接近,从而增加脑缺血的风险(因为 CBF 下降与低血压恶化平行),我们必须考虑静水压梯度,积极使手臂/心水平面上的患者血压恢复到基线水平。借用 Lanier 的警示性警告,这与我们作为易受伤害患者避免在麻醉和手术中出现脑损伤最后一道防线的历史角色是一致的。18
David Cullen(医学博士)是 St. Elizabeth 医学中心麻醉与疼痛医学系的前系主任(已退休)、塔夫斯大学医学院的麻醉学教授(已退休)、哈佛大学医学院马萨诸塞州总医院 (Boston, MA) 的前任麻醉学教授(已退休)
作者没有利益冲突。
参考文献
- Eichhorn JH, Cooper JB, Cullen DJ, et al. Standards for patient monitoring during anesthesia at Harvard Medical School. JAMA. 1986; 256:1017–1020.
- Eichhorn JH. Prevention of intraoperative anesthesia accidents and related severe injury through safety monitoring. Anesthesiology. 1989:70;572–577.
- Eichhorn JH, Hassan ZU. Anesthesia perioperative mortality and predictors of adverse outcomes. In: Lobato EB, Gravenstein N, and Kirby RR. (editors) Complications in Anesthesiology. 2007. 3rd ed. Philadelphia, Lippincott, Williams and Wilkins. pp 3–14.
- Eichhorn JH, Cooper JB, Cullen DJ et al. Anesthesia practice standards at Harvard: A review. J. Clin Anesth. 1988.1:55–65.
- Pohl A, Cullen DJ. Cerebral ischemia during shoulder surgery in the upright position: a case series. J Clin Anesth. 2005;17:463–469.
- Lee L, Caplan R. APSF Workshop: Cerebral perfusion experts share views on management of head up cases. APSF Newsletter. 2009;24:45–48. https://www.apsf.org/article/apsf-workshop-cerebral-perfusion-experts-share-views-on-management-of-head-up-cases/ Accessed August 12, 2020.
- Papadonikolakis A, Wiesler ER, Olympio MA, et al. Avoiding catastrophic complications of stroke and death related to shoulder surgery in the sitting position. J. Arthroscopic and Related Surgery. 2008;24:481–482.
- Enderby GEH. Postural ischaemia and blood pressure. Lancet. 1954;Jan 23: 185–187.
- Drummond JC. The lower limit of autoregulation: time to revise our thinking? Anesthesiology. 1997;86:1431–1433.
- Kirby RR, Cullen DJ. Complications of the beach chair position. In: Lobato EB, Gravenstein N, and Kirby RR. (editors) Complications in Anesthesiology. 2007 3rd ed. Philadelphia, Lippincott, Williams and Wilkins. 844–853.
- Brady KM, Hudson A, Hood R, et al. Personalizing the definition of hypotension to protect the brain. Anesthesiology. 2020;132:170–179.
- Shear T, Murphy G. Impact of the beach chair position on cerebral perfusion: what do we know so far? APSF Newsletter. 2013;28:18–20. https://www.apsf.org/article/impact-of-the-beach-chair-position-on-cerebral-perfusion-what-do-we-know-so-far/ Accessed August 12, 2020.
- Murphy G, Greenberg S, Szokol J. Safety of beach chair position shoulder surgery: a review of the current literature. Anesth Analg. 129:101–118.
- Monk TG, Bronsert MB, Henderson WG, et al. Association between intraoperative hypotension and 30 -day postoperative mortality in noncardiac surgery. Anesthesiology. 2015;123:307–319.
- Staplefeldt WH, Yuan H, Dryden DO, et al. The SLUS Score: A novel method for detecting hazardous hypotension in adult patients undergoing noncardiac surgical procedures. Anesth Analg. 2017;124:1135–1152.
- Ahuja S, Mascha EJ, Yang D. et al. Associations of intraoperative radial arterial systolic, diastolic, and pulse pressures with myocardial and acute kidney injury after noncardiac surgery. Anesthesiology. 2020;132:291–306.
- Drummond JC, Hargens AR, Patel TM. Hydrostatic gradient is important: Blood pressure should be corrected. APSF Newsletter. 2009;24:6. https://www.apsf.org/article/hydrostatic-gradient-is-important-blood-pressure-should-be-corrected/ Accessed August 25, 2020.
- Lanier W. Cerebral perfusion: err on the side of caution. APSF Newsletter. 2009 24:1–4. https://www.apsf.org/article/cerebral-perfusion-err-on-the-side-of-caution/ Accessed August 25, 2020.


 Issue PDF
Issue PDF