ビーチチェア位での手術のために麻酔中の患者では、脳内の血圧が自動調節の下限を下回る可能性があり、脳損傷をきたしうる。これを防ぐには、脳の自動調節の理解が不可欠である。脳内の平均血圧が約70〜80 mmHgを下回ると、脳血流が危険にさらされる。脳低血圧の迅速な認識と治療は、ビーチチェア位での手術患者の脳損傷の可能性を低減するはずである。
元の記事はオンラインで参照可能:https://www.apsf.org/article/beach-chair-position-may-decrease-cerebral-perfusion/
 多くの要因により、麻酔関連合併症の発生率は低下している。文化的な認識と患者安全の重視が発達したのは、1985年に麻酔管理のモニタリング標準が広く受け入れられたことに始まり、1 それ以降も多くの方法で進化してきた。1985年以前の麻酔関連死亡率は約10,000例に1例だった。JAMAでモニタリング標準を発表した際には、ハーバード関連病院でのみ適用可能であることを我々は強調したのだが、その後、世論の圧力により、米国麻酔科学会(ASA)は数か月しないうちにこの標準をそのままの形で採用した。
多くの要因により、麻酔関連合併症の発生率は低下している。文化的な認識と患者安全の重視が発達したのは、1985年に麻酔管理のモニタリング標準が広く受け入れられたことに始まり、1 それ以降も多くの方法で進化してきた。1985年以前の麻酔関連死亡率は約10,000例に1例だった。JAMAでモニタリング標準を発表した際には、ハーバード関連病院でのみ適用可能であることを我々は強調したのだが、その後、世論の圧力により、米国麻酔科学会(ASA)は数か月しないうちにこの標準をそのままの形で採用した。
パルスオキシメトリから始まりカプノグラフィが続いた新技術の導入、麻酔器とモニターの継続的な改良、より安全な薬剤などによって、麻酔過誤保険料と麻酔関連死亡率は健常なASA IおよびIIの患者で数十万例に1例にまで劇的に減少したのである。2-4
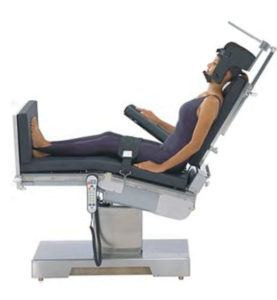
しかしながら、我々の原著論文で例示されているように、5 ビーチチェア位での肩の手術を受けた健常患者の脳損傷といった、新しい問題は常に発生する。2000年頃に気になる4症例があった。5 これら4人の患者の診療に直接関与した医師は誰も、その「脳卒中」が発生した理由が理解できなかった。それは自分たちでも認めているように、麻酔専門職たち、外科医たち、そしてその後に診察した神経科、循環器科、放射線科の指導医たちも、脳灌流に対する直立位あるいはビーチチェア位の重力効果と水力学的メカニズムに気づいていなかったからである。要するに、脳灌流圧(cerebral perfusion pressure, CPP)が、適切な脳灌流を担保する境界レベル以下に落ちていたのである。
よく知られている多くの理由により、ビーチチェア位での全身麻酔の初期段階には大概いつも血圧が低下して、通常は輸液負荷や昇圧薬投与で安全に回復する。もし手術前に肩への区域麻酔が実施される場合は、外科的刺激が弱まるかあるいはなくなるため、術中の血圧低下に拮抗する強力な因子が排除されることになる。さらに、組織の浮腫を軽減して、出血量を抑えて、術野の視界を改善させる目的で、意図的な低血圧を維持することを求めるあるいは好む外科医も多い。6,7 これにより、適切な脳血流(cerebral blood flow, CBF)を維持するのには不十分な平均動脈圧(mean arterial pressure, MAP)となりうる。なぜなら、ビーチチェア位の角度と患者の身長に応じて、脳幹の高さでの血圧は、心臓の高さにある腕のカフで実際に測定した血圧よりも約20〜40mmHg低くなるからである。
1954年にEnderbyらが座位の開頭術に関して最初に記述したように、CPPを概算するためには、脳幹の高さの代わりに外耳道の高さを利用して、腕の血圧カフから脳幹までの垂直方向の高さ1インチあたり2mmHg(または1.25cmあたり1mmHg)の血圧を差し引く必要がある。8 私が報告した4症例中の3症例、および私がレビューしたさらに多くの症例では、カフの血圧は通常、腕/心臓の高さでの測定で収縮期80~90mmHg台/拡張期50~60mmHg台であり、それより低いこともしばしばあった。脳幹のMAPは約20〜40 mmHg低く、大脳皮質の高さではさらに6〜9mmHg低いということになる。したがって、脳内のMAPはほとんど常に、許容可能な自動調節の下限(Lower Limit of Autoregulation, LLA)として初期に考えられていた約50mmHg以下になっていただろう。9
1990年代には、Drummond9 ならびに他の研究者たち10 による研究(表1)により、個体差があって完全な血管系が形成されない大脳動脈輪(40〜45%の症例にみられる)、予測していなかった側副血流、血流と脳酸素化の局所分布の個体差を考慮して、LLAは上方修正された。1990年代後半以降の上方修正されたLLAの範囲は、70~93 mmHgと幅があるが、平均値は80 ± 8 mmHgである。9,10 最近では、Bradyらが人工心肺中の仰臥位の成人患者で、最も強力な自動調節が行われるMAPが78 ± 11 mmHgで、平均LLAは65 ± 12 mmHgだったと報告している。11
表 1:ヒト研究での自動調節の下限(LLA)10
| 研究者 | LLAの平均(mmHg) |
| Strandgaard S. Br Med J. 1973;1:507–510. | 70 |
| Strandgaard S. Circulation. 1976;53:720–727. | 73 |
| Ohsumi H, et al. Resuscitation. 1985;13:41–45. | 81 |
| Waldemar G, et al. J Hypertens. 1989;7:229–235. | 93 |
| Schmidt JFG, et al. J Cardiovasc Pharmacol. 1990;15:983–988. | 85 |
| Larsen FS, et al. Stroke. 1994;25:1985–1988. | 79 |
| Olsen KS, et al. Br J Anaesth. 1995;75:51–54. | 88 |
| Olsen KS, et al. J Neurosurg Anesth. 1996;8:280–285. | 73 |
| 1973~1996年の8つの研究の平均LLA | 80 ± 8 |
LLA =自動調整の下限
直立位または座位の際のMAPについて、重力の違いに関係する物理学的および水力学的原理は、何十年にもわたってよく理解されていた。座位での開頭術が流行していた当時、観血的動脈圧をモニタリングする場合は、外耳道の高さでトランスデューサーをゼロ校正するのが標準的な方法だった。血圧のモニタリングに血圧カフのみを使用する場合は、カフから外耳道までの垂直方向の高さで補正をしていた。座位での開頭術が行われなくなって以降、この原則は忘れ去られたか、あるいは新しい麻酔専門職たちには教えられなくなったようだ。
2009年に、ビーチチェア位での手術の管理における脳灌流に関するAPSFシンポジウムをRobert Stoeltingが主催した。そこでは、全脳虚血(私としてはここに局所的な虚血も追加したい)の機序が証明されていないことと、LLAが何年にもわたって上方修正されてきたので、意図的な低血圧を利用したり、患者の血圧が低いのを許可したりする場合には、より詳しいことが分かるまでは慎重すぎるくらい慎重に行う必要があると、ほとんどの登壇者が賛同した。6 意図的な低血圧の利用をやめさせるためには、明らかにこの推奨事項を改訂する必要があるだろう。
ビーチチェア位での麻酔中のCBF、CPP、脳組織の酸素化をモニタリングできる日常的な臨床モニターは存在しないため、麻酔専門職は脳内の循環が適切かどうかを知ることはできない。では対照的に、例えば起きている人が椅子に直立して座っているところを想像してみる。恐怖や突然の出来事など、何らかの理由で、その人の血圧が低下したとする。最初の症状はおそらく、立ちくらみ、あるいは嘔気、または気が遠くなる感じだろう。そしてそれに対する最初の対応は、その人を仰向けに寝かせることだろう。これにより、少なくとも、CPPが心臓での血圧と同じになり、通常はこれで症状は十分に軽快する。しかし残念ながら、麻酔中の患者は低血圧が進行して脳に影響を与えるようになっても、これらの初期症状を訴えることができないので、麻酔は問題なく進行しているように見えてしまう。そこで間接的な方法を用いて、CPPと脳の酸素化が十分であることを可能な限り確実にすることは、麻酔専門職の責務である。麻酔中の酸素化を保証するためには、まず、吸入酸素濃度と麻酔器からの酸素供給が十分であることを確認する。次に、血液が十分に酸素化されていることを確認するために、パルスオキシメータを使用して酸素飽和度をモニタリングする。これにより、脳に送られる血液が十分に酸素飽和していることがわかる。さらに、呼気終末の二酸化炭素をモニタリングすることにより、二酸化炭素の正常レベルを維持できる。脳血管収縮を引き起こす低炭酸症が起きていないことをこれで確認する。最後に、腕で測定した血圧を利用して、CPPが十分高くて酸素化された血液が脳内に送られていることを推測する。患者が仰臥位であれば、この仮定は信頼できるのである。
APSFニュースレター6 に掲載された2009年のシンポジウムの議事録では、ビーチチェア位での血圧管理に関する現時点での最良推奨事項として以下のことが挙げられている:1) 静水圧平衡を考慮してビーチチェア位での血圧を調整する。2)ビーチチェア位では意図的な低血圧は利用しないようにすべき。3) ビーチチェア位での静水圧平衡をどのように調整した場合も血圧はベースラインから最大でも30%を超えて低下しないようにする。私を含め、この推奨事項を変更する必要があると考えている者もいる。具体的には、ビーチチェア位での手術時には(訳注:CPPが)LLAを下回らないように、カフで測定する血圧を覚醒時のベースライン血圧と同等に維持する必要があると考えている。12,13 必要なら輸液と昇圧剤を滴定して、血圧をベースラインに戻すべきである。10
この問題に関する科学的研究が求められており、血圧変動と関連した、脳の酸素化、局所的な脳血流、内頚静脈球部血の酸素化をモニタリングする方法を検討した研究がこれまでに多く発表されている。2013年のAPSF記事で、ShearとMurphyは、脳灌流に対するビーチチェア位の影響に関して当時入手できた研究をレビューした。12 その中で彼らは、脳内の酸素化と局所灌流についてもっと明らかになるまでは、臨床医はビーチチェア位の際の脳低灌流の危険性を認識し続ける必要があると記している。2019年には同じチームが、これらの研究に多くの新しい研究を加えて広範囲にレビューした。13 22の研究で、さまざまな研究ツールを利用して局所的な脳酸素飽和度、脳血流、内頚静脈酸素化が測定されていた。68の研究で、術中管理とアウトカムの関連が検討されていた。彼らは、ビーチチェア位での手術中にしばしば酸素またはCBFの需要と供給の不均衡がみられたと要約している。ただし、脳酸素化と局所脳血流というこれら変数の関係は明確には示されていない。さらに彼らは、その患者の脳内から得られたデータがない場合には、周術期の血圧管理の最も安全なアプローチは、手術中を通じてMAPをベースラインと同等に維持することであると結論付けている。これは賢明なアドバイスである。ただ、脳酸素化と局所脳血流に関するこのような研究が、低血圧と脳低灌流または局所脳低酸素症との真の因果関係を示したとしても、そのような研究ツールはまだ日常的な臨床モニターに利用できるわけではない。おそらく将来的には、脳酸素濃度計、近赤外分光法、CBFのモニター、処理を加えた脳波図、またはその他の新しいテクノロジーから派生した機器を使用して、費用対効果が高くて非侵襲的なCPP、CBF、酸素化のモニターが開発されることだろう。LLAについて現在までにわかっていることと、麻酔中の患者ひとりひとりの脳灌流の適切性についてはほとんどわかっていないこととを考慮すると、それまではCPPを十分に安全なレベルで維持する必要がある。
多様な手術を受けた患者の術中低血圧に関する2つの大規模研究では、脳灌流を減少させるビーチチェア位の潜在的なリスクが大局的に捉えられている。Monkらは、適切なリスク調整を行ったうえで、収縮期血圧70 mmHg、MAP 55 mmHg、拡張期血圧35 mmHgの閾値を約5分間下回ると、あらゆる原因による術後30日死亡率の増加と強く関連することを示した。14 この観察結果を拡張したStaplefeldtらは、MAPが75mmHgから45mmHgへ低下していくことと、術中低血圧への曝露時間との組み合わせが、あらゆる原因による術後30日死亡率を顕著に増加させることを発見した。15 Ahujaらによる3番目の研究では、16 非心臓手術を受けた23,140人の患者の心筋障害および急性腎障害が検査された。この研究では、すべての患者で1分間隔の観血的動脈圧測定値が記録されているが、収縮期血圧が90mm Hg未満でMAPが65 mm Hg未満が5分間継続した場合、心筋障害および腎障害との有意で臨床的に意味のある関連が示された。これら3つの研究は、ビーチチェア位での手術の際に脳の高さでのベースライン血圧を維持しなかった場合にもまた、脳損傷のリスクが高まる可能性がある、という懸念を裏付けるものである。なぜだろうか。なぜならば、MAPは脳幹(30〜50 mmHg)と皮質(20〜40 mmHg)ではより低く、ビーチチェア位での手術中にこのような高度低血圧へ曝露する時間は、3つの研究で報告された時間よりも通常はるかに長いためである。14-16 したがって、MAPが45 mmHgに向かって数分間低下すると術後30日死亡率が増加し、MAPが5分間65 mmHg未満に低下すると心筋や腎臓の損傷が増加する可能性があるならば、肩の手術中によくみられるように、CPPが30〜50 mmHgを下回り、脳低血圧が1~2時間持続した場合に、脳損傷のリスクを心配するのは理にかなっている。その一方で、麻酔記録は滑らかで安定した麻酔経過を示す。記録されているカフの血圧は腕/心臓の高さで測定されたものであり、直立したビーチチェア位のために調整されているわけではないから、比較的正常に見えるのである。
脳損傷をきたすことは、麻酔に起因する多くの他の悲惨な合併症と同様まれなことである。しかし、例えば悪性高熱症、低酸素脳症、挿管失敗後の死亡が発生するのもまれなことだが、このような合併症に多大な注意と資源がこれまでもこれからも注がれることは当然のことである。Drummondらが述べているように、「脳の『ある一部は」いかなるときも虚血に陥っていない、という考え方からは、保証を得ることはできない。体が不自由になるような脳の損傷が他の部分で進行している間も、脳神経系のある一部には血流が供給され続けていたということを知ったところで、障害を受けた患者やその家族にとってなんの慰めにもならないだろう。」17
自動調節は血圧の軽度低下に対して脳灌流を維持すべく穏やかには反応するので、自動調節が脳血流にどう影響するかを知っておくことは臨床診療で重要なことである。しかし、血圧がいつLLA(70〜80 mmHg)に近づいて、CBFが低血圧の悪化と並行して低下するようになり、脳虚血のリスクが高まるかということを知っておくことにより、静水圧平衡を考慮して、患者の血圧を腕/心臓の高さでのベースラインに積極的に戻しにいかなければならない。これは、Lanierの警告を引用するなら、麻酔中や手術中の脳損傷を回避するために脆弱な患者にとっての最後の恒常性の番人として我々がこれまでも担ってきた役割と一致するものである。18
David Cullenは、セントエリザベスメディカルセンターの麻酔・疼痛医学科の元科長(退職)、タフツ大学医学部の麻酔科教授(退職)、マサチューセッツ州ボストンのハーバード大学医学部・マサチューセッツ総合病院の麻酔・集中治療科の元教授(退職)である。
著者に、この記事に関する利益相反はない。
参考文献
- Eichhorn JH, Cooper JB, Cullen DJ, et al. Standards for patient monitoring during anesthesia at Harvard Medical School. JAMA. 1986; 256:1017–1020.
- Eichhorn JH. Prevention of intraoperative anesthesia accidents and related severe injury through safety monitoring. Anesthesiology. 1989:70;572–577.
- Eichhorn JH, Hassan ZU. Anesthesia perioperative mortality and predictors of adverse outcomes. In: Lobato EB, Gravenstein N, and Kirby RR. (editors) Complications in Anesthesiology. 2007. 3rd ed. Philadelphia, Lippincott, Williams and Wilkins. pp 3–14.
- Eichhorn JH, Cooper JB, Cullen DJ et al. Anesthesia practice standards at Harvard: A review. J. Clin Anesth. 1988.1:55–65.
- Pohl A, Cullen DJ. Cerebral ischemia during shoulder surgery in the upright position: a case series. J Clin Anesth. 2005;17:463–469.
- Lee L, Caplan R. APSF Workshop: Cerebral perfusion experts share views on management of head up cases. APSF Newsletter. 2009;24:45–48. https://www.apsf.org/article/apsf-workshop-cerebral-perfusion-experts-share-views-on-management-of-head-up-cases/ Accessed August 12, 2020.
- Papadonikolakis A, Wiesler ER, Olympio MA, et al. Avoiding catastrophic complications of stroke and death related to shoulder surgery in the sitting position. J. Arthroscopic and Related Surgery. 2008;24:481–482.
- Enderby GEH. Postural ischaemia and blood pressure. Lancet. 1954;Jan 23: 185–187.
- Drummond JC. The lower limit of autoregulation: time to revise our thinking? Anesthesiology. 1997;86:1431–1433.
- Kirby RR, Cullen DJ. Complications of the beach chair position. In: Lobato EB, Gravenstein N, and Kirby RR. (editors) Complications in Anesthesiology. 2007 3rd ed. Philadelphia, Lippincott, Williams and Wilkins. 844–853.
- Brady KM, Hudson A, Hood R, et al. Personalizing the definition of hypotension to protect the brain. Anesthesiology. 2020;132:170–179.
- Shear T, Murphy G. Impact of the beach chair position on cerebral perfusion: what do we know so far? APSF Newsletter. 2013;28:18–20. https://www.apsf.org/article/impact-of-the-beach-chair-position-on-cerebral-perfusion-what-do-we-know-so-far/ Accessed August 12, 2020.
- Murphy G, Greenberg S, Szokol J. Safety of beach chair position shoulder surgery: a review of the current literature. Anesth Analg. 129:101–118.
- Monk TG, Bronsert MB, Henderson WG, et al. Association between intraoperative hypotension and 30 -day postoperative mortality in noncardiac surgery. Anesthesiology. 2015;123:307–319.
- Staplefeldt WH, Yuan H, Dryden DO, et al. The SLUS Score: A novel method for detecting hazardous hypotension in adult patients undergoing noncardiac surgical procedures. Anesth Analg. 2017;124:1135–1152.
- Ahuja S, Mascha EJ, Yang D. et al. Associations of intraoperative radial arterial systolic, diastolic, and pulse pressures with myocardial and acute kidney injury after noncardiac surgery. Anesthesiology. 2020;132:291–306.
- Drummond JC, Hargens AR, Patel TM. Hydrostatic gradient is important: Blood pressure should be corrected. APSF Newsletter. 2009;24:6. https://www.apsf.org/article/hydrostatic-gradient-is-important-blood-pressure-should-be-corrected/ Accessed August 25, 2020.
- Lanier W. Cerebral perfusion: err on the side of caution. APSF Newsletter. 2009 24:1–4. https://www.apsf.org/article/cerebral-perfusion-err-on-the-side-of-caution/ Accessed August 25, 2020.


 Issue PDF
Issue PDF