INTRODUÇÃO
A mpox, popularmente conhecida como varíola dos macacos, é uma preocupação mundial de saúde.1 Embora detectada pela primeira vez em seres humanos em 1970 na República do Congo, sua propagação para países não endêmicos em 2022 levou a Organização Mundial da Saúde (OMS) a estabelecer medidas de emergência para diminuir o desenvolvimento de uma pandemia. Em 7 de novembro de 2022, a OMS relatou 78.474 casos confirmados e 3.685 casos prováveis em mais de 109 países. Os Estados Unidos são o país mais afetado, com 28.651 casos notificados.2 A nomenclatura preferencial da infecção foi mudada para mpox pela OMS em novembro de 2022. Os profissionais de saúde provavelmente encontrarão casos confirmados e/ou suspeitos de mpox na área perioperatória.
Como líderes em segurança do paciente, os profissionais de anestesia têm a oportunidade de aproveitar as evidências atuais e criar sistemas de cuidados para melhorar a segurança perioperatória dos pacientes através da prevenção de infecções. Nesta breve revisão, fornecemos uma estrutura objetiva para o cuidado perioperatório do paciente infectado pelo vírus da mpox com base em princípios e medidas de prevenção e controle de infecções. Concentramo-nos em considerações objetivas baseadas na literatura atual, em declarações de sociedades profissionais e nos conhecimentos atuais sobre a gestão do controle de infecções de vírus envelopados no ambiente perioperatório.
A mpox é transmitida por um vírus envelopado com DNA de cadeia dupla, membro da família Poxviridae e pertencente ao gênero Orthopoxvirus.3 Dois subtipos virais distintos incluem as cepas da Bacia do Congo e da África Ocidental. Enquanto o subtipo da África Ocidental é a cepa dominante em todo o mundo,4,5 com uma taxa de mortalidade estimada em 1%,6 a cepa da Bacia do Congo, menos dominante, é relatada como sendo de transmissão mais fácil entre humanos e está associada a uma taxa de mortalidade de até 10%.7 As complicações da mpox podem incluir infecções secundárias, broncopneumonia, sepse, encefalite e infecção da córnea com consequente perda de visão. A transmissão nosocomial é rara, mas há relatos ocorridos por contato direto com a pele afetada ou superfícies do ambiente e/ou via gotículas respiratórias. Esses meios de transmissão proporcionam certa urgência para que os anestesiologistas estejam preparados para a prevenção de infecções no ambiente de trabalho anestésico.
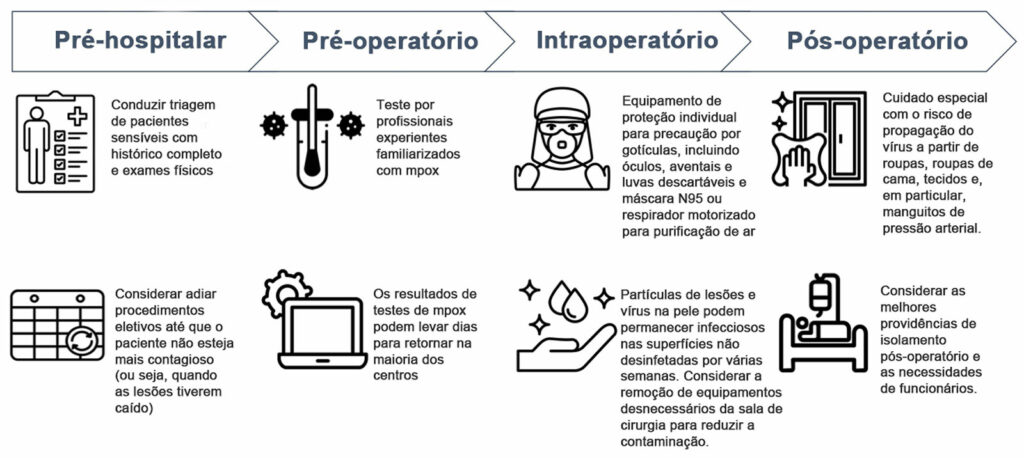
A OMS emitiu diretrizes de manejo clínico e prevenção e controle de infecção para mpox em junho de 2022.8 As recomendações gerais incluíram precauções de contato e de gotículas para qualquer paciente confirmado, assim como o uso de respiradores e precauções de transmissão respiratória para procedimentos geradores de aerossóis. A American Society of Anesthesiologists e a Anesthesia Patient Safety Foundation forneceram uma declaração conjunta de apoio e recomendações em 31 de agosto de 2022.9 Com base nessas diretrizes, foi desenvolvida uma estrutura objetiva para a preparação e o cuidado ideal dos pacientes com mpox específica para o ambiente de trabalho anestésico (Figura 1). Considerações importantes incluem a triagem e os testes pré-operatórios, considerações sobre a tomada de decisões para prosseguir ou atrasar cirurgias eletivas, além de medidas de controle de infecções intra e pós-operatórias.
CONSIDERAÇÕES SOBRE TRIAGEM E CIRURGIAS ELETIVAS
O ideal é que pacientes adultos e pediátricos com mpox, ou expostos à mpox, sejam identificados no pré-operatório. De modo geral, as pessoas são consideradas expostas após contato direto com as lesões cutâneas ou fluidos corporais de um indivíduo infectado ou contato indireto através de objetos que entram em contato com lesões cutâneas ou fluidos corporais (por exemplo, roupas de cama). Os indivíduos infectados podem relatar uma variedade de sintomas constitucionais, incluindo febre, mal-estar, fraqueza, linfadenopatia,10,11 além de erupção cutânea que pode levar quatro semanas para ser resolvida, embora alguns possam apresentar sintomas mínimos ou nenhum sintoma. A mpox é acompanhada de lesões cutâneas que podem ser generalizadas ou limitadas. As lesões, muitas vezes descritas como dolorosas, frequentemente ocorrem nas áreas genitais ou anorretais, o que pode tornar a triagem potencialmente desafiadora. Assim, os pacientes que relatam ter sido expostos ou diagnosticados com mpox devem ter cirurgias eletivas adiadas até que não haja preocupação de transmissão9 (Figura 2).

Figura 2: Considerações sobre o cronograma de procedimentos para pacientes expostos ou diagnosticados com mpox.
O objetivo do adiamento de cirurgias eletivas é reduzir o risco de transmissão de mpox. Definir a duração do período infeccioso da mpox pode ser desafiador. O período de incubação variável e as várias semanas para resolução da erupção cutânea dificultam essa estimativa. Isso inclui atrasar um procedimento eletivo por pelo menos 21 dias após a exposição, dado que o período de incubação relatado varia de 4 a 21 dias,12 ou, no caso de erupção cutânea, por até 4 semanas. O paciente com erupção associada à mpox não é mais considerado infeccioso quando as lesões caem e são substituídas por pele nova. É razoável que os pacientes com lesões ativas e erupções cutâneas consistentes com a mpox não sejam submetidos a cirurgias eletivas.
É importante ressaltar que, se surgir uma preocupação com a mpox durante o exame pré-operatório, o mesmo deverá ser interrompido e o equipamento de proteção individual (EPI) apropriado deverá ser usado. Os profissionais de saúde devem ter cuidado para não associar estigmas sociais a infecções por mpox. Queixas de dor retal ou genital inexplicável e/ou pústulas ou feridas periorais devem levar à avaliação de exposição à mpox ou fatores de risco relacionados (Tabela 1). A integração de ferramentas de triagem em sistemas de registros de saúde eletrônicos pode facilitar a triagem perioperatória e a comunicação dos riscos do paciente.13,14
Tabela 1: Perguntas clínicas para auxiliar na orientação da triagem e na tomada de decisões perioperatórias com pacientes suspeitos de mpox.
| Perguntas clínicas perioperatórias: |
|
TESTE DE MPOX
Informações sobre as recomendações atuais estão disponíveis no site dos Centers for Disease Control and Prevention (https://www.cdc.gov/poxvirus/mpox/clinicians/index.html). Atualmente, não se recomenda fazer testes de rotina para mpox. A mpox pode ser detectada através de ensaios de reação em cadeia da polimerase a partir de amostras de DNA das lesões. O teste sanguíneo não é recomendado, pois o vírus da mpox permanece no sangue apenas por um curto período de tempo. Os resultados dos testes de mpox podem demorar dias para serem retornados. Se surgir uma preocupação com a mpox no intraoperatório, recomendamos consultar o mais rapidamente possível o responsável local pelo controle de infecções ou o especialista em doenças infecciosas para discutir como evitar novas exposições e informar os profissionais de saúde que possam ter sido expostos ao vírus. A vacina pós-exposição para profilaxia está disponível e requer utilização em até quatro dias após a exposição para otimizar a prevenção da doença. A vacinação entre 4 e 14 dias após a data de exposição pode ser considerada, mas é menos eficaz.15
CONSIDERAÇÕES NA SALA DE CIRURGIA
O vírus da mpox se propaga principalmente a partir de lesões e pode permanecer infeccioso em superfícies por longos períodos sem desinfecção. Por exemplo, um estudo detectou vírus viável de mpox em uma superfície no porão de uma casa 15 dias depois que o indivíduo infectado deixou o local.16 Há um risco de propagação do vírus quando roupas, roupas de cama ou outros tecidos são movimentados. Deve-se ter cuidado ao manusear tecidos que tenham estado em contato com o paciente. O vírus da mpox foi isolado em amostras obtidas do ar durante a troca da roupa de cama. Outras precauções incluem monitores, como o manguito de pressão arterial. Por exemplo, deve-se ter cuidado para evitar a remoção frequente e rápida do manguito de pressão arterial, pois o processo de remoção pode espalhar o vírus. Todo tecido que tenha entrado em contato com o paciente deve ser descartado em sacos de lixo selados para evitar a aerossolização de partículas virais.
Os pacientes devem ser submetidos a cuidados em salas de pressão negativa para procedimentos com geração de aerossóis. Os profissionais de saúde devem usar EPI para precaução por gotículas ao cuidar de pacientes com mpox. Recomenda-se máscara N95 ou respirador motorizado para purificação de ar (PAPR). É necessário usar óculos de proteção, assim como avental e luvas de proteção descartáveis. Equipamentos desnecessários devem ser removidos da sala de cirurgia, o tráfego na sala deve ser limitado e deve-se evitar múltiplos anestésicos na mesma sala de cirurgia. Devem ser seguidas medidas de controle de infecção baseadas em evidências para a área de trabalho de anestesia, incluindo a higiene frequente das mãos e a limpeza ambiental pós-indução.17,18
A mpox é transmitida por um vírus envelopado que é efetivamente inativado pelo uso de desinfetantes registrados pela Agência de Proteção Ambiental (EPA, na sigla em inglês) dos Estados Unidos. Exemplos de desinfetantes registrados na EPA que podem ser usados para o vírus da mpox incluem soluções de limpeza que têm como ingrediente ativo álcool isopropílico, quaternário de amônio ou álcool etílico. Uma lista abrangente de produtos recomendados para desinfecção pode ser encontrada no site da EPA (https://www.epa.gov/pesticide-registration/disinfectants-emerging-viral-pathogens-evps-list-q).19
PÓS-OPERATÓRIO
Uma consideração importante no período pós-operatório é tentar minimizar o transporte e a movimentação de pacientes infectados e profissionais de saúde expostos no sistema de saúde. A liberação rápida da sala de cirurgia deve ser considerada quando aplicável. As emergências que podem levar pacientes com mpox ativa a serem submetidos a cirurgias muitas vezes requerem hospitalização pós-operatória ou cuidados intensivos. Será necessário usar EPI completo e isolamento no atendimento a esses pacientes, tanto para transporte como e para recuperação. Os profissionais de saúde que forem expostos sem proteção a pacientes com mpox podem precisar ficar em isolamento por até três semanas, e aqueles que desenvolvem lesões devem se isolar até que não sejam mais infecciosos.9
CONCLUSÃO
Os pacientes diagnosticados com mpox e/ou exposição ao vírus apresentam considerações perioperatórias únicas. Os profissionais da equipe de anestesia podem utilizar conhecimento e abordagens objetivas atuais para prevenção e controle de infecções a fim de otimizar a segurança perioperatória do paciente e do profissional.
Jonathan Tan, MD, MPH, MBI, FASA, é professor assistente de Anestesiologia e Ciências Espaciais, Children’s Hospital Los Angeles; Keck School of Medicine e Spatial Sciences Institute University of Southern California, Los Angeles, CA.
Randy Loftus, MD, é professor associado de anestesiologia na University of Iowa, Iowa City, IA.
Sara McMannus, RN, BSN, MBA, é consultora clínica, Sepsis Alliance, San Diego, CA.
Desiree Chappell, CRNA, é vice-presidente de Qualidade Clínica, NorthStar Anesthesia, Irving, TX.
Melanie Hollidge, MD, PhD, é professora associada de anestesiologia na University of Rochester, Rochester, NY.
Michelle Beam, DO, MBA, FASA, é anestesiologista clínica na Penn Medicine, West Chester, PA.
Morgan Hellman, RN, BSN, Pall Corporation, Port Washington, NY.
Raquel Bartz, MD, MMCi, é professora associada de anestesiologia no Brigham and Women’s Hospital, Boston, MA.
Richard A. Beers, MD, é professor de anestesiologia na Upstate Medical University, Syracuse, NY.
Jonathan E. Charnin, MD, FASA, é professor assistente de anestesiologia na Mayo Clinic, Rochester, MN.
Divulgações: Jonathan Tan recebe financiamento para bolsas de pesquisa da Anesthesia Patient Safety Foundation e Foundation for Anesthesia Education and Research (FAER).
Randy Loftus, MD, relata o financiamento atual de sua pesquisa proveniente de NIH R01 AI155752-01A1, “Estudo BASIC: Melhoria da implementação de abordagens baseadas em evidências e vigilância para prevenir a transmissão e infecção bacteriana” e recebeu financiamento da Anesthesia Patient Safety Foundation, Sage Medical Inc., BBraun, Draeger, Surfacide e Kenall, tem uma ou mais patentes pendentes, é sócio da RDB Bioinformatics, LLC, 1055 N 115th St #301, Omaha, NE 68154, uma empresa proprietária da OR PathTrac, e palestrou em congressos educacionais patrocinados pela Kenall e BBraun. A University of Iowa usa o sistema da RDB Bioinformatics PathTrac para medir a transmissão bacteriana.
Desiree Chappell, está no Banco de Palestrantes da Medtronic e Edwards LifeSciences e no Conselho Consultivo da ProVation.
Jonathan Charnin, Melanie Hollidge, Raquel Bartz, Morgan Hellman, Sarah McMannus, Richard Beers e Michelle Beam não relataram conflitos de interesse.
Referências
- World Health Organization. WHO recommends new name for monkeypox disease. Accessed Dec 1, 2022, https://www.who.int/news/item/28-11-2022-who-recommends-new-name-for-monkeypox-disease.
- World Health Organization. 2022 monkeypox outbreak: global trends. Updated November 8, 2022. Accessed November 8, 2022. https://worldhealthorg.shinyapps.io/mpx_global/.
- Tiecco G, Degli Antoni M, Storti S, et al. Monkeypox, a literature review: what is new and where does this concerning virus come from? Viruses. 2022;14:1894. PMID: 36146705.
- Hutson CL, Abel JA, Carroll DS, et al. Comparison of West African and Congo Basin monkeypox viruses in BALB/c and C57BL/6 mice. PLoS One. 2010;5:e8912. PMID: 20111702.
- Forni D, Molteni C, Cagliani R, Sironi M. Geographic structuring and divergence time frame of monkeypox virus in the endemic region. J Infect Dis. 2022;Jul 14;jiac298. Online ahead of print. PMID: 35831941.
- Huang Y, Mu L, Wang W. Monkeypox: epidemiology, pathogenesis, treatment and prevention. Signal Transduct Target Ther. 2022;7:373. PMID: 36319633.
- McCarthy MW. Recent advances in the diagnosis monkeypox: implications for public health. Expert Rev Mol Diagn. 2022;22:739–744. PMID: 35997157.
- World Health Organization. Clinical management and infection prevention and control for monkeypox: interim rapid response guidance. Accessed November 29, 2022, https://www.who.int/publications/i/item/WHO-MPX-Clinical-and-IPC-2022.1
- American Society of Anesthesiologists. ASA/APSF Statement on Monkeypox. Accessed November 29, 2022, https://www.asahq.org/about-asa/newsroom/news-releases/2022/08/asa-apsf–statement-on-monkeypox.
- Bayer-Garner IB. Monkeypox virus: histologic, immunohistochemical and electron-microscopic findings. J Cutan Pathol. 2005;32:28–34. PMID: 15660652.
- Ranganath N, Tosh PK, O’Horo J, et al. Monkeypox 2022: gearing up for another potential public health crisis. Mayo Clin Proc. 2022;97:1694–1699. PMID: 35985857.
- Alakunle E, Moens U, Nchinda G, Okeke MI. Monkeypox virus in Nigeria: infection biology, epidemiology, and evolution. Viruses. 2020;12:1257. PMID: 33167496.
- Birkhead GS, Klompas M, Shah NR. Uses of electronic health records for public health surveillance to advance public health. Annu Rev Public Health. 2015;36:345–59. PMID: 25581157.
- van den Blink A, Janssen LMJ, Hermanides J, et al. Evaluation of electronic screening in the preoperative process. J Clin Anesth. 2022;82:110941. PMID: 35939972.
- Centers for Disease Control and Prevention. Mpox vaccine considerations. Accessed Nov 29, 2022, https://www.cdc.gov/poxvirus/monkeypox/clinicians/vaccines/vaccine-considerations.html.
- Morgan CN, Whitehill F, Doty JB, et al. Environmental persistence of Monkeypox virus on surfaces in household of person with travel-associated infection, Dallas, Texas, USA, 2021. Emerg Infect Dis. 2022;28:1982–1989. PMID: 35951009.
- Loftus RW, Dexter F, Goodheart MJ, et al. The effect of improving basic preventive measures in the perioperative arena on staphylococcus aureus transmission and surgical site infections: a randomized clinical trial. JAMA Netw Open. 2020 Mar 2;3(3):e201934. PMID: 32219407
- Agency for Healthcare Research and Quality. Central line-associated bloodstream infections (CLABSI). Accessed July 26, 2022, https://www.ahrq.gov/topics/central-line-associated-bloodstream-infections-clabsi.html.
- United States Environmental Protection Agency. Disinfectants for emerging viral pathogens (EVPs): List Q. Accessed Nov 29, 2022, https://www.epa.gov/pesticide-registration/disinfectants-emerging-viral-pathogens-evps-list-q.


 Issue PDF
Issue PDF