| Reproduzido de Anestesia e analgesia, junho de 2022 • Volume 134 • Número 6, páginas 1192–1200, com a permissão da International Anesthesia Research Society. Títulos profissionais e nomenclatura estão padronizados e modificados de acordo com a consistência do texto e com a política da APSF. |

Neste artigo de debate de prós e contras, os autores foram solicitados a refutar ou apoiar uma posição em relação à anestesia para colangiopancreatografia retrógrada endoscópica (CPRE). As CPREs são exclusivas porque não apenas exigem uma via aérea compartilhada, mas também são normalmente realizadas na posição de decúbito ventral (ou semidecúbito ventral) em uma mesa de procedimento especial. Além disso, os tempos de procedimento podem variar de <1 hora a várias horas.
A prática da medicina geralmente varia entre os profissionais médicos quando não existe um padrão de atendimento definido. A causa dessa variabilidade é multifatorial. Fatores e comorbidades do paciente, habilidades e experiência do profissional, necessidades de procedimentos e ausência de dados são algumas das considerações. Portanto, não é surpresa que o modo primário de anestesia para pacientes com endoscopia digestiva alta (EDA) seja nitidamente dividido entre aqueles que defendem cuidados anestésicos monitorados (MAC) versus aqueles que dependem da anestesia geral endotraqueal (GEA).
A importância desse debate é ainda mais relevante devido ao crescente reconhecimento do potencial significativo de morbidade e mortalidade associado a esses anestésicos e procedimentos. Um relatório de Closed Claims da American Society of Anesthesiologists (ASA) sugere que eventos adversos em locais de anestesia fora da sala de cirurgia (NORA) resultam em uma maior incidência de complicações graves, incluindo morte e danos cerebrais permanentes, do que eventos semelhantes que ocorrem na sala de cirurgia.1 De fato, a sala de procedimento gastrointestinal foi responsável pela maior porcentagem de eventos adversos em todos os locais da NORA.
Os profissionais de anestesia certamente encontrarão uma demanda crescente por serviços no ambiente NORA e, especialmente, na sala de procedimento gastrointestinal. Assim, este debate de prós e contras fornece informações sobre a decisão do plano de cuidados de MAC versus GEA para procedimentos de CPRE, conforme resumido na Tabela 1. Nossos pacientes irão se beneficiar de mais estudos clínicos sistemáticos dessas abordagens variáveise seus resultados associados.
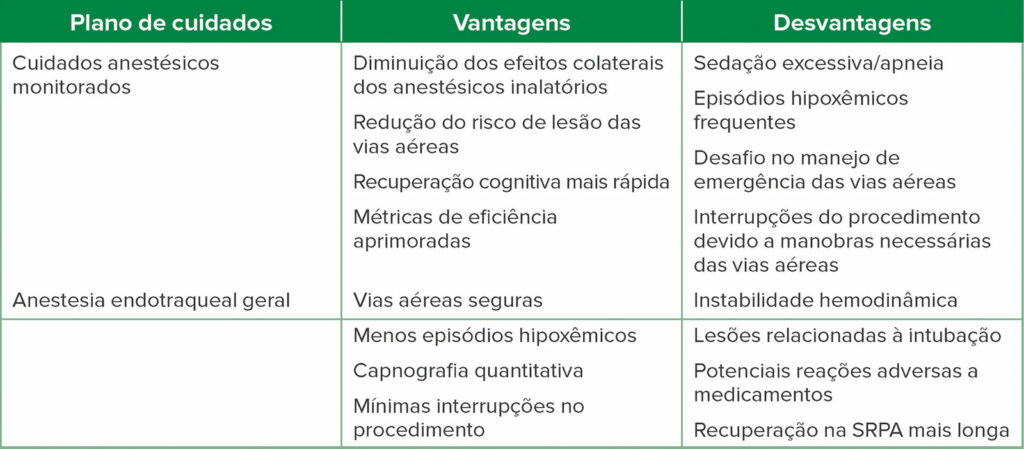
Tabela 1: Sumário sobre o debate de prós e contras:
Abreviações: CPRE, colangiopancreatografia retrógrada endoscópica; GEA, anestesia endotraqueal geral; MAC, cuidado anestésico monitorado; NORA, anestesia fora da sala de cirurgia; SRAE, evento adverso relacionado à sedação.
PRÓS: ANESTESIA PARA CPRE É MELHOR REALIZADA COM MAC
Samantha Stamper, MD, e
Christopher A. Troianos, MD, FASE, FASA
A CPRE utiliza fluoroscopia e endoscopia para intervenções diagnósticas e terapêuticas. Seu uso facilita a avaliação do fígado, vesícula biliar, ductos biliares e pâncreas. Nos últimos anos, a CPRE tem sido predominantemente utilizada para intervenções terapêuticas devido ao advento de técnicas terapêuticas endoscópicas avançadas e tecnologia de imagem (por exemplo, ressonância magnética com colangiopancreatografia por ressonância magnética, ultrassom endoscópico).13 Tais intervenções incluem esfincterotomia biliar, extração ou fragmentação de cálculos biliares, colocação de stent nos ductos biliares e pancreáticos e drenagem de pseudocistos pancreáticos.12,13 Muitos desses procedimentos anteriormente exigiam cirurgia aberta ou laparoscópica para tratamento, mas a CPRE agora é uma alternativa viável, econômica e preferível.
Intervenções endoscópicas avançadas têm o benefício adicional de serem minimamente invasivas, menos dolorosas e raramente requerem paralisia muscular.6 Mais de 500.000 CPREs são realizadas anualmente nos Estados Unidos, sendo que a maioria requer serviços de anestesia.14 CPREs são realizadas com mais frequência em pacientes mais velhos; muitos dos quais possuem mais comorbidades.13 Embora não haja atualmente nenhuma evidência de resultado realizada com base em estudos prospectivamente randomizados sobre se MAC ou GEA é superior para pacientes submetidos a intervenções de endoscopia avançada, há uma justificativa clínica convincente para priorizar uma abordagem que prioriza o MAC na maioria desses pacientes de endoscopia. Embora os planos anestésicos sejam sempre adaptados para cada indivíduo específico, a experiente equipe de endoscopia reconhecerá que a abordagem MAC pode ser a melhor, principalmente para pacientes mais saudáveis com índice de massa corporal (IMC) normal ou quase normal. Uma comunicação clara entre os profissionais da endoscopia e anestesia é fundamental. Por exemplo, a indicação específica para a CPRE (terapêutica versus diagnóstica) e a duração do caso são vitais para criar um modelo mental compartilhado e provavelmente contribuirão para a determinação do anestésico ideal. Por exemplo, se o plano de intervenção for uma remoção direta de um stent biliar, a MAC pode ser o mais apropriado. Por outro lado, a drenagem de um pseudocisto pancreático complexo e septado com paredes necróticas quase certamente exigirá GEA. Portanto, o tempo e o quão invasiva será a intervenção são informações vitais para a escolha anestésica, devendo ser consideradas as vantagens e desvantagens de cada técnica anestésica (Tabela 2).
Tabela 2: Vantagens e desvantagens de cada plano de cuidados anestésicos.
Fatores específicos da instalação também contribuem para a escolha do anestésico ideal. Essas considerações incluem a proximidade das principais salas de cirurgia, prontidão do equipamento de resgate, unidade adequada de cuidados pós-anestésicos e disponibilidade de ajuda adicional, se necessário. Outras considerações incluem o tamanho físico do espaço de trabalho de anestesia, que geralmente é limitado devido a equipamentos especializados (por exemplo, suprimentos de endoscopia, equipamento de imagem radiográfica, monitores/torres de visualização auxiliares). A comunicação com a instituição e a equipe de endoscopia antes do procedimento é importante para ajudar a mitigar quaisquer complicações indesejáveis. Além disso, o profissional prudente deve sempre garantir que um plano e caminho claros estejam em vigor, caso seja necessário um resgate emergencial das vias aéreas. Os fatores listados acima podem contribuir para a decisão de priorizar o MAC.
A endoscopia complexa, particularmente os procedimentos de CPRE, é rotineiramente realizada na posição de decúbito ventral ou semidecúbito ventral, o que pode limitar o acesso imediato às vias aéreas e/ou afetar o retorno venoso e a estabilidade cardiovascular.2 No entanto, essa posição geralmente mantém o fluxo sanguíneo pulmonar e a distribuição da ventilação (correspondência V/Q) nos pulmões, especialmente no paciente não intubado (por exemplo, MAC). Além disso, o próprio endoscópio pode atenuar o colapso das vias aéreas, atuando como um stent.15 A posição de decúbito ventral tem múltiplos efeitos positivos adicionais na função respiratória, especificamente aumentando a capacidade residual funcional (CRF) e a Po2 arterial.2
Uma grande preocupação em relação ao MAC na posição de decúbito ventral é a necessidade potencial de acesso urgente ou emergencial às vias aéreas, com a necessidade potencial de intubação endotraqueal de emergência. Uma estratégia potencial e provocativa é um profissional de endoscopia adequadamente treinado realizar uma intubação endotraqueal facilitada por gastroscópio. Isso requer um endoscópio menor capaz de ser introduzido na traqueia e um profissional de endoscopia que possua essas habilidades, prontamente viabilizadas por um anestesiologista. O gastroscópio “ultrafino” funciona de forma semelhante a um broncoscópio e tem um diâmetro externo de 5,4 mm que pode acomodar um tubo endotraqueal adulto sobre o escopo.16 Em uma revisão de mais de 3.400 pacientes submetidos a CPRE (46% com GEA versus 54% com MAC), a taxa geral de conversão de MAC para GEA foi de 2,3%. Os autores descreveram o uso bem-sucedido da intubação traqueal facilitada por gastroscópio em 16 pacientes devido à retenção de alimento no estômago e/ou hipóxia.17 Um benefício adicional do gastroscópio é que o material aspirado pode ser imediatamente aspirado da traqueia e dos brônquios, diminuindo assim o risco de complicações respiratórias.17 A extubação foi bem sucedida em todos os pacientes submetidos à intubação facilitada por gastroscópio e nenhum paciente apresentou evidência radiográfica de pneumonia por aspiração.17
Essa nova abordagem para resgatar a via aérea comprometida ou falha evita a preocupação mais comumente identificada pelos médicos, considerando o uso de MAC na posição de decúbito ventral ou semidecúbito ventral. O profissional de endoscopia no estudo mencionado acima foi autodidata nesta técnica, destacando o fato de que atualmente não há treinamento formal ou processo de credenciamento para intubação facilitada por gastroscópio.17 Esta técnica só deve ser considerada sob a supervisão direta de um anestesiologista ou realizada por um anestesiologista. Uma ressalva importante ao usar o gastroscópio ultrafino para intubação é que o profissional de endoscopia deve mudar do gastroscópio CPRE de visão lateral tradicional para o gastroscópio ultrafino carregado com um tubo endotraqueal. Essa troca de gastroscópios oferece o benefício de aspirar o estômago, esôfago e hipofaringe na retirada imediatamente antes da intubação, mas deve ser realizada de forma acelerada para minimizar o possível atraso na intubação.
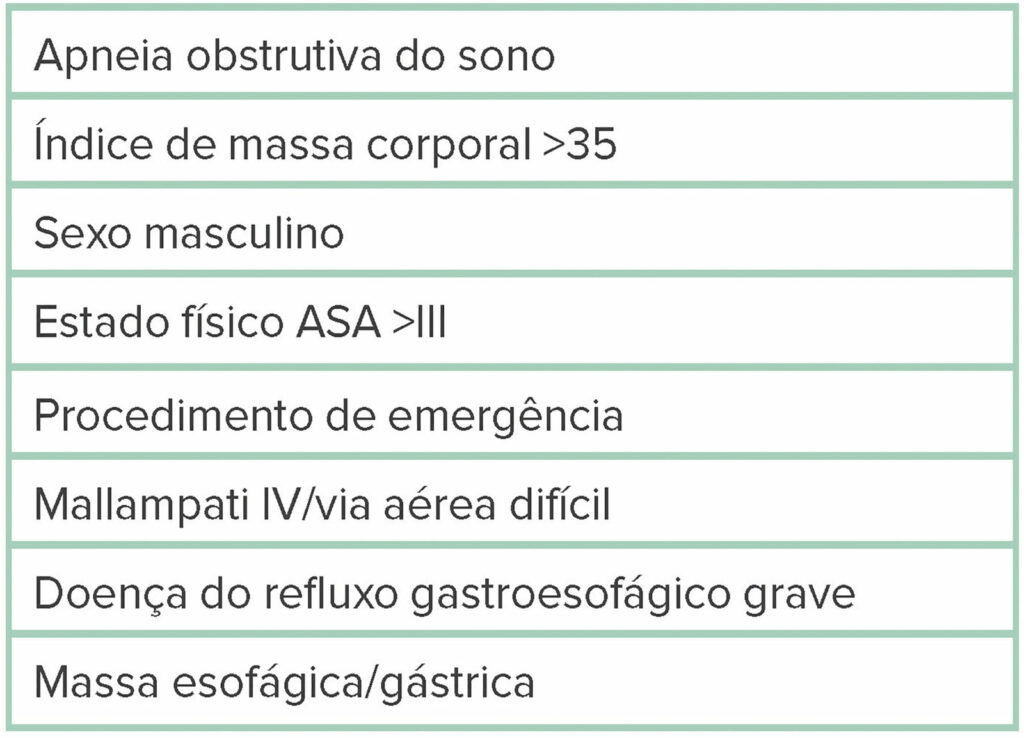
Tabela 3: Fatores de risco para eventos adversos relacionados à sedação durante MAC.
Antes de prosseguir com o MAC para CPRE, os fatores de risco para eventos adversos relacionados à sedação (SRAEs) devem ser considerados, conforme destacado na Tabela 3. Condições que aumentam a probabilidade de aspiração são consideradas por muitos como fatores de risco para SRAEs. Numerosos estudos demonstraram que o MAC é uma opção segura para CPRE, especialmente em pacientes com fatores de risco mínimos para SRAEs. Um grande estudo populacional de uma década em vários centros de endoscopia nos Estados Unidos não encontrou diferença significativa em eventos adversos graves gerais entre CPREs realizadas com MAC (n = 8.395) versus GEA (n = 10.715; razão de chances [OR] = 1,04, intervalo de confiança de 95% [IC], 0,76–1,43).2,3 No entanto, a maioria desses pacientes era relativamente saudável (estado físico ASA I e II), e os autores não tentaram controlar o viés de seleção. Não houve diferença significativa em eventos adversos entre pacientes com estado físico ASA I e estado físico ASA II (OR = 0,84 [0,49–1,46]), nem houve diferença entre pacientes com estado físico ASA III e estado físico ASA II (OR = 1,30 [1,00–1,69]). De fato, os dados sugerem que apenas pacientes com estado físico ASA IV apresentaram um risco significativamente maior de eventos adversos com MAC (OR = 3,19 [2,00–5,09]).2,3 Em outro estudo observacional prospectivo, a decisão entre MAC ou GEA foi deixada para o anestesiologista, com 393 pacientes recebendo MAC e 45 pacientes recebendo GEA.4 A taxa de conversão de MAC para GEA foi de 3,7%. Notavelmente, 25% dos pacientes convertidos para GEA eram pacientes com estado físico ASA IV.2,4 Dado o viés de seleção inerente a este estudo, não surpreende que o IMC médio tenha sido maior no grupo GEA do que no grupo MAC, assim como a porcentagem de pacientes com estado físico ASA IV.4,6 No entanto, as taxas de eventos adversos entre MAC e GEA não foram estatisticamente diferentes, e os autores do estudo concluíram que MAC é viável e bem tolerado para pacientes mais saudáveise não obesos que são avaliados antes do procedimento por um profissional de anestesia.2,4,6
A monitorização clínica durante o MAC para CPRE deve seguir os padrões de rotina para a monitorização básica da anestesia, que envolve a avaliação contínua da oxigenação, ventilação, circulação e temperatura do paciente18; isso inclui medir a pressão arterial não invasiva, oximetria de pulso, eletrocardiografia e capnografia. Muitos dos dispositivos de vias aéreas (por exemplo, cânulas nasais ou máscara facial simples) usados no MAC são capazes de monitorar o CO2 expirado e detectar apneia bem antes do início da hipóxia.4,19 Modalidades adicionais de monitoramento estão disponíveis para detectar apneia antes da diminuição da oximetria de pulso, incluindo pneumografia de impedância e, menos comumente usado em ambiente de sala de cirurgia, um monitor acústico de frequência respiratória.
Todos os anestésicos MAC começam com pré-oxigenação adequada. Isso é crucial na prevenção da hipoxemia, um precursor óbvio de eventos adversos mais graves (por exemplo, arritmias cardíacas, hipotensão e parada cardíaca).20 Idealmente, pré-oxigenar por 3 minutos ou 4 respirações de capacidade vital pode fornecer pelo menos 4 minutos de “tempo de segurança” antes que o paciente comece a dessaturar sem ventilação adequada.21 A pré-oxigenação adequada em pacientes obesos é de extrema importância, apesar da redução do “tempo de segurança” devido à diminuição da CRF. É importante ter em mente que os pacientes obesos frequentemente apresentam comorbidades pulmonares e sistêmicas concomitantes que podem ser ainda mais exacerbadas na posição de decúbito ventral, apesar da pré-oxigenação. A pré-oxigenação adequada antes da administração da sedação aumenta a margem de segurança caso ocorra apneia/hipoventilação transitória com a dose inicial em bolus de propofol. Nesses casos, a pré-oxigenação permite que a equipe de anestesia e endoscopia tenha mais tempo para intervir com medidas corretivas (por exemplo, elevação da mandíbula e inserção do endoscópio para estimulação) antes do início da hipoxemia.
Existem várias maneiras de fornecer oxigênio suplementar para pacientes submetidos a CPRE com MAC, incluindo cânulas nasais de baixo a alto fluxo, máscaras de oxigênio para procedimentos e máscaras de endoscopia especializadas. Todos esses dispositivos de vias aéreas variam com base na quantidade de oxigênio inspirado fracionado que pode ser fornecido. Muitos desses dispositivos também são capazes de fornecer monitoramento de capnografia durante o procedimento. Antes do início da sedação, muitos centros também solicitam que o paciente coloque um bloco de mordida na boca para evitar morder o endoscópio. Muitos blocos de mordida têm um recurso integrado de vias aéreas ou até mesmo uma porta de sucção que pode ajudar a limpar as secreções das vias aéreas.15 Além de garantir que o dispositivo de administração das vias aéreas seja confortável, a autoposição do paciente pode ajudar a diminuir o risco de compressão ou lesão nervosa que, de outra forma, poderia não ser reconhecida em um paciente submetido a GEA. Um benefício adicional do autoposicionamento é que menos funcionários são necessários para auxiliar na transferência do paciente, como seria necessário se o paciente estivesse sob anestesia geral.
Existem vários suplementos adicionais a serem considerados durante o MAC para procedimentos endoscópicos avançados. A pré-medicação com glicopirrolato reduz as secreções e melhora a eficácia dos anestésicos tópicos.22 Em centros de endoscopia de alta rotatividade, isso precisaria ser administrado na área pré-operatória para fazer efeito antes do procedimento. Os pacientes devem ser orientados sobre os efeitos colaterais de cada medicamento. Antes de iniciar a sedação, a anestesia faríngea tópica atenua a estimulação da inserção do endoscópio. Opções de anestésicos tópicos incluem sprays de anestesia local, que geralmente contêm benzocaína ou lidocaína como ingrediente ativo, ou lidocaína viscosa com a qual o paciente pode fazer bochecho e depois engolir. Se estiver usando soluções contendo benzocaína, é importante ter cuidado devido ao risco de metemoglobinemia. O anestésico de manutenção ideal permite titulação fácil, recuperação rápida e efeitos colaterais mínimos, mantendo a ventilação espontânea. O propofol é facilmente titulado para manter a ventilação espontânea enquanto simultaneamente fornece sedação de moderada a profunda.23 Se a analgesia for necessária, é aconselhável adicionar um opioide, dexmedetomidina, ou cetamina à anestesia intravenosa para atingir esse objetivo.22 Além disso, os procedimentos endoscópicos podem ser interrompidos quase que imediatamente pela simples remoção do endoscópio se for necessário um acesso urgente à via aérea. A remoção do endoscópio pode resultar em laringoespasmo, portanto, deve-se estar pronto para tratar com urgência essa complicação potencial enquanto se prepara para proteger as vias aéreas. Além da inserção do gastroscópio, a intensidade da estimulação permanece relativamente constante durante a CPRE, em oposição às oscilações que ocorrem durante uma operação cirúrgica tradicional. Devido à estimulação relativamente mínima ou ausente, a titulação do anestésico para manter a ventilação espontânea geralmente é facilmente alcançada.20 Quando usada sozinha, a sedação com propofol permite um retorno à linha de base cognitiva dentro de 30 a 45 minutos após a descontinuação, apesar do retorno tardio da velocidade psicomotora e do tempo de reação.24 O uso do MAC evita o uso de bloqueadores neuromusculares despolarizantes e não despolarizantes, muitos dos quais têm seus próprios efeitos colaterais. Há também menos náuseas e vômitos pós-operatórios se anestésicos inalatórios e opioides forem evitados, levando a uma melhor satisfação do paciente.
A GEA não está isenta de riscos. A intubação acarreta o risco de lesões nos lábios, língua, dentes e olhos e, embora raro, ruptura brônquica ou incapacidade de assegurar uma via aérea e necessidade de intervenção cirúrgica. A succinilcolina é mais frequentemente usada por seu início rápido e curta duração e, no caso de endoscopia, a paralisia geralmente não é necessária. Os efeitos adversos potenciais da succinilcolina incluem dor muscular, mioglobinemia, mioglobinúria e hipertermia maligna.20 O uso de relaxantes musculares não despolarizantes está associado a um risco aumentado de complicações pulmonares pós-operatórias por bloqueio neuromuscular residual.24 Os efeitos anticolinérgicos associados à reversão desses paralíticos também devem ser considerados, embora isso possa ser um problema menor em instituições onde o sugammadex está disponível. A profundidade da anestesia necessária durante a GEA aumenta o risco de hipotensão, que pode subsequentemente levar a um aumento do risco de lesão miocárdica, lesão renal e possivelmente morte.26 Como a CPRE é realizada na posição de decúbito ventral ou semidecúbito ventral, várias pessoas são necessárias para posicionar e proteger o paciente com segurança ao passar da posição de decúbito dorsal para a posição de decúbito ventral na mesa de fluoroscopia. Sempre existe o risco de deslocamento do tubo endotraqueal ou extubação acidental durante o posicionamento. Finalmente, os locais da NORA geralmente têm menos apoio de profissionais e outros membros da equipe para ajudar durante emergências e mudanças de anestesia, o que pode diminuir a eficiência do processo. Perbtani et al5 avaliaram o impacto da GEA em várias métricas de eficiência em um grande centro de endoscopia intervencionista. Mais de 1.400 pacientes submetidos a 1.635 procedimentos endoscópicos intervencionistas durante um período de 6 meses foram analisadoscom base em carimbos de data/hora para o tempo pronto para anestesia, tempo pronto para o profissional de endoscopia, tempo do procedimento, tempo de saída da sala, intervalo de tempo entre procedimentos sucessivos, tempo não processual decorrido, tempo total decorrido na unidade de endoscopia e número de casos por sala por dia.2,5 Todas as métricas de eficiência do processo, exceto o intervalo de tempo entre procedimentos sucessivos, foram significativamente prolongadas entre os pacientes intubados em comparação com os pacientes não intubados na unidade de endoscopia intervencionista. Um objetivo secundário do estudo mostrou que os pacientes submetidos a CPRE foram intubados com mais frequência do que aqueles submetidos a outros procedimentos (41,3% vs 12,4%).2,5
Em conclusão, o MAC oferece benefícios significativos em relação à GEA em pacientes adequadamente selecionados submetidos a CPRE. Esses benefícios incluem recuperação cognitiva mais rápida, diminuição dos efeitos colaterais dos medicamentos usados para induzir GEA, diminuição do risco de lesão das vias aéreas, diminuição das complicações pulmonares pós-operatórias e redução do tempo gasto no hospital devido à indução mais rápida e menor tempo de alta, aumentando assim as métricas de eficiência para a unidade, os provedores e os pacientes. Com monitoramento adequado, oxigênio suplementar e sedação cuidadosamente titulada para manter a ventilação espontânea, o MAC durante a CPRE é uma alternativa segura e muitas vezes superior à GEA.
CONTRAS: GEA OFERECE MAIS VANTAGENS SOBRE O MAC
Luke S. Janik, MD, e
Jeffery S. Vender, MD, MCCM
A CPRE é um procedimento frequentemente realizado no diagnóstico e manejo da doença pancreatobiliar. A cada ano, mais de 500.000 procedimentos de CPRE são realizados nos Estados Unidos, sendo as indicações mais comuns cálculos biliares e estenoses dos sistemas do ducto biliar e pancreático.27 A CPRE é uma ferramenta valiosa no tratamento de doenças hepáticas, biliares e pancreáticas, mas geralmente é considerada o procedimento de maior risco realizado na sala de procedimentos GI, com uma taxa geral de complicações de procedimento de 4%.28 As complicações do procedimento incluem pancreatite (2%–10%), colangite/sepse (0,5%–3%), sangramento pós-esfincterotomia (0,3%–2%), perfuração duodenal (0,08%–0,6%) e morte (0,06%).28,29 No entanto, o que pode ser mais preocupante para os profissionais de anestesia é a alta taxa de SRAEs durante o procedimento, com uma incidência relatada de até 21%.6,7 Isso levanta questões sobre quem deve administrar a anestesia e monitorar o paciente durante a CPRE e que tipo de anestesia deve ser administrada. Neste “Debate de prós e contras”, argumentamos que um anestesista qualificado deve administrar a anestesia para CPRE e que a GEA oferece vantagens significativas em relação ao MAC.
Existe uma grande variabilidade nos modelos de administração de anestesia para CPRE. Os 3 modelos mais comuns de administração de anestesia são (1) sedação dirigida por um profissional de endoscopia (EDS), (2) MAC e (3) GEA. No primeiro modelo, EDS, a sedação intravenosa é administrada por um membro da equipe de EDA, geralmente um enfermeiro, sob a supervisão do profissional de endoscopia, que geralmente realiza o procedimento simultaneamente. O uso da tradicional “sedação consciente” com titulação de benzodiazepínicos e narcóticos geralmente caiu em desuso devido às altas taxas de falha do procedimento, baixa satisfação do paciente e baixa satisfação do profissional de endoscopia.30 Consequentemente, a EDS adotou o uso de sedação com propofol por provedores não anestésicos, que a comunidade gastroenterológica considera segura e eficaz.31–33 Nos outros 2 modelos de anestesia, o paciente está sob os cuidados de um profissional de anestesia qualificado, recebendo MAC com sedação à base de propofol ou GEA. A escolha do modelo de prestação de cuidados anestésicos é específica da instituição e depende dos recursos e pessoal disponíveis, complexidade do procedimento, características e comorbidades do paciente e preferências individuais.
Antes de discutirmos como a anestesia deve ser realizada, precisamos reconhecer onde ela é realizada. O risco da anestesia em locais remotos é amplamente reconhecido. Uma análise do banco de dados ASA Closed Claims revisou reclamações de negligência contra profissionais de anestesia em locais remotos e demonstrou que eventos adversos em locais remotos resultaram em taxas mais altas de complicações graves, incluindo morte e danos cerebrais permanentes, do que eventos adversos na sala de cirurgia. De fato, a proporção de óbitos foi quase o dobro em locais remotos em relação à sala de cirurgia (54% versus 29%).11 Eventos respiratórios foram mais comuns em locais remotos do que na sala de cirurgia (44% versus 20%), com oxigenação/ventilação inadequada identificada como o mecanismo de lesão em 21% das reclamações em locais remotos versus 3% das reclamações na sala de cirurgia.11 Os dados de reclamações fechadas específicos de sala de procedimento gastrointestinal exigem maior atenção. Comparado a todos os outros locais remotos, a sala de procedimento gastrointestinal foi responsável pela maior porcentagem de reclamações de má prática anestésica (32%), a maior proporção de reclamações associadas à sedação excessiva (58%) e a maior taxa de utilização de MAC (> 80%).11 Esses dados não surpreendem os profissionais de anestesia. Locais desconhecidos, falta de recursos, ergonomia ruim, assistência limitada, culturas variáveis de segurança e distância física de equipamentos e pessoal de anestesia adicionais são obstáculos diários na sala de procedimento gastrointestinal. Além disso, os pacientes geralmente são mais velhos e mais doentes.11 A CPRE apresenta outros desafios únicos, incluindo o uso rotineiro da posição de decúbito ventral, acesso limitado às vias aéreas e o uso de um endoscópio capaz de causar obstrução das vias aéreas e laringoespasmo. Levando em consideração todos esses desafios, a anestesia para CPRE acarreta riscos substanciais e deve ser abordada com cuidado.
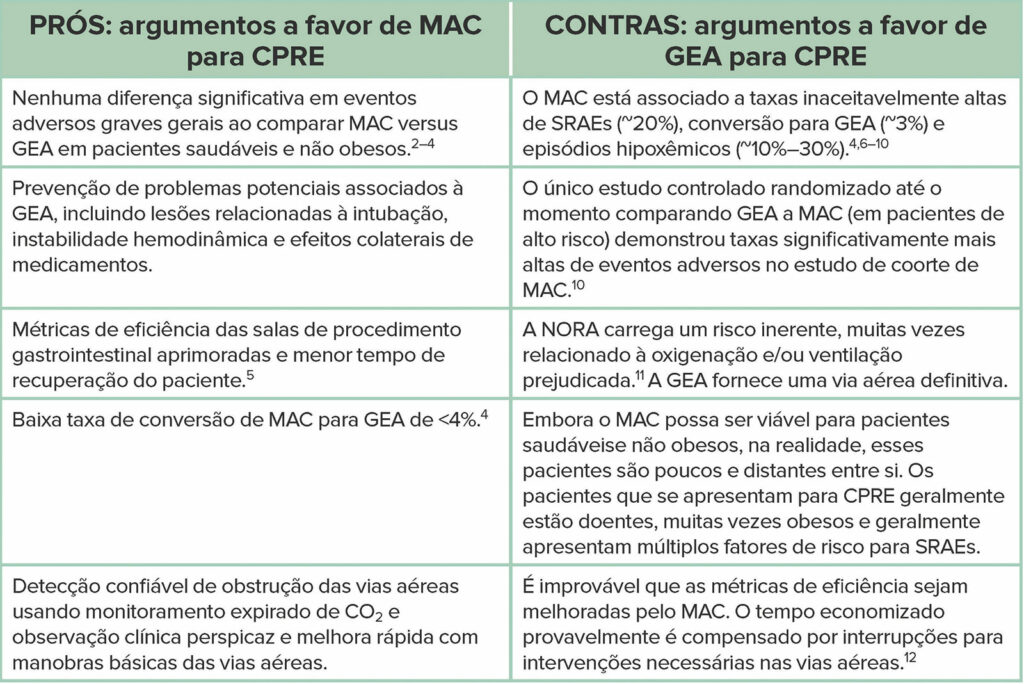
Os defensores do MAC para CPRE apontam numerosos estudos retrospectivos e prospectivos, principalmente da literatura gastroenterológica, que concluem que a técnica é segura e eficaz.4,6,8,33,34 Em um estudo prospectivo comparando MAC com GEA, Berzin et al6 relataram uma taxa geral de SRAEs de 21%. Eventos adversos específicos no estudo de coorte MAC incluíram hipoxemia (12,5%; definida como saturação de oxigênio <85%), ventilação com máscara não planejada (0,6%), intubação não planejada (3%) e interrupção do procedimento (5%).6 A partir desses dados, os autores concluíram que “eventos menores relacionados à sedação foram comuns (21%), mas levaram à interrupção transitória do procedimento em apenas 5% dos casos”. Eles descartaram casualmente a incidência de 3% de intubação não planejada, afirmando que “o acesso às vias aéreas foi facilmente obtido nas raras ocasiões em que a intubação não planejada foi considerada necessária”. Em um estudo prospectivo semelhante de CPRE sob MAC, Zhang et al7 descobriram que complicações relacionadas à sedação ocorreram em 18% dos pacientes, com hipoxemia (definida como saturação de oxigênio <90% por pelo menos 2 minutos) ocorrendo em 9% dos pacientes e >33% dos pacientes apresentando múltiplos episódios de hipoxemia. Os autores observaram que a incidência de hipoxemia em seu estudo foi comparável à taxa de hipoxemia em outros estudos semelhantes e, portanto, concluíram que “a sedação pelos profissionais de anestesia para CPRE é segura”. Em uma revisão retrospectiva de MAC para CPRE, Yang et al9 relataram uma incidência de hipoxemia (definida como saturação de oxigênio <90%) exigindo manipulação das vias aéreas em 28% dos casos, com 1,6% dos pacientes exigindo conversão para GEA devido a alimentos no estômago. Apesar de suas descobertas, os autores concluíram que “o propofol pode ser usado com segurança e eficácia como agente sedativo para pacientes submetidos a CPRE”.
Como os estudos que relatam taxas tão altas de SRAEs, episódios hipoxêmicos e manobras necessárias das vias aéreas podem concluir que a sedação é “segura” ou “viável” ou “apropriada”?4,6–9 Só porque um evento crítico não leva a um resultado crítico, não significa que o evento seja menos crítico! A interpretação dos dados, em última análise, depende da lente através da qual eles são vistos. Um gastroenterologista pode não se alarmar com uma taxa de intubação não planejada de até 3%,6 ou taxas de hipoxemia de até 33%,7 desde que o paciente não tenha sequelas a longo prazo. No entanto, um anestesiologista responsável pelo manejo emergencial das vias aéreas e ressuscitação cardiopulmonar pode ver cada um desses episódios hipoxêmicos como um evento de “quase perda”. Lembre-se de que a oximetria de pulso é uma medida de oxigenação, não de ventilação, e não pode ser usada com segurança para detectar hipoventilação e hipercapnia progressiva.35,36 A hipoxemia no contexto do uso de oxigênio suplementar, como é padrão durante o MAC para CPRE, é um marcador tardio de hipoventilação e um prenúncio de parada respiratória iminente.
Para fins de argumentação, vamos considerar um cenário diferente. Se dirigirmos sem cinto de segurança por um ano e nunca nos machucarmos em nenhum acidente que ocorra, estamos corretos ao concluir que dirigir sem cinto de segurança é seguro, viável e apropriado? Normalizar e aceitar altas taxas de hipoxemia durante o MAC para CPRE, enquanto em um local remoto, na posição de decúbito ventral e com acesso limitado às vias aéreas, estabelece um precedente perigoso. Admitimos que é difícil definir uma taxa “aceitável” de SRAEs e episódios hipoxêmicos durante a sedação. No entanto, em nossa opinião, as taxas de SRAEs e episódios hipoxêmicos relatados nos estudos mencionados são preocupantes e devem ser apresentadas como uma preocupação com a segurança do paciente, em vez de serem descartadas como um evento inconsequente.
Agora, vamos voltar nossa atenção para as evidências que apoiam a GEA para CPRE. Em um estudo randomizado controlado comparando a segurança do MAC com a GEA para CPRE, os resultados claramente favorecem a GEA.10 Este estudo incluiu pacientes identificados como de alto risco para SRAEs, incluindo aqueles com pontuação STOP-BANG (sistema de pontuação envolvendo: ronco, cansaço, apneia observada, pressão arterial, índice de massa corporal, idade, circunferência do pescoço, sexo) pontuação ≥3, ascite abdominal, IMC ≥35, doença pulmonar crônica, pontuação de estado físico ASA >3, vias aéreas classe 4 de Mallampati e uso moderado a pesado de álcool. As taxas de SRAEs foram nitidamente maiores no grupo MAC em comparação com o grupo GEA (51,5% versus 9,9%).10 No grupo MAC, a hipoxemia (definida como saturação de oxigênio <90%) ocorreu em 19% dos pacientes, com 45% necessitando de uma ou mais manobras de vias aéreas e 8% necessitando de ventilação com bolsa-máscara.10 Por outro lado, houve zero incidentes de hipoxemia ou manobras das vias aéreas no grupo GEA. O procedimento de CPRE teve que ser interrompido em 10,1% do grupo MAC, necessitando conversão para GEA por instabilidade respiratória (8%) e conteúdo gástrico retido (2%).10 Vale observar que a hipotensão requerendo um vasopressor ocorreu em taxas semelhantes em ambos os grupos, e não houve diferenças no tempo do procedimento, sucesso técnico e tempo de recuperação do paciente.10
Deixando os dados de lado por um momento, vamos dar um passo atrás e discutir a realidade do gerenciamento de crises da perspectiva de um anestesiologista. O comprometimento da via aérea na posição de decúbito ventral, enquanto isolado em um local remoto e com ajuda e recursos limitados, é o pesadelo de todo profissional de anestesia, como deveria ser. Quando cada segundo importa, pode parecer uma eternidade retirar o endoscópio, tirar o equipamento de fluoroscopia do caminho, trazer a maca para a sala e colocar o paciente em decúbito dorsal. No momento em que o paciente está adequadamente posicionado para controlar as vias aéreas, ele pode estar à beira de uma parada respiratória. Sim, este é um evento relativamente raro durante a sedação para CPRE, mas é evitável. Por que correr esse risco quando a via aérea pode ser protegida inicialmente com intubação endotraqueal em uma cirurgia eletiva, de forma controlada? Com as altas taxas de hipoxemia associadas à sedação durante a CPRE e os inúmeros desafios associados à intubação não planejada neste ambiente, a GEA é simplesmente a escolha lógica.
Há uma percepção entre os gastroenterologistas de que o MAC é mais rápido que a GEA, requer menos tempo de rotatividade e permite maior fluxo de pacientes. Embora existam alguns dados para apoiar essa percepção,5 outros dados sugerem que qualquer tempo economizado durante a sedação provavelmente é compensado por interrupções frequentes do procedimento devido ao comprometimento das vias aéreas.10 Na realidade, a eficiência da sala de procedimento gastrointestinal é um produto complexo de muitas variáveisdiferentes (incluindo a eficiência do procedimento pelo profissional de endoscopia), e é limitado pensar que a eficiência está relacionada apenas à presença ou ausência de um tubo endotraqueal. Há também a percepção de que o MAC é inerentemente mais suave, seguro e menos invasivo do que o GEA. Sim, o uso de GEA apresenta seus próprios riscos, incluindo potencial para lesões dentárias, bloqueio neuromuscular residual, instabilidade hemodinâmica e reações adversas a medicamentos. No entanto, ao comparar todos esses riscos com o risco de comprometimento das vias aéreas durante o MAC para CPRE na posição de decúbito ventral, francamente não há comparação. Nosso trabalho como profissionais de anestesia é mitigar o risco, e o potencial de comprometimento das vias aéreas durante o MAC para CPRE é um risco que não vale a pena correr.
Até que mais estudos controlados randomizados multicêntricos em grande escala sejam conduzidos, a controvérsia sobre MAC versus GEA para CPRE persistirá, e o padrão de tratamento permanecerá indefinido. O que todos os profissionais de anestesia podem afirmar, no entanto, é que, independentemente da técnica anestésica, a anestesia deve ser administrada por um profissional de anestesia qualificado. Nos Estados Unidos, a EDS para CPRE diminuiu de >50% dos casos em 2005 para 5% em 2014, mas continua prevalente na Europa e em outros países.3 Uma revisão retrospectiva de quase 27.000 CPREs realizadas em um período de 10 anos mostrou que a EDS resultou em uma taxa mais alta de eventos adversos (OR = 1,86) e foi quase duas vezes mais provável de exigir uma intervenção não planejada do que a sedação fornecida por anestesia.3 Estudos também demonstraram que a EDS levou a uma taxa mais alta de falha da sedação e, consequentemente, falha do procedimento, do que MAC ou GEA administrados por anestesia.30,34 Para piorar a situação, a EDS resultou em baixa satisfação do paciente e baixa satisfação do profissional de endoscopia.33 Em nossa opinião, o modelo EDS para CPRE é uma ameaça à segurança do paciente e deve ser abandonado. Acreditamos firmemente que a sedação com propofol só deve ser administrada por um anestesista qualificado e equipado com a capacidade de reconhecer rapidamente o comprometimento das vias aéreas e as habilidades para manejar uma via aérea em caso de emergência. Essas habilidades estão fora do escopo da prática de médicos, enfermeiros e técnicos em gastroenterologia.
A anestesia MAC durante a CPRE está associada a altas taxas de hipoxemia, manobras das vias aéreas e SRAEs. Esses riscos, juntamente com os perigos inerentes à anestesia em locais remotos, levantam preocupações significativas sobre a segurança do MAC para CPRE na posição de decúbito ventral. Para citar o sábio anestesiologista Dr. Carl Hug Jr, talvez o MAC devesse significar “precaução anestésica máxima” em vez de “cuidados anestésicos monitorados”.37 Acreditamos que todos os pacientes submetidos a procedimentos de CPRE devem estar sob os cuidados de um profissional de anestesia qualificado e que a GEA oferece vantagens significativas sobre o MAC.
RESUMO
Este artigo de prós e contras foi motivado pelo crescimento de procedimentos de endoscopia complexos nos últimos anos, juntamente com a falta de grandes ensaios clínicos randomizados para apoiar uma técnica anestésica definitiva para pacientes em CPRE. O debate é particularmente importante devido à incidência de comorbidades e porque o procedimento envolve uma via aérea compartilhada. Os benefícios do MAC incluem menos perturbações hemodinâmicas, diminuição dos efeitos colaterais dos agentes inalatórios, recuperação cognitiva mais rápida e menor tempo geral de procedimento, que deve ser ponderado contra a incidência de eventos críticos devido à oxigenação e/ou ventilação prejudicada que ocorrem durante o MAC. As 2 abordagens destacadas nesta discussão enfatizam a importância de ter um profissional de anestesia qualificado para determinar o anestésico ideal para um determinado paciente e circunstância clínica.
Luke S. Janik, MD, é professor assistente clínico na University of Chicago e docente no Departamento de Anestesiologia, Cuidado Intensivo e Medicina da Dor, NorthShore University HealthSystem, Evanston, IL.
Jeffery S. Vender, MD, MCCM, é professor clínico emérito do Departamento de Anestesia da University of Chicago, Chicago, IL.
Samantha Stamper, MD, é professora assistente no Cleveland Clinic Lerner College of Medicine of Case Western Reserve University e docente no Anesthesiology Institute, Cleveland Clinic, Cleveland, OH.
Christopher A. Troianos, MD, FASE, FASA, é professor clínico no Anesthesiology Institute, Cleveland Clinic Lerner College of Medicine of Case Western Reserve University, Cleveland Clinic, Cleveland, OH.
Divulgações: Luke S. Janik, MD, Samantha Stamper, MD, e Christopher A. Troianos, MD, FASE, FASA, não têm conflitos de interesse. Jeffery S. Vender, MD, MCCM, é consultor na Fresenius Kabi, Medline Industries e Medtronic.
REFERÊNCIAS
- Woodward ZG, Urman RD, Domino KB. Safety of non-operating room anesthesia: a closed claims update. Anesthesiol Clin. 2017;35:569–581. PMID: 29101947.
- Smith ZL, Das KK, Kushnir VM. Anesthesia-administered sedation for endoscopic retrograde cholangiopancreatography: monitored anesthesia care or general endotracheal anesthesia? Curr Opin Anaesthesiol. 2019;32:531–537. PMID: 30994476.
- Smith ZL, Nickel KB, Olsen MA, et al. Type of sedation and the need for unplanned interventions during ERCP: analysis of the clinical outcomes research initiative national endoscopic database (CORI-NED). Frontline Gastroenterol. 2020;11:104–110. PMID: 32133108.
- Barnett SR, Berzin T, Sanaka S, et al. Deep sedation without intubation for ERCP is appropriate in healthier, non-obese patients. Dig Dis Sci. 2013;58:3287–3292. PMID: 23877477.
- Perbtani YB, Summerlee RJ, Yang D, et al. Impact of endotracheal intubation on interventional endoscopy unit efficiency metrics at a tertiary academic medical center. Am J Gastroenterol. 2016;111:800–807. PMID: 27021194.
- Berzin TM, Sanaka S, Barnett SR, et al. A prospective assessment of sedation-related adverse events and patient and endoscopist satisfaction in ERCP with anesthesiologist-administered sedation. Gastrointest Endosc. 2011;73:710–717. PMID: 21316669.
- Zhang CC, Ganion N, Knebel P, et al. Sedation-related complications during anesthesiologist-administered sedation for endoscopic retrograde cholangiopancreatography: a prospective study. BMC Anesthesiol. 2020;20:131. PMID: 32466744.
- Coté GA, Hovis RM, Ansstas MA, et al. Incidence of sedation-related complications with propofol use during advanced endoscopic procedures. Clin Gastroenterol Hepatol. 2010;8:137–142. PMID: 19607937.
- Yang JF, Farooq P, Zwilling K, et al. Efficacy and safety of propofol-mediated sedation for outpatient endoscopic retrograde cholangiopancreatography (ERCP). Dig Dis Sci. 2016;61:1686–1691. PMID: 26825844.
- Smith ZL, Mullady DK, Lang GD, et al. A randomized controlled trial evaluating general endotracheal anesthesia versus monitored anesthesia care and the incidence of sedation-related adverse events during ERCP in high-risk patients. Gastrointest Endosc. 2019;89:855–862. PMID: 30217726.
- Metzner J, Posner KL, Domino KB. The risk and safety of anesthesia at remote locations: the US closed claims analysis. Curr Opin Anaesthesiol. 2009;22:502–508. PMID: 19506473.
- Wu WZ, Zheng MH, Wang JC, Chen S. The role of endoscopic retrograde cholangiopancreatography in perioperative period of laparoscopic cholecystectomy. Hepatobiliary Pancreat Dis Int. 2002;1:114–117. PMID: 14607638.
- Kapoor H. Anaesthesia for endoscopic retrograde cholangiopancreatography. Acta Anaesthesiol Scand. 2011;55:918–926.
- Huang RJ, Barakat MT, Girotra M, et al. Unplanned hospital encounters after endoscopic retrograde cholangiopancreatography in 3 large North American States. Gastroenterology. 2019;156:119.e3–129.e3. PMID: 30243620.
- Goudra B, Singh PM. Airway management during upper GI endoscopic procedures: state of the art review. Dig Dis Sci. 2017;62:45–53. PMID: 27838810.
- Shah T, Ianchulev S. Gastroscope-facilitated endotracheal intubation during ERCP: when is the best time to GETA (Big) MAC? Dig Dis Sci. 2021;66:938–940. PMID: 32643057.
- Barakat MT, Angelotti TP, Banerjee S. Use of an ultra-slim gastroscope to accomplish endoscopist-facilitated rescue intubation during ERCP: a novel approach to enhance patient and staff safety. Dig Dis Sci. 2021;66:1285–1290. PMID: 32504349.
- Standards for Basic Anesthetic Monitoring. American Society of Anesthesiologist Website. October 21, 1986, last amended on October 20, 2010, and last affirmed on October 28, 2016. https://www.asahq.org/~/media/Sites/ASAHQ/Files/Public/Resources/standards-guidelines/standards-for-basic-anesthetic-monitoring.pdf. Accessed March 20, 2021.
- Deitch K, Miner J, Chudnofsky CR, et al. Does end tidal CO2 monitoring during emergency department procedural sedation and analgesia with propofol decrease the incidence of hypoxic events? A randomized, controlled trial. Ann Emerg Med. 2010;55:258–264. PMID: 19783324.
- Goudra B, Singh PM. ERCP: the unresolved question of endotracheal intubation. Dig Dis Sci. 2014;59:513–519. PMID: 24221339.
- Gambee AM, Hertzka RE, Fisher DM. Preoxygenation techniques: comparison of three minutes and four breaths. Anesth Analg. 1987;66:468–470. PMID: 3578856.
- Tetzlaff JE, Vargo JJ, Maurer W. Nonoperating room anesthesia for the gastrointestinal endoscopy suite. Anesthesiol Clin. 2014;32:387–394. PMID: 24882126.
- Goulson DT, Fragneto RY. Anesthesia for gastrointestinal endoscopic procedures. Anesthesiol Clin. 2009;27:71–85. PMID: 19361769.
- Allampati S, Wen S, Liu F, Kupec JT. Recovery of cognitive function after sedation with propofol for outpatient gastrointestinal endoscopy. Saudi J Gastroenterol. 2019;25:188–193. PMID: 30618439.
- Berg H, Roed J, Viby-Mogensen J, et al. Residual neuromuscular block is a risk factor for postoperative pulmonary complications. A prospective, randomised, and blinded study of postoperative pulmonary complications after atracurium, vecuronium and pancuronium. Acta Anaesthesiol Scand. 1997;41:1095–1103. PMID: 9366929.
- Althoff FC, Agnihotri A, Grabitz SD, et al. Outcomes after endoscopic retrograde cholangiopancreatography with general anaesthesia versus sedation. Br J Anaesth. 2021;126:191–200. PMID: 33046219.
- Coelho-Prabhu N, Shah ND, Van Houten H, et al. Endoscopic retrograde cholangiopancreatography: utilisation and outcomes in a 10-year population-based cohort. BMJ Open. 2013;3:e002689. PMID: 23793659.
- Cotton PB, Garrow DA, Gallagher J, Romagnuolo J. Risk factors for complications after ERCP: a multivariate analysis of 11,497 procedures over 12 years. Gastrointest Endosc. 2009;70:80–88. PMID: 19286178.
- Chandrasekhara V, Khashab MA, Muthusamy R, et al. Committee ASoP. Adverse events associated with ERCP. Gastrointest Endosc. 2017;85:32–47. PMID: 27546389.
- Raymondos K, Panning B, Bachem I, et al. Evaluation of endoscopic retrograde cholangiopancreatography under conscious sedation and general anesthesia. Endoscopy. 2002;34:721–726. PMID: 12195330.
- Wehrmann T, Kokabpick S, Lembcke B, et al. Efficacy and safety of intravenous propofol sedation during routine ERCP: a prospective, controlled study. Gastrointest Endosc. 1999;49:677–683. PMID: 10343208.
- Lapidus A, Gralnek IM, Suissa A, et al. Safety and efficacy of endoscopist-directed balanced propofol sedation during endoscopic retrograde cholangiopancreatography. Ann Gastroenterol. 2019;32:303–311. PMID: 31040629.
- Goudra BG, Singh PM, Gouda G, et al. Safety of nonanesthesia provider-administered propofol (NAAP) sedation in advanced gastrointestinal endoscopic procedures: comparative meta-analysis of pooled results. Dig Dis Sci. 2015;60:2612–2627. PMID: 25732719.
- Buxbaum J, Roth N, Motamedi N, et al. Anesthetist-directed sedation favors success of advanced endoscopic procedures. Am J Gastroenterol. 2017;112:290–296. PMID: 27402501.
- Fu ES, Downs JB, Schweiger JW, et al. Supplemental oxygen impairs detection of hypoventilation by pulse oximetry. Chest. 2004;126:1552–1558. PMID: 15539726.
- Hutton P, Clutton-Brock T. The benefits and pitfalls of pulse oximetry. BMJ. 1993;307:457–458. PMID: 8400922.
- Hug CC Jr. MAC should stand for maximum anesthesia caution, not minimal anesthesiology care. Anesthesiology. 2006;104:221–223. PMID: 16436837.


 Issue PDF
Issue PDF