Los beneficios de la anestesia de bajo flujo están bien establecidos e incluyen la reducción de los desechos anestésicos inhalados, disminución de los costos y menos efecto invernadero de los gases1. Para los pacientes en particular, la anestesia de bajo flujo reduce la pérdida de calor y humedad por los pulmones2. Este artículo destacará las preocupaciones habituales de seguridad de la anestesia de bajo flujo. Esto no tiene la intención de ser una guía completa para la práctica de la anestesia de bajo flujo, que está bien descrita en la bibliografía3, y es un tema que se tratará en la próxima iniciativa de formación en tecnología médica de la APSF-ASA. La buena noticia es que los riesgos de adoptar una anestesia de bajo flujo son fácilmente manejables, y la preocupación por la seguridad de los pacientes no debería ser un obstáculo para reducir el flujo de gas fresco.
El «sistema circular» fue diseñado para reducir el desperdicio de anestesia al permitir que el agente anestésico que se exhala regrese al paciente en los gases inspirados (figura 1). La absorción de dióxido de carbono (CO2) es fundamental para el diseño del sistema circular. Aunque los absorbentes de CO2 son necesarios para el uso seguro del sistema circular, la presencia de un absorbente no garantiza que el sistema circular esté reduciendo realmente los residuos. La reducción efectiva de los residuos requiere que el profesional de la anestesia reduzca el flujo de gas fresco de manera tal que permita que los gases que se exhalan vuelvan al paciente4.
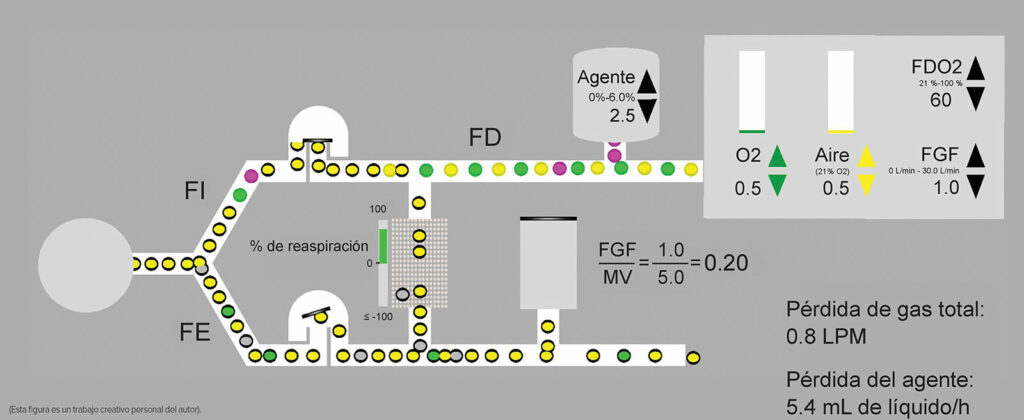
Figura 1: Esquema idealizado de un sistema cíclico donde FGF es una fracción del minuto de ventilación a 1 L/min – 0.5 L/min y O2 respectivamente. Aire = círculos amarillos, oxígeno = círculos verdes y agente = círculos morados. Círculos con bordes negros = gases exhalados o anestésicos, algunos de los cuales vuelven a la extremidad inspirada. Tenga en cuenta que la recirculación de gases exhalados, la concentración de oxígeno y la anestesia colocada en el flujo de gas fresco (FDO2 60 % y FDA 2.5 %) será distinta a la de las concentraciones inspiradas (FIO2 y FIA) debido a la combinación de gases frescos y gases exhalados (FEO2 y FEA). Las diferencias de concentración exactas dependerán de la fase del procedimiento y la diferencia disminuirá con el tiempo. FD = fracción entregada; FI = fracción inspirada; FE = fracción espirada; FGF = flujo de gas fresco; MV = minuto de ventilación.
La anestesia de bajo flujo se describe a veces como un flujo total de gas fresco de 1 litro/min. Sin embargo, en la práctica, la anestesia de bajo flujo no es un número único. Dependiendo de las circunstancias, 1 litro/min puede ser mucho para lograr el grado esperado de reducción de residuos, o muy poco para mantener una concentración adecuada de oxígeno o anestesia en el circuito. Para los efectos de esta discusión, los autores definen la práctica actual de la anestesia de bajo flujo como: Reducir el flujo de gas fresco por debajo de la ventilación minuto al nivel más bajo consistente con las capacidades del equipo y la comodidad del proveedor, mientras se garantiza atención segura y eficaz para el paciente. Aunque es cierto que la reducción del flujo de gas fresco reduce los residuos, los costos y la contaminación, no está exenta de tener consecuencias que repercutan en la seguridad del paciente.
La administración eficaz de oxígeno requiere una concentración de oxígeno inspirado que mantenga la concentración esperada de oxígeno en la sangre. Los requerimientos de los agentes anestésicos están dados por la necesidad de mantener un nivel adecuado de hipnosis y estabilidad fisiológica ante la estimulación quirúrgica y el trauma. A medida que se reduce el flujo de gas fresco y aumenta la reinhalación, las concentraciones suministradas en el gas fresco y las concentraciones inspiradas por el paciente pueden ser muy diferentes. Además, las concentraciones de gas y agentes cambian en el circuito más lentamente a medida que se reduce el flujo de gas fresco. El manejo de la relación entre las concentraciones administradas e inspiradas constituye el arte y la práctica de la anestesia de bajo flujo. Es importante tener en cuenta que el control de la concentración de dióxido de carbono está determinado por la ventilación minuto y no se ve afectado por el flujo de gas fresco.
Cómo garantizar un suministro adecuado de oxígeno
La preocupación por un suministro inadecuado de oxígeno que provoque hipoxemia o una inadvertida baja concentración de oxígeno inspirado es razonable, en la medida que se reduce el flujo de gas fresco. La concentración de oxígeno en el gas que se exhala (FEO2) siempre es menor que la concentración inspirada (FIO2) debido al consumo de oxígeno del paciente. A medida que aumenta el porcentaje de gas reinhalado, el FEO2 se mezcla con el oxígeno suministrado al paciente en el gas fresco (FDO2) para producir la FIO2. Cuanto más gas exhalado se permita devolver al paciente, mayor será el impacto de FEO2 en FIO2 (figura 1).
La vigilancia continua de la concentración de oxígeno inspirado es esencial para la práctica segura y eficaz de la anestesia de bajo flujo. A medida que se reducen los flujos, el proveedor de asistencia médica estima la concentración de oxígeno suministrada (FDO2) que mantendrá la concentración inspirada deseada (FIO2). En última instancia, el consumo de oxígeno del paciente y las posibles fugas en el circuito determinarán la FIO2 suministrada al paciente.
La vigilancia continua de la FIO2 ayudará a orientar los ajustes del flujo de gas fresco. Dado que la FIO2 cambia lentamente con un flujo de gas fresco bajo, se puede establecer una alarma de baja concentración de oxígeno por encima del nivel mínimo de seguridad para dar una notificación si la FIO2 es más baja de lo deseado.
El manejo de la concentración de oxígeno inspirado durante la anestesia de bajo flujo es relativamente sencillo, ya que el consumo de oxígeno es bastante constante durante un procedimiento. El manejo de la concentración inspirada del agente anestésico es un poco más desafiante, ya que la captación del agente disminuye exponencialmente con el tiempo.
Cómo garantizar una concentración adecuada del agente anestésico inspirado
Como se ha mencionado antes, la administración segura del agente anestésico requiere que el paciente tenga una concentración suficiente como para no estar consciente, pero no tanta como para que la estabilidad fisiológica se vea amenazada. Al igual que en el caso del oxígeno, la concentración expirada del agente anestésico (Agente FE) siempre será menor que la concentración inspirada del agente (Agente FI) por la captación, excepto durante la salida. Al principio del procedimiento, cuando la absorción del agente es alta, la diferencia entre Agente FE y Agente FI puede ser sustancial. Por ello, es más difícil reducir los flujos durante la inducción y mantener la concentración anestésica esperada en comparación con la fase de mantenimiento anestésico, cuando la captación se ha enlentecido y el Agente FE se aproxima al Agente FI.
La vigilancia continua de la concentración del agente anestésico inspirado y expirado es esencial para la práctica segura y eficaz de la anestesia de bajo flujo. La diferencia entre la concentración de agente anestésico inspirado y expirado indica la tasa de captación. A medida que la diferencia se reduce, la captación es más lenta y es más fácil reducir los flujos y mantener la concentración de anestesia esperada en el circuito. Mientras que la concentración del agente administrado, Agente FD, está determinada por el ajuste del vaporizador, el Agente FI indica lo que está siendo inspirado por el paciente. A medida que se reducen los flujos, puede ser necesario aumentar el ajuste del vaporizador por encima de la concentración mínima alveolar (MAC) esperada en el paciente para mantener el Agente FI y el Agente FE en los niveles deseados. Al igual que la administración de oxígeno, el ajuste del vaporizador es estimado por el proveedor de asistencia médica de bajo flujo, y la vigilancia continua de la concentración del agente se vuelve esencial para guiar los ajustes del vaporizador y del flujo de gas fresco.
Manejo del flujo de gas fresco cuando se cambian las concentraciones de oxígeno y agente
Un desafío importante para la práctica de la anestesia de bajo flujo es la velocidad de cambio de las concentraciones de oxígeno y agentes en el circuito. La constante de tiempo para la tasa de cambio es el volumen interno de la máquina de anestesia y del circuito respiratorio en litros dividido por el flujo de gas fresco en L/min. El volumen interno puede ser de 5 litros o más, de modo que un flujo de gas fresco de 1 L/min podría dar lugar a una constante de tiempo de 5 minutos, y pueden ser necesarias cuatro constantes de tiempo para llegar al equilibrio.
A medida que se reduce el flujo de gas fresco, las concentraciones de oxígeno y anestésico cambiarán más lentamente para llegar a un nuevo equilibrio. Como resultado, el proveedor puede cambiar la mezcla de gases o el ajuste del vaporizador, pero el impacto final sobre las concentraciones en el circuito no será evidente por varios minutos. Esta es otra razón para la vigilancia continua de las concentraciones de oxígeno y agentes en el circuito, y el uso de límites de alarma altos y bajos para llamar la atención sobre los cambios lentos que de otro modo podrían pasar desapercibidos. De hecho, puede ser necesario aumentar el flujo total de gas fresco para garantizar que las concentraciones de oxígeno y agentes cambien más rápidamente si es necesario.
¿Tiene el sevoflurano un flujo mínimo de gas fresco seguro?
El folleto del envase del sevoflurano indica que es seguro cuando el flujo de gas fresco no es menor de 1 L/min para un máximo de 2 MAC-hora o no menos de 2 L/min para procedimientos más largos5. Esta recomendación no es científicamente válida ni coherente con una práctica moderna de anestesia de bajo flujo. No obstante, teniendo en cuenta el etiquetado de la FDA, es comprensible que los proveedores se muestren reacios a reducir los flujos a menos de estas recomendaciones y a administrar sevoflurano «fuera de lo indicado». En otro artículo de la página 57 de este Boletín, Brian Thomas JD, vicepresidente de Gestión de Riesgos en Preferred Physicians Medical, da algunas orientaciones sobre las preocupaciones médico-legales reales asociadas a la administración de medicamentos fuera de lo indicado. Este artículo revisará brevemente la ciencia que indica claramente que un límite de flujo más bajo para el sevoflurano es innecesario.
La principal preocupación para reducir los flujos cuando se utiliza sevoflurano es la acumulación del compuesto A en el circuito y el potencial de toxicidad renal. Aunque no cabe duda de que el sevoflurano puede interactuar con algunas fórmulas absorbentes para producir el compuesto A, nunca se ha demostrado que produzca toxicidad renal en los seres humanos6. Además, después del etiquetado del sevoflurano de la FDA, se demostró claramente que el compuesto A resulta de la interacción del sevoflurano con absorbentes que contienen bases fuertes como el hidróxido de potasio (KOH) y el hidróxido de sodio (NaOH)7. También se ha demostrado que la eliminación del KOH y la limitación del NaOH a menos del 2 % produce un absorbente eficaz que no produce el compuesto A8. En resumen, aunque no existe una preocupación justificada por el daño al paciente a causa del compuesto A, no hay riesgo de producción de compuesto A cuando se utiliza uno de los muchos absorbentes de dióxido de carbono disponibles que limitan la base fuerte a NaOH <2 %. Todos los absorbentes tienen una ficha técnica de seguridad que se puede consultar fácilmente en internet y que indica la composición química del absorbente (figura 2). Cualquier flujo de gas fresco puede utilizarse con seguridad cuando se administra sevoflurano, siempre que se tengan en cuenta las consideraciones sobre la concentración de oxígeno que se indicaron antes.
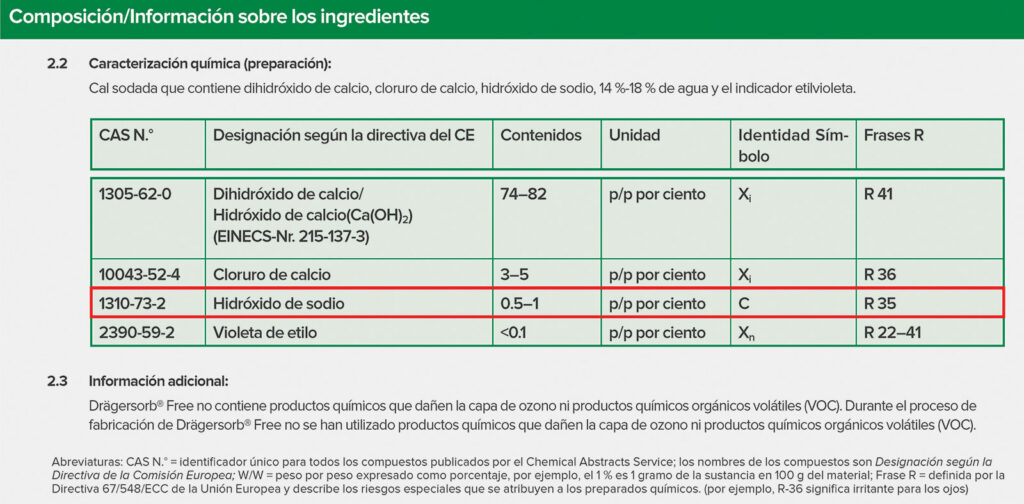
Figura 2: Instantánea de la hoja informativa de seguridad médica de Drägersorb Free. Tenga en cuenta que la composición química se nota claramente, la concentración de hidróxido de sodio es de 0.5 %-2 %. De https://www.medline.com/media/catalog/Docs/MSDS/MSD_SDSD71242.pdf.. Consultado el 4/4/2022. También hay hojas informativas similares de dominio público sobre seguridad de cualquier absorbente de CO2 disponible para la venta.
Conclusión
La práctica de la anestesia de bajo flujo, segura y eficaz, es un arte que requiere que el proveedor comprenda las capacidades y limitaciones del sistema circular, que ajuste el flujo de gas fresco y las concentraciones del vaporizador para calcular las necesidades del paciente, y que vigile continuamente las concentraciones resultantes en el circuito. ¿Está interesado en reducir los desechos y la contaminación en su práctica de la administración de anestesia inhalada? Busque el curso de la APSF-ASA sobre anestesia de bajo flujo que estará disponible en el sitio web de la APSF en otoño de 2022.
Jeffrey Feldman, MD, MSE es presidente del Comité de Tecnología de la APSF y profesor de anestesiología clínica en Children’s Hospital of Philadelphia Perelman School of Medicine.
Samsun Lampotang, PhD, FSSH, FAIMBE, es titular de la Cátedra JS Gravenstein de Anestesiología, y es director del CSSALT y director de Innovaciones de la Oficina de Educación Médica de la Facultad de Medicina de University of Florida.
El Dr. Feldman es consultor de Medtronic, Becton-Dickinson y Micropore. El Dr. Lampotang no tiene ningún conflicto de interés.
Referencias:
- Ryan SMR, Nielsen CJ. Global warming potential of inhaled anesthetics: application to clinical use. Anesth Analg. 2010;11:92–98. 20519425. Accessed April 22, 2022.
- Baum JA. Low flow anaesthesia. 2nd Edition. Butterworth-Heinemann. 2001. pp. 100–105.
- Feldman JM. Managing fresh gas flow to reduce environmental contamination. Anesth Analg. 2012;114:1093–1101. 22415533. Accessed April 22, 2022.
- Waters RM. Carbon dioxide absorption from anaesthetic atmospheres. proceedings of the Royal Society of Medicine. 1936;30:1–12. https://journals.sagepub.com/doi/pdf/10.1177/003591573603000102. Accessed April 22, 2022.
- Ultane (Sevoflurane). Revised 09/01/2003. https://www.accessdata.fda.gov/drugsatfda_docs/label/2006/020478s016lbl.pdf. Accessed March 13, 2022.
- Sondekoppam RV et. Al. The impact of sevoflurane anesthesia on postoperative renal function: a systematic review and meta-analysis of randomized controlled trials. Can J Anaesth. 2020;67:1595–1623. 32812189. Accessed April 22, 2022.
- Keijzer C, Perez R, DeLange J. Compound A and carbon monoxide production from sevoflurane and seven different types of carbon dioxide absorbent in a patient model. Acta Anaesthesiol Scand. 2007;51:31–37. 17096668. Accessed April 22, 2022.
- Kobayashi S, Bito H, et al. Amsorb Plus And Drägersorb Free, two new-generation carbon dioxide absorbents that produce a low compound a concentration while providing sufficient CO2 absorption capacity in simulated sevoflurane anesthesia. J Anesth. 2004;18:277–281. 15549470. Accessed April 22, 2022.


 Issue PDF
Issue PDF