| Este artículo se publicó anteriormente en el portal en línea de la APSF. Los autores actualizaron y modificaron esta versión para esta edición del Boletín informativo de la APSF. |
Estimados de Respuesta rápida:
La crisis global por COVID-19 ha afectado a todos los aspectos de nuestros sistemas de atención médica. Las preocupaciones sobre el peligro biológico del SARS-CoV-2, la propagación y la transmisión a los pacientes, al personal de atención médica, al entorno y a los equipos han sido muy difundidas, sobre todo con los procedimientos que generan aerosoles (AGP).1-3 La trasmisión del virus es de naturaleza principalmente respiratoria. El virión del SARS-CoV-2 mide aproximadamente 120 nanómetros de diámetro (0,06–0,14 μm) y se trasmite de persona a persona por partículas del portador biológico, como las gotitas o los aerosoles.2,3 Las recomendaciones sobre los niveles adecuados de EPI, el lavado de manos, la limpieza de superficies, la descontaminación y las precauciones en los procedimientos de manejo de la vía aérea se han analizado extensivamente en la pandemia.4-6 Como sucede con otras enfermedades respiratorias transmisibles, confiamos en dos sistemas importantes de filtrado: el filtrado de circuitos cuando se usan sistemas de respiración artificial en el pabellón o en las unidades de cuidados intensivos (UCI) y las mascarillas respiratorias.
Sin embargo, las cosas son un poco más complicadas:
- Las máquinas de anestesia y los respiradores mecánicos necesitan filtros para la purificación de la calidad del aire y para la prevención de la contaminación cruzada. El estándar de eficiencia de estos filtros se denomina “HEPA” por su alta eficiencia con partículas del aire/alta eficiencia en la capacidad para absorber partículas.7 La ASA recomienda situar los filtros HEPA entre la pieza “Y” del circuito respiratorio y la mascarilla del paciente, el tubo endotraqueal o la mascarilla laríngea.8
- Las normas para determinar la eficiencia de los filtros de EE. UU son diferentes a las de Europa: Las normas europeas usan un 99,95 % de eliminación de partículas con un diámetro de 0,3 μm, mientras que las de EE. UU usan un 99,97 %.9.
- La eficiencia de las mascarillas está determinada por el nivel de penetración de partículas. Por ejemplo, una mascarilla N95 elimina al menos el 95 % de las partículas de 300 nm por medio de un caudal de aire de 85 litros/min.10 Los respiradores de las mascarillas están regulados según el Instituto Nacional para la Seguridad y Salud Ocupacional de EE. UU. (U.S National Institute for Occupational Safety and Health, NIOSH) y según normas y pruebas reconocidas a nivel internacional.
- Los filtros en los circuitos de respiración y las máquinas de anestesia no están regulados. No existen pruebas estándares internacionales ni nacionales para los filtros de los circuitos respiratorios. Como no hay pruebas estándares, ¿todos los fabricantes informan lo mismo cuando se analiza el nivel de eficiencia?11
- ¿Los filtros actuales disponibles son adecuados para el COVID-19?
- Debido a que muchos pacientes de COVID-19 requieren ventilación mecánica prolongada, ¿con qué frecuencia deben cambiarse estos filtros en la unidad de cuidados intensivos (UCI)?
- ¿Qué deben hacer los profesionales de atención médica en caso de que haya escasez de filtros?
Estas son algunas de las preguntas apremiantes sobre los filtros HEPA que quisiera que se analicen.
Muchas gracias.
Felipe Urdaneta
Profesor clínico de Anestesiología
Universidad de Florida/NFSGVHS
Gainesville, Florida
El autor es asesor de Medtronic y miembro del consejo asesor de Vyaire, y ha recibido honores como portavoz en nombre de dichas entidades.
Referencias
- Canova V, Lederer Schlpfer H, Piso RJ, et al. Transmission risk of SARS-CoV-2 to healthcare workers—observational results of a primary care hospital contact tracing. Swiss Medical Weekly. 2020;150:1–5.
- Asadi S, Bouvier N, Wexler AS, et al. The coronavirus pandemic and aerosols: Does COVID-19 transmit via expiratory particles? Aerosol Sci Technol. 2020;0:1–4.
- van Doremalen N, Bushmaker T, Morris DH, et al. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1. N Engl J Med. 2020;382:1564–1567.
- Asenjo JF. Safer intubation and extubation of patients with COVID-19. Can J Anaesth. 2020:1–3.
- Chia SE, Koh D, Fones C, et al. Appropriate use of personal protective equipment among healthcare workers in public sector hospitals and primary healthcare polyclinics during the SARS outbreak in Singapore. Occup Environ Med. 2005;62:473–477.
- Sorbello M, El-Boghdadly K, Di Giacinto I, et al. The Italian coronavirus disease 2019 outbreak: recommendations from clinical practice. Anaesthesia. 2020;75:724–732.
- First MW. Hepa filters. Appl Biosaf. 1998;3:33–42.
- American Society of Anesthesiologists. Information for health care professionals. Published 2020. https://www.asahq.org/about-asa/governance-and-committees/asa-committees/committee-on-occupational-health/coronavirus. Accessed June, 2020.
- Wikipedia. HEPA. https://en.wikipedia.org/wiki/HEPA. Accessed June 9, 2020.
- Haghighat F, Bahloul A, Lara J, et al. Development of a procedure to measure the effectiveness of N95 respirator filters against nanoparticles. 2012.
- NIOSH-Approved Particulate Filtering Facepiece Respirators. https://www.cdc.gov/niosh/npptl/topics/respirators/disp_part/default.html. Accessed June 9, 2020.
Respuesta:
Agradecemos a Felipe Urdaneta, MD, por aclarar algunas confusiones sobre el uso de los filtros de sistemas respiratorios para la anestesia en respuesta a la pandemia de COVID-19. El sitio web de la APSF tiene una página (https://www.apsf.org/faq-on-anesthesia-machine-use-protection-and-decontamination-during-the-covid-19-pandemic/) que resume las estrategias actuales para proteger la máquina de anestesia de la contaminación por un paciente posiblemente infectado. Sin embargo, no brinda toda la información en la que se basan las recomendaciones. En este artículo se ofrecerá información, como el riesgo de que un paciente transmita la infección por medio del sistema respiratorio, los modos de transmisión del virus, los conceptos físicos de la filtración, los tipos de filtros y las pruebas estandarizadas y especificaciones de los filtros, en un esfuerzo por responder las preguntas de Felipe Urdaneta y aclarar confusiones similares entre nuestros lectores.
Riesgo de infección cruzada del paciente mediante el sistema respiratorio
Los sistemas de circuitos respiratorios presentan el riesgo hipotético de que el paciente tenga infección cruzada por la aspiración de gases que se exhalaron previamente. Antes de la década de 1990, los filtros para sistemas respiratorios en anestesia no se usaban de rutina, y se creía que la infección cruzada de los pacientes se prevenía mediante el paso del gas exhalado a través del absorbente de dióxido de carbono alcalino.1 Sin embargo, los filtros para sistemas de respiración fueron cada vez más necesarios en la década de 19902 después de un informe de nueve casos de infección cruzada por hepatitis C, que se atribuyó a sistemas respiratorios de anestesia contaminados.3 Hay evidencia contradictoria sobre el potencial para la infección cruzada; casi ningún caso fue documentado, pero las pruebas in vitro demuestran la posibilidad.4-6 En cualquier caso, diferentes sociedades de anestesia recomiendan el uso de filtros para sistemas de respiración, pero solo cuando los circuitos de respiración se vuelven a usar entre pacientes.7,8
Modos de transmisión de virus respiratorios
El COVID-19 (SARS-CoV-2) se transmite principalmente por vía aérea, como el síndrome respiratorio agudo grave (SARS-CoV), el síndrome respiratorio de Oriente Medio asociado con el coronavirus (MERS-CoV) y otros tipos de coronavirus. Se transmite mediante gotitas de un tamaño mayor a 20 micrones de diámetro y mediante aerosoles menores de 5 a 10 micrones de diámetro.9 Las gotitas tienden a caer por la gravedad, mientras que las partículas de aerosol flotan en el aire y siguen las corrientes de aire. Las partículas de tamaño intermedio comparten algunas propiedades de las gotitas y de los aerosoles. La evaporación rápida de las gotitas pequeñas ocasiona la formación de núcleos de gotitas incluso más pequeñas que también siguen las corrientes de aire. Las gotitas, los aerosoles y las partículas de tamaño intermedio se generan al toser, al estornudar y al hablar, mientras que los aerosoles se generan principalmente en la respiración pasiva. Un concepto importante en la filtración de los agentes patógenos es que los virus respiratorios no se transmiten como partículas de virus aisladas que flotan en el aire, sino por virus contenidos en partículas más grandes. Las gotitas y otras partículas de tamaño intermedio pueden depositarse en las superficies, lo que ocasiona una posible transmisión por superficies.
Ningún estudio ha calculado cuántas partículas de virus SARS-CoV-2 exhalan los pacientes infectados. Sin embargo, en un estudio que cuantificó la exhalación de otras partículas de virus respiratorios, se encontró que los pacientes infectados por coronavirus estacionales exhalaron y tosieron de 0 a 200 000 partículas de virus por hora.10
Aunque una sola partícula viral puede, en teoría, ocasionar una infección sistémica, la probabilidad de infección aumenta con la duración y la magnitud de la exposición viral.11
Conceptos físicos de la filtración
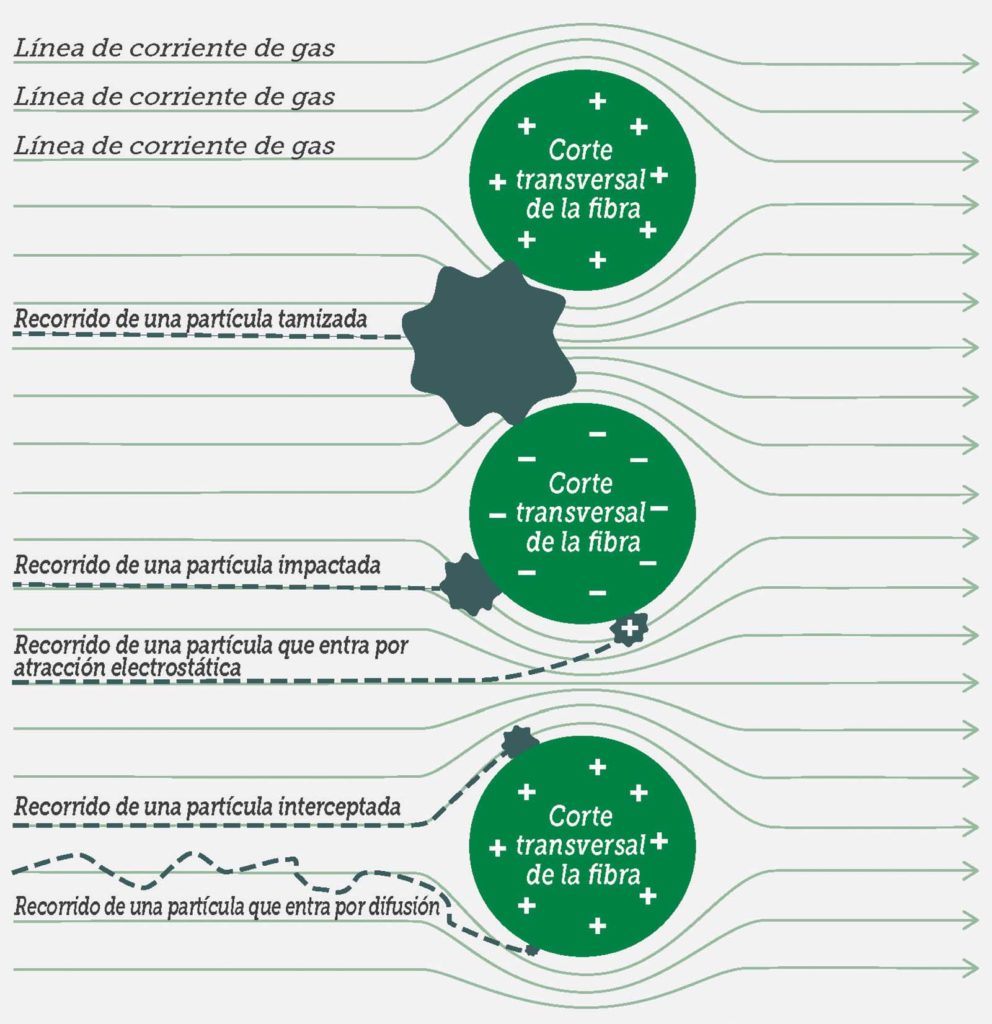
En general, la gente entiende los conceptos físicos de la filtración por tamiz, un fenómeno observable en coladores, en el que las partículas más grandes que los orificios más pequeños no pueden pasar por el filtro. Sin embargo, hay otras fuerzas que actúan con las partículas muy pequeñas (p. ej., de un diámetro <2 micrones).12 Las partículas muy pequeñas tienden a adherirse al material filtrado una vez que entran en contacto, incluso si pudieran pasar por los orificios del filtro. Existen cuatro mecanismos básicos en los que las partículas entran en contacto con el material del filtro. Las partículas que están en el intervalo de 0,11 micrones pueden impactar directamente la trama del filtro mediante un proceso llamado impacto por inercia. Las partículas que están en el intervalo de 0,05 micrones a 1 micrón pueden entrar en contacto tangencialmente con la trama del filtro mediante un proceso llamado intercepción. A medida que las partículas se hacen más pequeñas, exhiben un movimiento browniano cada vez mayor además de moverse con el flujo de aire, y pueden entrar en contacto con el material del filtro como consecuencia de este movimiento errático mediante un proceso llamado difusión. Finalmente, las partículas pequeñas cargadas pueden ser atraídas a la superficie cargada del material del filtro mediante un proceso llamado atracción electrostática. La figura 1 ilustra cada uno de estos fenómenos, y la figura 2 muestra cómo la suma de estos fenómenos afecta a la eficiencia general del filtro. Téngase en cuenta que, en la mayoría de filtros de aire, las partículas de aproximadamente 0,3 micrones (es decir, 300 nanómetros) de tamaño son las más difíciles de atrapar; las partículas más grandes o más pequeñas son más fáciles de atrapar.
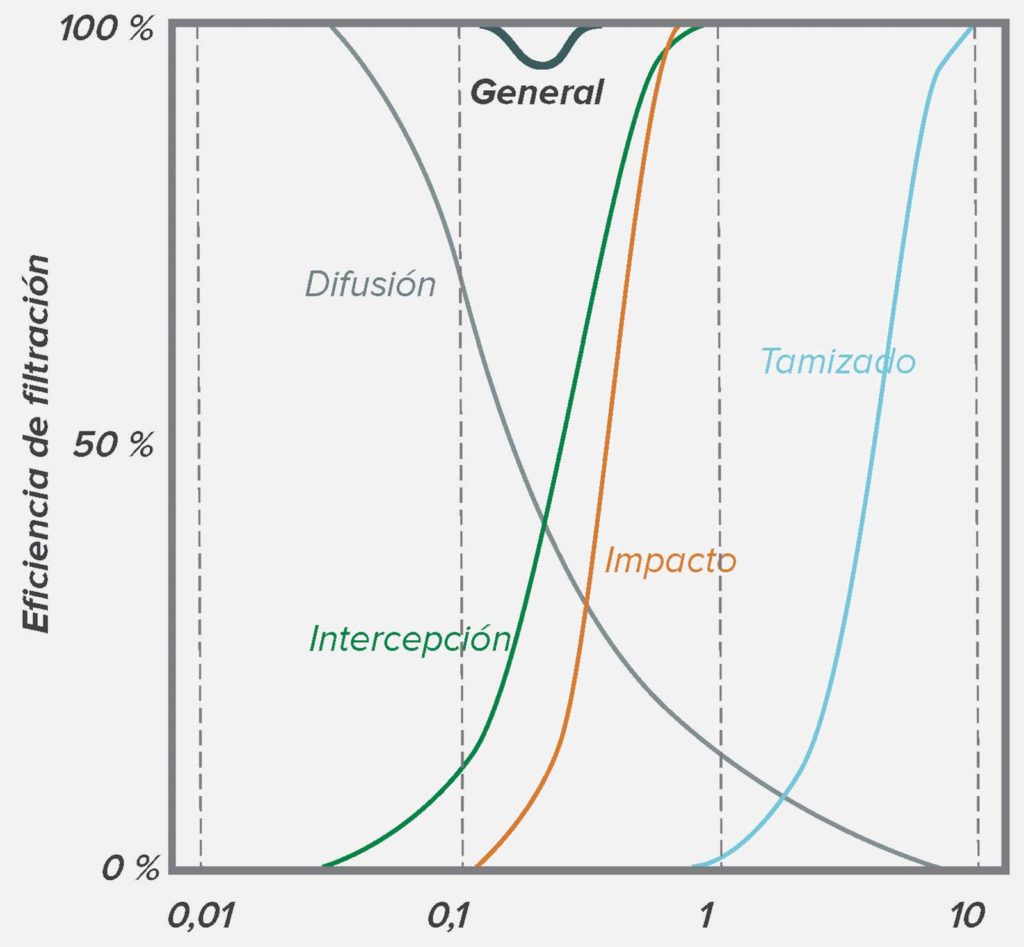
Figura 2: Los fenómenos de filtración individuales se acumulan y producen una filtración general para partículas de distintos tamaños. Obsérvese que la eficiencia más baja es de aproximadamente 0,3 micrones.
Tipos de filtros usados en los sistemas respiratorios de anestesia
Filtros mecánicos con pliegues
Los filtros mecánicos con pliegues contienen una capa gruesa de fibras compactas, orientadas aleatoriamente y de adhesión hidrófoba, que capturan partículas en la profundidad del filtro. El material del filtro tiene pliegues para aumentar el área de superficie y disminuir la resistencia al flujo de aire. Esto suele tener una eficiencia de filtración muy alta y también puede causar un poco de intercambio de calor y humedad cuando se coloca cerca de la vía aérea, en un lugar con un flujo de aire de dos vías. Cuando se usan en un entorno húmedo, su eficiencia de filtración y su resistencia al flujo de aire puede mejorar o empeorar; pero tienden a ser muy efectivos con la humedad.13 Los líquidos no pasan fácilmente por los filtros mecánicos con pliegues.14. Los filtros mecánicos suelen costar más y tienen un mayor volumen interno que los filtros electrostáticos.
Filtros electrostáticos
Los filtros electrostáticos contienen una capa delgada de fibras electrostáticas, con una trama menos densa. Su resistencia al flujo de aire es menor para una determinada área de superficie, así que no tienen pliegues. Los filtros electrostáticos suelen tener una eficiencia de filtración 1000 veces menor a los filtros mecánicos con pliegues.13 Su eficiencia de filtración y su resistencia al flujo de aire pueden mejorar o empeorar en un entorno húmedo. Los líquidos pasan fácilmente por un filtro electrostático.14
Filtros de intercambio de calor y humedad (HMEF)
Por sí solos, los dispositivos de intercambio de calor y humedad (HME) no funcionan como filtros. Los HME que contienen un filtro electrostático o mecánico con pliegues se denominan HMEF. Los HME y los HMEF solo son efectivos para la humidificación cuando se colocan cerca de la vía aérea, en un lugar con un flujo de aire de dos vías, donde absorben el agua en la exhalación y la liberan durante la inhalación.15
Filtros de membrana
Un tipo de filtro totalmente diferente se usa en los analizadores de gases respiratorios para prevenir el ingreso de líquido en la cámara analizadora. Aunque no están clasificados como filtros para sistemas respiratorios, los filtros de membrana hidrofóbica suelen incluirse en colectores de agua porque permiten que el gas pase cuando están secos, pero se obstruyen cuando están mojados. Los filtros de membrana tienen poros y canales muy pequeños que pueden evitar el pasaje de partículas, principalmente mediante el “tamizado”.
Pruebas estandarizadas y especificaciones de filtros
Filtración de partículas
Hay una única norma internacional para probar la eficiencia de filtración de los filtros para sistemas respiratorios, la ISO 23328-1: Filtros de sistemas respiratorios para uso anestésico y respiratorio.16 La norma describe un método, la prueba con solución salina, que cuantifica la cantidad de partículas de cloruro de sodio aéreas de 0,1 a 0,3 micrones que pasan por el filtro en una breve prueba con índices de flujo de aire que probablemente se encuentran durante el uso previsto. Los filtros pediátricos y para adultos son probados con 0,1 mg o 0,2 mg de partículas de cloruro de sodio a 15 l/min o 30 l/min, respectivamente. Los filtros son preacondicionados en aire humidificado para simular un período de uso clínico antes de pasar por la prueba. Para la prueba se usan partículas de sal seca cargadas no electrostáticamente, porque son muy difíciles de atrapar. El método no evalúa el rendimiento de la filtración para gotitas ni aerosoles, ni pretende probar el rendimiento de la filtración para microorganismos. Es solo con fines de comparación y no tiene importancia clínica comprobada. El estándar no contiene umbrales para el rendimiento mínimo sobre la eficiencia del filtro para sistemas respiratorios. Los resultados de la prueba están expresados como porcentaje de eficiencia de filtración, que es el porcentaje de partículas de la prueba que no pasa por el filtro. Por ejemplo, si el filtro se prueba con 10 millones (107) de partículas y se detectan 1000 (103) partículas del otro lado, el porcentaje de eficiencia de filtración es de 100 * (1 – 103/ 107) = 99,99 %.
Se usan diferentes estándares para probar y clasificar otros tipos de filtros. En particular, el Instituto Nacional para la Seguridad y Salud Ocupacional desarrolló el NIOSH 42 CFR Parte 84: Dispositivos de protección respiratoria17 como método para probar y calificar los respiradores purificadores de aire sin suministro eléctrico. La serie N de respiradores que se usan en atención médica se prueban con 200 mg de partículas de cloruro de sodio seco cargado no electrostáticamente que tienen entre 0,1 a 0,3 micrones de tamaño a una tasa de flujo de 85 l/min.18 Esta prueba es similar pero más estricta que la ISO 23328-1 debido a la mayor masa de partículas y tasa de flujo. Otra prueba de filtración estándar notable es la IEST-RP-CC001: Filtros HEPA Y ULPA,19 que prueban el rendimiento de los filtros usados en dispositivos de aire limpio y salas limpias. HEPA equivale a filtros de aire con partículas de alta eficiencia (high-efficiency particle air), que quitan el 99,97 % de las partículas con un diámetro de 0,3 micrones. Sin embargo, no es apropiado aplicar este término a los filtros para sistemas respiratorios porque los métodos de prueba son diferentes.
Filtración de microorganismos
Algunas publicaciones de productos de filtros para sistemas respiratorios contienen declaraciones sobre la eficiencia de filtración bacteriana o viral. No existe ninguna prueba estándar para determinar la eficiencia de filtración bacteriana o viral de los filtros para sistemas respiratorios, pero hay métodos estándar para dicha determinación en otros tipos de filtros. Uno de ellos es el ASTM F2101–19: Método de prueba estándar para evaluar la eficiencia de la filtración bacteriana (BFE) del material de mascarillas médicas, usando un aerosol biológico de Staphylococcus aureus.20 Un procedimiento similar en el que se usan aerosoles biológicos de Bacillus subtilis o colífago MS-2 para probar los filtros para sistemas respiratorios es descrito por Wilkes y otros21 y es el mismo que está en Draft BS EN 13328-1 (que nunca pasó de la etapa de borrador). En ambos procedimientos, las suspensiones de bacterias o virus son convertidas a aerosol en partículas líquidas del tamaño de 3,0 micrones y pasan por el material de filtro por vacío posterior. Todo lo que pasa a través del filtro se captura en un caldo de cultivo o en placas de cultivo. El porcentaje de eficiencia de filtración se calcula dividiendo la cantidad de partículas cultivadas de salida del filtro por la cantidad de entrada de la prueba. A simple vista, estos métodos podrían parecer más relevantes desde el punto de vista clínico que el método de la prueba de sal. Usan partículas de líquido de mayor tamaño que el método de la prueba de sal. Las partículas de líquido pueden estar cargadas electrostáticamente. Solo se cuentan los microorganismos viables. Sin embargo, estos métodos son menos reproducibles. En general, el mismo filtro tendrá eficiencias de filtración de mayor porcentaje para las bacterias que para los virus o las partículas de sal.
Prueba de punto de burbuja
Los filtros de membrana están clasificados por el tamaño de los poros, que se determina indirectamente usando la prueba de punto de burbuja. La prueba de punto de burbuja se basa en el principio de que el líquido se retiene en los poros del filtro por la tensión superficial y las fuerzas capilares, y que la presión mínima requerida para forzar la salida del líquido de los poros está relacionada con el diámetro del poro. Sin embargo, el tamaño de los poros no puede usarse como un sustituto para la eficiencia de filtración de una partícula o un agente patógeno. Los filtros de membrana hidrófilos de 0,22 micrones se utilizan frecuentemente para esterilizar productos farmacéuticos y mantener la esterilidad de las infusiones epidurales, pero no se ha probado su eficiencia para filtrar partículas aéreas. Algunos filtros de membrana hidrófobos de 0,2 micrones (p. ej., los de GE D-Fend Pro, Dräger WaterLock® 2, y las trampas de agua Covidien FilterLine®) fueron probados de manera independiente, y tienen una eficiencia de filtración viral aérea del 99,99 % o mayor.
Recomendaciones clínicas
En 2003, los Centros para el Control y la Prevención de Enfermedades de los EE. UU. afirmaron: “No puede darse una recomendación para la colocación de un filtro bacteriano en el sistema respiratorio o circuito del equipo de anestesia de un paciente”, citando estudios de hace 40 años que mostraron fallas en los circuitos respiratorios estériles o filtros para sistemas para reducir la incidencia de la neumonía posoperatoria.22 Actualmente, no hay reglamentos para el uso de filtros en el sistema respiratorio en las máquinas de anestesia. Sin embargo, parece prudente prevenir, tanto como sea posible, la infección cruzada de pacientes con SARS-CoV-2 en esta pandemia de COVID-19. Hay escasos informes de infección cruzada por máquinas de anestesia contaminadas antes del SARS, MERS y COVID-19, pero el riesgo de estos gérmenes patógenos actualmente se desconoce. Para tomar todas las precauciones y con la información de los conocimientos existentes, la APSF y la ASA recomiendan usar filtros en los sistemas de respiración, ya que reconocen que los estudios científicos estaban incompletos. (https://www.apsf.org/faq-on-anesthesia-machine-use-protection-and-decontamination-during-the-covid-19-pandemic/).
Agregar filtros al sistema de respiración tiene sus riesgos.23,24 Según la ubicación, pueden agregar espacio muerto, que aumenta la reaspiración de dióxido de carbono y demora la inducción y emergencia de la inhalación. Aumentan la resistencia a un flujo de inhalación o exhalación, lo que aumenta el trabajo respiratorio espontáneo, y afecta a la mecánica pulmonar (los métodos de prueba se describen en la norma internacional ISO 9360-1).25 Los filtros pueden obstruirse y causar hipoventilación y barotraumatismo, que ponen en peligro la vida. Agregan peso al circuito respiratorio y lugares para la desconexión accidental.
Se desconoce la eficiencia de filtración requerida para prevenir la infección de virus exhalados por el sistema. Si un paciente exhala 200 000 partículas de virus por hora, un filtro electrostático que atrape el 99,9 % de esos virus dejará pasar solamente 200. Colocar dos de estos filtros en serie (p. ej., uno en la vía aérea y otro en el conector de espiración) multiplicará la eficiencia de la filtración al 99,9999 %, haciendo que el riesgo de pasaje del virus sea casi nulo, pero duplicará la resistencia al flujo. Usar un solo filtro en el sistema de respiración mecánico con pliegues de alta eficiencia (p. ej., 99,9999 %) en la vía aérea capturará la misma cantidad de virus y causará menos resistencia en la vía aérea que dos filtros electrostáticos en serie, pero puede aumentar el espacio muerto.
Los profesionales clínicos deben conocer las especificaciones de los filtros para los sistemas que tienen disponibles. Estas pueden encontrarse en el sitio web o en la línea de ayuda del fabricante, en la documentación del producto, en línea y en artículos de publicaciones.13,14 Las especificaciones importantes son:
- eficiencia de filtración bacteriana y viral (cuanto más alto sea el porcentaje, mejor),
- eficiencia de filtración con cloruro de sodio o sal (cuanto más alto sea el porcentaje, mejor),
- resistencia al flujo (descenso en la presión en Pa o cmH2O en una tasa dada de flujo de aire en l/min; cuanto más bajo, mejor),
- cómo las especificaciones anteriores son afectadas por el acondicionamiento del filtro en la humedad,
- volumen interno (ml; cuanto más bajo, mejor), y
- humidificación
- (pérdida de la humedad en mgH2O/l de aire; cuanto más bajo, mejor), o
- (salida de humedad en mgH2O/l de aire; cuanto más alto, mejor).
Cabe destacar que algunas publicaciones mencionan evaluaciones que se hicieron hace 10 o 20 años, y que los productos pueden haber cambiado o ser fabricados o distribuidos por diferentes compañías.
Robert G. Loeb, MD, es profesor clínico de anestesiología en la Facultad de Medicina de la Universidad de Florida, Gainesville, FL.
Es empleado de la Universidad de Florida, director del Comité de la Sociedad Americana de Anestesiólogos en Equipos e Instalaciones, y pertenece al consejo asesor técnico de Masimo, Inc.
Referencias
- Murphy PM, Fitzgeorge RB, Barrett RF. Viability and distribution of bacteria after passage through a circle anaesthetic system. Br J Anaesth. 1991;66:300–304.
- Atkinson MC, Girgis Y, Broome IJ. Extent and practicalities of filter use in anaesthetic breathing circuits and attitudes towards their use: a postal survey of UK hospitals. Anaesthesia. 1999;54:37–41.
- Chant K, Kociuba K, Munro R, et al. Investigation of possible patient-to-patient transmission of hepatitis C in a hospital. New South Wales Public Health Bulletin. 1994;5:47–51.
- Spertini V, Borsoi L, Berger J, et al. Bacterial contamination of anesthesia machines’ internal breathing-circuit-systems. GMS Hyg Infect Control. 2011;6(1).
- Lloyd G, Howells J, Liddle C, et al. Barriers to hepatitis C transmission within breathing systems: efficacy of a pleated hydrophobic filter. Anaesth Intensive Care. 1997;25:235–238.
- Heinsen A, Bendtsen F, Fomsgaard A. A phylogenetic analysis elucidating a case of patient-to-patient transmission of hepatitis C virus during surgery. J Hosp Infect. 2000;46: 309–313.
- Australian & New Zealand College of Anaesthetists. PS28 Guideline on infection control in anaesthesia 2015. Available at: https://www.anzca.edu.au/safety-advocacy/standards-of-practice/policies,-statements,-and-guidelines Accessed July 6, 2020.
- Association of Anaesthetists of Great Britain & Ireland. Guidelines: infection prevention and control 2020. https://anaesthetists.org/Portals/0/PDFs/Guidelines%20PDFs/Infection_Control_Guideline_FINAL%202020.pdf?ver=2020-01-20-105932-143 Accessed July 6, 2020.
- Tellier R, Li Y, Cowling BJ, Tang JW. Recognition of aerosol transmission of infectious agents: a commentary. BMC Infect Dis. 2019;19:101.
- Leung NH, Chu DK, Shiu EY, et al. Respiratory virus shedding in exhaled breath and efficacy of face masks. Nat Med. 2020;26:676–680.
- Nicas M, Hubbard AE, Jones RM, Reingold AL. The infectious dose of variola (smallpox) virus. Appl Biosaf. 2004;9:118–127.
- Hakobyan NA. Introduction to basics of submicron aerosol particles filtration theory via ultrafine fiber media. Armen J Phys. 2015;8:140–151.
- Wilkes A. Breathing system filters: an assessment of 104 breathing system filters. MHRA Evaluation 04005. March 2004 https://www.psnetwork.org/wp-content/uploads/2018/01/An-assessment-of-104-breathing-system-filters-MHRA-Evaluation-04005-2004-.pdf Accessed July 6, 2020.
- Wilkes AR. The ability of breathing system filters to prevent liquid contamination of breathing systems: a laboratory study* APPARATUS. Anaesthesia. 2002;57:33–39.
- Wilkes AR. Heat and moisture exchangers and breathing system filters: their use in anaesthesia and intensive care. Part 1–history, principles and efficiency. Anaesthesia. 2011;66:31–9.
- International Organization for Standardization. Breathing system filters for anaesthetic and respiratory use — Part 1: Salt test method to assess filtration performance. (ISO 23328-1:2003) https://www.iso.org/standard/35330.html Accessed July 6, 2020.
- Department of Health and Human Services. 42 CFR Part 84 Respiratory protective devices; final rules and notice. Federal Register Volume 60, Number 110 (Thursday, June 8, 1995). https://www.govinfo.gov/content/pkg/FR-1995-06-08/html/95-13287.htm Accessed July 6, 2020.
- National Institute for Occupational Safety and Health. Determination of particulate filter efficiency level for N95 series filters against solid particulates for non-powered, air-purifying respirators standard testing procedure (STP). https://www.cdc.gov/niosh/npptl/stps/pdfs/TEB-APR-STP-0059-508.pdf Accessed July 6, 2020.
- Institute for Environmental Sciences and Technology. HEPA and ULPA Filters. (IEST-RP-CC001) https://www.iest.org/Standards-RPs/Recommended-Practices/IEST-RP-CC001 Accessed July 6, 2020.
- ASTM International. Standard test method for evaluating the bacterial filtration efficiency (BFE) of medical face mask materials, using a biological aerosol of Staphylococcus aureus. (F2101 – 19) https://compass.astm.org/EDIT/html_annot.cgi?F2101+19 Accessed July 6, 2020.
- Wilkes AR, Benbough JE, Speight SE, et al. The bacterial and viral filtration performance of breathing system filters. Anaesthesia. 2000;55:458–465.
- CDC Healthcare Infection Control Practices Advisory Committee. Guidelines for preventing health-care–associated pneumonia, 2003. MMWR 53(RR03); 1–36, 2004.
- Lawes EG. Hidden hazards and dangers associated with the use of HME/filters in breathing circuits. Their effect on toxic metabolite production, pulse oximetry and airway resistance. Br J Anaesth. 2003;91:249–264.
- Wilkes AR. Heat and moisture exchangers and breathing system filters: their use in anaesthesia and intensive care. Part 2–practical use, including problems, and their use with paediatric patients. Anaesthesia. 2011;66:40–51.
- International Standards Organization. Anaesthetic and respiratory equipment—heat and moisture exchangers (HMEs) for humidifying respired gases in humans—part 1: HMEs for use with tracheostomized patients having minimal tidal volume of 250 ml (ISO 9360-2: 2001).
La información incluida solo tiene fines educativos sobre la seguridad y no constituye asesoramiento médico ni legal. Las respuestas individuales o grupales son solo comentarios con fines educativos o de debate, y no representan consejos ni opiniones de la APSF. La APSF no pretende dar asesoramiento médico ni legal específicos, ni apoyar ninguna opinión ni recomendación específica en respuesta a las consultas publicadas. La APSF no es responsable en ningún caso, de manera directa o indirecta, por las pérdidas o los daños ocasionados o presuntamente ocasionados por la fiabilidad de dicha información o relacionada a ella.


 Issue PDF
Issue PDF