| Cet article a été publié initialement sur le site Internet de l’APSF. Cette version a été mise à jour et modifiée par l’auteur du Bulletin d’information de l’APSF actuel. |
Chère Réponse rapide,
La crise mondiale causée par la COVID-19 s’est introduite dans chacun des aspects de nos systèmes de soins. Les inquiétudes concernant le risque biologique du SARS-CoV-2, la propagation et la transmission par contact aux patients, le personnel soignant, l’environnement et les équipements ont été nombreuses, en particulier par rapport aux procédures qui génèrent des aérosols (AGP).1-3 La transmission du virus est principalement de nature respiratoire. Un virion de SARS-CoV-2 a un diamètre d’environ 120 nanomètres (0,06–0,14 µm) et passe d’une personne à l’autre dans des particules porteuses biologiques, telles que des gouttelettes ou des aérosols.2,3 Les recommandations concernant les EPI pertinents, la méthode de lavage des mains, le nettoyage des surfaces, la décontamination et les précautions pendant les procédures de gestion des voies aériennes ont été largement discutées pendant la pandémie.4-6 Comme avec les autres maladies respiratoires transmissibles, nous nous appuyons sur deux systèmes de filtration importants : les filtres des circuits en cas d’utilisation de systèmes de respiration artificielle au bloc opératoire et/ou les unités de soins intensifs (USI) et les masques respiratoires.
Cependant, la situation est un peu compliquée :
- Les appareils d’anesthésie et les ventilateurs mécaniques nécessitent des filtres pour la purification de l’air et la prévention des contaminations croisées. La norme d’efficacité de ces filtres porte la mention HEPA, signifiant une très haute efficacité d’absorption des particules.7 L’ASA recommande de placer des filtres HEPA entre la pièce en Y du circuit respiratoire et le masque du patient, le tube endotrachéal ou le masque laryngé.8
- Les normes européennes et américaines de détermination de l’efficacité des filtres sont différentes : Les normes européennes utilisent l’élimination de 99,95 % des particules d’un diamètre de 0,3 µm, alors que les États-Unis utilisent une valeur de 99,97 %.9
- L’efficacité d’un masque est déterminée par le niveau de pénétration des particules. Un masque N95 par exemple élimine au moins 95 % des particules de 300 nm à un débit de 85 litres/min.10 Les respirateurs à masque sont réglementés conformément au National Institute for Occupational Safety and Health (NIOSH) des États-Unis, ainsi que les normes et méthodes d’essai reconnues à l’échelle mondiale.
- Les filtres des respirateurs et les appareils d’anesthésie ne sont pas réglementés. Il n’existe aucun essai standard national ou international pour les filtres des respirateurs. En l’absence d’essais standard, les niveaux d’efficacité signalés par tous les fabricants sont-ils comparables ?11
- Les filtres actuellement disponibles sont-ils appropriés pour la COVID-19 ?
- Étant donné que de nombreux patients COVID-19 doivent être sous ventilation artificielle pendant des périodes prolongées, quelle doit être la fréquence de remplacement de ces filtres en USI ?
- Que doivent faire les soignants en cas de pénuries de filtres ?
Il s’agit des questions pressantes relatives aux filtres HEPA que je souhaiterais que vous discutiez.
Merci.
Felipe Urdaneta
Professeur clinique d’anesthésiologie
Université de Floride/NFSGVHS
Gainesville, Floride
L’auteur est consultant pour Medtronic, membre du Comité consultatif pour Vyaire et il a perçu des honoraires de conférencier pour son compte.
Documents de référence
- Canova V, Lederer Schlpfer H, Piso RJ, et al. Transmission risk of SARS-CoV-2 to healthcare workers—observational results of a primary care hospital contact tracing. Swiss Medical Weekly. 2020;150:1–5.
- Asadi S, Bouvier N, Wexler AS, et al. The coronavirus pandemic and aerosols: Does COVID-19 transmit via expiratory particles? Aerosol Sci Technol. 2020;0:1–4.
- van Doremalen N, Bushmaker T, Morris DH, et al. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1. N Engl J Med. 2020;382:1564–1567.
- Asenjo JF. Safer intubation and extubation of patients with COVID-19. Can J Anaesth. 2020:1–3.
- Chia SE, Koh D, Fones C, et al. Appropriate use of personal protective equipment among healthcare workers in public sector hospitals and primary healthcare polyclinics during the SARS outbreak in Singapore. Occup Environ Med. 2005;62:473–477.
- Sorbello M, El-Boghdadly K, Di Giacinto I, et al. The Italian coronavirus disease 2019 outbreak: recommendations from clinical practice. Anaesthesia. 2020;75:724–732.
- First MW. Hepa filters. Appl Biosaf. 1998;3:33–42.
- American Society of Anesthesiologists. Information for health care professionals. Published 2020. https://www.asahq.org/about-asa/governance-and-committees/asa-committees/committee-on-occupational-health/coronavirus. Accessed June, 2020.
- Wikipedia. HEPA. https://en.wikipedia.org/wiki/HEPA. Accessed June 9, 2020.
- Haghighat F, Bahloul A, Lara J, et al. Development of a procedure to measure the effectiveness of N95 respirator filters against nanoparticles. 2012.
- NIOSH-Approved Particulate Filtering Facepiece Respirators. https://www.cdc.gov/niosh/npptl/topics/respirators/disp_part/default.html. Accessed June 9, 2020.
Réponse :
Nous remercions le Dr Felipe Urdaneta d’avoir éclairé certains points concernant l’utilisation des filtres pour systèmes respiratoires utilisés en anesthésie en réponse à la pandémie de COVID-19. Le site Internet de l’APSF contient une page (https://www.apsf.org/faq-on-anesthesia-machine-use-protection-and-decontamination-during-the-covid-19-pandemic/) qui résume les stratégies actuelles pour protéger un appareil d’anesthésie de la contamination par un patient potentiellement infecté. Toutefois, il ne fournit pas les détails sur lesquels sont fondées les recommandations. Cet article fournit certains détails, tels que le risque de transmission de l’infection aux patients via le système respiratoire, les modes de transmission du virus, la physique de la filtration, les types de filtres, les tests normalisés, ainsi que les caractéristiques techniques des filtres, dans le but de répondre aux questions de Felipe Urdaneta et de faire disparaître d’éventuelles confusions que partagent nos lecteurs.
Risque de transmission de l’infection entre patients via le système respiratoire
Les systèmes respiratoires fermés présentent un risque hypothétique d’infection croisée en raison de la réinspiration du gaz précédemment insufflé. Avant les années 90, l’utilisation de filtres dans les systèmes respiratoires d’anesthésie n’était pas systématique et on pensait que l’infection croisée des patients était évitée par le passage du gaz insufflé à travers l’absorbant alcalin du dioxyde de carbone.1 Cependant, au cours des années 90, l’utilisation des filtres dans les systèmes respiratoires s’est répandue2 après le signalement de neuf cas d’infection croisée par hépatite C, attribuée à des systèmes respiratoires d’anesthésie infectés.3 Les preuves du risque d’infection croisée sont contradictoires. Quasiment aucun cas n’a été documenté, toutefois des tests in-vitro en démontrent la possibilité.4-6 Dans tous les cas, les filtres des systèmes respiratoires sont recommandés par plusieurs sociétés d’anesthésie, mais uniquement lorsque les circuits respiratoires sont réutilisés d’un patient à l’autre.7,8
Modes de transmission respiratoire du virus
La COVID-19 (SARS-CoV-2) est transmise principalement par voie respiratoire, comme le syndrome respiratoire aigu sévère (SARS-CoV), le coronavirus du syndrome respiratoire du Moyen-Orient (MERS-CoV) et d’autres coronavirus. Ce virus est transmis par des gouttelettes d’un diamètre supérieur à 20 microns, ainsi que par des aérosols d’un diamètre inférieur à 5–10 microns.9 Les gouttelettes ont tendance à tomber en raison de la gravité, alors que les aérosols flottent dans l’air et suivent les courants d’air. Les particules de taille intermédiaire ont en commun certaines des propriétés des gouttelettes et des aérosols. L’évaporation rapide des petites gouttelettes produit des noyaux de condensation qui suivent aussi les courants d’air. Les gouttelettes, les aérosols et les particules de taille intermédiaire sont produits par la toux, les éternuements et la parole, alors que les aérosols sont générés principalement pendant la respiration passive. Un concept important de la filtration des pathogènes est que les virus respiratoires ne sont pas transmis par des particules du virus isolées qui flottent dans l’air, mais par les virus contenus dans des particules de plus grande taille. Les gouttelettes et certaines particules de taille intermédiaire peuvent se déposer sur les surfaces, entraînant potentiellement une transmission par contact.
Aucune étude n’a estimé le nombre de particules virales que les patients infectés au SARS-CoV-2 expirent. Cependant, une étude qui quantifiait l’expiration de particules d’autres virus respiratoires, a permis de constater que les patients infectés au coronavirus saisonnier expiraient et projetaient en toussant entre 0 et 200 000 particules virales par heure.10
Alors qu’une seule particule virale peut en théorie entraîner une infection systémique, la probabilité d’infection augmente avec la durée et l’intensité de l’exposition virale.11
Physique de la filtration
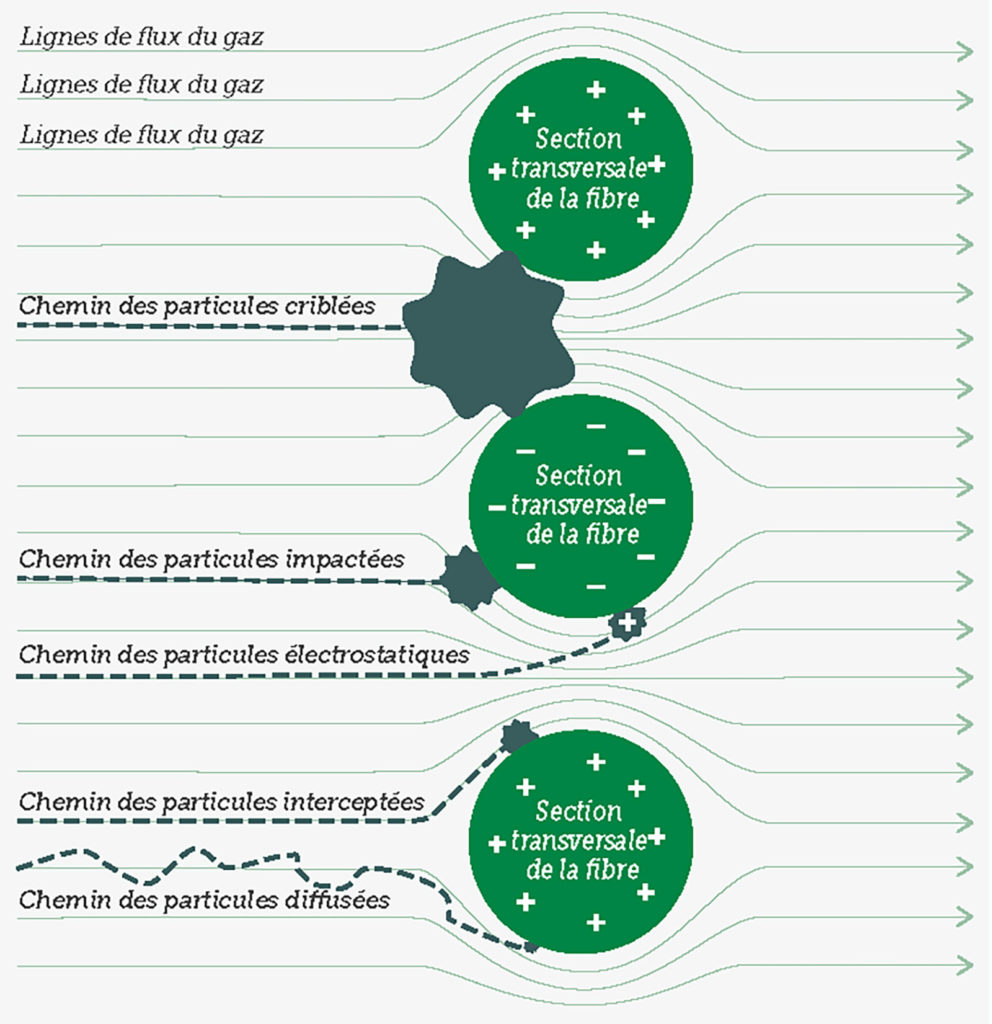
En général, les gens comprennent la physique de la filtration au moyen d’une passoire, un phénomène facile à observer, où une particule plus large que les plus petits trous ne traverse pas la passoire. Cependant, d’autres forces peuvent entrer en jeu avec des particules de très petite taille (par ex. diamètre < 2 microns).12 Une fois qu’elles entrent en contact avec la matière filtrante, les très petites particules ont tendance à y adhérer, même si elles pourraient passer à travers les ouvertures du filtre. Les particules entrent en contact avec la matière filtrante par quatre mécanismes de base. Les particules dans la fourchette de 0,11 microns peuvent venir impacter les fibres du filtre par un processus appelé impaction inertielle. Les particules dans la fourchette comprise entre 0,05 et 1 micron peuvent tangentiellement entrer en contact avec des fibres du filtre par un processus appelé interception. Au fur et à mesure que la taille des particules diminue, elles subissent de plus en plus le mouvement brownien (aléatoire) en plus de leur déplacement avec le flux d’air et elles peuvent venir au contact du filtre en raison d’un mouvement erratique causé par un processus appelé diffusion. Enfin, les petites particules chargées peuvent être attirées par la surface chargée de la matière filtrante par un processus appelé attraction électrostatique. La Figure 1 illustre chacun de ces phénomènes et la Figure 2 montre l’effet de l’addition de ces phénomènes sur l’efficacité générale du filtre. Il convient de noter que, pour la plupart des filtres à air, les particules dont la taille est de l’ordre de 0,3 micron (c.-à-d. 300 nanomètres) sont les plus difficiles à piéger. Les particules de plus petite ou de plus grande taille sont plus faciles à intercepter.
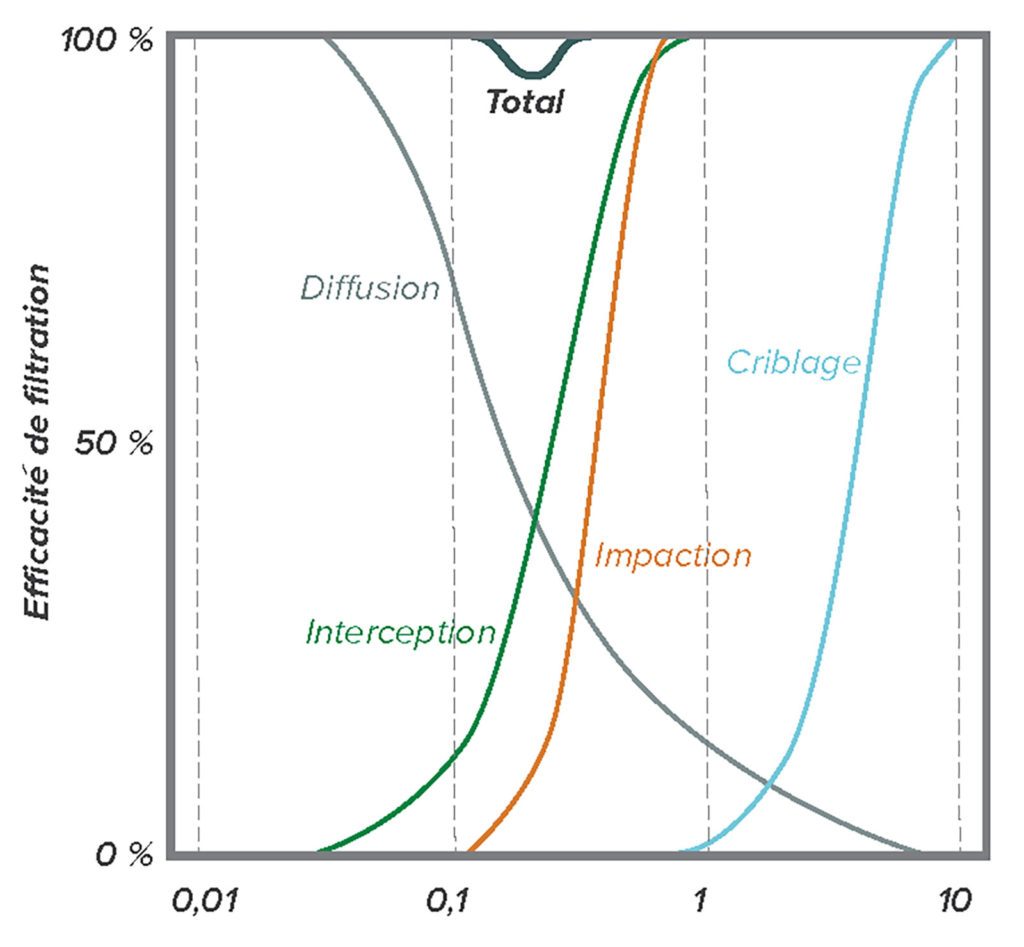
Figure 2 : Somme des phénomènes individuels de filtration pour produire la filtration globale des particules de tailles différentes. Remarque : l’efficacité la plus faible est de l’ordre de 0,3 micron.
Types de filtre utilisés dans les systèmes respiratoires d’anesthésie
Filtres mécaniques plissés
Les filtres mécaniques plissés contiennent une couche épaisse de fibres hydrophobiques non tissées, très serrées, à la disposition aléatoire, qui capturent les particules par la profondeur du filtre. La matière du filtre est plissée pour augmenter la surface et réduire la résistance au flux d’air. En règle générale, leur efficacité de filtration est très élevée et ils peuvent également permettre un échange de chaleur et d’humidité s’ils sont positionnés à proximité des voies aériennes, à un endroit où le flux d’air est bidirectionnel. Lorsqu’ils sont utilisés dans un environnement humide, leur efficacité de filtration et leur résistance au flux d’air peuvent s’améliorer ou s’aggraver. Ils restent cependant extrêmement efficaces quand ils sont humides.13 Les liquides ne traversent pas facilement les filtres mécaniques plissés.14 Généralement, ils coûtent plus cher et leur volume interne est supérieur aux filtres électrostatiques.
Filtres électrostatiques
Les filtres électrostatiques contiennent une fine couche de fibres électrostatiques au tissage serré. Leur résistance au flux d’air est inférieure pour une surface donnée, donc ils ne sont pas plissés. En règle générale, l’efficacité de filtration des filtres électrostatiques est 1000 fois inférieure à celle des filtres mécaniques plissés.13 Leur efficacité de filtration et leur résistance au flux d’air peuvent s’améliorer ou s’aggraver dans un environnement humide. Les liquides traversent facilement un filtre électrostatique.14
Filtres échangeurs de chaleur et d’humidité (FECH)
Les échangeurs de chaleur et d’humidité (ECH) seuls ne fournissent aucune filtration. Les ECH qui contiennent un filtre électrostatique ou un filtre mécanique plissé sont appelés FECH. Les ECH et les FECH sont uniquement efficaces pour l’humidification lorsqu’ils sont positionnés à proximité des voies aériennes, dans un endroit où le flux d’air est bidirectionnel, où ils absorbent l’eau pendant l’expiration et la libèrent pendant l’inhalation.15
Filtres à membrane
Un type de filtre totalement différent est utilisé dans les analyseurs de gaz respiratoires pour éviter que les fluides pénètrent dans la chambre de l’analyseur. Bien qu’ils ne soient pas classés comme des filtres pour système respiratoire, les filtres à membrane hydrophobe sont généralement inclus dans les pièges à eau parce qu’ils permettent aux gaz de passer lorsqu’ils sont secs, mais deviennent occlusifs lorsqu’ils sont humides. Les filtres à membrane possèdent des pores et des canaux très petits qui empêchent le passage des particules, principalement par tamisage.
Tests normalisés et caractéristiques techniques des filtres
Filtration des particules
Il existe une seule norme internationale pour tester l’efficacité de filtration des filtres des systèmes respiratoires, ISO 23328-1 : Filtres pour système respiratoire d’anesthésie et de réanimation .16 La norme décrit la méthode d’essai à l’aide d’une solution saline, qui quantifie le nombre de particules de chlorure de sodium de 0,1 à 0,3 micron en suspension dans l’air qui passent à travers le filtre pendant une exposition à court terme, avec des flux d’air qui sont susceptibles d’être présents lors de l’utilisation prévue. Les filtres pour enfants et pour adultes sont exposés à des particules de chlorure de sodium de 0,1 mg ou 0,2 mg, respectivement à 15ִ L/min ou 30 L/min. Les filtres sont préconditionnés dans de l’air humidifié afin de simuler une période d’utilisation clinique avant d’être testés. On utilise les particules salines sèches sans charge électrostatique pour le test de provocation parce qu’elles sont particulièrement difficiles à piéger. La méthode ne permet pas d’évaluer la performance de filtration pour les gouttelettes et les aérosols et ne prétend pas non plus tester la performance de filtration pour les microorganismes. Elle est utilisée uniquement à des fins de comparaison, sans aucune pertinence clinique prouvée. La norme ne précise aucun seuil de performance minimale de l’efficacité du filtre d’un système respiratoire. Les résultats du test sont exprimés par le pourcentage d’efficacité de filtration, qui correspond au pourcentage de particules dans le test de provocation qui ne traversent pas le filtre. Par exemple, si le filtre est exposé à 10 millions (107) de particules et que 1000 (103) particules sont détectées de l’autre côté, l’efficacité de filtration en pourcentage sera de 100 * (1 – 103/ 107) = 99,99 %.
Des normes complètement différentes sont utilisées pour tester et classer d’autres types de filtre. En particulier, le National Institute for Occupational Health and Safety (Institut national pour la santé et la sécurité au travail) a développé la norme NIOSH 42 CFR Part 84 : Appareils de protection respiratoire17 comme méthode de test et de classification des appareils de protection respiratoire à épuration d’air non motorisés. Les respirateurs de série N, utilisés pour les soins de santé, sont exposés à 200 mg de particules de chlorure de sodium sèches sans charge électrostatique, d’une taille comprise entre 0,1 et 0,3 microns, à un débit de 85 L/min.18 Ce test est semblable mais plus exigeant que celui de la norme ISO 23328-1, en raison de la masse de particules plus importante et du débit plus grand. Une autre norme d’essai de filtration intéressante est la norme IEST-RP-CC001 : Filtres HEPA et ULPA,19, qui teste la performance des filtres utilisés dans les dispositifs de filtration d’air et les salles propres. L’acronyme « HEPA » désigne les filtres high-efficiency particle air ou haute efficacité pour les particules aériennes, qui éliminent 99,97 % des particules d’un diamètre égal à 0,3 microns. Cependant, ce terme n’est pas approprié pour les filtres des systèmes respiratoires, parce que les méthodes d’essai sont différentes.
Filtration des microorganismes
Certaines documentations de produit relatives aux filtres pour systèmes respiratoires contiennent des éléments concernant l’efficacité de filtration bactérienne ou virale. Il n’existe aucun essai normalisé permettant de déterminer l’efficacité de filtration bactérienne ou virale des filtres des systèmes respiratoires, mais il existe des méthodes standard permettant de la déterminer pour d’autres types de filtre. L’une d’entre elles est la méthode ASTM F2101–19 : Méthode d’essais standard pour évaluer l’efficacité de la filtration bactérienne (BFE) des matériaux des masques médicaux, en utilisant un aérosol biologique de Staphylococcus aureus.20 Une procédure semblable, qui utilise des aérosols biologiques de Bacillus subtilis ou des coliphages MS-2 pour tester les filtres des systèmes respiratoires, est décrite par Wilkes et al.21. Elle est identique à la procédure prévue par le projet de norme BS EN 13328-1 (qui n’a jamais dépassé le stade de projet). Dans les deux procédures, les bactéries ou virus en suspension sont passés à l’état d’aérosols d’une taille de particule liquide moyenne de 3 microns et tirés à travers la matière filtrante par un vide en aval. Tout ce qui traverse le filtre est piégé par un bouillon de culture ou sur des plaques de culture. L’efficacité de filtration en pourcentage est calculée en divisant le nombre de particules cultivées en aval du filtre par le nombre de particules de l’essai en amont. À première vue, ces méthodes pourraient sembler plus pertinentes que la méthode d’essai à l’aide de la solution saline. Elles utilisent des particules liquides plus grosses que la méthode d’essai à solution saline. Les particules liquides peuvent être chargées en électrostatique. Seuls les microorganismes viables sont comptés. Cependant, ces méthodes sont moins reproductibles. En règle générale, le même filtre aura une efficacité de filtration supérieure en pourcentage pour les bactéries que pour les virus, que pour les particules de sel.
Test de point de bulle
Les filtres à membrane sont classés par taille de pore, qui est déterminée indirectement à l’aide du test de point de bulle. Celui-ci est fondé sur le principe que le liquide est retenu dans les pores du filtre par les forces de tension de surface et par capillarité, et que la pression minimale requise pour forcer le liquide à travers les pores est liée au diamètre des pores. Cependant, la taille des pores ne peut pas être utilisée comme indicateur d’efficacité de filtration des particules ou des pathogènes. Les filtres à membrane hydrophile de 0,22 microns sont généralement utilisés pour stériliser les produits pharmaceutiques et pour maintenir la stérilité des perfusions épidurales, mais leur efficacité de filtration des particules en suspension n’a pas été testée. Certains filtres à membrane hydrophobe de 0,2 micron (par exemple, ceux dans les pièges à eau GE D-Fend Pro, Dräger WaterLock® 2 et Covidien FilterLine®) ont été testés et ont une efficacité de filtration des particules virales en suspension égale ou supérieure à 99,99 %.
Recommandations cliniques
En 2003, le Centre de contrôle des maladies des États-Unis a déclaré : « Il est impossible de faire une recommandation relative à la pose d’un filtre antibactérien dans le système respiratoire ou le circuit du patient du matériel d’anesthésie », citant des études qui remontent maintenant à 40 ans, qui démontraient que les circuits respiratoires stériles ou les filtres des systèmes respiratoires ne réduisaient pas l’incidence des pneumonies postopératoires.22 Il n’existe actuellement aucune réglementation relative à l’utilisation de filtres pour système respiratoire dans le matériel d’anesthésie. Cependant, il semble prudent de prévenir, dans la mesure du possible, les infections croisées de SARS-CoV-2 entre patients dans le cadre de la pandémie de COVID-19. Il existe très peu de signalements d’infections croisées causées par du matériel d’anesthésie contaminé avant le SARS, le MERS et la COVID-19, mais le risque lié à ces pathogènes n’est pas connu actuellement. Par mesure de prudence et sur la base des connaissances actuelles, l’APSF et l’ASA recommandent l’utilisation de filtres pour systèmes respiratoires, en reconnaissant que les preuves scientifiques sont incomplètes. (https://www.apsf.org/faq-on-anesthesia-machine-use-protection-and-decontamination-during-the-covid-19-pandemic/).
L’ajout de filtres pour systèmes respiratoires n’est pas sans risque.23,24 En fonction de leur positionnement, ils peuvent créer un espace mort, qui augmente la réinhalation du dioxyde de carbone et ralentit l’induction par inhalation et le réveil. Ils augmentent la résistance au flux inspiratoire et/ou expiratoire, accroissant ainsi le travail de respiration spontanée et affectant la mécanique pulmonaire (les méthodes d’essai sont décrites dans la norme internationale ISO 9360-1).25 Les filtres peuvent s’obstruer, entraînant une hypoventilation et des barotraumatismes qui mettent la vie du patient en danger. Ils ajoutent du poids au circuit respiratoire et des raccords qui pourraient être accidentellement déconnectés.
L’efficacité de filtration nécessaire pour prévenir une infection causée par les virus expirés via le système respiratoire est inconnue. Si un patient expire 200 000 particules virales par heure, un filtre électrostatique qui piège 99,9 % d’entre elles en laissera passer seulement 200. Placer deux de ces filtres en série (c.-à-d. un sur les voies aériennes et un sur la branche expiratoire) permettra d’atteindre une efficacité de filtration de 99,9999 %, rendant le risque de passage du virus quasiment nul, mais doublera aussi la résistance au flux. L’utilisation d’un seul filtre respiratoire plissé mécanique haute efficacité (c.-à-d. 99,9999 %) sur les voies aériennes permettra de capturer le même nombre de particules virales et introduira moins de résistance des voies aériennes que deux filtres électrostatiques placés en série, mais risque d’augmenter l’espace mort.
Les cliniciens doivent connaître les caractéristiques techniques des filtres des systèmes respiratoires dont ils disposent. À ce titre, ils pourront consulter le site Internet du fabricant ou s’adresser à sa permanence téléphonique, consulter la documentation du produit, les informations en ligne et les articles des journaux spécialisés.13,14 Les caractéristiques techniques importantes sont les suivantes :
- efficacité de filtration bactérienne et virale (%, plus elle est élevée, mieux c’est),
- efficacité de filtration du chlorure de sodium ou du sel (%, plus elle est élevée, mieux c’est),
- résistance au flux (perte de pression en Pa ou cmH2O à un débit d’air donné en L/min, plus elle est faible, mieux c’est),
- comment les caractéristiques techniques sont affectées par le conditionnement en air par l’humidité,
- le volume interne (ml, plus il est faible, mieux c’est), et l’
- humidification
- (perte d’humidité en mgH2O/L d’air, plus elle est faible, mieux c’est), ou
- (quantité d’humidité délivrée en mgH2O/L d’air, plus elle est élevée, mieux c’est).
Il convient de noter que certaines publications citent des évaluations réalisées il y a 10 ou 20 ans et que les produits peuvent changer ou être fabriqués ou distribués par différentes sociétés.
Le Dr Robert G. Loeb est professeur d’anesthésiologie College of Medicine de l’Université de Floride, Gainesville, Floride.
Il est employé de l’Université de Floride, président du Comité sur les équipements et les installations de l’American Society of Anesthesiologists et il siège au Comité consultatif technique de Masimo, Inc.
Documents de référence
- Murphy PM, Fitzgeorge RB, Barrett RF. Viability and distribution of bacteria after passage through a circle anaesthetic system. Br J Anaesth. 1991;66:300–304.
- Atkinson MC, Girgis Y, Broome IJ. Extent and practicalities of filter use in anaesthetic breathing circuits and attitudes towards their use: a postal survey of UK hospitals. Anaesthesia. 1999;54:37–41.
- Chant K, Kociuba K, Munro R, et al. Investigation of possible patient-to-patient transmission of hepatitis C in a hospital. New South Wales Public Health Bulletin. 1994;5:47–51.
- Spertini V, Borsoi L, Berger J, et al. Bacterial contamination of anesthesia machines’ internal breathing-circuit-systems. GMS Hyg Infect Control. 2011;6(1).
- Lloyd G, Howells J, Liddle C, et al. Barriers to hepatitis C transmission within breathing systems: efficacy of a pleated hydrophobic filter. Anaesth Intensive Care. 1997;25:235–238.
- Heinsen A, Bendtsen F, Fomsgaard A. A phylogenetic analysis elucidating a case of patient-to-patient transmission of hepatitis C virus during surgery. J Hosp Infect. 2000;46: 309–313.
- Australian & New Zealand College of Anaesthetists. PS28 Guideline on infection control in anaesthesia 2015. Available at: https://www.anzca.edu.au/safety-advocacy/standards-of-practice/policies,-statements,-and-guidelines Accessed July 6, 2020.
- Association of Anaesthetists of Great Britain & Ireland. Guidelines: infection prevention and control 2020. https://anaesthetists.org/Portals/0/PDFs/Guidelines%20PDFs/Infection_Control_Guideline_FINAL%202020.pdf?ver=2020-01-20-105932-143 Accessed July 6, 2020.
- Tellier R, Li Y, Cowling BJ, Tang JW. Recognition of aerosol transmission of infectious agents: a commentary. BMC Infect Dis. 2019;19:101.
- Leung NH, Chu DK, Shiu EY, et al. Respiratory virus shedding in exhaled breath and efficacy of face masks. Nat Med. 2020;26:676–680.
- Nicas M, Hubbard AE, Jones RM, Reingold AL. The infectious dose of variola (smallpox) virus. Appl Biosaf. 2004;9:118–127.
- Hakobyan NA. Introduction to basics of submicron aerosol particles filtration theory via ultrafine fiber media. Armen J Phys. 2015;8:140–151.
- Wilkes A. Breathing system filters: an assessment of 104 breathing system filters. MHRA Evaluation 04005. March 2004 https://www.psnetwork.org/wp-content/uploads/2018/01/An-assessment-of-104-breathing-system-filters-MHRA-Evaluation-04005-2004-.pdf Accessed July 6, 2020.
- Wilkes AR. The ability of breathing system filters to prevent liquid contamination of breathing systems: a laboratory study* APPARATUS. Anaesthesia. 2002;57:33–39.
- Wilkes AR. Heat and moisture exchangers and breathing system filters: their use in anaesthesia and intensive care. Part 1–history, principles and efficiency. Anaesthesia. 2011;66:31–9.
- International Organization for Standardization. Breathing system filters for anaesthetic and respiratory use — Part 1: Salt test method to assess filtration performance. (ISO 23328-1:2003) https://www.iso.org/standard/35330.html Accessed July 6, 2020.
- Department of Health and Human Services. 42 CFR Part 84 Respiratory protective devices; final rules and notice. Federal Register Volume 60, Number 110 (Thursday, June 8, 1995). https://www.govinfo.gov/content/pkg/FR-1995-06-08/html/95-13287.htm Accessed July 6, 2020.
- National Institute for Occupational Safety and Health. Determination of particulate filter efficiency level for N95 series filters against solid particulates for non-powered, air-purifying respirators standard testing procedure (STP). https://www.cdc.gov/niosh/npptl/stps/pdfs/TEB-APR-STP-0059-508.pdf Accessed July 6, 2020.
- Institute for Environmental Sciences and Technology. HEPA and ULPA Filters. (IEST-RP-CC001) https://www.iest.org/Standards-RPs/Recommended-Practices/IEST-RP-CC001 Accessed July 6, 2020.
- ASTM International. Standard test method for evaluating the bacterial filtration efficiency (BFE) of medical face mask materials, using a biological aerosol of Staphylococcus aureus. (F2101 – 19) https://compass.astm.org/EDIT/html_annot.cgi?F2101+19 Accessed July 6, 2020.
- Wilkes AR, Benbough JE, Speight SE, et al. The bacterial and viral filtration performance of breathing system filters. Anaesthesia. 2000;55:458–465.
- CDC Healthcare Infection Control Practices Advisory Committee. Guidelines for preventing health-care–associated pneumonia, 2003. MMWR 53(RR03); 1–36, 2004.
- Lawes EG. Hidden hazards and dangers associated with the use of HME/filters in breathing circuits. Their effect on toxic metabolite production, pulse oximetry and airway resistance. Br J Anaesth. 2003;91:249–264.
- Wilkes AR. Heat and moisture exchangers and breathing system filters: their use in anaesthesia and intensive care. Part 2–practical use, including problems, and their use with paediatric patients. Anaesthesia. 2011;66:40–51.
- International Standards Organization. Anaesthetic and respiratory equipment—heat and moisture exchangers (HMEs) for humidifying respired gases in humans—part 1: HMEs for use with tracheostomized patients having minimal tidal volume of 250 ml (ISO 9360-2: 2001).
Ces informations sont fournies à des fins de formation liée à la sécurité et ne doivent pas être interprétées comme un avis médical ou légal. Les réponses individuelles ou de groupe ne sont que des commentaires fournis à des fins de formation ou de discussion et ne sont ni des déclarations d’avis ni des opinions de l’APSF. Il n’est pas dans l’intention de l’APSF de fournir un avis médical ou légal spécifique ni de se porter garante des points de vue ou recommandations exprimés en réponse aux questions postées. L’APSF ne pourra en aucun cas être tenue responsable, directement ou indirectement, des dommages ou des pertes causés ou présumés avoir été causés par, ou en rapport avec la confiance accordée à, ces informations.


 Issue PDF
Issue PDF