| Перепечатано из журнала «Анестезия и обезболивание», июнь, 2022 г.• том 134 • № 6, стр. 1192–1200, с разрешения Международного общества по изучению анестезии. Профессиональные названия и номенклатура были стандартизированы и изменены в тексте в соответствии с политикой APSF. |

В этой статье с комментариями к доводам «За» и «Против» авторам было предложено отвергнуть или поддержать ту или иную методику анестезии при эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ). Операции ЭРХПГ уникальны тем, что они не только требуют наличия проходимых дыхательных путей, но и обычно проводятся в лежачем (или полулежачем) положении на специальном операционном столе. Кроме того, время выполнения процедуры может варьироваться от <1 часа до нескольких часов.
Принципы врачебной практики часто варьируются среди медицинских работников, когда не существует определенного стандарта оказания медицинской помощи. Причина этой изменчивости является многофакторной. Предрасполагающие факторы и сопутствующие заболевания пациента, навыки и опыт врача, процедурные потребности и отсутствие научных данных — вот лишь некоторые из соображений. Таким образом, неудивительно, что выбор методики анестезии для пациентов, которым выполняют эндоскопию желудочно-кишечного тракта (ЖКТ), резко разделен между теми, кто выступает за применение мониторируемого анестезиологического пособия (МАП), и теми, кто применяет общую эндотрахеальную анестезию (ОЭА).
Важность этих дебатов становится еще более актуальной в связи с растущим признанием значительной потенциальной заболеваемости и смертности, связанных с этими анестетиками и процедурами. Отчет по закрытым претензиям Американского общества анестезиологов (ASA) свидетельствует о том, что неблагоприятные события в местах проведения анестезии, отличных от операционной (NORA) приводят к более высокой частоте тяжелых осложнений, включая смертельный исход и необратимые повреждения головного мозга, чем аналогичные события, происходящие в операционной.1 Действительно, на отделения гастроэнтерологии приходился самый высокий процент развития нежелательных явлений среди всех вариантов NORA.
Специалисты по анестезии, несомненно, столкнутся с растущим спросом на услуги в условиях отделения NORA и в особенности в отделении лечения заболеваний желудочно-кишечного тракта. Таким образом, это обсуждение доводов за и против дает представление о решении плана применения контролируемой анестезиологической помощи по сравнению с применением ОЭА для процедур ЭРХПГ, как показано в Таблице 1. Наши пациенты в конечном итоге получают пользу от дальнейшего систематического клинического изучения этих вариативных подходов и связанных с ними результатов.
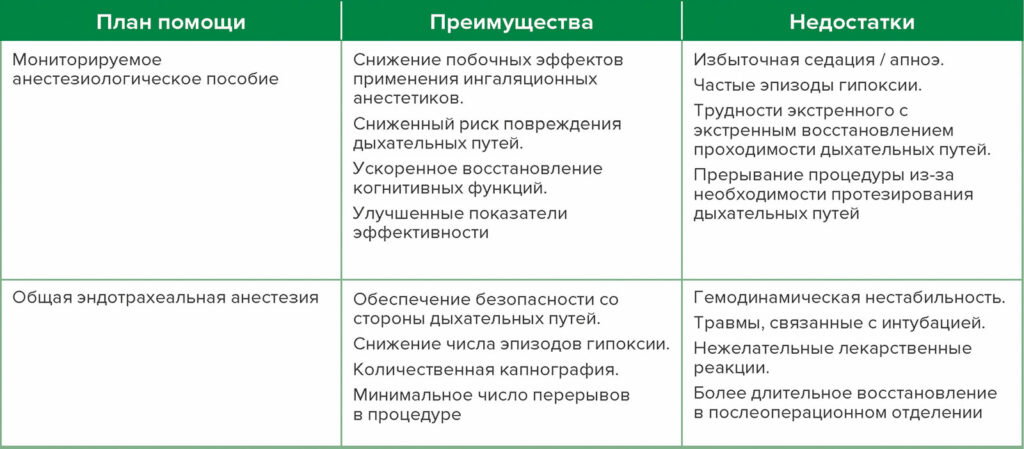
Таблица 1: Резюме дебатов за и против.

Сокращения: ЭРХПГ — эндоскопическая ретроградная холангиопанкреатография; ОЭА — общая эндотрахеальная анестезия; МАП — мониторируемое анестезиологическое пособие; NORA — анестезия в обстановке, отличной от операционной; НЯ — нежелательное явление.
ЗА: ПРИ ПРОВЕДЕНИИ АНЕСТЕЗИИ ДЛЯ ВЫПОЛНЕНИЯ ЭРХПГ ЛУЧШЕ ВСЕГО ВЫБРАТЬ МАП
Саманта Стампер (Samantha Stamper), MD, и
Кристофер А. Троянос (Christopher A. Troianos), MD, член Американского общества эхокардиографии (FASE), FASA
В ходе ЭРХПГ используется рентгеноскопия и эндоскопия как для диагностических, так и для терапевтических вмешательств. Их использование облегчает проведение оценки состояния печени, желчного пузыря, желчных протоков и поджелудочной железы. В последние годы ЭРХПГ преимущественно используют для терапевтических вмешательств, учитывая появление передовых методов эндоскопической терапии и технологии визуализации (таких как магнитно-резонансная томография с магнитно-резонансной холангиопанкреатографией, эндоскопическое ультразвуковое исследование).13 Такие вмешательства включают в себя сфинктеротомию желчных протоков, экстракцию или фрагментацию желчных камней, стентирование желчных и вирсунгова протоков и дренирование псевдокист поджелудочной железы.12,13 Многие из этих процедур ранее требовали проведения открытой или лапароскопической операции, но ЭРХПГ в настоящее время является доступной, экономически эффективной и предпочтительной альтернативой.
Расширенные эндоскопические вмешательства имеют дополнительное преимущество, заключающееся в том, что они являются минимально инвазивными, менее болезненными и редко требуют миоплегии.6 Более 500 000 операций ЭРХПГ выполняются ежегодно в Соединенных Штатах, причем большинство из них требуют проведения анестезии.14 Операцию ЭРХПГ чаще выполняют у пожилых пациентов; многие из них имеют выраженные сопутствующие заболевания.13 Несмотря на то, что в настоящее время нет данных, основанных на результатах проспективных рандомизированных исследований, о преимуществах применения МАП или ОЭА для пациентов, подвергающихся расширенным эндоскопическим вмешательствам, существует убедительное клиническое обоснование для приоритетного применения подхода «Вначале МАП» у большинства таких пациентов при проведении эндоскопии. В то время как план анестезии всегда адаптирован к каждому конкретному пациенту, опытная команда по обеспечению эндоскопии признает, что применение МАП может быть превосходным, особенно для более здоровых пациентов с нормальным или почти нормальным индексом массы тела (ИМТ). Наличие эффективной коммуникации между эндоскопистом и анестезиологом имеет решающее значение. Например, конкретные показания для ЭРХПГ (лечебные или диагностические) и продолжительность процедуры принципиально важны для создания ее общего плана и, вероятно, будут способствовать выбору оптимального способа анестезии. Например, если план вмешательства представляет собой простое удаление билиарного стента, то наиболее подходящим способом может быть МАП. Напротив, дренирование сложной, разделенной перегородками псевдокисты поджелудочной железы с некротическими стенками почти наверняка потребует применения ОЭА. Поэтому время проведения и инвазивность вмешательства являются жизненно важными факторами при выборе анестезии, и необходимо учитывать преимущества и недостатки каждого из ее методов (Таблица 2).
Таблица 2: Преимущества и недостатки каждого плана анестезиологической помощи.
Конкретные факторы медицинского учреждения аналогичным образом влияют на выбор оптимального способа анестезии. Эти соображения включают близость к основным операционным, готовность к применению жизнеобеспечивающего оборудования, наличие адекватного отделения наблюдения за пациентами после анестезии и доступность дополнительной помощи в случае необходимости. Другие соображения включают физическую площадь рабочего места анестезиолога, которая часто ограничена из-за специализированного оборудования (например, расходных материалов для эндоскопии, оборудования для радиографической визуализации, вспомогательных дисплеев и экранных стоек). Коммуникация как с медицинским учреждением, так и с командой эндоскопистов перед процедурой очень важна, чтобы помочь снизить вероятность развития любых осложнений. Более того, предусмотрительный врач должен всегда обеспечивать наличие четкого плана и схемы действий на случай необходимости экстренного протезирования дыхательных путей. Факторы, перечисленные выше, могут повлиять на решение о предпочтительном выборе МАП.
Сложные эндоскопические процедуры, в частности, ЭРХПГ, обычно выполняются в положении лежа или полулежа, что может ограничить доступ к дыхательным путям и (или) повлиять на венозный возврат и стабильность гемодинамики.2 Однако это положение обычно обеспечивает необходимый легочный кровоток и распределение вентиляции (соответствие вентиляции и перфузии) в легких, особенно у неинтубированного пациента (например, при МАП). Более того, сам эндоскоп может уменьшить вероятность коллапса дыхательных путей, действуя как стент.15 Положение лежа на животе оказывает многократное дополнительное положительное влияние на дыхательную функцию, в частности, увеличивая функциональную остаточную емкость легких (ФОЕЛ) и артериальную PO2.2
Одной из основных проблем, связанных с МАП в положении лежа на животе, является потенциальная необходимость срочного или экстренного доступа к дыхательным путям с потенциальной необходимостью экстренной эндотрахеальной интубации. Одна из возможных провокационных стратегий заключается в том, чтобы адекватно обученный эндоскопист проводил эндотрахеальную интубацию с помощью гастроскопа. Для этого необходимы эндоскоп меньшего размера, который можно ввести в трахею, и эндоскопист, обладающий этими навыками, при содействии анестезиолога. «Ультратонкий» гастроскоп функционирует аналогично бронхоскопу и имеет наружный диаметр 5,4 мм, что позволяет надеть на него эндотрахеальную трубку для взрослых.16 В обзоре более 3400 пациентов, перенесших операцию ЭРХПГ (46% пациентов с ОЭА по сравнению с 54% пациентов с МАП), общий коэффициент перехода от МАП к ОЭА был низким и составлял 2,3%. Авторы описали свое успешное использование гастроскопа при интубации трахеи у 16 пациентов в связи с задержкой пищи в желудке и (или) гипоксией.17 Дополнительным преимуществом применения гастроскопа является то, что аспирированный материал можно немедленно извлекать из трахеи и бронхов, тем самым снижая риск респираторных осложнений.17 Экстубация прошла успешно у всех пациентов, которым была проведена интубация с помощью гастроскопа, и ни у одного пациента не было рентгенографических признаков аспирационной пневмонии.17
Этот новый подход к протезированию скомпрометированных или несостоятельных дыхательных путей устраняет наиболее часто встречающуюся проблему, с которой сталкиваются врачи, рассматривающие возможность использования МАП в положении лежа или полулежа. Эндоскопист в вышеупомянутом исследовании самостоятельно научился этой технике; это свидетельствует о том, что в настоящее время не существует формального обучения или процесса присвоения квалификации для интубации с помощью гастроскопа.17 Применение этого метода следует рассматривать только под непосредственным наблюдением анестезиолога или в исполнении специалиста-анестезиолога. Важным предостережением при использовании ультратонкого гастроскопа для интубации является то, что эндоскопист должен переключиться с традиционного гастроскопа для ЭРХПГ с боковым обзором на ультратонкий гастроскоп с эндотрахеальной трубкой. Такая замена гастроскопов обеспечивает возможность аспирации содержимого желудка, пищевода и гортанной части глотки при извлечении обычного прибора непосредственно перед интубацией, но должна выполняться в ускоренном режиме, чтобы минимизировать возможную задержку интубации.
Таблица 3: Факторы риска развития нежелательных явлений, связанных с седацией, во время проведения контролируемой анестезиологической помощи.

Сокращения: ASA — Американское общество анестезиологов; MAП — мониторируемое анестезиологическое пособие.
Прежде чем приступить к проведению МАП при выполнении ЭРХПГ необходимо рассмотреть факторы риска нежелательных явлений (НЯ), связанных с седацией, как указано в Таблице 3. Многие считают, что условия, повышающие вероятность аспирации, являются факторами риска развития НЯ, связанных с седацией. Многочисленные исследования показали, что МАП является безопасным вариантом для выполнения ЭРХПГ, особенно у пациентов с минимальными факторами риска развития НЯ, связанных с седацией. В рамках крупного, популяционного исследования продолжительностью несколько десятилетий, проведенного в нескольких центрах эндоскопии в Соединенных Штатах, не было обнаружено существенной разницы в общем количестве серьезных нежелательных явлений между результатами ЭРХПГ, выполненных с применением МАП (n = 8395) и ОЭА (n = 10.715; отношение шансов [ОШ] = 1,04, 95% доверительный интервал [ДИ], 0,76–1,43).2,3 Хотя большинство этих пациентов были относительно здоровыми (физический статус I и II по шкале ASA), авторы не пытались контролировать систематическую ошибку отбора. Не было выявлено значимых различий в частоте развития нежелательных явлений между пациентами с физическим статусом I и физическим статусом II по ASA (ОШ = 0,84 [0,49–1,46]), а также между пациентами с физическим статусом III и II по ASA (ОШ = 1,30 [1,00–1,69]). Фактически, данные свидетельствуют о том, что только у пациентов с физическим статусом IV по шкале ASA был отмечен значительно более высокий риск развития нежелательных явлений в результате применения МАП (ОШ = 3,19 [2,00–5,09]).2,3 В другом проспективном наблюдательном исследовании решение о применении МАП или ОЭА было оставлено на усмотрение специалиста-анестезиолога, при этом 393 пациента получали МАП, а 45 пациентов получали ОЭА.4 Коэффициент конверсии применения МАП в ОЭА составил 3,7%. Примечательно, что 25% пациентов, переведенных на применение ОЭА, были пациентами с физическим статусом IV по шкале ASA.2,4 Учитывая присущую этому исследованию систематическую ошибку отбора, неудивительно, что средний ИМТ был выше в группе применения ОЭА, чем в группе применения МАП, как и у доли пациентов с физическим статусом IV по шкале ASA.4,6 Тем не менее, разница частоты развития нежелательных явлений между применением МАП и ОЭА статистически не была значимой, и авторы исследования пришли к выводу, что применение МАП возможно и хорошо переносится более здоровыми пациентами, не страдающими ожирением, оценку состояния которых выполняет перед процедурой специалист-анестезиолог.2,4,6
Клинический мониторинг во время выполнения МАП при ЭРХПГ должен соответствовать стандартам мониторинга базовой анестезии, который включает в себя постоянную оценку оксигенации, вентиляции, кровообращения и температуры пациента18; это включает в себя неинвазивное измерение артериального давления, пульсоксиметрию, электрокардиографию и капнографию. Многие дыхательные устройства (например, назальные канюли или простые лицевые маски), используемые при контролируемой анестезиологической помощи, способны контролировать конечный объем CO2 и выявлять апноэ задолго до наступления гипоксии.4,19 Дополнительные методы мониторинга доступны для обнаружения апноэ до снижения показателей пульсовой оксиметрии, включая импедансную пневмографию и — менее широко используемый в операционной — акустический монитор частоты дыхания.
Все методы МАП начинаются с применения адекватной предварительной оксигенации. Это имеет решающее значение для предотвращения гипоксемии — очевидного предшественника более серьезных нежелательных явлений (например, сердечных аритмий, артериальной гипотензии и остановки кровообращения).20 В идеале, проведение преоксигенации в течение 3 минут или с помощью 4 вдохов с использованием жизненной емкости легких может обеспечить по крайней мере 4 минуты «времени безопасности», прежде чем у пациента начнется десатурация без достаточной вентиляции.21 Адекватная преоксигенация у пациентов с ожирением имеет первостепенное значение, несмотря на сокращение «времени безопасности», учитывая снижение ФОЕЛ. Важно учитывать, что пациенты с ожирением часто имеют сопутствующие заболевания со стороны дыхательной системы и системные сопутствующие заболевания, которые могут еще больше усугубиться в положении лежа, несмотря на проведение преоксигенации. Выполнение соответствующей преоксигенации перед седацией увеличивает запас прочности в случае преходящего апноэ/гиповентиляции при введении начальной болюсной дозы пропофола. В этих случаях преоксигенация предоставляет специалистам группы проведения анестезии и эндоскопии больше времени для вмешательства с помощью корректирующих мер (например, выдвижения нижней челюсти и установки эндоскопа для стимуляции) до начала развития гипоксемии.
Существует несколько способов обеспечения дополнительным кислородом пациентов, перенесших ЭРХПГ с применением МАП, включая низкопоточные и высокопоточные назальные канюли, процедурные кислородные маски и специализированные эндоскопические маски. Все эти устройства для дыхательных путей различаются в зависимости от фракции вдыхаемого кислорода, которая может быть доставлена. Многие из этих устройств также способны обеспечить контроль капнографии во время процедуры. Перед началом седации во многих центрах пациенту также предлагается поместить в рот блок для предотвращения прикусывания эндоскопа. Многие блоки для предотвращения прикусывания имеют встроенную функцию обеспечения проходимости дыхательных путей или даже отверстие для аспирации, которое может помочь очистить дыхательные пути от содержимого.15 Помимо обеспечения комфорта при использовании устройства для обеспечения проходимости дыхательных путей, произвольное позиционирование пациента может помочь снизить риск сдавления или повреждения нервов, которые в противном случае могут быть не обнаружены у пациента при использовании ОЭА. Дополнительное преимущество произвольного позиционирования заключается в том, что требуется меньшее количество персонала для оказания помощи в транспортировке пациента, как это было бы необходимо, если бы пациент находился под общей анестезией.
Существует множество дополнительных устройств, применение которых следует рассмотреть во время МАП для сложных эндоскопических процедур. Премедикация с применением гликопирролата снижает секрецию и повышает эффективность местных анестетиков.22 В центрах с быстрым оборотом выполнения эндоскопии его необходимо вводить в предоперационной зоне, чтобы он начал действовать до начала процедуры. Пациенты должны быть соответствующим образом проинформированы о побочных эффектах каждого препарата. Перед началом седации проводится местная анестезия глотки, притупляющая чувствительность при введении эндоскопа. Среди вариантов местной анестезии — спреи для местной анестезии, которые обычно содержат бензокаин или лидокаин в качестве действующего вещества, или вязкий лидокаин, который пациент может распылить в ротовой полости и затем проглотить. При использовании растворов, содержащих бензокаин, важно соблюдать осторожность из-за риска развития метгемоглобинемии. Идеальный анестетик для постоянной анестезии обеспечивает простое титрование дозы, быстрое восстановление и минимальные побочные эффекты при сохранении спонтанной вентиляции легких. Дозу пропофола легко титровать для поддержания спонтанной вентиляции легких, одновременно обеспечивая седацию от умеренной до глубокой.23 Если необходима анальгезия, для достижения этой цели рекомендуется добавление к внутривенному анестетику опиоидного препарата короткого действия, дексмедетомидина или кетамина.22 Кроме того, проведение эндоскопических процедур можно прервать практически немедленно, просто удалив эндоскоп, если требуется срочный доступ к дыхательным путям. Извлечение эндоскопа может привести к ларингоспазму, поэтому необходимо быть готовым к срочному устранению этого потенциального осложнения при подготовке к обеспечению проходимости дыхательных путей. Помимо введения гастроскопа, интенсивность стимулирующего воздействия остается относительно постоянной во время ЭРХПГ, в отличие от перепадов, которые происходят во время традиционной хирургической операции. Из-за относительно минимальной или отсутствующей стимуляции, титрование анестетика для поддержания спонтанной вентиляции обычно легко достигается.20 При использовании отдельно, седация с помощью пропофола позволяет вернуться к исходному когнитивному уровню в течение 30–45 минут после прекращения, несмотря на задержку возврата психомоторной скорости и времени реакции.24 Использование МАП позволяет избежать использования как деполяризующих, так и недеполяризующих миорелаксантов; многие из которых характеризуются своими собственными уникальными побочными эффектами. Также уменьшаются проявления послеоперационной тошноты и рвоты, если избегать применения ингаляционных анестетиков и опиоидов, что приводит к повышению уровня удовлетворенности пациентов.
Применение ОЭА не лишено риска. Применение интубации сопряжено с риском травм губы, языка, зубов и глаз и, хотя встречается редко, с риском разрыва бронхов или невозможности обеспечения проходимости дыхательных путей и необходимости хирургического вмешательства. Сукцинилхолин чаще всего используется из-за его быстрого начала действия и короткой продолжительности, а в случае эндоскопии другой необходимости в миоплегии обычно нет. Потенциальные побочные эффекты применения сукцинилхолина включают боль в мышцах, миоглобинемию, миоглобинурию и злокачественную гипертермию.20 Использование недеполяризующих мышечных релаксантов связано с повышенным риском развития послеоперационных осложнений со стороны легких в результате остаточной нервно-мышечной блокады.24 Необходимо также учитывать холинергические эффекты, связанные с декураризацией, хотя это может быть менее актуально в учреждениях, где доступно применение сугаммадекса. Глубина анестезии, необходимая во время проведения ОЭА, увеличивает риск развития артериальной гипотензии, что впоследствии может привести к увеличению риска повреждения миокарда, повреждения почек и, возможно, смерти.26 Поскольку процедура ЭРХПГ выполняется в положении лежа или полулежа, требуется несколько человек для безопасного позиционирования и фиксации пациента при переходе от положения лежа на спине к положению лежа на животе на столе для рентгеноскопии. Всегда существует риск смещения эндотрахеальной трубки или случайной экстубации во время позиционирования. Наконец, в условиях NORA коллеги и другие члены команды часто оказывают меньшую поддержку во время чрезвычайных ситуаций и анестезиологических процедур, что впоследствии может привести к снижению эффективности работы учреждения. Perbtani и соавт.5 оценили влияние ОЭА на различные показатели эффективности в крупном медицинском центре интервенционной эндоскопии. Более 1400 пациентов, которым было выполнено 1635 интервенционных эндоскопических процедур в течение 6 месяцев, были проанализированы на основе отметок времени готовности к анестезии, времени готовности эндоскописта, времени процедуры, времени выхода из палаты, интервала времени между последовательными процедурами, времени, прошедшего без процедуры, общего времени, проведенного в отделении эндоскопии, и количества процедур в кабинете в сутки.2,5 Все показатели эффективности процесса, за исключением интервала времени между последовательными процедурами, были значительно увеличены среди пациентов, которые были интубированы, по сравнению с неинтубированными пациентами в отделении интервенционной эндоскопии. Вторичная цель исследования состояла в подтверждении того, что пациенты, которым выполняли процедуру ЭРХПГ, интубировались чаще, чем пациенты, которым выполняли другие процедуры (41,3% по сравнению с 12,4%).2,5
В заключение, применение МАП характеризуется значительными преимуществами по сравнению с применением ОЭА у правильно отобранных пациентов, которым выполняют ЭРХПГ. Эти преимущества включают более быстрое когнитивное восстановление, снижение частоты развития побочных эффектов применения лекарственных препаратов, используемых для индукции ОЭА, снижение риска повреждения дыхательных путей, снижение послеоперационных легочных осложнений, а также сокращение времени пребывания в больнице за счет более быстрой индукции и более короткого времени до выписки, что повышает показатели эффективности для отделения, врачей и пациентов. При надлежащем мониторинге, применении дополнительного кислорода и седации, доза которой тщательно титруется для поддержания спонтанной вентиляции, МАП во время ЭРХПГ является безопасной и часто лучшей альтернативой ОЭА.
ПРОТИВ: ОСНОВНЫЕ ПРЕИМУЩЕСТВА ОЭА ПО СРАВНЕНИЮ С МАП
Люк С. Яник (Luke S. Janik), MD, и
Джеффри С. Вендер (Jeffery S. Vender), MD, магистр реаниматологии (MCCM)
ЭРХПГ — это часто выполняемая процедура при диагностике и лечении заболеваний органов панкреатобилиарной зоны. Каждый год в Соединенных Штатах проводится >500 000 процедур ЭРХПГ, наиболее частыми показаниями к которым являются камни желчных протоков и стриктуры желчных и вирсунгова протоков.27 Процедура ЭРХПГ является бесценным инструментом в лечении заболеваний печени, желчных протоков и поджелудочной железы, но, как правило, считается процедурой с самым высоким риском, выполняемой при заболеваниях желудочно-кишечного тракта, с общей частотой развития осложнений 4%.28 К осложнениям процедуры относятся панкреатит (2–10%), холангит/сепсис (0,5–3%), кровотечение после сфинктеротомии (0,3–2%), перфорация двенадцатиперстной кишки (0,08–0,6%) и смертельный исход (0,06%).28,29 Однако, что может быть более тревожным для специалистов в области анестезии, так это высокая частота развития НЯ, связанных с седацией, во время процедуры, по сообщениям, составляющая до 21%.6,7 В связи с этим возникают вопросы о том, кто должен проводить анестезию и наблюдать за пациентом во время ЭРХПГ и какой вид анестезии следует применять. В этом обсуждении доводов за и против мы утверждаем, что анестезию при ЭРХПГ должен проводить квалифицированный специалист по анестезии, и что применение ОЭА создает значительные преимущества по сравнению с применением МАП.
Существует широкая вариабельность в выборе анестезии при выполнении ЭРХПГ. К трем наиболее распространенным моделям оказания анестезиологической помощи относятся (1) седация под руководством эндоскописта (EDS), (2) МАП и (3) ОЭА. В первой модели, EDS, внутривенную седацию выполняет член команды по лечению заболеваний ЖКТ, обычно медсестра, под наблюдением эндоскописта, который часто одновременно выполняет процедуру. Использование традиционной «седации при сохраненном сознании» с титрованием бензодиазепинов и наркотических средств, как правило, вышло из употребления из-за высоких показателей неудач процедуры, низкой удовлетворенности как пациента, так и эндоскопистов.30 Следовательно, при седации под руководством эндоскописта принято использование пропофола профессионалами не-анестезиологами, которое сообщество гастроэнтерологов называет безопасным и эффективным.31–33 При использовании двух других моделей оказания анестезиологической помощи пациент находится под наблюдением квалифицированного специалиста по анестезии и получает либо МАП с седацией на основе пропофола, либо ОЭА. Выбор модели оказания анестезиологической помощи зависит от медицинского учреждения и от имеющихся ресурсов и персонала, сложности процедуры, характеристик пациентов и сопутствующих заболеваний, а также индивидуальных предпочтений.
Прежде чем мы обсудим, как следует проводить анестезию, необходимо определить место, где ее выполняют. Риск проведения анестезии в отдаленных местах является широко распространенным. На основании анализа базы данных о закрытых претензиях ASA было рассмотрено заявление о неправомерных действиях в адрес специалистов по анестезии в удаленных местах и продемонстрировано, что нежелательные явления в удаленных местах привели к более высоким показателям тяжелых осложнений, включая смертельный исход, а также стойкое повреждение головного мозга, чем при нежелательных явлениях в операционной. Фактически, доля смертельных исходов была почти вдвое выше в удаленных местах по сравнению с операционной (54% по сравнению с 29%).11 Критические инциденты со стороны дыхательной системы были более частыми в отдаленных местах, чем в операционной (44% по сравнению с 20%), при этом недостаточная оксигенация/вентиляция была определена в качестве механизма повреждения в 21% случаев претензий в отношении удаленных мест по сравнению с 3% случаев претензий при проведении процедуры в операционной.11 Данные закрытых претензий, относящиеся к гастроэнтерологическим отделениям, требуют дальнейшего внимания. По сравнению со всеми другими удаленными местами, на отделения гастроэнтерологии приходился самый высокий процент претензий о нарушении применения анестезии (32%), самый высокий процент претензий, связанных с переутомлением (58%), и самый высокий показатель использования МАП (>80%).11 Эти данные не являются неожиданными для специалистов-анестезиологов. Незнакомые места, нехватка ресурсов, плохая эргономика, ограниченная помощь, различные культуры безопасности и физическое расстояние от дополнительного анестезиологического оборудования и персонала являются повседневными проблемами в отделении гастроэнтерологии. Кроме того, чаще всего встречаются пациенты более старшего возраста, которые имеют более тяжелые заболевания.11 При проведении ЭРХПГ возникают и другие необычные проблемы, включая рутинное использование положения лежа на животе, ограниченный доступ к дыхательным путям и использование эндоскопа, которое может привести к обструкции дыхательных путей и ларингоспазму. Принимая во внимание все эти проблемы, анестезия при ЭРХПГ сопряжена со значительным риском, и к ней следует подходить с осторожностью.
Сторонники применения МАП при ЭРХПГ указывают на результаты многочисленных ретроспективных и проспективных исследований — главным образом, на основании данных литературы по гастроэнтерологии, в которых делается вывод о том, что методика является безопасной и эффективной. 4,6,8,33,34 В ходе проспективного исследования, сравнивающего применение МАП с применением ОЭА, Berzin и соавт.6 сообщили, что общая частота развития НЯ, связанных с седацией, составляет 21%. Конкретные нежелательные явления в когорте применения МАП включали гипоксемию (12,5%; определяется как сатурация <85%), незапланированную вентиляцию с помощью маски (0,6%), незапланированную интубацию (3%) и прерывание процедуры (5%).6 Исходя из этих данных, авторы пришли к выводу, что «нежелательные явления, связанные с седацией, были частыми (21%), но приводили к временному прерыванию процедуры только в 5% случаев». Они неумышленно отклонили 3% случаев незапланированной интубации, заявив, что «в редких случаях, когда проведение незапланированной интубации считалось необходимым, доступ к дыхательным путям был легко обеспечен». В аналогичном проспективном исследовании ERCP мониторируемого анестезиологического пособия (MAC), Чжан и соавт. (Zhang et al)7 обнаружили, что осложнения, связанные с седацией, возникли у 18% пациентов, при этом гипоксемия (определяемая как насыщение кислородом <90% на протяжении не менее чем 2 минут) возникла у 9% пациентов, и >33% пациентов перенесли несколько эпизодов гипоксемии. Авторы отметили, что частота развития гипоксемии в их исследовании была сопоставима с ее частотой в других аналогичных исследованиях, и, таким образом, пришли к выводу, что «седация, проводимая анестезиологическим персоналом, при выполнении ЭРХПГ является безопасной». В ретроспективном обзоре МАП при проведении ЭРХПГ, Yang и соавт.9 сообщили о частоте развития гипоксемии (определяемой как сатурация <90%), требующей протезирования дыхательных путей в 28% случаев, при этом у 1,6% пациентов требовался переход на ОЭА из-за присутствия пищи в желудке. Несмотря на полученные результаты, авторы пришли к выводу, что «применение пропофола является безопасным и эффективным в качестве седативного средства у пациентов, которым проводилась ЭРХПГ».
Как можно на основании исследований, в которых сообщается о таких высоких показателях развития НЯ, связанных с седацией, эпизодов гипоксии и необходимости проведения манипуляций с дыхательными путями, сделать вывод о том, что седация является «безопасной», «осуществимой» или «уместной»?4,6–9 То, что критический инцидент не привел к критическому результату, не означает, что он является менее критическим! Интерпретация данных в конечном итоге зависит от того, через какую призму они рассматриваются. Гастроэнтеролога может не насторожить частота незапланированной интубации до 3%,6 или гипоксемии до 33%,7 при условии, что у пациента не было никаких отдаленных последствий. Однако анестезиолог, который отвечает за экстренное протезирование дыхательных путей и сердечно-легочную реанимацию, может рассматривать каждый из этих эпизодов гипоксемии как жизнеугрожающее событие. Следует помнить, что пульсоксиметрия является способом оценки оксигенации, а не вентиляции, и она не может быть надежно использована для обнаружения гиповентиляции и прогрессирующей гиперкапнии.35,36 Гипоксемия в условиях дополнительного использования кислорода — это стандартная практика во время выполнения МАП при ЭРХПГ, что является поздним маркером развития гиповентиляции и предвестником приближающейся остановки дыхания.
В качестве аргумента давайте рассмотрим другой сценарий. Если в течение года мы ездим, не пристегиваясь ремнями безопасности, и ни разу не пострадали ни в одной аварии, правильно ли будет сделать вывод, что езда без ремней безопасности безопасна, целесообразна и оправдана? Признание нормой высокой частоты развития гипоксемии во время МАП при ЭРХПГ, при нахождении в отдаленном месте, в положении лежа на животе и с ограниченным доступом к дыхательным путям, создает опасный прецедент. Мы признаем, что трудно определить «приемлемую» частоту развития НЯ, связанных с седацией, и эпизодов гипоксии во время седации. Однако, по нашему мнению, частота развития НЯ и эпизодов гипоксии, связанных с седацией, о которых сообщалось в вышеупомянутых исследованиях, вызывает беспокойство и должна быть осознана как проблема безопасности пациента, а не отклонена как несущественное явление.
Теперь давайте обратим наше внимание на доказательства в поддержку проведения ОЭА при ЭРХПГ. В рандомизированном контролируемом исследовании, сравнивающем безопасность применения МАП с ОЭА при выполнении ЭРХПГ, результаты явно указывают на преимущество применения ОЭА.10 В данное исследование были включены пациенты с высоким риском развития НЯ, связанных с седацией, в том числе с наличием STOP-BANG (системы оценки, включающей показатели: «храп», «усталость», «наблюдаемое апноэ», «артериальное давление», «индекс массы тела», «возраст», «окружность шеи», «пол») ≥3, «асцит», «ИМТ ≥35», «хронические заболевания легких», «оценка физического состояния по шкале ASA >3», «состояние дыхательных путей класса 4 по шкале Маллампати» и «степень употребления алкоголя от умеренной до тяжелой». Частота развития НЯ, связанных с седацией, была заметно выше в группе применения МАП по сравнению с группой применения ОЭА (51,5% в сравнении с 9,9%).10 В группе применения контролируемой анестезиологической помощи гипоксемия (определяемая как сатурация <90%) наблюдалась у 19% пациентов, при этом у 45% пациентов требовалось проведение одной или нескольких манипуляций на дыхательных путях, и у 8% требовалось использование вентиляции с помощью мешка Амбу.10 И наоборот, в группе применения ОЭА не было ни одного случая развития гипоксемии или манипуляций с дыхательными путями. Процедуру ЭРХПГ пришлось прервать у 10,1% пациентов в группе применения МАП, при этом требовался переход на ОЭА из-за нестабильности дыхания (8%) и наличия содержимого в желудке (2%).10 Следует отметить, что гипотензия, требующая применения вазопрессоров, возникала с одинаковой частотой в обеих группах пациентов, и не было никаких различий во времени процедуры, успехе проведения манипуляции и времени восстановления пациента.10
Оставив на время в стороне данные, давайте вернемся назад и обсудим реальность кризисного управления с точки зрения анестезиолога. Нарушение проходимости дыхательных путей в положении лежа на животе, в удаленном месте, при ограниченности помощи и ресурсов — это кошмар для каждого специалиста по анестезии, как и предвидится. Когда важна каждая секунда, может показаться, что на извлечение эндоскопа, перемещение рентгеноскопического оборудования в другое место, внесение носилок в палату и переворачивание пациента на спину может уйти целая вечность. К тому времени, когда пациент будет надлежащим образом размещен для обеспечения доступа к дыхательным путям, он может оказаться на грани остановки дыхания. Да, это относительно редкое явление во время седации при проведении ЭРХПГ, но его можно предотвратить. Зачем идти на такой риск, если проходимость дыхательных путей может быть изначально обеспечена с помощью эндотрахеальной интубации в условиях управляемого выбора? Учитывая высокую частоту развития гипоксемии, связанной с седацией во время ЭРХПГ, и многочисленные проблемы, связанные с незапланированной интубацией в таких условиях, применение ОЭА является логически обоснованным выбором.
Среди гастроэнтерологов сформировалось мнение, что применение МАП быстрее, чем ОЭА, требует меньше времени для восстановления и обеспечивает более высокую пропускную способность для пациентов. Несмотря на то, что существуют некоторые данные, подтверждающие это мнение,5 другие данные говорят о том, что любая экономия времени во время седации, скорее всего, компенсируется частыми прерываниями процедур из-за нарушения проходимости дыхательных путей.10 В действительности, эффективность работы гастроэнтерологического отделения является сложным итогом взаимодействия различных переменных (включая эффективность процедур, проводимых эндоскопистом), и было бы недальновидным полагать, что эффективность связана исключительно с наличием или отсутствием эндотрахеальной трубки. Существует также мнение, что МАП по своей сути является более щадящим, безопасным и менее инвазивным методом, чем ОЭА. Несомненно, применение ОЭА вносит свои собственные риски, в том числе потенциальные травмы зубов, остаточную нервно-мышечную блокаду, гемодинамическую нестабильность и нежелательные реакции в результате применения лекарственных препаратов. Однако при сравнении всех этих рисков с риском нарушения проходимости дыхательных путей во время МАП при проведении ЭРХПГ в положении лежа на животе, вывод будет очевидным. Наша работа в качестве анестезиологов заключается в снижении риска, а на риск нарушения проходимости дыхательных путей во время МАП при ЭРХПГ не стоит идти.
До тех пор, пока не будут проведены дальнейшие крупномасштабные многоцентровые рандомизированные контролируемые исследования, будут сохраняться разногласия относительно выбора МАП по сравнению с ОЭА при проведении ЭРХПГ, при этом стандарт лечения останется неопределенным. Однако все анестезиологи могут согласиться с тем, что независимо от метода анестезии, анестезию должен проводить квалифицированный специалист. В Соединенных Штатах применение седации под руководством эндоскописта при проведении ЭРХПГ снизилось с >50% случаев в 2005 г. до 5% в 2014 г., но она по-прежнему распространена в странах Европы и других странах.3 Ретроспективный обзор почти 27 000 наблюдений ЭРХПГ, проведенных в течение 10-летнего периода, показал, что седация под руководством эндоскописта привела к более высокой частоте развития нежелательных явлений (ОШ = 1,86), при этом почти в два раза чаще требовалось проведение незапланированного вмешательства, чем при седации с применением анестезии.3 Исследования также показали, что применение седации под руководством эндоскописта привело к более высокой частоте неудач при седации и, следовательно, к более частому развитию осложнений, чем при использовании МАП или ОЭА.30,34 Что еще хуже, применение седации под руководством эндоскописта привело к низкой удовлетворенности и пациентов, и самих эндоскопистов.33 По нашему мнению, модель седации под руководством эндоскописта для ЭРХПГ представляет угрозу для безопасности пациентов и должна быть исключена. Мы твердо убеждены, что седацию с применением пропофола должен проводить только квалифицированный специалист по анестезии, который способен быстро распознавать нарушения проходимости дыхательных путей и обладает навыками ее восстановления в случае чрезвычайной ситуации. Эти навыки выходят за рамки практики врачей-гастроэнтерологов, медсестер и среднего медицинского персонала.
Применение МАП во время ЭРХПГ связано с высокой частотой развития гипоксемии, необходимости протезирования дыхательных путей и НЯ, связанных с седацией. Эти риски в сочетании с опасностями, связанными с проведением анестезии в отдаленных местах, вызывают значительную озабоченность по поводу безопасности применения МАП при ЭРХПГ в положении лежа на животе. По словам мудрого анестезиолога доктора Карла Хага-младшего (Dr. Carl Hug Jr), возможно, «МАП» необходимо расшифровывать как «максимальную анестезиологическую предосторожность», а не «мониторируемое анестезиологическое пособие».37 Мы считаем, что все пациенты, которым выполняют процедуры ЭРХПГ, должны находиться под наблюдением квалифицированного анестезиолога и что применение ОЭА имеет значительные преимущества по сравнению с применением МАП.
РЕЗЮМЕ
Написание этой статьи с обсуждением доводов «За» и «Против» было вызвано ростом числа сложных эндоскопических процедур в последние годы в сочетании с отсутствием крупных рандомизированных контролируемых исследований для поддержки определения окончательного метода анестезии для пациентов при ЭРХПГ. Дебаты особенно важны из-за частоты сопутствующих заболеваний и в связи с тем, что процедура включает в себя манипуляции с дыхательными путями. Преимущества МАП включают меньшее число гемодинамических нарушений, снижение побочных эффектов от применения ингаляционных препаратов, более быстрое восстановление когнитивных функций и более короткое общее время выполнения процедуры, которое должно быть сопоставлено с частотой развития критических явлений из-за нарушений оксигенации и (или) вентиляции, которые, как известно, возникают во время проведения МАП. Два подхода, выделенные в этом обсуждении, подчеркивают важность наличия квалифицированного специалиста-анестезиолога, который определяет оптимальный анестетик для конкретного пациента на основании клинических обстоятельств.
Люк С. Яник, MD, является клиническим доцентом кафедры анестезиологии и реаниматологии Чикагского университета и практикующим анестезиологом на кафедре анестезиологии, реаниматологии и медицины управления болью в системе здравоохранения Университета Нортшор в г. Эванстон, шт. Иллинойс.
Джеффри С. Вендер, MD, MCCM, является почетным клиническим профессором факультета анестезиологии Чикагского университета, г. Чикаго, шт. Иллинойс.
Саманта Стампер, MD, является доцентом Медицинского колледжа Кливлендской клиники Лернера Университета Кейс Вестерн Резерв и преподавателем Института анестезиологии Кливлендской клиники, г. Кливленд, шт. Огайо.
Кристофер А. Троянос, MD, FASE, FASA, является клиническим профессором Медицинского колледжа Кливлендской клиники Лернера Университета Кейс Вестерн Резерв и преподавателем Института анестезиологии Кливлендской клиники, г. Кливленд, шт. Огайо.
Раскрытие информации: Люк С. Яник, MD, Саманта Стампер, MD, и Кристофер А. Троянос, MD, FASE, FASA, не имеют конфликта интересов. Джеффри С. Вендер, MD, MCCM, является консультантом компаний Fresenius Kabi, Medline Industries и Medtronic.
Список литературы
- Woodward ZG, Urman RD, Domino KB. Safety of non-operating room anesthesia: a closed claims update. Anesthesiol Clin. 2017;35:569–581. PMID: 29101947.
- Smith ZL, Das KK, Kushnir VM. Anesthesia-administered sedation for endoscopic retrograde cholangiopancreatography: monitored anesthesia care or general endotracheal anesthesia? Curr Opin Anaesthesiol. 2019;32:531–537. PMID: 30994476.
- Smith ZL, Nickel KB, Olsen MA, et al. Type of sedation and the need for unplanned interventions during ERCP: analysis of the clinical outcomes research initiative national endoscopic database (CORI-NED). Frontline Gastroenterol. 2020;11:104–110. PMID: 32133108.
- Barnett SR, Berzin T, Sanaka S, et al. Deep sedation without intubation for ERCP is appropriate in healthier, non-obese patients. Dig Dis Sci. 2013;58:3287–3292. PMID: 23877477.
- Perbtani YB, Summerlee RJ, Yang D, et al. Impact of endotracheal intubation on interventional endoscopy unit efficiency metrics at a tertiary academic medical center. Am J Gastroenterol. 2016;111:800–807. PMID: 27021194.
- Berzin TM, Sanaka S, Barnett SR, et al. A prospective assessment of sedation-related adverse events and patient and endoscopist satisfaction in ERCP with anesthesiologist-administered sedation. Gastrointest Endosc. 2011;73:710–717. PMID: 21316669.
- Zhang CC, Ganion N, Knebel P, et al. Sedation-related complications during anesthesiologist-administered sedation for endoscopic retrograde cholangiopancreatography: a prospective study. BMC Anesthesiol. 2020;20:131. PMID: 32466744.
- Coté GA, Hovis RM, Ansstas MA, et al. Incidence of sedation-related complications with propofol use during advanced endoscopic procedures. Clin Gastroenterol Hepatol. 2010;8:137–142. PMID: 19607937.
- Yang JF, Farooq P, Zwilling K, et al. Efficacy and safety of propofol-mediated sedation for outpatient endoscopic retrograde cholangiopancreatography (ERCP). Dig Dis Sci. 2016;61:1686–1691. PMID: 26825844.
- Smith ZL, Mullady DK, Lang GD, et al. A randomized controlled trial evaluating general endotracheal anesthesia versus monitored anesthesia care and the incidence of sedation-related adverse events during ERCP in high-risk patients. Gastrointest Endosc. 2019;89:855–862. PMID: 30217726.
- Metzner J, Posner KL, Domino KB. The risk and safety of anesthesia at remote locations: the US closed claims analysis. Curr Opin Anaesthesiol. 2009;22:502–508. PMID: 19506473.
- Wu WZ, Zheng MH, Wang JC, Chen S. The role of endoscopic retrograde cholangiopancreatography in perioperative period of laparoscopic cholecystectomy. Hepatobiliary Pancreat Dis Int. 2002;1:114–117. PMID: 14607638.
- Kapoor H. Anaesthesia for endoscopic retrograde cholangiopancreatography. Acta Anaesthesiol Scand. 2011;55:918–926.
- Huang RJ, Barakat MT, Girotra M, et al. Unplanned hospital encounters after endoscopic retrograde cholangiopancreatography in 3 large North American States. Gastroenterology. 2019;156:119.e3–129.e3. PMID: 30243620.
- Goudra B, Singh PM. Airway management during upper GI endoscopic procedures: state of the art review. Dig Dis Sci. 2017;62:45–53. PMID: 27838810.
- Shah T, Ianchulev S. Gastroscope-facilitated endotracheal intubation during ERCP: when is the best time to GETA (Big) MAC? Dig Dis Sci. 2021;66:938–940. PMID: 32643057.
- Barakat MT, Angelotti TP, Banerjee S. Use of an ultra-slim gastroscope to accomplish endoscopist-facilitated rescue intubation during ERCP: a novel approach to enhance patient and staff safety. Dig Dis Sci. 2021;66:1285–1290. PMID: 32504349.
- Standards for Basic Anesthetic Monitoring. American Society of Anesthesiologist Website. October 21, 1986, last amended on October 20, 2010, and last affirmed on October 28, 2016. https://www.asahq.org/~/media/Sites/ASAHQ/Files/Public/Resources/standards-guidelines/standards-for-basic-anesthetic-monitoring.pdf. Accessed March 20, 2021.
- Deitch K, Miner J, Chudnofsky CR, et al. Does end tidal CO2 monitoring during emergency department procedural sedation and analgesia with propofol decrease the incidence of hypoxic events? A randomized, controlled trial. Ann Emerg Med. 2010;55:258–264. PMID: 19783324.
- Goudra B, Singh PM. ERCP: the unresolved question of endotracheal intubation. Dig Dis Sci. 2014;59:513–519. PMID: 24221339.
- Gambee AM, Hertzka RE, Fisher DM. Preoxygenation techniques: comparison of three minutes and four breaths. Anesth Analg. 1987;66:468–470. PMID: 3578856.
- Tetzlaff JE, Vargo JJ, Maurer W. Nonoperating room anesthesia for the gastrointestinal endoscopy suite. Anesthesiol Clin. 2014;32:387–394. PMID: 24882126.
- Goulson DT, Fragneto RY. Anesthesia for gastrointestinal endoscopic procedures. Anesthesiol Clin. 2009;27:71–85. PMID: 19361769.
- Allampati S, Wen S, Liu F, Kupec JT. Recovery of cognitive function after sedation with propofol for outpatient gastrointestinal endoscopy. Saudi J Gastroenterol. 2019;25:188–193. PMID: 30618439.
- Berg H, Roed J, Viby-Mogensen J, et al. Residual neuromuscular block is a risk factor for postoperative pulmonary complications. A prospective, randomised, and blinded study of postoperative pulmonary complications after atracurium, vecuronium and pancuronium. Acta Anaesthesiol Scand. 1997;41:1095–1103. PMID: 9366929.
- Althoff FC, Agnihotri A, Grabitz SD, et al. Outcomes after endoscopic retrograde cholangiopancreatography with general anaesthesia versus sedation. Br J Anaesth. 2021;126:191–200. PMID: 33046219.
- Coelho-Prabhu N, Shah ND, Van Houten H, et al. Endoscopic retrograde cholangiopancreatography: utilisation and outcomes in a 10-year population-based cohort. BMJ Open. 2013;3:e002689. PMID: 23793659.
- Cotton PB, Garrow DA, Gallagher J, Romagnuolo J. Risk factors for complications after ERCP: a multivariate analysis of 11,497 procedures over 12 years. Gastrointest Endosc. 2009;70:80–88. PMID: 19286178.
- Chandrasekhara V, Khashab MA, Muthusamy R, et al. Committee ASoP. Adverse events associated with ERCP. Gastrointest Endosc. 2017;85:32–47. PMID: 27546389.
- Raymondos K, Panning B, Bachem I, et al. Evaluation of endoscopic retrograde cholangiopancreatography under conscious sedation and general anesthesia. Endoscopy. 2002;34:721–726. PMID: 12195330.
- Wehrmann T, Kokabpick S, Lembcke B, et al. Efficacy and safety of intravenous propofol sedation during routine ERCP: a prospective, controlled study. Gastrointest Endosc. 1999;49:677–683. PMID: 10343208.
- Lapidus A, Gralnek IM, Suissa A, et al. Safety and efficacy of endoscopist-directed balanced propofol sedation during endoscopic retrograde cholangiopancreatography. Ann Gastroenterol. 2019;32:303–311. PMID: 31040629.
- Goudra BG, Singh PM, Gouda G, et al. Safety of nonanesthesia provider-administered propofol (NAAP) sedation in advanced gastrointestinal endoscopic procedures: comparative meta-analysis of pooled results. Dig Dis Sci. 2015;60:2612–2627. PMID: 25732719.
- Buxbaum J, Roth N, Motamedi N, et al. Anesthetist-directed sedation favors success of advanced endoscopic procedures. Am J Gastroenterol. 2017;112:290–296. PMID: 27402501.
- Fu ES, Downs JB, Schweiger JW, et al. Supplemental oxygen impairs detection of hypoventilation by pulse oximetry. Chest. 2004;126:1552–1558. PMID: 15539726.
- Hutton P, Clutton-Brock T. The benefits and pitfalls of pulse oximetry. BMJ. 1993;307:457–458. PMID: 8400922.
- Hug CC Jr. MAC should stand for maximum anesthesia caution, not minimal anesthesiology care. Anesthesiology. 2006;104:221–223. PMID: 16436837.


 Issue PDF
Issue PDF