| 转载自《麻醉与镇痛》,2022 年 6 月 • 第 134 卷 • 第 6 期,第 1192-1200 页,获得国际麻醉研究协会许可。根据 APSF 政策,对文本中的专业职称和术语进行了标准化和修改。 |

在这篇利弊评论文章中,作者被要求反对或支持关于经内镜逆行性胰胆管造影 (ERCP) 麻醉的立场。ERCP 的独特之处在于,不仅需要共用气道,通常还需要在特殊手术台上以俯卧(或半俯卧)姿势进行。此外,手术时间可能从 1 小时以内到数小时不等。
当没有明确的治疗标准时,医疗专业人士的医疗实践往往各不相同。造成这种差异的原因是多方面的。患者因素和合并症、医护人员技能和经验、手术需求以及缺乏数据是需要考虑的一些因素。因此,对于胃肠道 (GI) 内镜患者的主要麻醉方式,观点明显分为提倡监护下镇静全麻 (MAC) 与依赖于气管插管全麻 (GEA),这并不奇怪。
对与这些麻醉剂和手术相关的潜在发病率和死亡率的认识正日益加深,突显了此辩论的重要性。美国麻醉医师协会 (American Society of Anesthesiologists, ASA) 的一份已终结索赔报告显示,与手术室发生的类似事件相比,非手术室麻醉 (NORA) 地点发生的不良事件导致严重并发症(包括死亡和永久性脑损伤)的发生率更高。1事实上,在所有 NORA 地点中,GI 病房的不良事件占比最高。
麻醉专业人士必然会面对在 NORA 环境中(尤其是在 GI 病房中)提供服务的日益增加的需求。因此,本次利弊辩论为使用 MAC 与 GEA 进行 ERCP 手术的照护计划决策提供了见解,总结见表 1。我们的患者最终将受益于对这些可变方法及其相关结果的进一步系统临床研究。
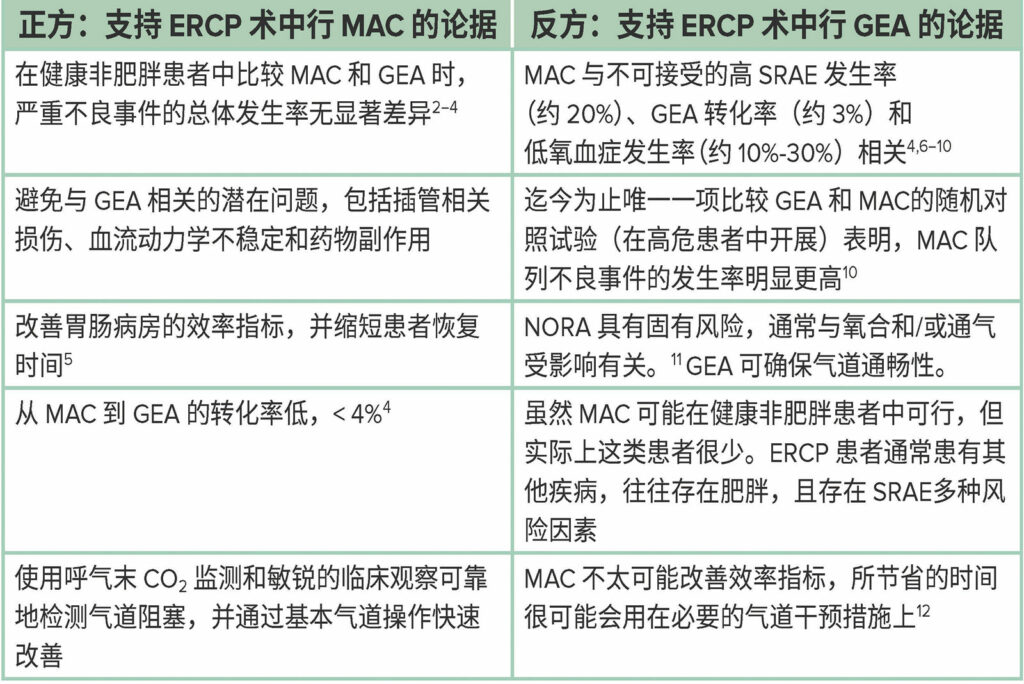
表 1:利弊辩论总结。
正方:ERCP 麻醉最好采用 MAC
Samantha Stamper, MD 和
Christopher A. Troianos, MD, FASE, FASA
ERCP 利用透视和内镜进行诊断和治疗干预。这有助于对肝脏、胆囊、胆管和胰腺进行评估。近年来,由于先进内镜治疗技术和成像技术(如磁共振胰胆管造影和内镜超声)的出现,ERCP 主要用于治疗干预。13此类干预包括胆囊括约肌切开术、胆石取出或粉碎术、胆管和胰管支架置入术以及胰腺假性囊肿引流术。12,13在这些手术中,许多手术既往都需要采用开腹手术或腹腔镜手术来治疗,但 ERCP 现已成为一种可行、具有经济效益的首选方案。
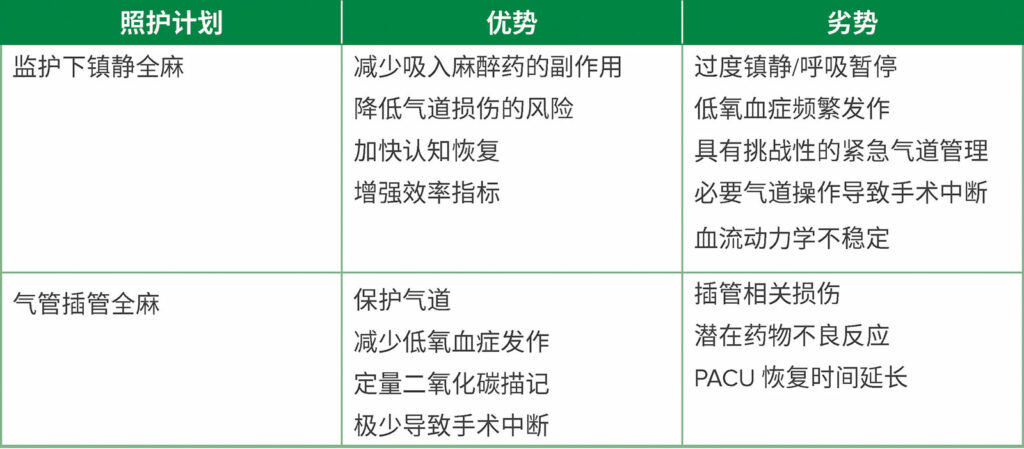
先进的内镜干预还可提供一项额外的益处,即微创、疼痛小,且很少需要肌肉麻痹。6美国每年会进行 50 多万次 ERCP,其中大多数患者都需要麻醉服务。14ERCP 更常在老年患者中进行;大多数老年患者同时患有其他严重疾病。13虽然目前还没有基于前瞻性随机试验的结果证据表明 MAC 或 GEA 对接受先进内镜干预的患者是否优于其他患者,但存在有说服力的临床依据,支持在大多数内镜患者中优先考虑“MAC 优先”的方法。虽然麻醉计划总是针对每个特定个体制定,但经验丰富的内镜团队将认识到 MAC 方法可能是更好的选择,特别是对于体重指数 (BMI) 正常或接近正常的健康患者。内镜医生与麻醉专业人士进行清晰的沟通至关重要。例如,ERCP 的具体适应症(治疗与诊断)和病程对于创建共享的心理模型至关重要,且可能有助于确定最佳麻醉方式。例如,如果干预计划是直接取出胆道支架,则 MAC 可能最为合适。相比之下,如果要对有坏死壁的复杂、分隔性胰腺假性囊肿进行引流,则通常要采用 GEA。因此,干预时间和侵入性是麻醉选择的重要考虑因素,必须考虑每种麻醉技术的优缺点(表 2)。
表 2:每种麻醉照护计划的优势和劣势。
同样,选择最佳麻醉方式还需考虑特定的设施因素。这些考虑因素包括与主手术室的距离、救援设备的可用性、麻醉后照护病房的充足性以及其他需求(如有需要)。其他考虑因素包括麻醉工作区的物理占地面积,这常因专用设备(如内镜用品、射线成像设备、辅助显示器/观察塔)而受到限制。术前与机构和内镜团队进行沟通对于减少任何不良并发症至关重要。此外,谨慎的医务人员必须始终确保有明确的计划和路径可用,以防需要紧急气道救援。上述因素可能有助于做出优先选择 MAC 的决策。
复杂的内镜手术,尤其是 ERCP 手术,通常采用俯卧或半俯卧位进行,这可能会限制气道的可及性和/或影响静脉血回流和心血管稳定性。2然而,这种体位通常可保持肺部的肺血流量和通气分布(V/Q 匹配),尤其是在非插管(如 MAC)患者中。此外,内镜本身可以作为支架缓解气道塌陷。15俯卧位对呼吸功能有多种额外的积极影响,特别是可增加功能性残气量 (FRC) 和动脉 Po2。2
俯卧位 MAC 的一个主要问题是可能需要进行紧急气管插管。一种潜在可行的策略是让一名训练有素的内镜医生进行胃镜辅助气管插管。这需要一个能够进入气管的小型内镜和一名具备这些技能的内镜医生,且随时由麻醉专业人士协助。“超细”胃镜的功能类似于支气管镜,外径为 5.4 毫米,可插入成人气管插管。16在一项对 3400 多名接受 ERCP 的患者(46% 采用 GEA,54% 采用 MAC)进行的综述中,从 MAC 到 GEA 的总转化率较低,为 2.3%。作者描述了其在 16 名患者中因胃中滞留有食物和/或缺氧成功使用了胃镜辅助气管插管。17胃镜的另一个益处是可以立即从气管和支气管中吸出吸入物,从而降低出现呼吸系统并发症的风险。17所有接受胃镜辅助插管的患者均成功拔管,没有患者存在吸入性肺炎的影像学证据。17
这种用于抢救气道受损或塌陷的新方法消除了临床医生考虑以俯卧位或半俯卧位使用 MAC 时最常见的担忧。上述研究中的内镜医生对这项技术进行了自我训练,这突显了一点,即,目前尚无针对胃镜辅助插管的正式培训或认证程序。17这种技术只能在麻醉专业人士的直接监督下进行,或由麻醉专业人士执行。使用超细胃镜进行插管的一个重要警告是,内镜医生必须从传统的侧视 ERCP 胃镜切换到装有气管插管的超细胃镜。这种胃镜更换提供了在撤出时(即将插管前)抽吸胃部、食管和下咽的益处,但应加速进行,以尽量减少可能出现的插管延迟。
表 3:MAC 期间导致镇静相关不良事件的风险因素。
在使用 MAC 进行 ERCP 之前,必须考虑镇静相关不良事件 (SRAE) 的风险因素(如表 3 所示)。许多人认为,增加误吸可能性的状况是导致 SRAE 的风险因素。许多研究表明,MAC 是 ERCP 的安全选择,尤其是在 SRAE 风险因素极少的患者中。在美国多个内镜中心进行的一项为期 10 年的大规模、基于人群的研究发现,使用 MAC (n = 8395) 与 GEA(n = 10,715;比值比 [OR] = 1.04,95% 置信区间 [CI],0.76-1.43)的 ERCP 在总体严重不良事件方面没有显著差异。2,3尽管如此,大多数患者相对健康(ASA 健康状态分级为 I 级和 II 级),但作者并未试图控制选择偏差。ASA 健康状态分级为 I 级和 II 级的患者不良事件的发生率没有显著差异(OR = 0.84 [0.49-1.46]),ASA 健康状态分级为 III 级和 II 级的患者不良事件的发生率也没有差异(OR = 1.30 [1.00-1.69])。事实上,数据表明,仅 ASA 健康状态分级为 IV 级的患者发生 MAC 不良事件的风险明显更高(OR = 3.19 [ 2.00-5.09])。2,3在另一项前瞻性观察研究中,让麻醉专业人士决定是选择 MAC 还是 GEA,393 名患者接受 MAC,45 名患者接受 GEA。4从 MAC 到 GEA 的转化率为 3.7%。值得注意的是,25% 转化为 GEA 的患者是 ASA 健康状态分级为 IV 级的患者。2,4考虑到本研究固有的选择偏差,GEA 组的平均 BMI 高于 MAC 组以及 ASA 健康状态分级为 IV 级的患者百分比均在意料之中。4,6尽管如此,MAC 组与 GEA 组的不良事件发生率之间的差异并无统计学意义,研究人员因此得出结论,对于术前经麻醉专业人士评估的健康非肥胖患者,MAC 可行且具有良好的耐受性。2,4,6
使用 MAC 进行 ERCP 期间的临床监测应遵循基本麻醉监护的常规标准,包括持续评估患者的氧合、通气、循环和体温18;这包括测量无创血压、脉搏血氧测定、心电图和二氧化碳描记。MAC 中使用的许多气道设备(如鼻插管或简易面罩)能够监测呼气末 CO2,并在开始缺氧之前检出呼吸暂停。4,19可采取其他监测方式在脉搏血氧下降之前检出呼吸暂停,包括阻抗呼吸描记法,以及较少用于手术室的声呼吸频率监测仪。
所有 MAC 麻醉均从充分预充氧开始。这对于预防低氧血症至关重要,低氧血症通常是更严重不良事件(如心律失常、低血压和心脏骤停)的前兆。20理想情况下,预充氧 3 分钟或 4 次肺活量呼吸可以提供至少 4 分钟的“安全时间”,然后患者在没有充分通风的情况下开始去饱和。21尽管 FRC 降低使“安全时间”减少,但对肥胖患者进行充分预充氧至关重要。务必记住一点,肥胖患者通常伴有肺部和全身性合并症,就算进行了预充氧,但俯卧位可能会进一步加重这些合并症。如果推注初始剂量的丙泊酚导致短暂性呼吸暂停/通气不足,在给予镇静剂之前进行适当预充氧可增加安全范围。在这些情况下,预充氧可以让麻醉和内镜团队在发生低氧血症之前有更多的时间介入纠正措施(例如,采用托颌法和内镜插入进行刺激)。
有几种方法可以为接受采用 MAC 的 ERCP 的患者提供补氧,包括低流量至高流量鼻插管、程序性氧气面罩和专用内镜面罩。根据可输送的吸入氧分数,这些气道设备均存在差异。其中许多设备还能够在手术过程中提供二氧化碳描记监测。在开始镇静之前,许多中心还会在患者嘴里放一块牙垫,以防咬到内镜。许多牙垫都有内置的气道功能,甚至有一个吸入口可以帮助清除气道分泌物。15除了确保气道输送装置舒适外,让患者自己调整姿势也有助于降低接受 GEA 的患者出现压迫或神经损伤(可能无法识别出)的风险。让患者自己调整姿势的另一个益处是,如果患者处于全身麻醉状态,转运过程中则需要较少的工作人员协助。
在使用 MAC 进行复杂内镜手术的过程中,可考虑使用许多额外的补充剂。在术前服用甘罗溴铵可减少分泌物,并提高局部麻醉的效果。22在快速周转内镜中心,这需要在术前区域进行给药,以便在手术前起效。应相应地将每种药物的副作用告知患者。在开始镇静之前,咽部局部麻醉会削弱内镜插入的刺激。局部麻醉的选择包括局部麻醉喷雾剂(通常含苯佐卡因或利多卡因作为活性成分)或粘稠的利多卡因溶液(可供患者漱口,然后吞咽)。如果使用含苯佐卡因的溶液,由于存在导致高铁血红蛋白血症的风险,因此务必谨慎使用。理想的维持麻醉剂可以方便地滴定、快速恢复,且仅引起极轻度的副作用,同时保持自然通气。丙泊酚很容易滴定,以维持自发通气,同时提供中度至深度镇静效果。23如果需要镇痛,建议在静脉麻醉剂中添加短效阿片类药物、右美托咪定或氯胺酮,以实现这一目标。22此外,如果需要紧急访问气道,只需取出内窥镜,内镜手术几乎可以立即中止。取出内镜可能会导致喉痉挛,因此在准备保护气道的同时,必须准备好紧急治疗这一潜在并发症。除插入胃镜外,ERCP 期间的刺激强度相对稳定,而不会像传统外科手术期间一样波动。由于刺激相对较小或无刺激,滴定麻醉剂以维持自发通气通常很容易实现。20单独使用时,丙泊酚镇静可在停药后 30 至 45 分钟内恢复至认知基线,但精神运动速度和反应时间会延迟恢复。24使用 MAC 可避免使用去极化和非去极化神经肌肉阻滞剂;其中许多药物都有其特有的副作用。如果避免吸入麻醉剂和阿片类药物,术后恶心和呕吐也会减少,从而提高患者满意度。
GEA 并非没有风险。插管可能会导致嘴唇、舌头、牙齿和眼部损伤,极少数情况下会导致支气管破裂或无法固定气道,需要手术干预。琥珀酰胆碱因起效快、持续时间短最常使用,而在内镜检查中,通常无需麻痹。琥珀酰胆碱的潜在副作用包括肌肉疼痛、肌红蛋白血症、肌红蛋白尿和恶性高热。20使用非去极化肌肉松弛剂会增加出现残余神经肌肉阻滞引发的术后肺部并发症的风险。24还必须考虑与这些麻痹药逆转相关的抗胆碱能作用,但在易获得舒更葡糖的机构中,这可能不是大问题。GEA 期间所需的麻醉深度增加了出现低血压的风险,继而可能会增加出现心肌损伤、肾损伤和死亡的风险。26由于 ERCP 采用俯卧或半俯卧位进行,所以在透视检查床上从仰卧位转到俯卧位时,需要多人参与才能安全实现患者的定位和固定。定位期间,始终存在气管插管移位或意外拔管的风险。最后,在紧急情况下和麻醉翻身期间,NORA 地点的医务人员通常很少能获得同事和其他团队成员的帮助,这可能会降低设施的效率。Perbtani 等人5评估了 GEA 对大型介入内镜中心各项效率指标的影响。根据麻醉准备时间、内镜医生准备时间、手术时间、出手术室的时间、连续手术之间的时间间隔、非手术时间、在内镜病房的总时间的时间戳以及每天每个病房的病例数,对在 6 个月内接受 1635 次介入性内镜手术的 1400 多名患者进行了分析。2,5与介入内镜病房中的非插管患者相比,插管患者的所有过程效率指标(连续手术之间的时间间隔除外)均显著延长。该研究的第二个目的表明,接受 ERCP 的患者插管频率高于接受其他手术的患者(41.3% 与 12.4%)。2,5
综上所述,在适当选择的接受 ERCP 的患者中,MAC 提供的益处明显优于 GEA。这些益处包括认知恢复更快、诱导 GEA 用药物的副作用更少、气道损伤的风险降低、术后肺部并发症减少、得益于更快诱导的住院时间缩短以及至出院时间缩短,从而提高病房、医务人员和患者的效率指标。通过进行适当的监测、补氧和镇静,并仔细滴定以维持自发通气,ERCP 期间的 MAC 是一种安全且通常更优的 GEA 替代方案。
反方:GEA 与 MAC 相比具有重大优势
Luke S. Janik, MD 和
Jeffery S. Vender, MD, MCCM
ERCP 是诊断和治疗胰胆管疾病的常用手术。美国每年会进行超过 500,000 例ERCP 手术,最常见的适应症为胆管结石以及胆管和胰腺导管系统狭窄。27ERCP 在治疗肝脏、胆道和胰腺疾病时是一种极有用的工具,但通常被认为是在 GI 病房中执行风险最高的手术,总体手术并发症率为 4%。28手术并发症包括胰腺炎 (2%-10%)、胆管炎/脓毒症 (0.5%-3%)、括约肌切开术后出血 (0.3%-2%)、十二指肠穿孔 (0.08%-0.6%) 和死亡 (0.06%)。28,29然而,麻醉专业人士更担心的可能是手术期间 SRAE 的高发生率,据报告,其发生率高达 21%。6,7这提出了一个问题,即,在 ERCP 期间应由谁负责对患者进行麻醉和监测,以及应对患者采用何种麻醉方式。在本次“利弊辩论”中,我们认为应由具备资质的麻醉专业人士为 ERCP 实施麻醉,且 GEA 与 MAC 相比具有显著优势。
ERCP 的麻醉方式有很大的可变性。提供麻醉照护的三种最常见方法是:(1) 内镜医生指导下的镇静 (EDS),(2) MAC 和 (3) GEA。在第一种方法(即 EDS)中,由 GI 团队的一名成员(通常是护士)在内镜医生的指导下给予静脉镇静药物,内镜医生通常会同时执行手术。由于手术失败率高、患者满意度低且内镜医生满意度低,使用苯二氮卓类和麻醉剂滴定法进行的传统“清醒镇静”已普遍不受欢迎。30因此,EDS 采用了由非麻醉专业人士进行的丙泊酚镇静,胃肠病学界称其安全有效。31–33在其他 2 种提供麻醉照护的方法中,由具备资质的麻醉专业人士为患者提供照护,患者接受使用丙泊酚镇静的 MAC 或是 GEA。选择何种提供麻醉照护的方法特异于机构,且取决于可用的资源和人员、手术复杂性、患者特征及合并症以及个人偏好。
在讨论采取何种麻醉方式之前,我们需要先确认实施麻醉的地点。人们已经普遍认识到在偏远的地点进行麻醉的风险。对 ASA 已终结索赔数据库进行的分析审查了针对偏远地区麻醉专业人士的医疗事故索赔,并证明偏远地点的不良事件导致严重并发症(包括死亡和永久性脑损伤)的发生率高于手术室不良事件。事实上,偏远地点的死亡比例几乎是手术室的两倍(54% 与 29%)。11呼吸系统事件在偏远地点比手术室更为常见(44% 与 20%),在 21% 的偏远地点索赔与 3% 的手术室索赔中,氧合/通气不足被确定为损伤机制。11还需进一步关注特定于 GI 病房的已终结索赔数据。与所有其他偏远地点相比,GI 病房麻醉医疗事故索赔的占比 (32%)、与过度镇静相关的占比 (58%) 以及 MAC 的使用率 (> 80%) 最高。11这些数据在麻醉专业人士的预期之内。地理位置不熟悉、资源匮乏、人机工程学较差、援助有限、安全文化多变,以及与其他麻醉设备和人员的物理距离是 GI 病房的常见障碍。此外,患者往往年纪较大,病情较重。11ERCP 还带来了其他独特的挑战,包括对俯卧位的常规使用、限制访问气道以及使用可能导致气道阻塞和喉痉挛的内镜。考虑到所有这些挑战,认为 ERCP 麻醉存在显著风险,应谨慎处理。
使用 MAC 进行 ERCP 的支持者指出,多项回顾性和前瞻性研究(主要来自胃肠病文献)得出结论,这项技术安全有效。4,6,8,33,34在一项比较 MAC 和 GEA 的前瞻性研究中,Berzin 等人6报告,SRAE 的总发生率为 21%。MAC 队列发生的特定不良事件包括低氧血症(12.5%;定义为血氧饱和度 < 85%)、计划外面罩通气 (0.6%)、计划外插管 (3%) 和手术中断 (5%)。6根据这些数据,作者得出结论:“轻度镇静相关事件常见 (21%),但仅导致 5% 的病例出现短暂的手术中断。”他们认为 3% 的计划外插管发生率可忽略不计,称“在认为有必要进行计划外插管的罕见情况下,可轻松访问气道。”在一项于 MAC 下进行 ERCP 的类似前瞻性研究中,Zhang 等人7发现,18% 的患者出现镇静相关并发症,9% 的患者出现低氧血症(定义为血氧饱和度 < 90% 至少 2 分钟),且 > 33% 的患者出现多次低氧血症发作。作者指出,其研究中低氧血症的发生率与其他类似研究相当,因此,得出结论“在由麻醉人士实施镇静的情况下进行 ERCP 是安全的。”在一项使用 MAC 进行 ERCP 的回顾性综述中,Yang 等人9报告,28% 的患者出现需要进行气道操作的低氧血症(定义为血氧饱和度 < 90%),1.6% 的患者因胃中有食物而需要转为 GEA。除这些发现外,作者还总结道:“丙泊酚可安全有效地用作 ERCP 患者的镇静剂。”
SRAE、低氧血症发作和需进行气道操作发生率如此高的研究如何得出镇静“安全”、“可行”或“适当”的结论?4,6–9仅仅因为重要事件并未导致重要结果,并不意味着该事件的重要性会降低!对数据的解读最终取决于审视数据的视角。只要患者没有出现任何长期后遗症,胃肠科医生可能不会对高达 3% 的计划外插管率6或高达 33% 7低氧血症率感到担忧。然而,负责紧急气道管理和心肺复苏的麻醉专业人士可能会将每一次低氧血症发作视为“未遂”事件。请记住,脉搏血氧是一项氧合指标,而不是通气指标,它无法可靠地用于检测通气不足和进行性高碳酸血症。35,36在使用 MAC 进行的 ERCP 期间,补氧情况下发生的低氧血症是通气不足的晚期标志,也是即将发生呼吸停止的先兆。
为便于讨论,让我们设想一种不同的情况。如果我们在不系安全带的情况下驾驶一年,且从未在任何事故中受伤,我们是否可以得出不系安全带驾驶安全、可行且适当的结论?在使用 MAC 进行 ERCP 期间,如果处于偏远位置、采用俯卧位且气道通路受限,正常化并接受低氧血症的高发生率会开创一个危险的先例。需要承认的一点是,很难确定镇静期间 SRAE 和低氧血症发作的“可接受”发生率。但我们认为,前述研究中报告的 SRAE 和低氧血症的发生率令人担忧,应视为患者安全问题,而不是作为无关紧要的事件不予理会。
现在,让我们把注意力转向支持使用 GEA 进行 ERCP 的证据。在一项比较使用 MAC 与 GEA 进行 ERCP 的安全性的随机对照试验中,结果明显有利于 GEA。10该研究纳入了确定为 SRAE 高风险的患者,包括 STOP-BANG(评分系统涉及:打鼾、疲劳、观察到的呼吸暂停、血压、体重指数、年龄、颈围、性别)评分 ≥ 3、腹水、BMI ≥ 35、患有慢性肺病、ASA 健康状态分级 > 3、Mallampati 4 级气道以及中度至重度饮酒的患者。MAC 组的 SRAE 发生率明显高于 GEA 组(51.5% 与 9.9%)。10在 MAC 组中,19% 的患者出现低氧血症(定义为血氧饱和度 < 90%),45% 的患者需要一次或多次气道操作,8% 的患者需要气囊面罩通气。10相反,GEA 组未发生低氧血症或气道操作事件。在 MAC 组中,10.1% 的患者不得不中断 ERCP 手术,并因呼吸不稳定 (8%) 和胃内容物残留 (2%) 而需要转为 GEA。10值得注意的是,两组需使用血管加压药的低血压的发生率相似,且两组在手术时间、技术成功率和患者恢复时间方面不存在差异。10
先不谈数据,让我们退一步,从麻醉专业人士的角度出发讨论危象管理的实际情况。俯卧位气道损伤、被隔离在偏远地点且帮助和资源有限的情况,是所有麻醉专业人士的噩梦。当每一秒都很重要时,取出内镜、将透视设备移开、把担架抬进房间,并使患者仰卧,可能会让人感觉十分漫长。一切就绪,当患者处于适当位置,可管理气道时,他们可能已经处于呼吸停止的边缘。是的,这是 ERCP 镇静期间相对罕见的事件,但却是可以预防的。如果可以在一开始通过选择性、可控的气管插管来保护气道,那为何要冒此风险?ERCP 期间与镇静相关低氧血症的发生率较高,且这种环境下存在与计划外插管相关的诸多挑战,因此 GEA 是合理的选择。
胃肠科医生认为,MAC 比 GEA 更快,所需周转时间更短,更多的患者能获得手术治疗。虽然有一些数据支持这种看法,5但其他数据表明,镇静期间节省的任何时间都可能会被气道损伤导致的频繁手术中断所抵消。10实际上,GI 病房效率是多个不同变量共同作用的结果(包括内镜医生的手术效率),认为效率仅与是否进行气管插管有关并未从长远的角度看待这一问题。还有一种看法认为,MAC 本质上比 GEA 更温和、更安全且侵入性更小。是的,使用 GEA 会带来与其自身相关的风险,包括潜在的牙齿损伤、残余神经肌肉阻滞、血流动力学不稳定和药物不良反应。然而,当将所有这些风险与使用 MAC 以俯卧位进行的 ERCP 期间发生气道损伤风险进行比较时,坦白而言,后者与前者并无可比性。作为麻醉专业人士,我们的工作是降低风险,ERCP 期间进行 MAC可能发生气道损伤 ,不值得为此冒险。
在进行进一步的大规模、多中心随机对照试验之前,关于 ERCP 期间采用 MAC 还是GEA的争议将持续存在,标准治疗也仍不明确。但所有麻醉专业人士都一致认为,无论采用何种麻醉技术,麻醉都应由具备资质的麻醉专业人士实施。在美国,ERCP 采用 EDS的比率从 2005 年的 > 50% 下降至 2014 年的 5%,但在欧洲和其他国家仍然普遍。3一项对 10 年内近 27,000 次 ERCP 进行的回顾性综述表明,EDS 导致不良事件的发生率较高 (OR = 1.86),需要计划外干预的可能性几乎是麻醉镇静的两倍。3此外,多项研究表明,EDS 导致的镇静失败并在后续导致手术失败的发生率高于使用麻醉的 MAC 或 GEA。30,34更糟的是,EDS 同时导致患者满意度差和内镜医生满意度差。33我们认为,在 ERCP 期间采用 EDS对患者安全造成了威胁,应予以弃用。我们坚持认为,丙泊酚镇静仅应由具备快速识别气道损伤能力和在紧急情况下管理气道技能的具备资质的麻醉专业人士实施。这些技能不属于胃肠科医生、护士和技术人员的专业范畴。
ERCP 期间 MAC 麻醉与低氧血症、气道操作和 SRAE 的高发生率相关。这些风险加上在偏远地点进行麻醉的固有危险,引起了人们对使用 MAC 以俯卧位进行 ERCP 的安全性的高度担忧。引用麻醉医师 Carl Hug Jr 博士的话,也许 MAC 应该代表“最应关注的麻醉注意事项”,而不是“监护下的麻醉照护”。37我们认为,所有接受 ERCP 手术的患者都应接受由具备资质的麻醉专业人士提供的照护,且 GEA 与 MAC 相比具有显著优势。
总结
这篇利弊辩论文章在近年来复杂内镜手术增加以及缺乏大规模随机对照试验来支持 ERCP 患者最佳麻醉技术的背景下应运而生。由于合并症的发生率较高且手术涉及共用气道,因此该辩论尤为重要。MAC 可提供的益处包括血液动力学紊乱更少、吸入剂副作用减少、认知恢复更快和整体手术时间更短,必须将这些益处与 MAC 期间已知的氧合和/或通气受影响所致重要事件的发生率相权衡。本讨论中的两种方法强调了让具备资质的麻醉专业人士为特定患者和临床情况确定最佳麻醉方法的重要性。
Luke S. Janik(医学博士)是芝加哥大学的临床副教授,也是北岸大学医疗系统(伊利诺伊州埃文斯通)麻醉学、重症监护及疼痛医学系的教员。
Jeffery S. Vender(医学博士、MCCM)是芝加哥大学(伊利诺伊州芝加哥)麻醉系的名誉临床教授。
Samantha Stamper(医学博士)是凯斯西储大学克利夫兰诊所勒纳医学院的副教授,也是克利夫兰诊所(俄亥俄州克利夫兰)麻醉研究所的教员。
Christopher A. Troianos(医学博士、FASE、FASA)是克利夫兰诊所(俄亥俄州克利夫兰)凯斯西储大学克利夫兰诊所勒纳医学院麻醉研究所的临床副教授。
公开信息:Luke S. Janik, MD、Samantha Stamper, MD 和 Christopher A. Troianos, MD, FASE, FASA 无利益冲突。Jeffery S. Vender(医学博士、MCCM)是 Fresenius Kabi、Medline Industries 和 Medtronic 的顾问。
参考文献
- Woodward ZG, Urman RD, Domino KB. Safety of non-operating room anesthesia: a closed claims update. Anesthesiol Clin. 2017;35:569–581. PMID: 29101947.
- Smith ZL, Das KK, Kushnir VM. Anesthesia-administered sedation for endoscopic retrograde cholangiopancreatography: monitored anesthesia care or general endotracheal anesthesia? Curr Opin Anaesthesiol. 2019;32:531–537. PMID: 30994476.
- Smith ZL, Nickel KB, Olsen MA, et al. Type of sedation and the need for unplanned interventions during ERCP: analysis of the clinical outcomes research initiative national endoscopic database (CORI-NED). Frontline Gastroenterol. 2020;11:104–110. PMID: 32133108.
- Barnett SR, Berzin T, Sanaka S, et al. Deep sedation without intubation for ERCP is appropriate in healthier, non-obese patients. Dig Dis Sci. 2013;58:3287–3292. PMID: 23877477.
- Perbtani YB, Summerlee RJ, Yang D, et al. Impact of endotracheal intubation on interventional endoscopy unit efficiency metrics at a tertiary academic medical center. Am J Gastroenterol. 2016;111:800–807. PMID: 27021194.
- Berzin TM, Sanaka S, Barnett SR, et al. A prospective assessment of sedation-related adverse events and patient and endoscopist satisfaction in ERCP with anesthesiologist-administered sedation. Gastrointest Endosc. 2011;73:710–717. PMID: 21316669.
- Zhang CC, Ganion N, Knebel P, et al. Sedation-related complications during anesthesiologist-administered sedation for endoscopic retrograde cholangiopancreatography: a prospective study. BMC Anesthesiol. 2020;20:131. PMID: 32466744.
- Coté GA, Hovis RM, Ansstas MA, et al. Incidence of sedation-related complications with propofol use during advanced endoscopic procedures. Clin Gastroenterol Hepatol. 2010;8:137–142. PMID: 19607937.
- Yang JF, Farooq P, Zwilling K, et al. Efficacy and safety of propofol-mediated sedation for outpatient endoscopic retrograde cholangiopancreatography (ERCP). Dig Dis Sci. 2016;61:1686–1691. PMID: 26825844.
- Smith ZL, Mullady DK, Lang GD, et al. A randomized controlled trial evaluating general endotracheal anesthesia versus monitored anesthesia care and the incidence of sedation-related adverse events during ERCP in high-risk patients. Gastrointest Endosc. 2019;89:855–862. PMID: 30217726.
- Metzner J, Posner KL, Domino KB. The risk and safety of anesthesia at remote locations: the US closed claims analysis. Curr Opin Anaesthesiol. 2009;22:502–508. PMID: 19506473.
- Wu WZ, Zheng MH, Wang JC, Chen S. The role of endoscopic retrograde cholangiopancreatography in perioperative period of laparoscopic cholecystectomy. Hepatobiliary Pancreat Dis Int. 2002;1:114–117. PMID: 14607638.
- Kapoor H. Anaesthesia for endoscopic retrograde cholangiopancreatography. Acta Anaesthesiol Scand. 2011;55:918–926.
- Huang RJ, Barakat MT, Girotra M, et al. Unplanned hospital encounters after endoscopic retrograde cholangiopancreatography in 3 large North American States. Gastroenterology. 2019;156:119.e3–129.e3. PMID: 30243620.
- Goudra B, Singh PM. Airway management during upper GI endoscopic procedures: state of the art review. Dig Dis Sci. 2017;62:45–53. PMID: 27838810.
- Shah T, Ianchulev S. Gastroscope-facilitated endotracheal intubation during ERCP: when is the best time to GETA (Big) MAC? Dig Dis Sci. 2021;66:938–940. PMID: 32643057.
- Barakat MT, Angelotti TP, Banerjee S. Use of an ultra-slim gastroscope to accomplish endoscopist-facilitated rescue intubation during ERCP: a novel approach to enhance patient and staff safety. Dig Dis Sci. 2021;66:1285–1290. PMID: 32504349.
- Standards for Basic Anesthetic Monitoring. American Society of Anesthesiologist Website. October 21, 1986, last amended on October 20, 2010, and last affirmed on October 28, 2016. https://www.asahq.org/~/media/Sites/ASAHQ/Files/Public/Resources/standards-guidelines/standards-for-basic-anesthetic-monitoring.pdf. Accessed March 20, 2021.
- Deitch K, Miner J, Chudnofsky CR, et al. Does end tidal CO2 monitoring during emergency department procedural sedation and analgesia with propofol decrease the incidence of hypoxic events? A randomized, controlled trial. Ann Emerg Med. 2010;55:258–264. PMID: 19783324.
- Goudra B, Singh PM. ERCP: the unresolved question of endotracheal intubation. Dig Dis Sci. 2014;59:513–519. PMID: 24221339.
- Gambee AM, Hertzka RE, Fisher DM. Preoxygenation techniques: comparison of three minutes and four breaths. Anesth Analg. 1987;66:468–470. PMID: 3578856.
- Tetzlaff JE, Vargo JJ, Maurer W. Nonoperating room anesthesia for the gastrointestinal endoscopy suite. Anesthesiol Clin. 2014;32:387–394. PMID: 24882126.
- Goulson DT, Fragneto RY. Anesthesia for gastrointestinal endoscopic procedures. Anesthesiol Clin. 2009;27:71–85. PMID: 19361769.
- Allampati S, Wen S, Liu F, Kupec JT. Recovery of cognitive function after sedation with propofol for outpatient gastrointestinal endoscopy. Saudi J Gastroenterol. 2019;25:188–193. PMID: 30618439.
- Berg H, Roed J, Viby-Mogensen J, et al. Residual neuromuscular block is a risk factor for postoperative pulmonary complications. A prospective, randomised, and blinded study of postoperative pulmonary complications after atracurium, vecuronium and pancuronium. Acta Anaesthesiol Scand. 1997;41:1095–1103. PMID: 9366929.
- Althoff FC, Agnihotri A, Grabitz SD, et al. Outcomes after endoscopic retrograde cholangiopancreatography with general anaesthesia versus sedation. Br J Anaesth. 2021;126:191–200. PMID: 33046219.
- Coelho-Prabhu N, Shah ND, Van Houten H, et al. Endoscopic retrograde cholangiopancreatography: utilisation and outcomes in a 10-year population-based cohort. BMJ Open. 2013;3:e002689. PMID: 23793659.
- Cotton PB, Garrow DA, Gallagher J, Romagnuolo J. Risk factors for complications after ERCP: a multivariate analysis of 11,497 procedures over 12 years. Gastrointest Endosc. 2009;70:80–88. PMID: 19286178.
- Chandrasekhara V, Khashab MA, Muthusamy R, et al. Committee ASoP. Adverse events associated with ERCP. Gastrointest Endosc. 2017;85:32–47. PMID: 27546389.
- Raymondos K, Panning B, Bachem I, et al. Evaluation of endoscopic retrograde cholangiopancreatography under conscious sedation and general anesthesia. Endoscopy. 2002;34:721–726. PMID: 12195330.
- Wehrmann T, Kokabpick S, Lembcke B, et al. Efficacy and safety of intravenous propofol sedation during routine ERCP: a prospective, controlled study. Gastrointest Endosc. 1999;49:677–683. PMID: 10343208.
- Lapidus A, Gralnek IM, Suissa A, et al. Safety and efficacy of endoscopist-directed balanced propofol sedation during endoscopic retrograde cholangiopancreatography. Ann Gastroenterol. 2019;32:303–311. PMID: 31040629.
- Goudra BG, Singh PM, Gouda G, et al. Safety of nonanesthesia provider-administered propofol (NAAP) sedation in advanced gastrointestinal endoscopic procedures: comparative meta-analysis of pooled results. Dig Dis Sci. 2015;60:2612–2627. PMID: 25732719.
- Buxbaum J, Roth N, Motamedi N, et al. Anesthetist-directed sedation favors success of advanced endoscopic procedures. Am J Gastroenterol. 2017;112:290–296. PMID: 27402501.
- Fu ES, Downs JB, Schweiger JW, et al. Supplemental oxygen impairs detection of hypoventilation by pulse oximetry. Chest. 2004;126:1552–1558. PMID: 15539726.
- Hutton P, Clutton-Brock T. The benefits and pitfalls of pulse oximetry. BMJ. 1993;307:457–458. PMID: 8400922.
- Hug CC Jr. MAC should stand for maximum anesthesia caution, not minimal anesthesiology care. Anesthesiology. 2006;104:221–223. PMID: 16436837.


 Issue PDF
Issue PDF