| Reproduit à partir de Anesthesia & Analgesia, Juin 2022 • Volume 134 • Numéro 6, pages 1192–1200, avec l’autorisation de l’International Anesthesia Research Society. Les titres et la nomenclature des professionnels de santé ont été normalisés et modifiés au sein du texte conformément à la politique de l’APSF. |

Dans cet article qui discute des avantages et des inconvénients, il a été demandé aux auteurs de réfuter ou de confirmer une position concernant l’anesthésie pour une cholangio-pancréatographie rétrograde endoscopique (CPRE). Les CPRE sont uniques car non seulement elles nécessitent un partage des voies aériennes mais elles sont généralement réalisées en décubitus ventral (ou semi-ventral) sur une table opératoire spéciale. En outre, les temps d’intervention peuvent varier d’une heure à plusieurs heures.
La pratique de la médecine varie souvent d’un médecin à un autre lorsqu’il n’existe pas de norme de soins définie. La cause de cette variabilité est multifactorielle. Les facteurs liés aux patients et leurs comorbidités, les compétences et l’expérience du médecin, les besoins en matière de procédure et l’absence de données sont quelques-unes des considérations. Par conséquent, il n’est pas surprenant que le mode d’anesthésie principal pour les patients sous endoscopie digestive soit nettement divisé entre ceux et celles qui militent en faveur de soins d’anesthésie surveillés (monitored anesthesia care, MAC), contre ceux et celles qui ont recours à l’anesthésie endotrachéale générale (AEG).
L’importance de ce débat est encore plus pertinente en raison de la constatation toujours plus grande du taux potentiellement élevé de morbidité et de mortalité associé à ces anesthésies et à ces procédures. Un rapport sur le projet Closed Claims de l’American Society of Anesthesiologists (ASA) suggère que des évènements défavorables dans le cadre d’une anesthésie hors bloc opératoire (AHBO) avaient pour conséquence un plus grand nombre de complications graves (notamment la mort et des lésions cérébrales permanentes), que des évènements semblables qui surviennent au bloc opératoire.1 En fait, le service de chirurgie digestive représentait le pourcentage le plus élevé d’évènements défavorables parmi tous les espaces AHBO.
Les anesthésistes seront sans aucun doute confrontés à une demande croissante de services dans le contexte des AHBO et en particulier, dans le service de chirurgie digestive. Ainsi, ce débat sur les avantages et les inconvénients permet d’acquérir des informations sur la décision d’utiliser les MAC plutôt que l’AEG pour des procédures CPRE dans le programme de soins, comme le résume le Tableau 1. En définitive, nos patients tireront partie d’autres études cliniques systémiques de ces diverses approches et des conséquences qui leur sont associées.
Tableau 1 : récapitulatif du débat sur les avantages et les inconvénients

Abréviations : CPRE, cholangio-pancréatographie rétrograde endoscopique ; AEG, anesthésie endotrachéale générale ; MAC ou « monitored anesthesia care », soins d’anesthésie surveillés ; AHBO, anesthésie hors bloc opératoire ; EIAS, évènements indésirables associés à la sédation.
AVANTAGES : POUR UNE CPRE IL EST PRÉFÉRABLE DE RECOURIR À DES MAC POUR L’ANESTHÉSIE
Samantha Stamper, MD, et
Christopher A. Troianos, MD, FASE, FASA
La CPRE utilise la fluoroscopie et l’endoscopie à des fins diagnostiques et thérapeutiques. Son utilisation permet l’évaluation du foie, de la vésicule biliaire, des voies biliaires et du pancréas. Au cours des dernières années, la CPRE a été utilisée principalement à des fins thérapeutiques, grâce à l’arrivée des techniques thérapeutiques par endoscopie avancée et de la technologie de l’imagerie (par ex. imagerie par résonance magnétique avec la cholangio-pancréatographie par résonance magnétique, échographie endoscopique).13 Il s’agit des interventions suivantes : sphinctérotomie, extraction ou fragmentation des calculs biliaires, endoprothèse des voies biliaires et pancréatiques et drainage de pseudo-kyste pancréatique.12,13 Auparavant, ces procédures nécessitaient en majorité une chirurgie ouverte ou laparoscopique pour procéder au traitement, mais la CPRE est désormais une alternative préférable, viable et rentable.
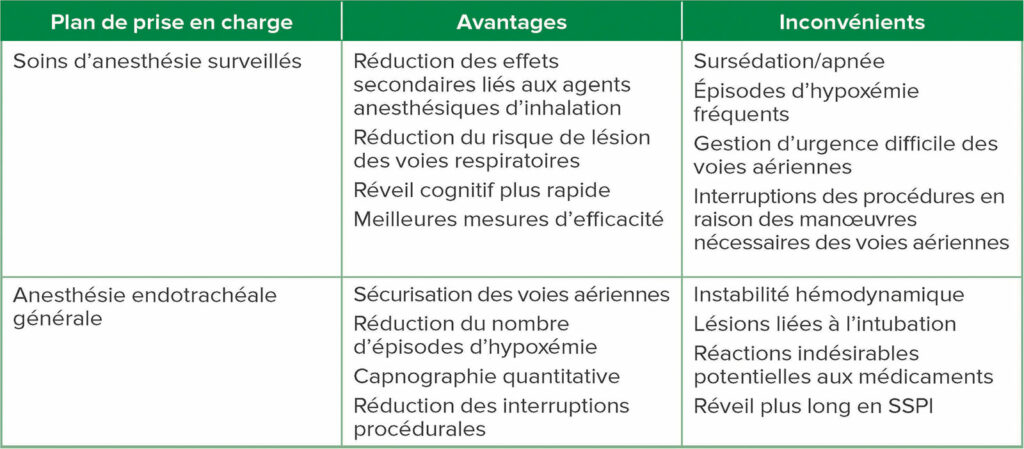
Les interventions par endoscopie avancée présentent également l’avantage d’être peu invasives, moins douloureuses et elles nécessitent rarement une paralysie musculaire.6 Plus de 500 000 CPRE sont réalisées chaque année aux États-Unis, une majorité faisant appels aux services d’anesthésie.14 Les CPRE sont plus souvent réalisées sur des patients plus âgés, qui sont très nombreux à présenter un plus grand nombre de comorbidités.13 Il n’existe actuellement aucune preuve des effets, sur la base d’études prospectives randomisées permettant de déterminer si la méthode MAC ou AEG est supérieure pour les patients subissant des interventions par endoscopie avancée, toutefois la logique clinique indique de manière convaincante qu’il faut donner la priorité à une approche « MAD en premier » dans la majorité des patients subissant une endoscopie. Bien que les plans d’anesthésie soient toujours personnalisés en fonction de chaque individu, l’équipe expérimentée qui réalise l’endoscopie reconnaîtra que l’approche MAC peut être supérieure, en particulier pour les patients en meilleure santé dont l’indice de masse corporelle (IMC) est normal ou quasi-normal. Une communication claire entre le médecin endoscopiste et l’anesthésiste est essentielle. Par exemple, l’indication spécifique de la CPRE (thérapeutique versus diagnostique) et la durée du cas sont des éléments fondamentaux pour créer un modèle mental commun et ils contribueront probablement à la détermination de la méthode d’anesthésie optimale. Par exemple, si le plan d’intervention est le simple retrait d’une prothèse biliaire, les MAC peuvent être plus appropriés. En revanche, le drainage d’un pseudo-kyste pancréatique septé complexe, avec des cloisons nécrotiques, nécessitera presque certainement une AEG. Par conséquent, la durée et le caractère invasif de l’intervention sont des éléments essentiels dans le choix de la méthode d’anesthésie, et les avantages et inconvénients de chaque technique doivent être pris en compte (Tableau 2).
Tableau 2 : Avantages et inconvénients de chaque plan de prise en charge anesthésique
Par ailleurs, les facteurs spécifiques à un établissement contribuent au choix de la méthode d’anesthésie optimale. Ces considérations sont notamment la proximité par rapport aux principaux blocs opératoires, la disponibilité des équipements de sauvetage, une salle de surveillance post-interventionnelle adéquate et la disponibilité de ressources humaines supplémentaires, le cas échéant. D’autres considérations comprennent l’empreinte physique de l’espace de travail dédié aux anesthésies, qui est souvent limité en raison des équipements spécialisés (par ex. fournitures endoscopiques, équipement d’imagerie radiographique, écrans auxiliaires/colonnes de visualisation). La communication avec l’établissement et l’équipe d’endoscopie avant la procédure est importante afin de permettre de réduire les complications malencontreuses. En outre, un médecin prudent devra toujours s’assurer qu’un plan clair et un accès sont en place au cas où des insufflations de sauvetage seraient nécessaires. Les facteurs indiqués ci-dessus peuvent contribuer à la décision de privilégier les MAC.
Les endoscopies complexes (en particulier les procédure CPRE) sont habituellement réalisées en décubitus ventral ou semi-ventral, pouvant limiter l’accès aux voies aériennes et/ou avoir une incidence sur le retour veineux et la stabilité cardiovasculaire.2 Cependant, cette position permet généralement de maintenir la circulation sanguine pulmonaire et la distribution de la ventilation (rapport V/Q) dans les poumons, en particulier chez un patient qui n’est pas intubé (par ex. MAC). Par ailleurs, l’endoscope peut lui aussi atténuer la compression des voies aériennes en agissant comme une prothèse.15 Le décubitus ventral produit de nombreux autres effets positifs sur la fonction respiratoire, en particulier l’augmentation de la capacité résiduelle fonctionnelle (CRF) et la Po2 artérielle.2
La préoccupation principale concernant les MAC en décubitus ventral est le potentiel de la nécessité urgente ou émergente d’accéder aux voies aériennes, et éventuellement d’une intubation endotrachéale en urgence. Une stratégie provocatrice potentielle serait qu’un endoscopiste formé à ce geste réalise une intubation endotrachéale sous gastroscopie. Pour cela, il faut un endoscope plus petit capable de pénétrer dans la trachée et un endoscopiste qui possède ces compétences, avec le soutien d’un anesthésiste. Le gastroscope « ultrafin » fonctionne comme un bronchoscope et son diamètre extérieur de 5,4 mm peut accommoder un tube endotrachéal adulte, placé par-dessus le dispositif.16 Dans une étude de plus de 3400 patients subissant une CPRE (46 % avec une AEG contre 54 % avec les MAC), le taux global de conversion de MAC en AEG était faible, à 2,3 %. Les auteurs ont décrit l’utilisation réussie d’une intubation trachéale sous gastroscopie chez 16 patients en raison de la présence d’aliments dans l’estomac et/ou d’hypoxie.17 Un autre avantage du gastroscope est qu’il est possible d’extraire immédiatement les substances aspirées de la trachée et des bronches, réduisant ainsi le risque de complications respiratoires.17 L’extubation a réussi chez tous les patients qui ont subi l’intubation sous gastroscopie et l’examen radiographique n’a révélé aucune pneumopathie d’inhalation chez aucun des patients.17
Cette approche innovante pour récupérer les voies aériennes compromises ou obstruées permet de parer la préoccupation la plus couramment exprimée par les cliniciens qui envisagent l’utilisation des MAC en décubitus ventral ou demi-ventral. Dans l’étude susmentionnée, l’endoscopiste s’était formé lui-même à cette technique, précisant qu’il n’existe actuellement aucune formation officielle ni aucun processus d’accréditation pour l’intubation sous gastroscopie.17 Cette technique devra être envisagée uniquement sous la supervision directe d’un anesthésiste ou réalisée par un anesthésiste. Il convient de faire une mise en garde concernant l’utilisation d’un gastroscope ultrafin pour une intubation. L’endoscopiste doit remplacer le gastroscope de CPRE traditionnel avec vision latérale par un gastroscope ultrafin muni d’un tube endotrachéal. Cet échange d’instruments procure l’avantage de pouvoir aspirer l’estomac, l’œsophage et l’hypopharynx au moment du retrait (juste avant l’intubation) mais il doit être effectué de manière rapide afin de réduire au minimum le retard potentiel de l’intubation.
Tableau 3 : Facteurs de risque d’évènements indésirables liés à la sédation pendant les MAC.
Avant de pratiquer des MAC pour une CPRE, il faut étudier les facteurs de risque liés aux évènements indésirables associés à la sédation (EIAS), précisés au Tableau 3. De nombreux professionnels considèrent que les troubles qui augmentent la probabilité d’inhalation sont des facteurs de risque d’EIAS. De nombreuses études ont démontré que les MAC sont une option sûre pour une CPRE, en particulier chez des patients qui présentent des facteurs de risque minimes d’EIAS. Une grande étude en population, réalisée sur une décennie dans plusieurs centres d’endoscopie aux États-Unis n’a permis de constater aucune différence significative en ce qui concerne les évènements indésirables graves entre les CPRE réalisées avec des MAC (n = 8395) par rapport à une AEG (n = 10.715, odds ratio [OR] = 1,04, intervalle de confiance [CI] de 95 %, 0,76–1,43).2,3 Toutefois, la majorité des patients étaient relativement en bonne santé (état physique ASA I et II) et les auteurs n’ont pas tenté de contrôler le biais de sélection. Aucune différence significative n’a été constatée relativement aux évènements indésirables entre les patients à l’état physique ASA I et ceux à l’état physique ASA II (OR = 0,84 [0,49–1,46]), ni entre les patients à l’état physique ASA III et ceux à l’état physique ASA II (OR = 1,30 [1,00–1,69]). En fait, les données suggèrent que seuls les patients à l’état physique ASA IV avaient enregistré un risque légèrement plus élevé d’évènements indésirables avec des MAC (OR = 3,19 [2,00–5,09]).2,3 Dans une autre étude observationnelle prospective, le choix entre les MAC ou l’AEG a été laissé à l’anesthésiste. Ainsi, 393 patients ont reçu des MAC et 45 patients, une AEG.4 Le taux de conversion de MAC en AEG était de 3,7 %. Il convient de noter que 25 % des patients convertis en AEG étaient classés en état physique ASA IV.2,4 Compte tenu du biais de sélection inhérent à cette étude, il n’est pas surprenant que l’IMC moyen ait été supérieur dans le groupe AEG par rapport au groupe MAC, à l’image du pourcentage de patients classés en état physique ASA IV.4,6 Néanmoins, les taux d’évènements indésirables entre les MAC et l’AEG n’étaient pas statistiquement différents et les auteurs de l’étude ont conclu que les MAC sont faisables et bien tolérés pour les patients en meilleure santé, qui ne sont pas obèses, qui sont évalués avant la procédure par un anesthésiste.2,4,6
La surveillance clinique pendant les MAC pour une CPRE doit suivre des normes standard de monitorage ordinaire d’une anesthésie, à savoir l’évaluation continue de l’oxygénation, de la ventilation, de la circulation et de la température du patient18. Il s’agira d’utiliser la mesure non invasive de la pression artérielle, l’oxymétrie, l’électrocardiographie et la capnographie. Un grand nombre de dispositifs pour les voies aériennes (par ex. canules nasales ou simple masque) utilisés dans les MAC permettent de surveiller le CO2 et de détecter l’apnée bien avant la survenue d’une hypoxie.4,19 Il existe d’autres modalités de monitorage permettant de détecter l’apnée avant la baisse de l’oxymétrie, notamment la pneumographie par impédance et un capteur acoustique de respiration, moins utilisé dans le cadre du bloc opératoire.
Toutes les anesthésies MAC débutent par une préoxygénation adéquate. Cet étape est fondamentale pour prévenir l’hypoxémie, un précurseur évident d’autres évènements indésirables plus graves (par ex. arythmies cardiaques, hypotension et arrêt cardiaque).20 Dans l’idéal, une préoxygénation de 3 minutes ou 4 respirations de capacité vitale peuvent procurer un « délai de sécurité » d’au moins 4 minutes avant que le patient commence à désaturer sans ventilation adaptée.21 Une préoxygénation chez les patients obèses est absolument primordiale en dépit de la réduction du « délai de sécurité » en raison de la baisse de la CRF. Il est important de se souvenir que les patients obèses présentent souvent des comorbidités pulmonaires et systémiques concomitantes, qui peuvent être aggravées en décubitus ventral, malgré la préoxygénation. Une préoxygénation appropriée avant l’administration de la sédation augmente la marge de sécurité en cas d’apnée transitoire/hypoventilation avec le bolus initial de propofol. Dans ces cas, la préoxygénation donne à l’équipe d’anesthésie et d’endoscopie un délai supplémentaire pour intervenir avec des mesures correctives (par ex. poussée de la mâchoire et insertion d’un endoscope pour stimulation) avant l’apparition de l’hypoxémie.
La supplémentation en oxygène peut être apportée aux patients qui subissent une CPRE avec MAC par plusieurs méthodes, notamment une canule nasale à haut débit, un masque à oxygène chirurgical et un masque spécial endoscopie. Ces dispositifs pour les voies aériennes varient en fonction du volume de la fraction inspirée en oxygène qui peut être administrée. Très souvent, ces dispositifs peuvent également permettre la surveillance par capnographie pendant la procédure. Avant de débuter la sédation, de nombreux centres demandent au patient de placer un cale-dents dans sa bouche, afin d’éviter qu’il morde l’endoscope. De nombreux cale-dents sont dotés d’une voie aérienne intégrée, voire d’un port d’aspiration, pouvant permettre de dégager les sécrétions des voies aériennes.15 Outre le fait que le dispositif d’administration des voies aériennes soit ainsi confortable, demander au patient de le positionner lui-même peut contribuer à réduire le risque de compression ou de lésions nerveuses, qui passeraient inaperçues chez un patient subissant une AEG. Le positionnement par le patient présente également l’avantage qu’il faut moins de personnel pour transférer le patient que si le patient était sous anesthésie générale.
Il existe de nombreux autres facteurs à prendre en compte dans le cadre de MAC pour des procédures endoscopiques avancées. La prémédication avec du glycopyrrolate réduit les sécrétions et permet d’améliorer l’efficacité d’une anesthésie topique.22 Dans les centres d’endoscopie, où les rotations sont rapides, il faudrait qu’elle soit administrée dans la salle de préparation préopératoire afin de prendre effet avant la procédure. Les patients devront être informés des effets secondaires de chaque médicament. Avant de débuter la sédation, une anesthésie pharyngée topique atténue la stimulation provoquée par l’insertion de l’endoscope. Les options d’anesthésie topique sont notamment les sprays anesthésiques locaux, dont l’ingrédient actif est généralement de la benzocaïne ou de la lidocaïne, ou contenant de la lidocaïne visqueuse, que le patient peut utiliser en bain de bouche, puis avaler. En cas d’utilisation de solutions contenant de la benzocaïne, il est important de prendre des précautions en raison du risque de méthémoglobinémie. Une anesthésie de maintien idéale facilite le titrage, un réveil rapide et des effets secondaires minimes tout en maintenant une ventilation spontanée. Le propofol est facile à titrer pour maintenir une ventilation spontanée, tout en procurant une sédation modérée à profonde.23 S’il faut administrer un analgésique, il est conseillé d’ajouter un opiacé à action de courte durée, de la dexmédétomidine ou de la kétamine à l’anesthésique intraveineux.22 En outre, il est possible d’interrompre quasiment immédiatement les procédures endoscopiques en retirant simplement l’endoscope, si un accès urgent aux voies aériennes est nécessaire. Le retrait de l’endoscope peut causer un laryngospasme. Il faut donc se tenir prêt à traiter en urgence cette complication potentielle pendant la préparation de la gestion des voies aériennes. Hormis l’insertion du gastroscope, l’intensité de la stimulation reste relativement constante pendant un CPRE, contrairement aux fluctuations qui surviennent pendant une opération chirurgicale traditionnelle. En raison de la stimulation minime, voire absente, le titrage de l’anesthésique pour maintenir la ventilation spontanée est généralement facile à obtenir.20 Lorsqu’elle est utilisée seule, la sédation au propofol permet un retour à la fonction cognitive de base en 30 à 45 minutes après l’interruption de la sédation, malgré un retour différé de la vitesse psychomotrice et du temps de réaction.24 L’utilisation des MAC permet d’éviter l’utilisation de curares dépolarisants et non dépolarisants, qui sont nombreux à avoir des effets secondaires uniques. On constate également moins de nausées et de vomissements postopératoires en évitant les anesthésies par inhalation et les opiacés, entraînant une plus grande satisfaction des patients.
L’AEG n’est pas sans risque. L’intubation comporte un risque de lésions des lèvres, de la langue, des dents et des yeux et, bien que rare, de rupture bronchique ou l’incapacité de dégager les voies aériennes et la nécessité d’une intervention chirurgicale. On utilise le plus souvent la succinylcholine en raison de son action rapide et brève et dans le cas d’une endoscopie, la paralysie n’est généralement pas nécessaire. Les effets indésirables potentiels de la succinylcholine sont notamment des douleurs musculaires, la myoglobinémie, la myoglobinurie et l’hyperthermie maligne.20 L’utilisation de curares non dépolarisants est associée à un risque accru de complications pulmonaires postopératoires engendrées par un bloc neuromusculaire résiduel.24 Les effets anticholinergiques associés à l’inversion de ces agents paralysants doivent également être pris en compte, bien qu’ils constituent un problème moindre dans les établissements où le sugammadex est disponible. La profondeur de l’anesthésie requise pendant une AEG augmente le risque d’hypotension, qui peut ensuite entraîner un risque de lésion myocardique ou rénale, voire la mort.26 Étant donné que la CPRE est réalisée en décubitus ventral ou semi-ventral, il faut plusieurs personnes pour positionner et sécuriser le patient pendant qu’il est retourné de la position de décubitus dorsal en décubitus ventral sur la table de fluoroscopie. Il existe toujours un risque de déplacement du tube endotrachéal ou d’extubation accidentelle pendant le positionnement. Enfin, les espaces AHBO bénéficient souvent de moins de soutien de la part de collègues et autres membres de l’équipe pour apporter une aide en cas d’urgence et de positionnement pendant l’anesthésie, pouvant alors amoindrir l’efficacité de l’établissement. Perbtani et al5 ont évalué l’impact d’une AEG sur diverses mesures de l’efficacité dans un grand centre d’endoscopie interventionnelle. Plus de 1 400 patients subissant 1 635 procédures endoscopiques interventionnelles sur une période de 6 mois ont été analysés en fonction de l’horodatage de l’heure de fin de préparation de l’anesthésie et de l’endoscopiste, de la durée de la procédure, de l’heure de sortie du bloc, de l’intervalle de temps entre les procédures successives, du temps non procédural écoulé, du temps total passé dans l’unité d’endoscopie et du nombre de cas par bloc par jour.2,5 Toutes les mesures d’efficacité des processus, hormis l’intervalle de temps entre les procédures successives, étaient considérablement plus longues pour les patients intubés que pour ceux qui ne l’étaient pas dans l’unité d’endoscopie interventionnelle. Le deuxième objectif de l’étude a permis de constater que les patients subissant une CPRE étaient intubés plus souvent que ceux qui subissaient d’autres procédures (41,3 % contre 12,4 %).2,5
En conclusion, les MAC procurent d’importants avantages par rapport à une AEG chez des patients soigneusement sélectionnés qui subissent une CPRE. Ces avantages incluent un réveil cognitif plus rapide, moins d’effets secondaires des médicaments utilisés pour induire l’AEG, un risque réduit de lésions des voies aériennes, la réduction des complications pulmonaires postopératoires et du séjour hospitalier, grâce à l’induction rapide et une sortie plus rapide, permettant ainsi une amélioration des mesures d’efficacité de l’unité, des prestataires et des patients. Avec une surveillance appropriée, une supplémentation en oxygène et une sédation correctement titrée pour maintenir une ventilation spontanée, les MAC pendant une CPRE sont une alternative sûre et souvent supérieure à l’AEG.
INCONVÉNIENTS : L’AEG PRÉSENTE DE NOMBREUX AVANTAGES PAR RAPPORT AUX MAC
Luke S. Janik, MD, et
Jeffery S. Vender, MD, MCCM
La CPRE est une procédure souvent réalisée pour diagnostiquer et gérer une maladie pancréato-biliaire. Chaque année, plus de 500 000 procédures de CPRE sont réalisées aux États-Unis, les indications les plus courantes étant des calculs biliaires et des sténoses des canaux biliaires et pancréatiques.27 La CPRE est un outil précieux dans la gestion des maladies hépatiques, biliaires et pancréatiques, mais elle est généralement considérée comme la procédure la plus risquée réalisée au bloc de chirurgie digestive, avec un taux de complication procédurale de 4 %.28 Les complications procédurales sont notamment la pancréatite (2 %–10 %), la cholangite/septicémie (0,5 %–3 %), l’hémorragie post-sphinctérotomie (0,3 %–2 %), la perforation du duodénum (0,08 %–0,6 %) et la mort (0,06 %).28,29 Toutefois, le problème le plus inquiétant pour les anesthésistes est le taux élevé d’EIAS pendant la procédure, avec une incidence signalée avançant un chiffre de 21 %.6,7 Ces éléments soulèvent la question de savoir qui devrait administrer l’anesthésie et surveiller le patient pendant une CPRE et quel type d’anesthésie devrait être administré. Dans ce débat sur les avantages et les inconvénients, nous estimons qu’un anesthésiste doit administrer l’anesthésie pour une CPRE et que l’AEG présente des avantages conséquents par rapport aux MAC.
Les modèles d’administration de l’anesthésie pour une CPRE varient énormément. Les trois modèles les plus courants d’administration de l’anesthésie sont (1) la sédation dirigée par un endoscopiste (SDE), (2) les MAC et (3) l’AEG. Dans le premier modèle, la SDE, la sédation intraveineuse est administrée par un membre de l’équipe de chirurgie digestive, généralement un(e) infirmier(ière), sous la surveillance de l’endoscopiste, qui souvent, réalise simultanément la procédure. L’utilisation de la « sédation consciente » traditionnelle avec titrage des benzodiazépines et des narcotiques a globalement cessé d’être prisée en raison des taux élevés d’échec des procédures, de l’insatisfaction des patients et des endoscopistes.30 Par conséquent, la SDE a adopté l’utilisation de la sédation par propofol réalisée par des intervenants qui ne sont pas des anesthésistes, ce que la communauté de la gastro-entérologie présente comme une option sûre et efficace.31–33 Dans les deux autres modèles d’administration de l’anesthésie, le patient est pris en charge par un anesthésiste, pour recevoir des MAC avec une sédation à base de propofol ou une AEG. Le choix du modèle d’administration de l’anesthésie est spécifique à l’établissement concerné et dépend des ressources matérielles et humaines disponibles, de la complexité de la procédure, des caractéristiques et comorbidités du patient et des préférences individuelles.
Avant de discuter de la manière de réaliser l’anesthésie, nous devons prendre en compte le lieu où elle est effectuée. Le risque lié à l’anesthésie en dehors du bloc opératoire est largement reconnu. Une analyse de la base de données du projet Closed Claims de l’ASA a étudié les plaintes pour faute professionnelle à l’encontre des anesthésistes en dehors du bloc opératoire. Elle a démontré que les évènements indésirables qui surviennent en dehors du bloc opératoire avaient pour conséquence des taux plus élevés de complications graves, notamment la mort et des lésions cérébrales permanentes, que des évènements indésirables au bloc opératoire. En fait, le pourcentage de décès était quasiment doublé pour les procédures réalisées en dehors du bloc opératoire par rapport au bloc opératoire (54 % contre 29 %).11 Les complications respiratoires étaient plus fréquentes en dehors du bloc opératoire qu’au bloc opératoire (44 % contre 20 %), une oxygénation/ventilation insuffisante étant identifiée comme le mécanisme causant les lésions dans 21 % des plaintes concernant des patients anesthésiés en dehors du bloc opératoire par rapport à 3 % des plaintes liées au bloc opératoire.11 Les données du projet Closed Claims spécifiques au service de chirurgie gastriques nécessitent une étude plus approfondie. Par rapport à tous les autres lieux hors bloc opératoire, le bloc opératoire de chirurgie digestive représentait le pourcentage le plus élevé de plaintes pour faute professionnelle en matière d’anesthésie (32 %), la part la plus élevée de plaintes associées à une sédation trop forte (58 %) et le taux le plus élevé d’utilisation de MAC (>80 %).11 Ces données ne sont pas surprenantes pour les anesthésistes. Les lieux inhabituels, la pénurie de ressources, une mauvaise ergonomie, une assistance limitée, des cultures de sécurité différentes et la distance physique d’équipements et de personnel supplémentaires pour pratiquer une anesthésie sont des obstacles quotidiens dans le service de chirurgie digestive. D’autre part, les patients sont souvent plus âgés et plus gravement malades.11 La CPRE présente d’autres problèmes uniques, notamment l’utilisation habituelle du décubitus ventral, un accès limité aux voies aériennes et l’utilisation d’un endoscope, susceptible d’obstruer les voies aériennes et de causer un laryngospasme. En tenant compte de tous ces problèmes, l’anesthésie pour la CPRE présente un risque important et elle doit être envisagée avec précaution.
Les partisans des MAC pour une CPRE s’appuient sur plusieurs études rétrospectives et prospectives, issues principalement d’ouvrages de gastro-entérologie, qui concluent que la technique est sûre et efficace.4,6,8,33,34 Dans une étude prospective comparant les MAC et l’AEG, Berzin et al6 ont signalé un taux global d’EIAS de 21 %. Des effets défavorables spécifiques liés à la cohorte des MAC comportaient notamment l’hypoxémie (12,5 %, définie comme une saturation en oxygène <85 %), une ventilation imprévue par masque (0,6 %), une intubation imprévue (3 %) et une interruption de la procédure (5 %).6 À partir de ces données, les auteurs ont conclu que « des évènements mineurs liés à la sédation étaient courants (21 %) mais qu’ils entraînaient une interruption provisoire de la procédure uniquement dans 5 % des cas ». Ils ont simplement balayé les 3 % d’intubations imprévues en déclarant que « l’accès aux voies aériennes était facile à obtenir dans les rares occasions où une intubation imprévue s’avérait nécessaire ». Dans une étude prospective semblable de la CPRE sous MAC, Zhang et al7 ont constaté que les complications liées à la sédation survenaient chez 18 % des patients, avec une hypoxémie (définie comme une saturation en oxygène <90 % pendant au moins 2 minutes) survenant chez 9 % des patients, et >33 % des patients subissaient plusieurs épisodes d’hypoxémie. Les auteurs ont noté que l’incidence d’hypoxémie dans leur étude était comparable au taux d’hypoxémie dans d’autres études semblables et par conséquent, ils ont conclu que « la sédation par des anesthésistes pour une CPRE est sûre ». Dans une étude rétrospective des MAC pour une CPRE, Yang et al9 ont signalé une incidence d’hypoxémie (définie comme une saturation en oxygène <90 %) nécessitant une manipulation des voies aériennes dans 28 % des cas, avec 1,6 % des patients pour lesquels une conversion en AEG était nécessaire en raison de la présence d’aliments dans l’estomac. Malgré ces constatations, les auteurs ont conclu que « le propofol peut être utilisé en toute sécurité et de manière efficace comme agent sédatif pour les patients subissant une CPRE ».
Comment des études qui signalent des taux aussi élevés d’EIAS, d’épisodes d’hypoxémie et de manœuvres nécessaires des voies aériennes peuvent-elles conclure que la sédation est « sûre » ou « faisable » ou « appropriée » ?4,6–9 Le fait qu’un évènement critique n’entraîne pas un résultat critique ne réduit pas la gravité de l’évènement ! En définitive, l’interprétation des données dépend du prisme par lequel elles sont étudiées. Un gastro-entérologue peut ne pas être alarmé par un taux d’intubation imprévue allant jusqu’à 3 %,6 ou des taux d’hypoxémie atteignant 33 %,7 tant que le patient n’a pas souffert de séquelles à long terme. Toutefois, un anesthésiste qui est responsable de gérer des voies aériennes en urgence et de pratiquer la réanimation cardiorespiratoire peut considérer que chacun de ces épisodes d’hypoxémie est un accident évité de justesse. Il faut rappeler que l’oxymétrie est une mesure de l’oxygénation, pas de la ventilation, et qu’elle ne peut pas être utilisée de manière fiable pour détecter une hypoventilation et une hypercapnie progressive.35,36 L’hypoxémie dans le cadre de l’utilisation d’une supplémentation en oxygène (comme c’est la pratique courante pendant des MAC pour une CPRE) est un marqueur tardif d’une hypoventilation et un précurseur d’un arrêt respiratoire imminent.
Pour répondre pleinement à l’argument soulevé, considérons un scénario différent. Si nous conduisons sans ceinture de sécurité pendant un an et que nous ne sommes jamais blessés lors d’accidents qui surviennent, est-il correct de conclure que conduire sans ceinture de sécurité est sûr, faisable et approprié ? La normalisation et l’acceptation de taux élevés d’hypoxémie pendant des MAC pour une CPRE, hors bloc opératoire, en décubitus ventral et avec un accès limité aux voies aériennes, établit un précédent dangereux. Nous admettons qu’il est difficile de définir un taux « acceptable » d’EIAS et d’épisodes d’hypoxémie pendant la sédation. Toutefois, nous estimons que les taux d’EIAS et d’épisodes d’hypoxémie signalés dans les études susmentionnées sont inquiétants et doivent être présentés comme une préoccupation pour la sécurité des patients, plutôt que d’être balayés comme un évènement inconséquent.
Nous allons maintenant nous intéresser aux éléments probants en faveur d’une AEG pour une CPRE. Dans un essai contrôlé randomisé comparant la sécurité des MAC à une AEG pour une CPRE, les résultats sont clairement en faveur d’une AEG.10 Cette étude comportait des patients identifiés comme représentant un risque élevé d’EIAS, notamment ceux avec un score STOP-BANG (système de cotation s’intéressant aux éléments suivants : ronflements, fatigue, observation de l’apnée, tension artérielle, indice de masse corporelle, âge, circonférence du cou, genre) ≥3, une ascite abdominale, un IMC ≥35, une maladie pulmonaire chronique, un score ASA >3, des voies aériennes au score de Mallampati 4 et une consommation d’alcool modérée à forte. Les taux d’EIAS étaient considérablement plus élevés dans le groupe MAC que dans le groupe AEG (51,5 % versus 9,9 %).10 Dans le groupe MAC, l’hypoxémie (définie comme une saturation en oxygène <90 %) est survenue chez 19 % des patients, avec 45 % qui ont nécessité une ou plusieurs manœuvres des voies aériennes et 8 % ont nécessité une ventilation au ballon et masque.10 En revanche, aucun accident d’hypoxémie ni aucune manœuvre des voies aériennes n’est survenu dans le groupe AEG. La procédure CPRE a dû être interrompue dans 10,1 % des cas du groupe MAC, nécessitant une conversion en AEG pour instabilité respiratoire (8 %) et la présence d’un contenu gastrique (2 %).10 Il convient de noter qu’une hypotension nécessitant un vasopresseur est survenue dans un pourcentage de cas semblable dans les deux groupes, que la durée de la procédure, la réussite technique et le délai de réveil du patient étaient identiques.10
Si nous laissons les données de côté momentanément, nous pouvons réfléchir à la réalité de la gestion de crise du point de vue d’un anesthésiste. L’atteinte des voies aériennes en décubitus ventral, isolé hors du bloc opératoire, avec de l’aide et des ressources limitées, est le cauchemar de tout anesthésiste, comme il se doit. Alors que chaque seconde compte, les étapes de retrait de l’endoscope, d’éloignement des équipements de fluoroscopie, d’arrivée du brancard dans la salle et de repositionnement du patient en décubitus dorsal peuvent sembler une éternité. Une fois que le patient est correctement positionné pour gérer ses voies aériennes, il peut être sur le point de passer en arrêt respiratoire. Effectivement, il s’agit d’un évènement relativement rare pendant la sédation pour une CPRE, mais il est possible de l’éviter. Pourquoi prendre ce risque alors que les voies aériennes pourraient être gérées initialement par une intubation endotrachéale dans le cadre d’une méthode élective et contrôlée ? Avec les taux élevés d’hypoxémie associés à la sédation pendant une CPRE et les nombreux défis associés à une intubation imprévue dans cet environnement, l’AEG est simplement le choix logique.
Les gastro-entérologues ont le sentiment que les MAC sont plus rapides que l’AEG, nécessitent moins de temps de rotation et permettent le traitement d’un plus grand flux de patients. Malgré l’existence de données qui étayent ce sentiment,5 d’autres données suggèrent que le temps gagné pendant la sédation est susceptible d’être compensé par des interruptions fréquentes de la procédure en raison de l’atteinte des voies aériennes.10 En réalité, l’efficacité du service de chirurgie digestive est un produit complexe de nombreuses variables différentes (notamment l’efficacité procédurale de l’endoscopiste) et ce serait manquer de vision que de penser que l’efficacité est liée simplement à la présence ou à l’absence d’un tube endotrachéal. On retrouve également le sentiment que les MAC sont naturellement plus doux, plus sûrs et moins invasifs que l’AEG. Effectivement, l’utilisation de l’AEG présente ses propres risques, notamment le potentiel de lésions dentaires, d’un bloc neuromusculaire résiduel, d’une instabilité hémodynamique et d’effets indésirables des médicaments. Toutefois, si on compare l’ensemble de ces risques au risque d’atteinte des voies aériennes pendant des MAC pour une CPRE en décubitus ventral, il n’y a franchement aucune comparaison possible. Notre mission en tant qu’anesthésistes est de réduire les risques au minimum et le potentiel d’atteinte des voies aériennes pendant des MAC pour une CPRE est un risque injustifié.
Jusqu’à ce que soient réalisées d’autres études contrôlées, randomisées, multicentriques, à plus grande échelle, la controverse concernant les MAC par rapport à l’AEG pour une CPRE persistera et la norme de soin demeurera imprécise. Tous les professionnels de santé, néanmoins, peuvent s’accorder sur le fait que, quelle que soit la technique d’anesthésie, celle-ci doit être administrée par un anesthésiste. Aux États-Unis, le nombre de SDE pour une CPRE a baissé de >50 % des cas en 2005 à 5 % en 2014, mais cette méthode reste largement répandue en Europe et dans d’autres pays.3 Une étude rétrospective de près de 27 000 CPRE réalisées sur une durée de 10 ans a montré que la SDE entraînait un taux plus élevé d’évènements indésirables (OR = 1,86) et qu’elle était deux fois plus susceptible de nécessiter une intervention imprévue qu’une sédation par anesthésie.3 Des études ont également démontré que la SDE générait un taux plus élevé d’échecs de la sédation et par conséquent, un échec de la procédure, que des MAC administrés par anesthésie ou une AEG.30,34 Pire encore, la SDE causait l’insatisfaction du patient et de l’endoscopiste.33 Nous sommes d’avis que le modèle de la SDE pour une CPRE est une menace pour la sécurité du patient et qu’il devrait être abandonné. Nous sommes foncièrement convaincus que la sédation au propofol doit être administrée exclusivement par un anesthésiste qui sait reconnaître rapidement une atteinte des voies aériennes et qui possède les compétences de les gérer en cas d’urgence. Ces compétences ne relèvent pas du champ de compétences pratiques des médecins, du personnel infirmier et des techniciens du service de gastro-entérologie.
L’anesthésie MAC pendant une CPRE est associée à des taux élevés d’hypoxémie, de manœuvres des voies aériennes et d’EIAS. Ces risques associés aux dangers inhérents de l’anesthésie hors bloc opératoire suscitent de graves inquiétudes pour la sécurité des MAC pour une CPRE en décubitus ventral. Pour citer le sage anesthésiste Dr Carl Hug Jr, MAC devrait être l’abréviation de « Maximal Anesthesia Caution » (précautions maximales pour une anesthésie) plutôt que « Monitored Anesthesia Care » (soins d’anesthésie surveillés).37 Nous pensons que tous les patients qui subissent une procédure de CPRE devraient être pris en charge par un anesthésiste et que l’AEG présente des avantages significatifs par rapport aux MAC.
RÉSUMÉ
Ce débat sur les avantages et les inconvénients a été suscité par la croissance du nombre de procédures endoscopiques complexes au cours des dernières années, associée à l’absence d’études contrôlées randomisées de grande échelle pour soutenir une technique définitive d’anesthésie pour les patients subissant une CPRE. Ce débat est particulièrement important en raison de l’incidence des comorbidités et le fait que la procédure implique un partage des voies aériennes. Les avantages des MAC sont notamment la diminution du nombre de perturbations hémodynamiques, la réduction des effets secondaires liés aux agents d’inhalation, un réveil cognitif plus rapide et un temps globalement plus court de procédure. Ils doivent être mis au regard de l’incidence d’évènements critiques causés par l’insuffisance de l’oxygénation et/ou de la ventilation qui est avérée pendant les MAC. Les deux approches présentées dans le cadre de ce débat mettent l’accent sur l’importance de la présence d’un anesthésiste qui détermine la méthode d’anesthésie optimale pour un patient et une situation clinique particuliers.
Luke Janik, MD, est professeur assistant clinique de l’Université de Chicago et membre du corps professoral du Département d’anesthésie-réanimation et médecine de la douleur du NorthShore University HealthSystem à Evanston, Illinois.
Jeffery S. Vender, MD, MCCM, est professeur clinique émérite du département d’anesthésie de l’Université de Chicago, Chicago, Illinois.
Samantha Stamper, MD, est professeure adjointe de l’école Cleveland Clinic Lerner College of Medicine de l’Université Case Western Reserve et membre du corps professoral de l’Institut d’anesthésiologie, Cleveland Clinic, Cleveland, Ohio.
Christopher A. Troianos, MD, FASE, FASA, est professeur clinique à l’Institut d’anesthésiologie de l’école Cleveland Clinic Lerner College of Medicine de l’Université Case Western Reserve, Cleveland Clinic, Cleveland, Ohio.
Déclarations : Luke S. Janik, MD, Samantha Stamper, MD, et Christopher A. Troianos, MD, FASE, FASA, ne signalent aucun conflit d’intérêts. Jeffery S. Vender, MD, MCCM, est consultant pour Fresenius Kabi, Medline Industries et Medtronic.
Documents de référence
- Woodward ZG, Urman RD, Domino KB. Safety of non-operating room anesthesia: a closed claims update. Anesthesiol Clin. 2017;35:569–581. PMID: 29101947.
- Smith ZL, Das KK, Kushnir VM. Anesthesia-administered sedation for endoscopic retrograde cholangiopancreatography: monitored anesthesia care or general endotracheal anesthesia? Curr Opin Anaesthesiol. 2019;32:531–537. PMID: 30994476.
- Smith ZL, Nickel KB, Olsen MA, et al. Type of sedation and the need for unplanned interventions during ERCP: analysis of the clinical outcomes research initiative national endoscopic database (CORI-NED). Frontline Gastroenterol. 2020;11:104–110. PMID: 32133108.
- Barnett SR, Berzin T, Sanaka S, et al. Deep sedation without intubation for ERCP is appropriate in healthier, non-obese patients. Dig Dis Sci. 2013;58:3287–3292. PMID: 23877477.
- Perbtani YB, Summerlee RJ, Yang D, et al. Impact of endotracheal intubation on interventional endoscopy unit efficiency metrics at a tertiary academic medical center. Am J Gastroenterol. 2016;111:800–807. PMID: 27021194.
- Berzin TM, Sanaka S, Barnett SR, et al. A prospective assessment of sedation-related adverse events and patient and endoscopist satisfaction in ERCP with anesthesiologist-administered sedation. Gastrointest Endosc. 2011;73:710–717. PMID: 21316669.
- Zhang CC, Ganion N, Knebel P, et al. Sedation-related complications during anesthesiologist-administered sedation for endoscopic retrograde cholangiopancreatography: a prospective study. BMC Anesthesiol. 2020;20:131. PMID: 32466744.
- Coté GA, Hovis RM, Ansstas MA, et al. Incidence of sedation-related complications with propofol use during advanced endoscopic procedures. Clin Gastroenterol Hepatol. 2010;8:137–142. PMID: 19607937.
- Yang JF, Farooq P, Zwilling K, et al. Efficacy and safety of propofol-mediated sedation for outpatient endoscopic retrograde cholangiopancreatography (ERCP). Dig Dis Sci. 2016;61:1686–1691. PMID: 26825844.
- Smith ZL, Mullady DK, Lang GD, et al. A randomized controlled trial evaluating general endotracheal anesthesia versus monitored anesthesia care and the incidence of sedation-related adverse events during ERCP in high-risk patients. Gastrointest Endosc. 2019;89:855–862. PMID: 30217726.
- Metzner J, Posner KL, Domino KB. The risk and safety of anesthesia at remote locations: the US closed claims analysis. Curr Opin Anaesthesiol. 2009;22:502–508. PMID: 19506473.
- Wu WZ, Zheng MH, Wang JC, Chen S. The role of endoscopic retrograde cholangiopancreatography in perioperative period of laparoscopic cholecystectomy. Hepatobiliary Pancreat Dis Int. 2002;1:114–117. PMID: 14607638.
- Kapoor H. Anaesthesia for endoscopic retrograde cholangiopancreatography. Acta Anaesthesiol Scand. 2011;55:918–926.
- Huang RJ, Barakat MT, Girotra M, et al. Unplanned hospital encounters after endoscopic retrograde cholangiopancreatography in 3 large North American States. Gastroenterology. 2019;156:119.e3–129.e3. PMID: 30243620.
- Goudra B, Singh PM. Airway management during upper GI endoscopic procedures: state of the art review. Dig Dis Sci. 2017;62:45–53. PMID: 27838810.
- Shah T, Ianchulev S. Gastroscope-facilitated endotracheal intubation during ERCP: when is the best time to GETA (Big) MAC? Dig Dis Sci. 2021;66:938–940. PMID: 32643057.
- Barakat MT, Angelotti TP, Banerjee S. Use of an ultra-slim gastroscope to accomplish endoscopist-facilitated rescue intubation during ERCP: a novel approach to enhance patient and staff safety. Dig Dis Sci. 2021;66:1285–1290. PMID: 32504349.
- Standards for Basic Anesthetic Monitoring. American Society of Anesthesiologist Website. October 21, 1986, last amended on October 20, 2010, and last affirmed on October 28, 2016. https://www.asahq.org/~/media/Sites/ASAHQ/Files/Public/Resources/standards-guidelines/standards-for-basic-anesthetic-monitoring.pdf. Accessed March 20, 2021.
- Deitch K, Miner J, Chudnofsky CR, et al. Does end tidal CO2 monitoring during emergency department procedural sedation and analgesia with propofol decrease the incidence of hypoxic events? A randomized, controlled trial. Ann Emerg Med. 2010;55:258–264. PMID: 19783324.
- Goudra B, Singh PM. ERCP: the unresolved question of endotracheal intubation. Dig Dis Sci. 2014;59:513–519. PMID: 24221339.
- Gambee AM, Hertzka RE, Fisher DM. Preoxygenation techniques: comparison of three minutes and four breaths. Anesth Analg. 1987;66:468–470. PMID: 3578856.
- Tetzlaff JE, Vargo JJ, Maurer W. Nonoperating room anesthesia for the gastrointestinal endoscopy suite. Anesthesiol Clin. 2014;32:387–394. PMID: 24882126.
- Goulson DT, Fragneto RY. Anesthesia for gastrointestinal endoscopic procedures. Anesthesiol Clin. 2009;27:71–85. PMID: 19361769.
- Allampati S, Wen S, Liu F, Kupec JT. Recovery of cognitive function after sedation with propofol for outpatient gastrointestinal endoscopy. Saudi J Gastroenterol. 2019;25:188–193. PMID: 30618439.
- Berg H, Roed J, Viby-Mogensen J, et al. Residual neuromuscular block is a risk factor for postoperative pulmonary complications. A prospective, randomised, and blinded study of postoperative pulmonary complications after atracurium, vecuronium and pancuronium. Acta Anaesthesiol Scand. 1997;41:1095–1103. PMID: 9366929.
- Althoff FC, Agnihotri A, Grabitz SD, et al. Outcomes after endoscopic retrograde cholangiopancreatography with general anaesthesia versus sedation. Br J Anaesth. 2021;126:191–200. PMID: 33046219.
- Coelho-Prabhu N, Shah ND, Van Houten H, et al. Endoscopic retrograde cholangiopancreatography: utilisation and outcomes in a 10-year population-based cohort. BMJ Open. 2013;3:e002689. PMID: 23793659.
- Cotton PB, Garrow DA, Gallagher J, Romagnuolo J. Risk factors for complications after ERCP: a multivariate analysis of 11,497 procedures over 12 years. Gastrointest Endosc. 2009;70:80–88. PMID: 19286178.
- Chandrasekhara V, Khashab MA, Muthusamy R, et al. Committee ASoP. Adverse events associated with ERCP. Gastrointest Endosc. 2017;85:32–47. PMID: 27546389.
- Raymondos K, Panning B, Bachem I, et al. Evaluation of endoscopic retrograde cholangiopancreatography under conscious sedation and general anesthesia. Endoscopy. 2002;34:721–726. PMID: 12195330.
- Wehrmann T, Kokabpick S, Lembcke B, et al. Efficacy and safety of intravenous propofol sedation during routine ERCP: a prospective, controlled study. Gastrointest Endosc. 1999;49:677–683. PMID: 10343208.
- Lapidus A, Gralnek IM, Suissa A, et al. Safety and efficacy of endoscopist-directed balanced propofol sedation during endoscopic retrograde cholangiopancreatography. Ann Gastroenterol. 2019;32:303–311. PMID: 31040629.
- Goudra BG, Singh PM, Gouda G, et al. Safety of nonanesthesia provider-administered propofol (NAAP) sedation in advanced gastrointestinal endoscopic procedures: comparative meta-analysis of pooled results. Dig Dis Sci. 2015;60:2612–2627. PMID: 25732719.
- Buxbaum J, Roth N, Motamedi N, et al. Anesthetist-directed sedation favors success of advanced endoscopic procedures. Am J Gastroenterol. 2017;112:290–296. PMID: 27402501.
- Fu ES, Downs JB, Schweiger JW, et al. Supplemental oxygen impairs detection of hypoventilation by pulse oximetry. Chest. 2004;126:1552–1558. PMID: 15539726.
- Hutton P, Clutton-Brock T. The benefits and pitfalls of pulse oximetry. BMJ. 1993;307:457–458. PMID: 8400922.
- Hug CC Jr. MAC should stand for maximum anesthesia caution, not minimal anesthesiology care. Anesthesiology. 2006;104:221–223. PMID: 16436837.


 Issue PDF
Issue PDF