El origen de la ketamina (ketamine)
 Desde su síntesis en un laboratorio de Detroit hace casi seis décadas, la ketamina ha demostrado ser un medicamento complejo con propiedades inusuales, heterogéneo, de mecanismos interconectados y usos clínicos diversos, a veces controvertidos.
Desde su síntesis en un laboratorio de Detroit hace casi seis décadas, la ketamina ha demostrado ser un medicamento complejo con propiedades inusuales, heterogéneo, de mecanismos interconectados y usos clínicos diversos, a veces controvertidos.
La historia de la ketamina comienza en 1956 cuando científicos identificaron una nueva clase de medicamentos anestésicos llamadas “ciclohexilaminas”.1 El primero de esta clase de medicamentos se llamó “fenciclidina” (phencyclidine) (PCP). En 1962, se descubrió un nuevo compuesto (CI-581) que tenía todas las cualidades positivas de la PCP sin los principales efectos secundarios negativos, como agitación intensa y psicosis profunda.2 Este nuevo medicamento finalmente se llamaría “ketamina”. En el estudio inicial, varios sujetos que recibieron ketamina describieron sentirse como si no tuvieran “brazos ni piernas”. Otros se sintieron “como si estuvieran muertos” y tuvieron alucinaciones vívidas. Estas descripciones llevaron a los investigadores a acuñar el término “anestesia disociativa”.2,3
Ciencia básica
Se cree que la propiedad de la ketamina como antagonista del receptor NMDA es la responsable principal de sus efectos amnésicos, anestésicos y disociativos.4 Se ha demostrado que el bloqueo del receptor NMDA impide la formación de la memoria en los roedores.5 Además, los receptores NMDA de la columna vertebral participan de manera estrecha en la sensibilización central y, por lo tanto, el agonismo repetido puede producir hiperalgesia. La actividad con la NO sintetasa, el ácido gamma-aminobutírico (GABA) y la acetilcolina también pueden contribuir a las acciones y los efectos secundarios únicos y complejos que se observan con la ketamina.6
El metabolismo de la ketamina se produce principalmente en el hígado, donde se convierte en norketamina (norketamine), un metabolito activo que también tiene propiedades anestésicas potentes. Además de las acciones de la norketamina, la lipofilicidad de la ketamina puede ser responsable de su vida media distributiva prolongada de entre 10 y 15 minutos después de una dosis de inducción por vía intravenosa estándar de 1 o 2 mg/kg. A diferencia de otros medicamentos de inducción, los pacientes que reciben grandes dosis de ketamina pueden tener nistagmo, dilatación de las pupilas o es posible que no puedan cerrar los ojos pese a haber alcanzado los niveles anestésicos generales del medicamento. En la tabla 1 se resumen algunos de los beneficios y los efectos secundarios frecuentes de la ketamina.
Tabla 1: Posibles beneficios y efectos secundarios de la ketamina
| Beneficios |
| Mantenimiento del impulso respiratorio |
| Depresión cardiovascular mínima |
| Atenuación de la hiperalgesia perioperatoria inducida por opiáceos |
| Tratamiento complementario de los síndromes de dolor agudo y crónico |
| Propiedades antidepresivas y antisuicidas |
| Efectos secundarios |
| Aumento de las secreciones de las vías respiratorias, atenuación mínima de los reflejos de las vías respiratorias |
| Frecuencia cardíaca, presión y resistencia vascular sistémica elevadas; isquemia miocárdica en pacientes con arteriopatía coronaria grave |
| Alucinaciones, confusión, sueños vívidos, delirio |
| Duración prolongada en los pacientes con insuficiencia hepática |
| Visión doble o borrosa |
SVR: resistencia vascular sistémica. CAD: arteriopatía coronaria
Los efectos fisiológicos y psicotrópicos asociados a la ketamina se han descrito de manera minuciosa después de los primeros estudios en humanos (tabla 1). Los aumentos en la presión, la frecuencia cardíaca, la contractilidad y la resistencia vascular sistémica derivaron en la descripción inicial de un efecto simpaticomimético de la ketamina.2 Ahora se sabe que este aumento observado en el tono simpático es secundario a la liberación de catecolamina en las glándulas adrenales desencadenada por la ketamina. Curiosamente, la ketamina aislada tiene un efecto inotrópico negativo directo que, en general, es cancelado por este aumento del tono simpático. Se debe tener precaución cuando se induce a los pacientes con un tono simpático alto (p. ej., pacientes con traumatismos) con ketamina, ya que sus efectos cardiodepresores pueden sobrecargar la posible liberación de catecolamina de las glándulas adrenales ya sobrecargadas. También se debe tener prudencia cuando se administra ketamina a pacientes con arteriopatía coronaria grave, ya que la demanda de oxígeno del miocardio es desproporcionadamente mayor que el aumento del suministro de oxígeno a partir de la administración de ketamina.
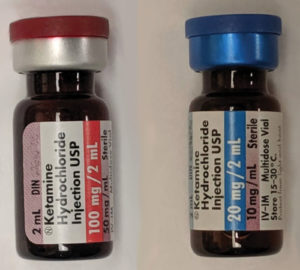
Dos dosis de ketamina por vía intravenosa, 50 mg/ml y 10 mg/ml. Fuente: Wikipedia. https://creativecommons.org/share-your-work/licensing-considerations/compatible-licenses.
La ketamina es uno de los pocos anestésicos intravenosos con efectos mínimos en los patrones respiratorios. Además, sus efectos broncodilatadores pueden ser beneficiosos para los pacientes asmáticos en particular.7 Dada la escasez de ensayos aleatorizados controlados grandes y las pautas posológicas heterogéneas y no informadas, es difícil determinar una dosis broncodilatadora óptima. Los efectos respiratorios adversos, como el aumento de las secreciones de las vías respiratorias, pueden reducirse con el uso de antisialagogos.
Hay distintos patrones del electroencefalograma (EEG) asociados al aumento de las dosis de ketamina, ya que los pacientes desarrollan un patrón de ráfagas de gamma (oscilaciones gamma interrumpidas por oscilaciones delta lentas), seguido de un patrón beta/gamma estable.8 Apenas después de esta secuencia del EEG, hay una transición al estado inconsciente inducido por la ketamina. Por lo tanto, como no hay un estado de EEG isoeléctrico asociado a la ketamina, no se recomienda determinar el nivel de profundidad anestésica con este patrón.
En varios documentos históricos se ha informado de que la ketamina aumenta la presión intracraneal (PIC).9,10 Se planteó que los aumentos en el flujo sanguíneo cerebral (CBF) y el consumo cerebral de oxígeno provocaban este aumento. Por eso, la enseñanza clásica era evitar la ketamina en los procedimientos neurológicos. Sin embargo, en varios de estos estudios se permitió que los pacientes respiraran de manera espontánea después de una dosis de inducción de ketamina, lo que pudo haber elevado falsamente la PIC por la vasodilatación inducida por hipercapnia.11 Ha habido muchos retos recientes a este dogma. Las investigaciones actuales sugieren que, cuando se usa en pacientes con respirador mecánico con otros medicamentos sedantes, no hay aumento de la PIC.12–14 No hay datos sobre el efecto de la ketamina a dosis subanestésicas en la PICP; sin embargo, cuando se administra a esta dosis más baja y sin efecto sedante, es probable que los efectos en la PICP sean mínimos.
Uso actual en anestesiología
Después de que la FDA aprobó la ketamina en 1970, su primer uso generalizado importante fue como anestésico en el campo de batalla en la guerra de Vietnam.3 En 1985, la Organización Mundial de la Salud clasificó a la ketamina como un “medicamento esencial”, y en la actualidad se cree que es el anestésico que se usa con más frecuencia en el mundo.15
En los entornos de atención de pacientes agudos, como la unidad de cuidados intensivos o la sala de emergencias, la sedación con ketamina para procedimientos se ha usado de manera segura durante décadas.16 El interés en su uso intraoperatorio se ha renovado con el aumento de la epidemia de opioides. La ketamina cuando se administra en dosis subanestésicas, puede reducir la tolerancia a los opiáceos y disminuir la hiperalgesia inducida por opiáceos después de la cirugía.17 Cuando se administra a pacientes con dolor crónico que se someten a una cirugía de espalda, se ha comprobado que la ketamina reduce las puntuaciones del dolor y el consumo de opiáceos en distintos momentos del período postoperatorio.18 Incluso puede ayudar a los pacientes que nunca tomaron opiáceos y que se someten a procedimientos que tienen una evolución posoperatoria dolorosa prevista.19 En la tabla 2, se resumen algunos intervalos de dosis de ketamina que se usan con frecuencia.
Tabla 2: Recomendaciones para la administración30,35,36
| Vía | Intervalo de dosificación |
| Inducción anestésica | 1 a 2 mg/kg |
| Dosis de carga (para la sedación y la analgesia) | 0,1 a 0,5 mg/kg administrados en 60 segundos para evitar la depresión respiratoria y la respuesta simpática |
| Inyección en bolo/dosis complementaria | 0,1 a 0,5 mg/kg según sea necesario |
| Sedación/Analgesia (para pacientes intubados) | 5 a 30 mcg/kg/min |
| Analgesia (para pacientes no intubados) | 1 a 5 mcg/kg/min |
| Depresión resistente al tratamiento | 0,5 mg/kg durante 40 minutos |
El uso de ketamina en la anestesia neuroaxial ha sido controvertido por el potencial de neurotoxicidad por los conservantes y la apoptosis neuronal directa.20 Sin embargo, ambas etiologías solo se han visto en algunos modelos animales,21,22 y en estudios posteriores no se ha demostrado una neurotoxicidad relevante desde el punto de vista clínico en seres humanos.23 Esto ha provocado que varios estudios evalúen el papel de la ketamina en el bloqueo del desarrollo de dolor en el muñón después de una amputación24 y en la disminución del dolor después de una toracotomía.25
La ketamina se usa con frecuencia en los servicios de dolor agudo para tratar el dolor posoperatorio que no se alivia con el tratamiento de analgesia controlada por el paciente (PCA) con opioides habituales. Los pacientes no quirúrgicos que tienen exacerbaciones del dolor agudo o crónico, como crisis por oclusión vascular provocadas por la anemia de células falciformes, también pueden beneficiarse de la ketamina.26 En general, las dosis son más bajas con infusiones de menos de 0,3 mg/kg/h, con o sin una inyección en bolo. La incorporación de infusiones de ketamina puede reducir el consumo de opioides y mejorar la transición de la PCA a opioides orales. Incluso hay pruebas de que las soluciones de PCA que contienen ketamina (entre 1 y 5 mg por bolo) pueden mejorar el control del dolor y reducir el consumo de opioides.27
Consideraciones de seguridad
Las contraindicaciones de la ketamina incluyen embarazo, insuficiencia hepática, enfermedad coronaria significativa y psicosis (tabla 3). La PIC elevada, como se describe previamente, no se produce en pacientes sedados con ventilación controlada. La presión intraocular (IOP) elevada es una contraindicación que se menciona con frecuencia en función de los primeros estudios,28 pero según pruebas recientes las fluctuaciones de la IOP son mínimas.29 Se cree que el mecanismo se debe a cambios en el tono de los músculos extraoculares.28
Tabla 3: Indicaciones/Contraindicaciones
| Indicaciones |
Analgesia
|
| Exacerbaciones del dolor agudo o crónico |
| Sedación (ventilación mecánica) |
| Sedación para procedimientos |
| Intubación de secuencia rápida |
| Depresión resistente al tratamiento |
| Contraindicaciones |
| Psicosis |
| Abuso activo de sustancias |
| Insuficiencia hepática grave |
| Enfermedad coronaria significativa |
| Hipertensión mal controlada |
Cuando la ketamina se administra de manera intraoperatoria, se debe implementar el monitoreo estándar de la Sociedad Americana de Anestesiólogos (ASA), ya sea que se use como el único anestésico o como un analgésico complementario. Las dosis subanestésicas de ketamina también implican un riesgo de afectación de las vías respiratorias, alteraciones cardiovasculares y eventos psicosomáticos. En entornos de atención de pacientes agudos, debe haber un aparato de toma de presión, un saturómetro y un electrocardiograma. Según las Directrices consensuadas sobre el uso de ketamina por vía intravenosa para el dolor crónico de la Sociedad Americana de Anestesia Regional y Medicina del Dolor (American Society of Regional Anesthesia and Pain Medicine, ASRA), la Academia Americana de Medicina del Dolor (American Academy of Pain Medicine, AMPA) y la Sociedad Americana de Anestesiólogos (ASA),30 los profesionales encargados de la supervisión deben tener una certificación en soporte vital cardiovascular avanzado (ACLS) y cumplir los requisitos de la ASA para la sedación moderada. Las personas que administran ketamina deben tener al menos un título en enfermería, haber recibido capacitación en sedación moderada y farmacología de la ketamina y tener una certificación en ACLS.
Ketamina como antidepresivo
La ketamina se produce como una mezcla racémica de esketamina (esketamine) y arketamina (arketamine). En marzo de 2019, el interés científico y público en la ketamina estalló con la aprobación de la FDA de la esketamina, el enantiómero positivo de la ketamina racémica, como el primer medicamento antidepresivo de su clase para el manejo de la depresión resistente al tratamiento.31
La ketamina demuestra propiedades antidepresivas y antisuicidas sólidas.32 Sin embargo, como antidepresivo, puede tener efectos categóricamente diferentes según las distintas concentraciones séricas, y es posible que sus efectos no sigan las curvas dosis-respuesta estándar. En dosis muy superiores a la dosis de anestesia de inducción completa, el efecto antidepresivo de la ketamina no parece ser mayor que el efecto en dosis subanestésicas. En este aspecto, se parece a otros medicamentos psiquiátricos, como trazodona (trazodone), un medicamento multimecanismo habitual que funciona como sedante en dosis inferiores a 150 mg, pero como antidepresivo en dosis superiores a 150 mg.33
El mecanismo de acción antidepresivo y antisuicida de la ketamina puede producirse por las concentraciones de glutamato en suero después de la activación de los receptores AMPA. Por lo general, los médicos clínicos de los centros académicos que administran ketamina por vía intravenosa a pacientes como tratamiento para la depresión se han inclinado, hasta hace poco, por un régimen de dosificación de 0,5 mg/kg durante 40 minutos (tabla 2).34 Esta tendencia refleja el predominio de la investigación con esta dosis, que se corresponde con una concentración sérica de entre 2000 y 3000 ng/ml, aproximadamente. Los tratamientos suelen administrarse de 1 a 3 veces a la semana. Sin embargo, los protocolos para la ketamina no se comparten de manera amplia, y hay diferentes regímenes de dosificación en los distintos centros. Tanto las investigaciones como la experiencia práctica sugieren la utilidad de aumentar gradualmente las dosis con prudencia.
De manera similar a las directrices de las sociedades de anestesia,30,36 la Asociación Americana de Psiquiatría (American Psychiatric Association) recomienda que los proveedores que administran ketamina en entornos ambulatorios estén certificados en ACLS.34 La baja probabilidad de que la ketamina produzca depresión respiratoria cuando se usa en dosis bajas ha contribuido a su percepción como un medicamento relativamente “seguro” en dosis bajas. Aunque los efectos simpaticomiméticos (niveles altos de presión y frecuencia cardíaca) se observan a menudo con dosis de inducción de la anestesia, estos cambios son poco frecuentes cuando se administran dosis subanestésicas.35 El monitoreo en la sedación, como mínimo, debe incluir controles continuos de la presión y la saturación cada diez minutos.35 Asimismo, cuando se usa en el contexto de casos activos de pensamientos suicidas o depresión grave, se deben supervisar y manejar los efectos psiquiátricos, a corto y a largo plazo, para garantizar la seguridad del paciente.34 Antes del tratamiento, se entrevista a los pacientes para evaluar sus síntomas iniciales y su respuesta al tratamiento. Después de que termina la infusión, los pacientes suelen recuperarse durante un período de entre 30 minutos y 2 horas antes de recibir el alta con un acompañante. Se debe tener en cuenta que estas directrices son específicas de nuestra práctica y es probable que otras instituciones tengan métodos de monitoreo y tratamiento diferentes. Se necesitan más recomendaciones comprobadas antes de la adopción generalizada de un conjunto de directrices.
Conclusión
La ketamina es un medicamento antiguo que está teniendo un nuevo surgimiento de interés entre los médicos para la medicina perioperatoria y el tratamiento de la depresión. Con la cantidad cada vez mayor de pacientes que sufren dolor crónico y necesitan un manejo del dolor sin opioides, y con su creciente utilidad en dosis mínimas para el tratamiento de la depresión y, posiblemente, de otros trastornos psiquiátricos, este antiguo medicamento ahora tiene más usos para la atención del paciente. Sin embargo, pronto se harán más investigaciones sobre el monitoreo adecuado para la administración de este medicamento en los entornos posoperatorios y ambulatorios.
El Dr. Kung es residente de Anestesiología en Massachusetts General Hospital, Boston, MA.
El Dr. Meisner es director médico del Servicio de Ketamina en McClean Hospital, Belmont, MA, y auxiliar de psiquiatría en Massachusetts General Hospital, Boston, MA.
La Dra. Berg es profesora auxiliar de Anestesiología en Massachusetts General Hospital, Boston, MA.
El Dr. Ellis es profesor de Anestesiología en Massachusetts General Hospital, Boston, MA.
Los Dres. Kung, Berg y Ellis no tienen conflictos de intereses. El Dr. Meisner trabajó en comités asesores para Janssen Pharmaceutical.
Referencias
- Maddox VH, Godefroi EF, Parcell RF. The synthesis of phencyclidine and other 1-arylcyclohexylamines. J Med Chem. 1965;8:230–235.
- Domino EF, Chodoff P, Corssen G. Pharmacologic effects of CI-581, a new dissociative anesthetic, in man. Clin Pharmacol Ther. 1965;6:279–291.
- Mion G. History of anaesthesia. Clin Pharmacol Ther. 2017;34: 571–575.
- Persson J. Wherefore ketamine? Curr Opin Anaesthesiol. 2010;23:455–460.
- Mathews MJ, Mead RN, Galizio, M. Effects of N-Methyl-D-aspartate (NMDA) antagonists ketamine, methoxetamine, and phencyclidine on the odor span test of working memory in rats. Exp Clin Psychopharmacol. 2018;26:6–17.
- Kohrs R, Durieux ME. Ketamine. Anesth Analg. 1998;87,
1186–1193. - Agrawal A, Goyal S. Ketamine in status asthmaticus: a review. Indian J Crit Care Med. 2013;17:154–161.
- Akeju O, Song AH, Hamilos AE, et al. Electroencephalogram signatures of ketamine anesthesia-induced unconsciousness. Clin Neurophysiol. 2016;127: 2414–2422.
- Gardner AE, Dannemiller FJ, Dean D. Intracranial cerebrospinal fluid pressure in man during ketamine anesthesia. Anesth Analg. 1972;51:741–745.
- Gardner AE, Olson BE, Lichtiger M. Cerebrospinal-fluid pressure during dissociative anesthesia with ketamine. Anesthesiology. 1971;35:226–228.
- Wang X, Ding X, Tong Y, et al. Ketamine does not increase intracranial pressure compared with opioids: meta-analysis of randomized controlled trials. J Anesth. 2014;28:821–827.
- Chang LC, Raty SR, Ortiz J, et al. The emerging use of ketamine for anesthesia and sedation in traumatic brain injuries. CNS Neurosci Ther. 2013;19:390–395.
- Zeiler FA, Teitelbaum J, West M, et al. The ketamine effect on ICP in traumatic brain injury. Neurocrit Care. 2014;21: 163–173.
- Zeiler FA, Teitelbaum J, West M, Gillman LM. The ketamine effect on intracranial pressure in nontraumatic neurological illness. J Crit Care. 2014;29:1096–1106.
- Fact file on ketamine. (2016, March). Retrieved from https://www.who.int/medicines/news/20160309_FactFile_Ketamine.pdf?ua=1.
- Sheikh S, Phyllis H. The expanding role of ketamine in the emergency department. Drugs. 2018;78:727–735.
- Nielsen RV, Fomsgaard JS, Siegel H, et al. Intraoperative ketamine reduces immediate postoperative opioid consumption after spinal fusion surgery in chronic pain patients with opioid dependency. Pain. 2017;158:463–470.
- Loftus RW, Yeager MP, Clark JA, et al. Intraoperative ketamine reduces perioperative opiate consumption in opiate-dependent patients with chronic back pain undergoing back surgery. Anesthesiology. 2010;113:639–646.
- Laskowski K, Stirling A, McKay WP, Lim HJ. A systematic review of intravenous ketamine for postoperative analgesia. Can J Anaesth. 2011;58:911–923.
- Schmid R, Katz J. Neural toxicity of ketamine and other NMDA antagonists. Pain. 2000;88:312.
- Borgbjerg FM, Svennson BA, Frigast C, Gordh T Jr., Histopathology after repeated intrathecal injections of preservative-free ketamine in the rabbit: a light and electron microscopic examination. Anesth Analg. 1994;79:105–111.
- Olney JW, Labruyere J, Price MT. Pathological changes induced in cerebrocortical neurons by phencyclidine and related drugs. Science. 1989;244:1360–1362.
- Subramaniam K, Subramaniam B, Steinbrook RA. Ketamine as adjuvant analgesic to opioids: a quantitative and qualitative systematic review. Anesth Analg. 2004;99:482–495.
- Wilson JA, Nimmo AF, Fleetwood-Walker SM, et al. A randomised double blind trial of the effect of pre-emptive epidural ketamine on persistent pain after lower limb amputation. Pain. 2008;135:108–118.
- Feltracco P, Barbieri S, Rizzi S, et al. Perioperative analgesic efficacy and plasma concentrations of s( )-ketamine in continuous epidural infusion during thoracic surgery. Anesth Analg. 2013;116:1371–1375.
- Puri L, Morgan KJ, Anghelescu DL. Ketamine and lidocaine infusions decrease opioid consumption during vaso-occlusive crisis in adolescents with sickle cell disease.Curr Opin Support Palliat Care. 2019;13:402–407.
- Wang L, Johnston B, Kaushal A, et al. Ketamine added to morphine or hydromorphone patient-controlled analgesia for acute postoperative pain in adults: a systematic review and meta-analysis of randomized trials. Can J Anaesth. 2016;63:311–325.
- Yoshikawa K, Murai Y. The effect of ketamine on intraocular pressure in children. Anesth Analg. 1971;50:199–202.
- Drayna PC, Estrada C, Wang W, et al. Ketamine sedation is not associated with clinically meaningful elevation of intraocular pressure. Am J Emerg Med. 2012;30:1215–1218.
- Cohen SP, Bhatia A, Buvanendran A, et al. Consensus guidelines on the use of intravenous ketamine infusions for chronic pain from the American Society of Regional Anesthesia and Pain Medicine, the American Academy of Pain Medicine, and the American Society of Anesthesiologists. Reg Anesth Pain Med. 2018;43:521–546.
- Kim J, Farchione T, Potter A, et al. Esketamine for treatment-resistant depression—first FDA-approved antidepressant in a new class. NEJM. 2019;381:1–4.
- Ionescu DF, Swee MB, Pavone KJ, et al. Rapid and sustained reductions in current suicidal ideation following repeated doses of intravenous ketamine secondary analysis of an open label study. J Clin Psychiatry. 2016;77:e7-19-25.
- Stahl SM. Mechanism of action of trazodone: a multifunctional drug. CNS Spectr. 2009;14:536–546.
- Sanacora G, Frye MA, Mcdonald W, et al. A Consensus Statement on the Use of Ketamine in the Treatment of Mood Disorders. JAMA Psychiatry. 2017;74:399.
- Riva-Posse P, Reiff CM, Edwards JA, et al. Blood pressure safety of subanesthetic ketamine for depression: a report on 684 infusions. J Affect Disord. 2018;236:291–297.
- Schwenk ES, Viscusi ER, Buvanendran A, et al. Consensus guidelines on the use of intravenous ketamine infusions for acute pain management from the American Society of Regional Anesthesia and Pain Medicine, the American Academy of Pain Medicine, and the American Society of Anesthesiologists. Reg Anesth Pain Med. 2018:43:456-466.


 Issue PDF
Issue PDF