L’origine de la kétamine
 Depuis sa synthèse dans un laboratoire de Détroit il y a près de 60 ans, il a été prouvé que la kétamine est un médicament complexe, aux propriétés inhabituelles, aux actions hétérogènes et interconnectées et aux usages cliniques divers, parfois contestés.
Depuis sa synthèse dans un laboratoire de Détroit il y a près de 60 ans, il a été prouvé que la kétamine est un médicament complexe, aux propriétés inhabituelles, aux actions hétérogènes et interconnectées et aux usages cliniques divers, parfois contestés.
L’histoire de la kétamine a débuté en 1956 lorsque des chercheurs ont identifié une nouvelle catégorie d’anesthésiques appelée cyclohexylamines.1 Le premier médicament de cette catégorie s’appelait la phéncyclidine (PCP). En 1962, un nouvel élément a été découvert (CI-581). Il possédait toutes les qualités positives du PCP sans les effets secondaires négatifs, tels que la forte excitation et la profonde psychose.2 À ce nouveau médicament sera enfin donné le nom de kétamine. Dans son étude initiale, plusieurs sujets auxquels la kétamine a été administrée ont décrit la sensation de ne plus avoir « ni bras ni jambes ». D’autres avaient « l’impression d’être morts » et ont eu des hallucinations vives. Ces descriptions ont conduit les chercheurs à utiliser l’expression « anesthésique dissociatif ».2,3
Science fondamentale
On estime que l’action antagoniste de la kétamine sur les récepteurs NMDA est principalement responsable de ses effets amnésiques, anesthésiques et dissociatifs.4 Il a été démontré que le blocage des NMDA empêchait la mémorisation chez les rongeurs.5 D’autre part, les récepteurs NMDA au niveau spinal sont intimement impliqués dans la sensibilisation centrale et par conséquent, une stimulation répétée peut entraîner une hyperalgésie. L’activité avec l’oxyde nitrique synthase, l’acide gamma-aminobutyrique (GABA) et l’acétylchonine peut également contribuer aux actions uniques et complexes et aux effets secondaires constatés avec la kétamine.6
Le métabolisme de la kétamine intervient principalement dans le foie, où la kétamine est convertie en norkétamine, un métabolite actif qui possède également des propriétés anesthésiques puissantes. Outre les actions de la norkétamine, la lipophilie de la kétamine peut être responsable de la demi-vie de distribution prolongée de la kétamine de 10 à 15 minutes après une dose d’induction intraveineuse standard de 1 à 2 mg/kg. Contrairement à d’autres médicaments d’induction, les patients auxquels sont administrées des doses de kétamine peuvent développer un nystagmus, une dilatation pupillaire et leurs yeux peuvent ne pas se fermer, même après avoir atteint les niveaux d’anesthésique général du médicament. Le Tableau 1 récapitule quelques avantages courants et effets secondaires de la kétamine.
Tableau 1. Avantages potentiels et effets secondaires de la kétamine
| Avantages |
| Maintien de la fonction respiratoire |
| Dépression cardiovasculaire minime |
| Atténuation de l’hyperalgésie induite par les opiacés périopératoires |
| Traitement d’appoint des syndromes de douleurs aiguës/chroniques |
| Propriétés de prévention du suicide et de la dépression |
| Effets secondaires |
| Intensification des sécrétions des voies respiratoires ; affaiblissement minime des réflexes des voies aériennes |
| Élévation de la fréquence cardiaque, de la tension artérielle et de la SVR ; ischémie myocardique chez les patients souffrant de CAD |
| Hallucinations, confusion, rêves d’apparence réelle, délire |
| Durée prolongée chez les patients souffrant d’insuffisance hépatique |
| Vision double, vision trouble |
SVR, résistance vasculaire systémique ; CAD, maladie coronarienne
Les effets physiologiques et psychotropes associés à la kétamine ont été bien décrits après les premières études sur les humains (Tableau 1). L’augmentation de la tension artérielle, de la fréquence cardiaque, de la contractilité et de la résistance vasculaire générale a conduit à la description initiale d’un effet sympathomimétique de la kétamine.2 On sait maintenant que cette observation constatée du tonus sympathique est secondaire à la sécrétion de catécholamine par les glandes surrénales déclenchée par la kétamine. Il est intéressant de constater que la kétamine seule a un effet inotrope négatif direct, généralement atténué par cet afflux sympathique. Il convient de faire preuve de prudence lors de l’induction de patients dont le tonus sympathique est élevé (par ex. les victimes de trauma) avec de la kétamine, car les effets cardio-dépressifs de la kétamine peuvent surpasser la sécrétion potentielle de catécholamine par des glandes surrénales déjà stressées. Il convient également de prendre garde lors de l’administration de kétamine à des patients présentant une coronaropathie grave, car la demande du myocarde en oxygène est disproportionnée par rapport à l’augmentation de l’apport en oxygène provenant de l’administration de la kétamine.
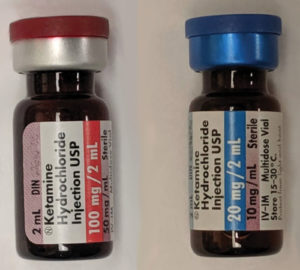
Deux doses de kétamine intraveineuse, 50mg/ml et 10mg/ml. Source : Wikipedia. https://creativecommons.org/share-your-work/licensing-considerations/compatible-licenses
La kétamine est l’un des rares anesthésiques intraveineux qui a des effets minimes sur les schémas respiratoires. En outre, ses effets bronchodilatateurs peuvent être bénéfiques, en particulier chez les patients asthmatiques.7 En raison de l’absence d’essais cliniques randomisés à grande échelle et des posologies hétérogènes et inconnues, il est difficile de déterminer une dose bronchodilatatrice optimale. Les effets respiratoires indésirables, tels que l’augmentation des sécrétions des voies respiratoires, peuvent être atténues grâce à l’utilisation d’antisialogogues.
On constate des schémas d’électroencéphalogramme (EEG) spécifiques associés à l’escalade des doses de kétamine, les patients développant un sursaut des ondes gamma (fluctuation des ondes gamma interrompues par des fluctuations des ondes delta lentes), puis une stabilisation du profil bêta/gamma.8 Cette progression de l’EEG se poursuit par une transition rapide en état d’inconscience induit par la kétamine. Ainsi, en raison de l’absence d’EEG isoélectrique associé à la kétamine, il n’est pas recommandé de titrer la profondeur de l’anesthésie par ce moyen.
Plusieurs anciens articles ont signalé que la kétamine entraînait une augmentation de la pression intracrânienne (PIC).9,10 Certains supposaient que l’augmentation du débit sanguin cérébral (DSC) et de la consommation d’oxygène par le cerveau causait cette augmentation. Par conséquent, l’enseignement classique préconisait d’éviter la kétamine dans les procédures neurologiques. Cependant, plusieurs de ces études laissaient les patients respirer spontanément après une dose d’induction de kétamine, ce qui a pu entraîner une élévation faussée de la PIC en raison d’une vasodilatation induite par l’hypercapnie.11 Ce dogme a été fortement contesté récemment. Des études récentes suggèrent que dans le cadre d’une utilisation avec des patients ventilés mécaniquement, en association avec d’autres sédatifs, on ne constate aucune augmentation de la PIC.12–14 Il manque des données relatives à l’effet de la kétamine en doses subanesthésiques sur la PIC, cependant lorsqu’elle est administrée à cette dose non sédative plus faible, les effets sur la PIC sont probablement minimes.
Utilisation actuelle en anesthésie
Après l’autorisation de mise sur le marché de la kétamine par la Food and Drug Administration en 1970, elle a été utilisée de manière généralisée pour la première fois comme anesthésique sur un champ de bataille, pendant la guerre du Vietnam.3 En 1985, l’Organisation mondiale de la santé a inscrit la kétamine à la liste des « médicaments essentiels ». Elle est désormais considérée comme l’anesthésique le plus couramment utilisé à travers le monde.15
Dans les cadres de soins aigus, tels que les services de soins intensifs ou les urgences, la sédation à la kétamine est utilisée depuis des dizaines d’années en toute sécurité.16 On a constaté un regain d’intérêt pour son utilisation pendant les interventions en conséquence de la hausse de l’addiction aux opiacés. La kétamine, lorsqu’elle est administrée à des doses subanesthésiques, peut réduire la tolérance aux opiacés et diminuer l’hyperalgésie induite par les opiacés après la chirurgie.17 Lorsqu’elle est administrée à des patients souffrant de douleurs chroniques qui subissent une chirurgie dorsale, il a été démontré que la kétamine réduisait les scores de douleur et la consommation d’opiacés à différents moments après l’intervention.18 Elle peut même s’avérer bénéfique chez les patients n’ayant jamais pris d’opiacés qui subissent des interventions avec des suites opératoires douloureuses.19 Le Tableau 2 récapitule quelques plages posologiques de la kétamine couramment utilisées.
Tableau 2. Suggestions d’administration30,35,36
| Voie | Plage posologique |
| Induction de l’anesthésie | 1–2 mg/kg |
| Dose de charge (pour la sédation et l’analgésie) | 0,1–0,5 mg/kg administré sur 60 secondes pour éviter une dépression respiratoire et une réponse sympathique |
| Bolus/dose supplémentaire | 0,1–0,5 mg/kg selon le besoin |
| Sédation/analgésie (pour les patients intubés) | 5–30 mcg/kg/min |
| Analgésie (pour les patients non intubés) | 1–5 mcg/kg/min |
| Dépression résistante au traitement | 0,5 mg/kg en 40 minutes |
L’utilisation de la kétamine dans le cadre d’une anesthésie neuraxiale a fait l’objet de controverses en raison du potentiel de neurotoxicité causée par les conservateurs et d’apoptose directe des cellules neuronales.20 Toutefois, les deux étiologies ont été constatées uniquement dans des modèles animaux particuliers,21,22 et des études plus récentes n’ont pas démontré de neurotoxicité cliniquement pertinente chez les humains.23 Cela a conduit à plusieurs études sur le rôle de la kétamine dans le blocage de l’évolution de la douleur du moignons après une amputation24 et la réduction de la douleur après une thoracotomie.25
La kétamine est souvent utilisée par des services de traitement des douleurs aiguës lorsque la douleur postopératoire n’est pas soulagée par une analgésie contrôlée par le patient basée sur des opiacés courants. Les patients non chirurgicaux qui présentent une exacerbation de douleurs aiguës ou chroniques, telles que des crises vaso-occlusives liées à la drépanocytose, peuvent également être soulagés par la kétamine.26 La posologie est généralement plus faible, avec des perfusions inférieures à 0,3 mg/kg/h, avec ou sans bolus. L’ajout de kétamine en perfusion peut réduire la consommation d’opiacés et faciliter la transition de la pompe de délivrance des opiacées à une administration par voie orale. Il existe désormais des données qui suggèrent que les solutions contenant de la kétamine administrée par pompe (1 à 5 mg/bolus) peuvent améliorer le contrôle de la douleur et réduire la consommation d’opiacés.27
Considérations de sécurité
Les contre-indications à la kétamine comprennent la grossesse, une insuffisance hépatique, une maladie coronarienne grave et une psychose (Tableau 3). L’élévation de la PIC, telle qu’elle est décrite ci-dessus, ne survient pas chez les patients sédatés et ventilés. Une élévation de la pression intraoculaire (PIO) est une contre-indication souvent citée dans des études anciennes.28 Cependant des études plus récentes suggèrent une fluctuation minime de la PIO.29 Il est suggéré que le mécanisme est dû aux modifications du tonus des muscles extra-oculaires.28
Tableau 3. Indications/contre-indications
| Indications |
Analgésie
|
| Exacerbation de douleurs aiguë ou chroniques |
| Sédation (ventilation mécanique) |
| Sédation procédurale |
| Intubation en séquence rapide |
| Dépression résistante au traitement |
| Contre-indications |
| Psychose |
| Toxicomanie active |
| Insuffisance hépatique sévère |
| Maladie coronarienne grave |
| Hypertension mal contrôlée |
Lors d’une administration pendant une opération, il convient d’appliquer le monitorage standard préconisé par l’American Society of Anesthesiologists (ASA), que la kétamine soit utilisée comme anesthésique unique ou en complément d’un autre anesthésique. La kétamine en doses subanesthésiques présente encore des risques d’atteinte à la respiration, de perturbations cardiovasculaires et d’effets psychomimétiques. Dans le cadre de soins aigus, il faudra disposer de tensiomètres, d’électrocardiographes et d’oxymètres de pouls. D’après les recommandations par consensus sur l’utilisation de la kétamine intraveineuse pour les douleurs chroniques de l’American Society of Regional Anesthesia and Pain Medicine (ASRA), l’American Academy of Pain Medicine (AMPA) et l’American Society of Anesthesiologists (ASA),30 les médecins responsables de la surveillance doivent être certifiés en techniques avancées de réanimation cardiorespiratoire (ACLS) et remplir les critères de l’ASA en matière de sédation modérée. Les personnes qui administrent de la kétamine doivent être titulaires au minimum d’un diplôme d’infirmier(ière), avoir suivi une formation en sédation modérée et pharmacologie de la kétamine, et être certifiées ACLS.
La kétamine comme anti-dépresseur
La kétamine est le composé racémique d’eskétamine et d’arkétamine, respectivement énantiomère positif (S+) et négatif (R-) de la kétamine racémique. En mars 2019, l’intérêt du monde scientifique et du grand public pour la kétamine a explosé lorsque la FDA a approuvé l’eskétamine comme anti-dépresseur de premier rang pour la gestion des dépressions résistantes aux traitements.31
Les propriétés robustes de prévention du suicide et de la dépression de la kétamine sont démontrées.32 Toutefois, en tant qu’antidépresseur, elle peut avoir des effets extrêmement différents à diverses concentrations sériques, et ses effets peuvent ne pas suivre les courbes dose-réponse standard. À des doses très supérieures aux doses d’induction d’anesthésie, l’effet antidépresseur de la kétamine ne semble pas être supérieur aux doses subanesthésiques. En fait, il ressemble à d’autres médicaments psychiatriques, tels que la trazadone, un médicament courant au mécanisme d’action multiple, qui fonctionne comme sédatif à des doses inférieures à 150 mg mais comme antidépresseur à des doses supérieures à 150 mg.33
Le mécanisme d’action de prévention du suicide et de la dépression de la kétamine peut être dû aux concentrations de glutamate sérique après l’activation des récepteurs AMPA. En règle générale, les cliniciens des centres universitaires qui administrent de la kétamine intraveineuse aux patients pour traitement de la dépression ont préconisé, jusqu’à très récemment, une posologie de 0,5 mg/kg sur 40 minutes (Tableau 2).34 Cette tendance reflète la prépondérance de la recherche à cette dose, qui correspond à une concentration sérique de l’ordre de 2000–3000 ng/mL. Généralement, les traitements sont administrés une à trois fois par semaine. Cependant, les protocoles de la kétamine ne sont pas largement communiqués et il existe diverses posologies dans différents centres, la recherche et l’expérience pratique suggérant l’utilité d’augmenter les doses avec précaution.
À l’image des recommandations de l’Anesthesia Society,30,36 l’American Psychiatric Association recommande que les soignants qui administrent la kétamine en soins ambulatoires soient certifiés ACLS.34 En raison de la faible probabilité que la kétamine provoque des troubles respiratoires à faibles doses, elle est perçue comme un médicament relativement « sans danger » à faibles doses. Alors qu’on constate souvent les effets sympathomimétiques (élévation de la fréquence cardiaque et de la tension artérielle) à des doses d’induction de l’anesthésie, ces changements sont rares à des doses subanesthésiques.35 Le monitorage pendant la sédation devrait comprendre, au minimum, des contrôles continus de l’oxymétrie et de la tension artérielle toutes les dix minutes.35 De même, lorsqu’elle est utilisée dans le cadre d’idéation suicidaire ou de forte dépression, les effets psychiatriques, aussi bien à court terme qu’à long terme, devront être suivis et gérés pour assurer la sécurité du patient.34 Avant le traitement, les patients sont interrogés afin d’évaluer leurs symptômes de départ et réponses au traitement. Après la perfusion, les patients récupèrent généralement pendant un délai de 30 minutes à 2 heures avant de partir accompagnés. Il convient de noter que ces recommandations sont spécifiques à notre établissement et qu’il est probable que d’autres établissements aient choisi d’autres protocoles de monitorage et de traitement. Il faudra d’autres recommandations fondées sur les faits avant de pouvoir adopter plus globalement un ensemble spécifique de directives.
Conclusion
La kétamine est un médicament ancien qui fait l’objet d’un regain d’intérêt parmi les cliniciens dans le cadre de la médecine périopératoire et de la gestion de la dépression. Avec le nombre croissant de patients qui souffrent de douleurs chroniques et qui nécessitent une gestion de la douleur sans opiacés et l’évolution de son utilité à des doses minimes dans le traitement de la dépression et potentiellement d’autres troubles psychiatriques, cet ancien médicament présente désormais de nouvelles applications pour la prise en charge des patients. Néanmoins, d’autres études sont attendues sur le monitorage approprié de l’administration de ce médicament dans un cadre postopératoire et de soins ambulatoires.
Le Dr. Kung est résident en anesthésiologie du Massachusetts General Hospital, Boston, Massachusetts.
Le Dr. Meisner est directeur médical du Service Kétamine de l’Hôpital McClean de Belmont, Massachusetts et assistant en psychiatrie au Massachusetts General Hospital, Boston, Massachusetts.
Le Dr. Berg est professeur-assistant d’anesthésiologie au Massachusetts General Hospital, Boston, Massachusetts.
Le Dr. Ellis est enseignant en anesthésiologie au Massachusetts General Hospital, Boston, Massachusetts.
Drs Kung, Berg et Ellis ne signalent aucun conflit d’intérêts en lien avec cet article. Le Dr. Meisner a siégé à des comités consultatifs pour Janssen Pharmaceutical.
Documents de référence
- Maddox VH, Godefroi EF, Parcell RF. The synthesis of phencyclidine and other 1-arylcyclohexylamines. J Med Chem. 1965;8:230–235.
- Domino EF, Chodoff P, Corssen G. Pharmacologic effects of CI-581, a new dissociative anesthetic, in man. Clin Pharmacol Ther. 1965;6:279–291.
- Mion G. History of anaesthesia. Clin Pharmacol Ther. 2017;34: 571–575.
- Persson J. Wherefore ketamine? Curr Opin Anaesthesiol. 2010;23:455–460.
- Mathews MJ, Mead RN, Galizio, M. Effects of N-Methyl-D-aspartate (NMDA) antagonists ketamine, methoxetamine, and phencyclidine on the odor span test of working memory in rats. Exp Clin Psychopharmacol. 2018;26:6–17.
- Kohrs R, Durieux ME. Ketamine. Anesth Analg. 1998;87,
1186–1193. - Agrawal A, Goyal S. Ketamine in status asthmaticus: a review. Indian J Crit Care Med. 2013;17:154–161.
- Akeju O, Song AH, Hamilos AE, et al. Electroencephalogram signatures of ketamine anesthesia-induced unconsciousness. Clin Neurophysiol. 2016;127: 2414–2422.
- Gardner AE, Dannemiller FJ, Dean D. Intracranial cerebrospinal fluid pressure in man during ketamine anesthesia. Anesth Analg. 1972;51:741–745.
- Gardner AE, Olson BE, Lichtiger M. Cerebrospinal-fluid pressure during dissociative anesthesia with ketamine. Anesthesiology. 1971;35:226–228.
- Wang X, Ding X, Tong Y, et al. Ketamine does not increase intracranial pressure compared with opioids: meta-analysis of randomized controlled trials. J Anesth. 2014;28:821–827.
- Chang LC, Raty SR, Ortiz J, et al. The emerging use of ketamine for anesthesia and sedation in traumatic brain injuries. CNS Neurosci Ther. 2013;19:390–395.
- Zeiler FA, Teitelbaum J, West M, et al. The ketamine effect on ICP in traumatic brain injury. Neurocrit Care. 2014;21: 163–173.
- Zeiler FA, Teitelbaum J, West M, Gillman LM. The ketamine effect on intracranial pressure in nontraumatic neurological illness. J Crit Care. 2014;29:1096–1106.
- Fact file on ketamine. (2016, March). Retrieved from https://www.who.int/medicines/news/20160309_FactFile_Ketamine.pdf?ua=1.
- Sheikh S, Phyllis H. The expanding role of ketamine in the emergency department. Drugs. 2018;78:727–735.
- Nielsen RV, Fomsgaard JS, Siegel H, et al. Intraoperative ketamine reduces immediate postoperative opioid consumption after spinal fusion surgery in chronic pain patients with opioid dependency. Pain. 2017;158:463–470.
- Loftus RW, Yeager MP, Clark JA, et al. Intraoperative ketamine reduces perioperative opiate consumption in opiate-dependent patients with chronic back pain undergoing back surgery. Anesthesiology. 2010;113:639–646.
- Laskowski K, Stirling A, McKay WP, Lim HJ. A systematic review of intravenous ketamine for postoperative analgesia. Can J Anaesth. 2011;58:911–923.
- Schmid R, Katz J. Neural toxicity of ketamine and other NMDA antagonists. Pain. 2000;88:312.
- Borgbjerg FM, Svennson BA, Frigast C, Gordh T Jr., Histopathology after repeated intrathecal injections of preservative-free ketamine in the rabbit: a light and electron microscopic examination. Anesth Analg. 1994;79:105–111.
- Olney JW, Labruyere J, Price MT. Pathological changes induced in cerebrocortical neurons by phencyclidine and related drugs. Science. 1989;244:1360–1362.
- Subramaniam K, Subramaniam B, Steinbrook RA. Ketamine as adjuvant analgesic to opioids: a quantitative and qualitative systematic review. Anesth Analg. 2004;99:482–495.
- Wilson JA, Nimmo AF, Fleetwood-Walker SM, et al. A randomised double blind trial of the effect of pre-emptive epidural ketamine on persistent pain after lower limb amputation. Pain. 2008;135:108–118.
- Feltracco P, Barbieri S, Rizzi S, et al. Perioperative analgesic efficacy and plasma concentrations of s( )-ketamine in continuous epidural infusion during thoracic surgery. Anesth Analg. 2013;116:1371–1375.
- Puri L, Morgan KJ, Anghelescu DL. Ketamine and lidocaine infusions decrease opioid consumption during vaso-occlusive crisis in adolescents with sickle cell disease.Curr Opin Support Palliat Care. 2019;13:402–407.
- Wang L, Johnston B, Kaushal A, et al. Ketamine added to morphine or hydromorphone patient-controlled analgesia for acute postoperative pain in adults: a systematic review and meta-analysis of randomized trials. Can J Anaesth. 2016;63:311–325.
- Yoshikawa K, Murai Y. The effect of ketamine on intraocular pressure in children. Anesth Analg. 1971;50:199–202.
- Drayna PC, Estrada C, Wang W, et al. Ketamine sedation is not associated with clinically meaningful elevation of intraocular pressure. Am J Emerg Med. 2012;30:1215–1218.
- Cohen SP, Bhatia A, Buvanendran A, et al. Consensus guidelines on the use of intravenous ketamine infusions for chronic pain from the American Society of Regional Anesthesia and Pain Medicine, the American Academy of Pain Medicine, and the American Society of Anesthesiologists. Reg Anesth Pain Med. 2018;43:521–546.
- Kim J, Farchione T, Potter A, et al. Esketamine for treatment-resistant depression—first FDA-approved antidepressant in a new class. NEJM. 2019;381:1–4.
- Ionescu DF, Swee MB, Pavone KJ, et al. Rapid and sustained reductions in current suicidal ideation following repeated doses of intravenous ketamine secondary analysis of an open label study. J Clin Psychiatry. 2016;77:e7-19-25.
- Stahl SM. Mechanism of action of trazodone: a multifunctional drug. CNS Spectr. 2009;14:536–546.
- Sanacora G, Frye MA, Mcdonald W, et al. A Consensus Statement on the Use of Ketamine in the Treatment of Mood Disorders. JAMA Psychiatry. 2017;74:399.
- Riva-Posse P, Reiff CM, Edwards JA, et al. Blood pressure safety of subanesthetic ketamine for depression: a report on 684 infusions. J Affect Disord. 2018;236:291–297.
- Schwenk ES, Viscusi ER, Buvanendran A, et al. Consensus guidelines on the use of intravenous ketamine infusions for acute pain management from the American Society of Regional Anesthesia and Pain Medicine, the American Academy of Pain Medicine, and the American Society of Anesthesiologists. Reg Anesth Pain Med. 2018:43:456-466.


 Issue PDF
Issue PDF