Cada vez hay más pruebas que apoyan la asociación entre la IOH y los resultados posoperatorios negativos, siendo los más significativos el daño renal agudo (AKI), la lesión miocárdica después de una cirugía no cardíaca y la mortalidad. Estudios recientes también muestran asociaciones entre la IOH y el delirio, los derrames cerebrales y las readmisiones. Las complicaciones asociadas a la IOH tienen consecuencias de gran alcance para los pacientes y el sistema de salud. La IOH es un riesgo modificable y la forma de abordarlo es muy variable en la práctica, algo que no podemos seguir tolerando.
Una solicitud habitual de los pacientes a los profesionales de la anestesia es: “Cuídeme bien”. Aunque podemos responder con confianza “lo haré”, muchos anestesiólogos pueden no ser conscientes del creciente número de estudios que relacionan la hipotensión intraoperatoria (HIO) con la morbilidad y mortalidad de los pacientes. Cada vez hay más pruebas que apoyan la asociación entre la HIO y los resultados posoperatorios negativos, siendo los más significativos el daño renal agudo (LRA), la lesión miocárdica después de una cirugía no cardiaca y la mortalidad1-9. Estudios recientes también muestran asociaciones entre la HIO y el delirio, los accidentes cerebrovasculares y los reingresos1,4,9-11. Las complicaciones asociadas a la HIO tienen consecuencias de gran alcance para los pacientes y el sistema de atención médica. El daño renal agudo por sí solo se asocia a la aparición de otras complicaciones, como accidentes cerebrovasculares, lesiones miocárdicas, enfermedad renal crónica y mortalidad hospitalaria y al cabo de un año, así como a un aumento del tiempo de hospitalización, del uso de recursos médicos y de los costos de la atención médica4,12,13. Los anestesiólogos pueden no ser conscientes de estos resultados alarmantes, sobre todo si no reciben información sobre los resultados posoperatorios. Las pruebas sugieren que debemos reducir la HIO para evitar daños a los pacientes.
La hipotensión intraoperatoria puede definirse como la presión sanguínea (BP) por debajo de un “umbral seguro” que provoca una hipoperfusión de los órganos1-9. La incidencia de la HIO varía en función de la definición usada, que puede implicar una reducción de la presión sanguínea y la duración de la reducción. Un estudio evaluó la relación entre la HIO y los resultados de la LRA y la lesión miocárdica2. Para definir la HIO, evaluaron tanto una reducción relativa con respecto al valor basal (es decir, un 20 % por debajo de la BP preoperatoria) como un umbral absoluto. Descubrieron que los umbrales absolutos y relativos permitían diferenciar de forma comparable a los pacientes con lesión miocárdica o daño renal de los que no la padecían, lo que sugiere que puede usarse un umbral absoluto. Las presiones arteriales medias (PAM), equivalentes a menos de 65 mm Hg por un minuto, se asociaron a un riesgo elevado de LRA y de lesión miocárdica2. El riesgo de desarrollar LRA y lesión miocárdica aumentaba en función de la duración de la HIO2. Este descubrimiento llevó a definir la HIO como una PAM inferior a 65 mm Hg por al menos un minuto2.
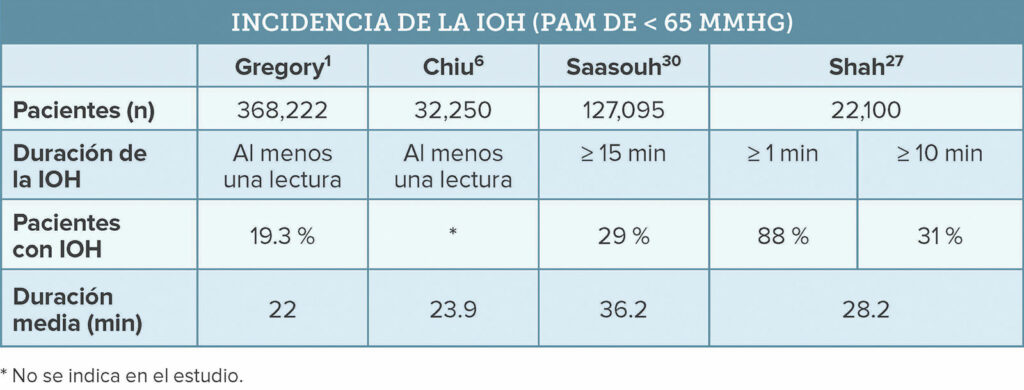
Una revisión de la literatura disponible sobre HIO publicada entre 2017 y finales de 2022, junto con estudios recientes relevantes, sugiere que las definiciones más comunes de HIO se refieren a cualquier PAM inferior a 65 mm Hg1,4,6,10,14-18 o una PAM inferior a 65 mm Hg por al menos un minuto8,10,19-26. Con este umbral absoluto de PAM, la HIO es muy frecuente. Un reciente estudio observacional retrospectivo hecho entre varios centros y en el que participaron más de 22,000 pacientes informó de que el 88 % de los pacientes de cirugías no cardíacas experimentaron al menos un episodio de HIO con una duración media de 28.2 minutos (Tabla 1)27. Los autores observaron variaciones significativas en el tratamiento de la HIO en los once centros médicos participantes en el estudio, lo que indica que existen diferencias en la tolerancia de la HIO entre los proveedores27.
Tabla 1. Comparación de la incidencia de la IOH entre cuatro estudios
Los Centros de Servicios de Medicare y Medicaid (CMS) reconocen una nueva medida de calidad de la HIO, definida como una PAM inferior a 65 mm Hg por más de 15 minutos, como criterio en el Sistema de Pago de Incentivos Basado en el Mérito (MIPS)28. Una puntuación global más baja de la HIO significa que se ha pasado menos tiempo bajo la PAM definida28. La puntuación del MIPS se obtiene a partir de mediciones de calidad, actividades de mejora, fomento de la interoperabilidad y gastos. La medida ePreop31 es una de las seis medidas de anestesia que pueden presentarse para la parte de calidad de la puntuación del MIPS28,29. La puntuación final del MIPS determina el ajuste de pago aplicado a las reclamaciones de la Parte B de Medicare29. Un estudio reciente en el que se usó la definición de HIO del MIPS de los CMS reveló que la incidencia de HIO en la práctica anestésica comunitaria era del 29 % en procedimientos no cardíacos30. Este estudio encontró una incidencia de HIO variable entre el personal clínico, lo que se suma a las pruebas que apoyan la necesidad de reducir la variación de la práctica en el tratamiento de la HIO14,30,31. Los autores consideraron la HIO como un riesgo modificable y sugirieron adoptar iniciativas de mejora de la calidad para reducir la tolerancia a la HIO30.
Un tema frecuente, independientemente de la definición de la IOH, es que los grados más graves de hipotensión y una mayor duración de la hipotensión acumulada se relacionan con un mayor riesgo de morbilidad y mortalidad del paciente. Muchos estudios muestran que una MAP PAM de < 65 mmHg en períodos prolongados, o cualquier período de una MAP PAM de ≤ 55 mmHg, se relaciona con un mayor riesgo de resultados negativos1-3,9,16,17,32. Por lo tanto, solo debemos reducir la aparición, la gravedad y la duración de la IOH.
Esto podría ser difícil cuando se usa el monitoreo de la oscilometría intermitente de la presión sanguínea (IOBP) tradicional con un manguito. Las preocupaciones con el monitoreo de la IOBP incluyen el retraso o la falta de detección de los cambios en la presión sanguínea o episodios de hipotensión, falta de precisión durante los extremos hemodinámicos y sobreestimación de la presión sanguínea durante la hipotensión que da lugar a episodios más graves de lo esperado19,33. La posibilidad de que no se detecten eventos de hipotensión con el monitoreo de la IOBP varía según la frecuencia de las mediciones elegidas o la configuración predeterminada en el monitor fisiológico. En un estudio reciente, se descubrió que las frecuencias más habituales para las mediciones de la IOBP elegidas eran cada dos a cinco minutos25. Estas infrecuencias permiten la acumulación no detectada de minutos de hipotensión entre mediciones, lo que podría aumentar el riesgo del paciente de sufrir daños y esto podría haberse reducido con el monitoreo continuo15,19,25.
Nuevos estudios respaldan el uso del monitoreo continuo de la presión sanguínea y promocionan varios beneficios sobre la IOBP, incluyendo una menor variabilidad de la presión sanguínea16, una mejor estabilidad hemodinámica33, la detección de episodios de hipotensión no detectados por la IOBP19, un reconocimiento y tratamiento anticipados de la IOH15,25 y reducciones generales de la IOH15,19,25,33. El monitoreo continuo de la presión sanguínea se puede lograr de manera invasiva con el monitoreo intraarterial de la presión sanguínea, pero conlleva riesgos, como infección, daño a los nervios, trombos y pseudoaneurisma25. El monitoreo continuo de la presión sanguínea de manera no invasiva con un manguito para el dedo evita los riesgos relacionados con las líneas arteriales invasivas y, al mismo tiempo, da valores de la MAP comparables25,33. Las limitaciones de esta tecnología incluyen costos adicionales comparados con la oscilometría intermitente y la posibilidad de una menor precisión en pacientes adultos mayores o con aterosclerosis25,34,35. En el manguito no invasivo para el dedo que se especifica en estudios recientes, se emplea una tecnología de abrazadera de volumen en la que se usa presión variable del manguito sobre las arterias del dedo para mantener un volumen constante25,33. La presión sanguínea arterial del dedo se reconstruye en una forma de onda arterial, lo que permite el análisis de la onda del pulso, que ofrece variables hemodinámicas avanzadas (p. ej., volumen sistólico, gasto cardíaco, variación del volumen sistólico) útiles para determinar la causa de la IOH25. Un manguito no invasivo para el dedo puede ser una opción adecuada para el monitoreo continuo de la presión sanguínea cuando no se necesitan muestras de sangre arterial en el procedimiento quirúrgico33.
El personal clínico debe reducir la aparición, la gravedad y la duración de la IOH
El manejo inadecuado de líquidos y vasopresores podría causar hipoperfusión de órganos y lesión de órganos terminales, lo que enfatiza la importancia de estrategias intencionales para evitar estos problemas1,3,6,7,12,32. Ariyarathna et al. describieron una relación entre el uso elevado de vasopresores y la LRA postoperatoria, independientemente de la IOH12. En otro estudio, se sugirió que la implementación de la restricción de líquidos con su protocolo ERAS se asoció con aumentos considerables en la hipotensión postoperatoria31. En este estudio, las personas con hipotensión postoperatoria también tuvieron IOH considerable y recibieron menos líquidos intraoperatorios totales. En un reciente estudio retrospectivo multicéntrico de cinco años entre instituciones del Multicenter Perioperative Outcomes Group (MPOG) de más de 32,000 pacientes a los que les hicieron una cirugía abdominal, se observaron mayores tasas de LRA a pesar de una reducción general de la IOH6. Además, descubrieron una disminución en la administración de líquidos intraoperatoria y un mayor uso de vasopresores que se relacionaron con una mayor incidencia de LRA. Cuando la administración de cristaloides aumentó de uno a diez mililitros por kilogramo por hora (ml/kg/h), observaron una disminución del 58 % en el riesgo de la LRA. Estos conmovedores resultados respaldan el concepto fisiológico de que de depender de vasopresores para mantener la presión sanguínea mientras se reduce la administración de líquidos podría disminuir la perfusión esplácnica y renal ya comprometida y potencialmente causar daño iatrogénico en forma de íleo, náuseas y vómitos postoperatorios, infecciones en el lugar de la intervención y LRA6,7,12,36.
Las causas de la IOH se deben a varios factores e incluyen reducción de la contractilidad miocárdica, vasodilatación, hipovolemia, bradicardia, compresión extrínseca de las cavidades cardíacas (p. ej., derrame pericárdico o neumotórax) o un “tipo mixto” explicado por diversas alteraciones hemodinámicas8,18. El uso de monitores que indican variables hemodinámicas avanzadas (p. ej., volumen sistólico, gasto cardíaco, variación del volumen sistólico) podría ser conveniente para prevenir, diagnosticar y tratar la hipotensión8. Después, las intervenciones podrían dirigirse a la causa fundamental de la IOH mediante una estrategia de terapia dirigida por objetivos (GDT), en lugar de simplemente mejorar el número de la MAP que se muestra en el monitor fisiológico.
El término GDT podría conceptualizarse como un término general que especifica la administración óptima, en el momento más apropiado, de líquidos, inotrópicos y vasopresores mediante un monitor hemodinámico avanzado. Las intervenciones intraoperatorias dentro de una estrategia de GDT se dirigen a criterios de valoración u objetivos específicos para optimizar el suministro de oxígeno a los tejidos y prevenir la hipoperfusión de órganos (Figura 1)5,17. El monitor hemodinámico se usa para evaluar la capacidad de respuesta del paciente a estas intervenciones. La fluidoterapia dirigida por objetivos (GDFT) fue la primera y más habitualmente conocida versión del concepto moderno de GDT. El monitor hemodinámico avanzado se usa para identificar la dependencia de la precarga, ayudar en la decisión de tratar con bolos de líquido para optimizar la posición del paciente en la curva de Frank-Starling y después evaluar la capacidad de respuesta a los líquidos7,17. En la declaración del consenso de la Iniciativa de Calidad Perioperatoria (POQI) de 2020 sobre el manejo de líquidos, se afirmó que el método más seguro y eficaz para guiar la terapia con líquidos es evaluar la capacidad de respuesta a los mismos7. Además, optimizar el SV con líquidos da lugar a una mejor perfusión gastrointestinal y menos complicaciones, lo que indica la importancia de un volumen circulante y una perfusión intestinal adecuados36. La terapia hemodinámica dirigida por objetivos (GDHT), otro componente de la GDT, mejoró la estrategia original de la GDFT por la incorporación del mantenimiento de la PAM para evitar la IOH en el protocolo17. Las estrategias de la GDT que incorporan una optimización hemodinámica se relacionan con reducciones considerables de la morbilidad y la mortalidad5,11,32. En la Figura 1, se muestra el concepto de GDT moderno que abarca los componentes de su primera repetición de la GDFT, después la GDHT, que incorpora la imagen completa de la perfusión.
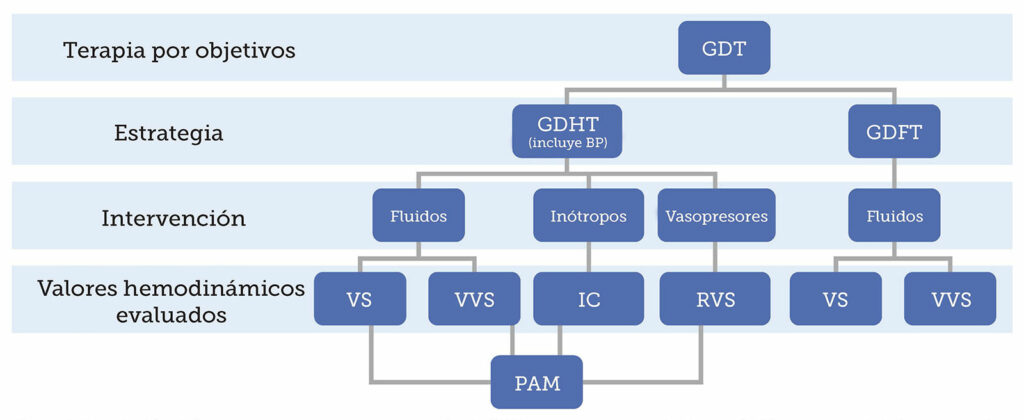
Figura 1. Descripción de los componentes de una estrategia de GDT, como consecuencia de una fusión conceptual de las estrategias de GDHT y GDFT, junto con valores hemodinámicos que guían intervenciones específicas.
Terapia dirigida con objetivos; GDHT: Terapia hemodinámica dirigida con objetivos; GDFT: Fluidoterapia dirigida con objetivos; SV: Volumen sistólico;
SVV: Variación del volumen sistólico; CI: Índice cardíaco; RVS: Resistencia vascular sistémica; MAP: Presión arterial media
Diversos estudios que usan monitoreo hemodinámico avanzado con un protocolo de la GDT destinado a determinar tratamientos adecuados específicos para las causas de la IOH y optimizar la hemodinámica mostraron reducciones considerables en las complicaciones postoperatorias5,11,24,32. En un estudio, se encontró que el uso de un protocolo de GDHT redujo las complicaciones y la duración de la estancia en el hospital (LOS) en pacientes quirúrgicos de riesgo bajo a moderado en el histórico ensayo FEDORA5. Otro estudio incluyó pacientes de alto riesgo a los que les hicieron una cirugía importante y también se usó un protocolo de GDHT. Gracias a este ensayo, se obtuvo una reducción en la disfunción postoperatoria de los órganos32. Una fortaleza de este estudio posterior fue el algoritmo hemodinámico protocolizado que se usó para guiar la administración de líquidos para optimizar el volumen sistólico, manteniendo así el volumen intravascular y la presión de perfusión de los órganos y dando protección contra la hipoperfusión. En un estudio de pacientes adultos mayores a los que les hicieron una cirugía de columna, el uso de un protocolo de GDT resultó en menos IOH, náuseas y vómitos postoperatorios y delirio en el grupo de GDT comparado con el grupo de control11. Además, según otros estudios en los que se usó un protocolo de GDT, hubo reducciones en la IOH, lo que respalda aún más el uso de protocolos para guiar la atención destinada a tratar las causas de la IOH21,23,24. Se demostró que la GDT beneficia a diversos pacientes, incluyendo pacientes de riesgo bajo, moderado y alto.
La IOH es un problema grave de salud pública
En el artículo de 2021 sobre la relación de la IOH y los resultados adversos, la IOH se describió como un “problema grave de salud pública” que no es tolerable para ningún grupo de edad ni en ningún momento1. Por el tamaño de la población en riesgo de exposición a la IOH, los autores recomendaron urgentemente futuras investigaciones centradas en su prevención. El manejo hemodinámico tradicional se basa en el tratamiento reactivo de la IOH después de que ocurre, que es demasiado tarde porque ya está causando daño a los órganos20. En un artículo del boletín informativo de la APSF de 2021, Sessler se refirió a los beneficios de predecir la IOH con avances tecnológicos recientes basados en inteligencia artificial y aprendizaje automático37. Desde entonces, se publicaron varios estudios que validan el uso de nueva tecnología para predecir y reducir con precisión la IOH8,20-23,26. Una de esas tecnologías disponibles para predecir la probabilidad de una IOH inminente, junto con su causa fundamental, usa un parámetro llamado índice de predicción de la hipotensión (HPI). El HPI establece un número sin unidades en una escala de cero a 100, que indica la probabilidad de que ocurra un evento de hipotensión38. El uso de la información que provee el monitor sobre la causa subyacente de la IOH inminente permite al profesional clínico intervenir adecuadamente con tratamientos específicos, evitando así la IOH. En una revisión sistemática de ensayos controlados aleatorios en la que se evalúa la capacidad del HPI para reducir la IOH, los autores afirmaron que el HPI tiene el potencial de reducir la aparición, la duración y la gravedad de la IOH durante la cirugía no cardíaca, pero enfatizaron la importancia del cumplimiento protocolizado del tratamiento cuando se usa la tecnología22. Este resultado respalda aún más la función de la reducción de la variación de la práctica en la reducción de la incidencia de la IOH.
Los profesionales de la anestesia se esfuerzan por dar una excelente atención anestésica a sus pacientes, pero es posible que desconozcan las consecuencias potencialmente perjudiciales de su manejo hemodinámico. Como afirmaron contundentemente Gregory y sus colegas, la IOH es un “problema de seguridad pública” que debe reducirse1. Un método paso a paso podría ayudar a lograr este objetivo. En la Figura 2, se mencionan los próximos pasos que sugieren los autores de este artículo incorporando recomendaciones de consenso y mejores prácticas de la APSF publicadas recientemente39.
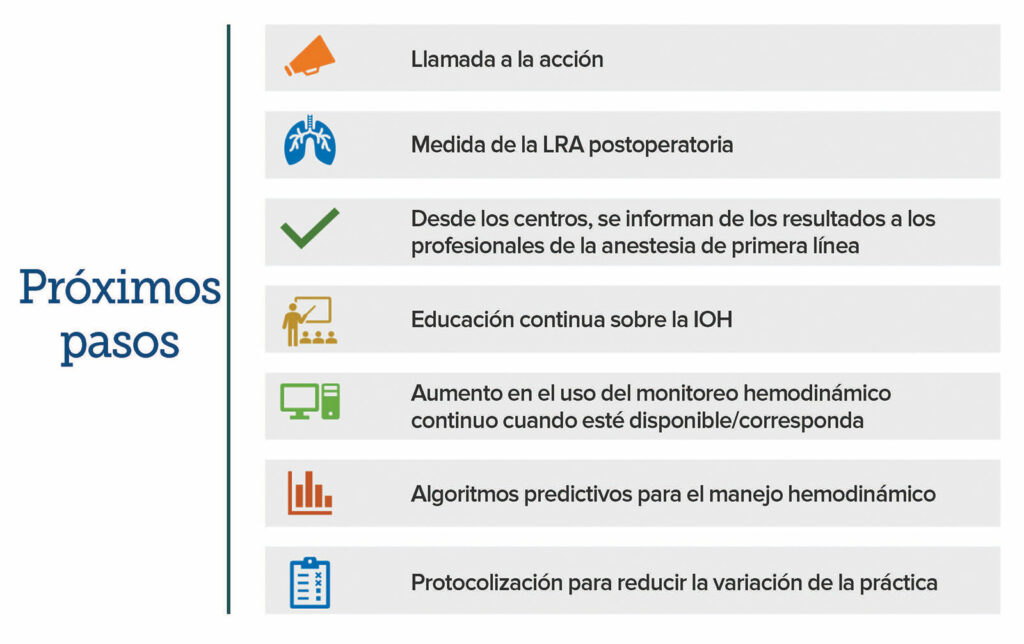
Figura 2. Próximos pasos sugeridos para los profesionales de la anestesia. En la figura, se incorporan recomendaciones del consenso publicadas recientemente y mejores prácticas de la APSF para ayudar a lograr el objetivo de reducir la IOH y los daños relacionados causados al paciente39.
LRA: daño renal agudo; IOH: hipotensión intraoperatoria.
Debemos reconocer que la IOH es un problema frecuente y crear conciencia entre los colegas mediante la educación y el monitoreo y seguimiento de los resultados postoperatorios, como la LRA y la lesión miocárdica después de una cirugía no cardíaca. Debemos monitorear continuamente con tecnologías hemodinámicas avanzadas cuando sea pertinente para evitar la IOH no detectada. Debemos manejar de forma adecuada la hemodinámica equilibrando la circulación para corregir el problema (p. ej., el protocolo de GDT), en lugar de tratar el número en el monitor con vasopresores. La IOH es un riesgo modificable que simplemente no deberíamos seguir tolerando.
Amy Yerdon, DNP, MNA, CRNA, CNE, CHSE, es profesora adjunta en la Facultad de Enfermería de la University of Alabama en Birminghamen y directora adjunta del Programa de Enfermería de Anestesia de Birmingham, AL.
D. Matthew Sherrer, MD, MBA, FASA, FAACD es profesor adjunto en la University of Alabama en Birmingham, Departamento de Anestesiología y Medicina Perioperatoria, Birmingham, AL.
Desiree Chappell, MSNA, CRNA, FAANA, es vicepresidenta de calidad clínica de Northstar Anesthesia, Louisville, KY.
Amy Yerdon, DNP, MNA, CRNA, es miembro de la oficina del portavoz de Edwards Lifesciences. D. Matthew Sherrer, MD, MBA, FASA, FAACD, no tiene conflictos de intereses. Desiree Chappell, MSNA, CRNA, FAANA, es la jefa de redacción y presentadora principal de TopMedTalk, miembro de la oficina del portavoz de Edwards Lifesciences y Medtronic, y miembro de la junta de asesores de Provation.
REFERENCIAS
- Gregory A, Stapelfeldt W, Khanna A, et al. Intraoperative hypotension is associated with adverse clinical outcomes after noncardiac surgery. Anesth Analg. 2021 ;132:1654–1665. PMID: 33177322.
- Salmasi V, Maheshwari K, Yang D, et al. Relationship between intraoperative hypotension, defined by either reduction from baseline or absolute thresholds, and acute kidney and myocardial injury after noncardiac surgery: a retrospective cohort analysis. Anesthesiology. 2017;126:47–65. PMID: 27792044.
- Wesselink E, Kappen T, Torn H, et al. Intraoperative hypotension and the risk of postoperative adverse outcomes: a systematic review. Br J Anaesth. 2018;121:706–721. PMID: 30236233.
- Stapelfeldt WH, Khanna AK, Shaw AD, et al. Association of perioperative hypotension with subsequent greater healthcare resource utilization. J Clin Anesth. 2021;75. PMID: 34536719.
- Calvo-Vecino JM, Ripollés-Melchor J, Mythen MG, et al. Effect of goal-directed haemodynamic therapy on postoperative complications in low–moderate risk surgical patients: a multicentre randomized controlled trial (FEDORA trial). Br J Anaesth. 2018;120:734–744.
- Chiu C, Fong N, Lazzaresch, D, et al. Fluids, vasopressors, and acute kidney injury after major abdominal surgery between 2015 and 2019: A multicentre retrospective analysis. Br J Anaesth. 2022;12:317–326. PMID: 29576114.
- Martin GS, Kaufman DA, Marik PE, et al. Perioperative Quality Initiative (POQI) consensus statement on fundamental concepts in perioperative fluid management: fluid responsiveness and venous capacitance. Perioper Med (Lond). 2020;9:1–12. PMID: 32337020.
- Ranucci M, Barile L, Ambrogi F, Pistuddi V. Surgical and Clinical Outcome Research (SCORE) Group. Discrimination and calibration properties of the hypotension probability indicator during cardiac and vascular surgery. Minerva Anestesiol. 2019;85:724–730. PMID: 30481996.
- Putowski Z, Czajka S, Krzych ŁJ. Association between intraoperative BP drop and clinically significant hypoperfusion in abdominal surgery: a cohort study. J Clin Med. 2021;10(21):5010. PMID: 34768530.
- Maheshwari K, Ahuja S, Khanna AK, et al. Association between perioperative hypotension and delirium in postoperative critically ill patients: a retrospective cohort analysis. Anesth Analg. 2020;130:636–643. PMID: 31725024.
- Zhang N, Liang M, Zhang D, et al. Effect of goal-directed fluid therapy on early cognitive function in elderly patients with spinal stenosis: a case-control study. Int J Surg. 2018;54:201–205. PMID: 29678619.
- Ariyarathna D, Bhonsle A, Nim J, et al. Intraoperative vasopressor use and early postoperative acute kidney injury in elderly patients undergoing elective noncardiac surgery. Ren Fail. 2022;44:648–659. PMID: 35403562.
- French WB, Shah PR, Fatani YI, et al. Mortality and costs associated with acute kidney injury following major elective, non-cardiac surgery. J Clin Anesth. 2022;82:110933. PMID: 35933842.
- Christensen AL, Jacobs E, Maheshwari K, et al. Development and evaluation of a risk-adjusted measure of intraoperative hypotension in patients having nonemergent, noncardiac surgery. Anesth Analg. 2021;133:445–454. PMID: 33264120.
- Maheshwari K, Khanna S, Bajracharya GR, et al. A randomized trial of continuous noninvasive BP monitoring during noncardiac surgery. Anesth Analg. 2018;127:424–431. PMID: 29916861.
- Park S, Lee HC, Jung CW, et al. Intraoperative arterial pressure variability and postoperative acute kidney injury. Clin J Am Soc Nephrol. 2020;15:35–46. PMID: 31888922.
- French WB, Scott M. Fluid and hemodynamics. Anesthesiol Clin. 2022;40:59–71. PMID: 35236583.
- Kouz K, Brockmann L, Timmermann LM, et al. Endotypes of intraoperative hypotension during major abdominal surgery: a retrospective machine learning analysis of an observational cohort study. Br J Anaesth. 2023;130:253–261. PMID: 36526483.
- Kouz K, Weidemann F, Naebian A, et al. Continuous finger-cuff versus intermittent oscillometric arterial pressure monitoring and hypotension during induction of anesthesia and noncardiac surgery: the DETECT Randomized Trial. Anesthesiology. 2023;139:298–308. PMID: 37265355.
- Frassanito L, Giuri PP, Vassalli F, et al. Hypotension Prediction Index with non-invasive continuous arterial pressure waveforms (ClearSight): clinical performance in gynaecologic oncologic surgery. J Clin Monit Comput. 2022;36:1325–1332. PMID: 34618291.
- Grundmann CD, Wischermann JM, Fassbender P, et al. Hemodynamic monitoring with Hypotension Prediction Index versus arterial waveform analysis alone and incidence of perioperative hypotension. Acta Anaesthesiol Scand. 2021;65:1404–1412. PMID: 34322869.
- Li W, Hu Z, Yuan Y, Liu J, Li K. Effect of hypotension prediction index in the prevention of intraoperative hypotension during noncardiac surgery: a systematic review. J Clin Anesth. 2022;83:110981. PMID: 36242978.
- Schneck E, Schulte D, Habig L, et al. Hypotension Prediction Index based protocolized haemodynamic management reduces the incidence and duration of intraoperative hypotension in primary total hip arthroplasty: a single centre feasibility randomised blinded prospective interventional trial. J Clin Monit Comput. 2020;34:1149–1158. PMID: 31784852.
- Wijnberge M, Geerts BF, Hol L, et al. Effect of a machine learning-derived early warning system for intraoperative hypotension vs standard care on depth and duration of intraoperative hypotension during elective noncardiac surgery: the HYPE randomized clinical trial. JAMA. 2020;323:1052–1060. PMID: 32065827.
- Wijnberge M, van der Ster B, Vlaar APJ, et al. The effect of intermittent versus continuous non-invasive BP monitoring on the detection of intraoperative hypotension, a sub-study. J Clin Med. 2022;11:4083. PMID: 35887844.
- Kouz K, Monge García MI, Cercutti E, et al. Intraoperative hypotension when using hypotension prediction index software during major noncardiac surgery: a European multicentre prospective observational registry (EU HYPROTECT). BJA Open. 2023;6:100140. PMID: 37588176.
- Shah N, Mentz G, Kheterpal S. The incidence of intraoperative hypotension in moderate to high risk patients undergoing non-cardiac surgery: a retrospective multicenter observational analysis. J Clin Anesth. 2020;66:1–12. PMID: 32663738.
- Provation. ePreop 31: Intraoperative hypotension (IOH) among non-emergent noncardiac surgical cases. 2020. https://www.provationmedical.com/wp-content/uploads/2022/08/ePreop-Provation_IOH_Specifications.pdf . Accessed March 2024.
- U.S. Centers for Medicare & Medicaid Services (CMS). Traditional MIPS overview. CMS Quality Payment Program. https://qpp.cms.gov/mips/traditional-mips. Accessed January 3, 3024.
- Saasouh W, Christensen AL, Xing F, et al. Incidence of intraoperative hypotension during non-cardiac surgery in community anesthesia practice: a retrospective observational analysis. Perioper Med (Lond). 2023;12:29. Published 2023 Jun 24. PMID: 37355641.
- Anolik RA, Sharif-Askary B, Hompe E, et al. Occurrence of symptomatic hypotension in patients undergoing breast free flaps: is enhanced recovery after surgery to blame? Plast Reconstr Surg. 2020;145:606–616. PMID: 32097291.
- Futier E, Lefrant JY, Guinot PG, et al. Effect of individualized vs standard BP management strategies on postoperative organ dysfunction among high-risk patients undergoing major surgery. JAMA. 2017;318:1346. PMID: 28973220.
- Meidert AS, Nold JS, Hornung R, et al. The impact of continuous non-invasive arterial BP monitoring on BP stability during general anaesthesia in orthopaedic patients: a randomised trial. Eur J Anaesthesiol. 2017;34:716–722. PMID: 28922340.
- Klose P, Lorenzen U, Berndt R, et al. Continuous noninvasive monitoring of arterial pressure using the vascular unloading technique in comparison to the invasive gold standard in elderly comorbid patients: a prospective observational study. Health Sci Rep. 2020;3:e204. PMID: 33204849.
- Maheshwari K, Buddi S, Jian Z, et al. Performance of the Hypotension Prediction Index with non-invasive arterial pressure waveforms in non-cardiac surgical patients. J Clin Monit Comput. 2021;35:71–78. PMID: 31989416.
- Davies SJ, Mythen M. Hemodynamic and intestinal microcirculatory changes in a phenylephrine corrected porcine model of hemorrhage. Anesth Analg. 2021;133:1060–1069. PMID: 33755645.
- Sessler D. Perioperative hypotension. APSF Newsletter. 2021;36:89–94. https://www.apsf.org/article/perioperative-hypotension/ . Accessed March 2024.
- Edwards Lifesciences. Acumen IQ sensor: minimally-invasive predictive decision support. https://www.edwards.com/healthcare-professionals/products-services/predictive-monitoring/acumen-iq-sensor. Accessed March 27, 2023.
- Scott MJ, and the APSF Hemodynamic Instability Writing Group. Perioperative patients with hemodynamic instability: consensus recommendations of the Anesthesia Patient Safety Foundation. Anesth Analg. 2024;138:713–724. PMID: 38153876.


 Issue PDF
Issue PDF