En una era de implementación casi completa de expedientes médicos electrónicos (EHR) y fusión de datos médicos entre departamentos e instituciones, surgió un reconocimiento creciente de la variación en las prácticas. El cuidado perioperatorio no es una excepción, ya que estudios recientes demuestran una amplia variación a nivel institucional tanto en prácticas como en las técnicas anestésicas empleadas1, los medicamentos administrados2,3 y los modelos de personal de quirófano usados4. En algunos casos, se justifica la variación en la práctica, como lo explican factores como la formación en subespecialidades, las limitaciones de los recursos médicos locales y las expectativas que informan los pacientes. Sin embargo, en otros casos, la variación no se explica o es injustificada y posiblemente se atribuya a una falta de análisis comparativo de la práctica, una asignación de recursos hospitalarios subóptima o una falta de atención precisa adaptada a las necesidades individuales de los pacientes5,6.
En algunos casos, dicha variación en la práctica podría asociarse con peores resultados, incluyendo los patrones de práctica de la proporción de personal profesional de la anestesia4, el cumplimiento de las prácticas de seguridad a nivel del hospital7 y las tasas de fracaso en el rescate.8
Para tratar la variación inexplicable o injustificada, las iniciativas modernas de mejora de la calidad (QI) y de investigación buscan cada vez más enfoques multicéntricos de sistemas de aprendizaje y salud, integrando pruebas de eficacia comparativa que se toman de la variación en la práctica entre centros para crear análisis comparativos de desempeño y medidas de calidad9,10. Con la implementación de infraestructuras multicéntricas estratégicas, dichos análisis comparativos y medidas de calidad pueden a su vez difundirse entre las instituciones participantes para reiterar rápidamente la evolución de las mejores prácticas y mejorar la seguridad del paciente y el valor de la atención médica11,12. Una infraestructura del sistema de salud de aprendizaje pertinente para el cuidado perioperatorio es el Multicenter Perioperative Outcomes Group (MPOG) que cubrimos en este artículo para mostrar: (i) los métodos necesarios para integrar los EHR perioperatorios para la investigación y la mejora de la calidad (QI); (ii) las herramientas de macrodatos que pueden usarse para aprovechar eficazmente grandes volúmenes de datos médicos perioperatorios acumulados; y (iii) la propuesta de valor de crear investigaciones comunitarias que compartan resultados de medidas de calidad para progresar en el cuidado perioperatorio y la seguridad del paciente. Finalmente, con el auge de los métodos de inteligencia artificial y aprendizaje automático que ofrecen nuevas oportunidades para mejorar la recopilación de información médica y la toma de decisiones clínicas, especificamos las dificultades centrales para la implementación exitosa y sostenida de métodos y modelos de inteligencia artificial/aprendizaje automático para poder tratarlas.
PRINCIPIOS DE UN SISTEMA DE SALUD DE APRENDIZAJE GUIADO POR DATOS PERIOPERATORIOS: EL MULTICENTER PERIOPERATIVE OUTCOMES GROUP: MULTICENTER PERIOPERATIVE OUTCOMES GROUP (MPOG)
Los datos del EHR son muy variables entre las instituciones
Un sistema de salud de aprendizaje (LHS) se definió como aquel “en el que la generación de conocimiento está tan arraigada en el núcleo de la práctica de la medicina que es una consecuencia natural y un producto del proceso de prestación de atención médica y da lugar a una mejora continua de la atención”13. El MPOG aspira a ser un sistema de salud de aprendizaje centrado en el cuidado perioperatorio que trate normas en continuo crecimiento para la QI, la investigación y la seguridad del paciente (Figura 1). Varios centros académicos, que les interesaba usar sus sistemas electrónicos de mantenimiento de registros de anestesia recientemente implementados para análisis observacionales multicéntricos, crearon el MPOG en 2008. Sin embargo, pronto fue evidente que este mismo conjunto de datos, con una gestión y colaboración adecuadas, podría ser la base de un sistema de salud de aprendizaje donde los datos del MPOG generan conocimiento. Este conocimiento da lugar a cambios en la práctica y los cambios en la práctica dan lugar a nuevos datos. El efecto volante de este método dio lugar a la participación de casi 100 hospitales en el grupo MPOG. A su vez, el MPOG desarrolló herramientas para extraer, tomar, limpiar y analizar estos datos para diversos usos relacionados con la investigación, la QI y la educación. El conjunto mínimo de datos presentado por cada institución incluye datos fisiológicos, de medicamentos, de notas de texto, de personal, de eventos importantes y de entrada y salida de líquidos durante el período perioperatorio. Todos estos marcadores se derivan de manera automática de datos mapeados institucionalmente dentro de los expedientes médicos de anestesia existentes y son en gran medida independientes del proveedor de EHR específico que se usa en cada institución. Además, se incluye la historia preoperatoria y la información física, los resultados de análisis de laboratorio y los datos administrativos, como códigos de terminología de procedimientos (CPT) actuales, diagnósticos en el momento del alta y datos de mortalidad en el hospital.
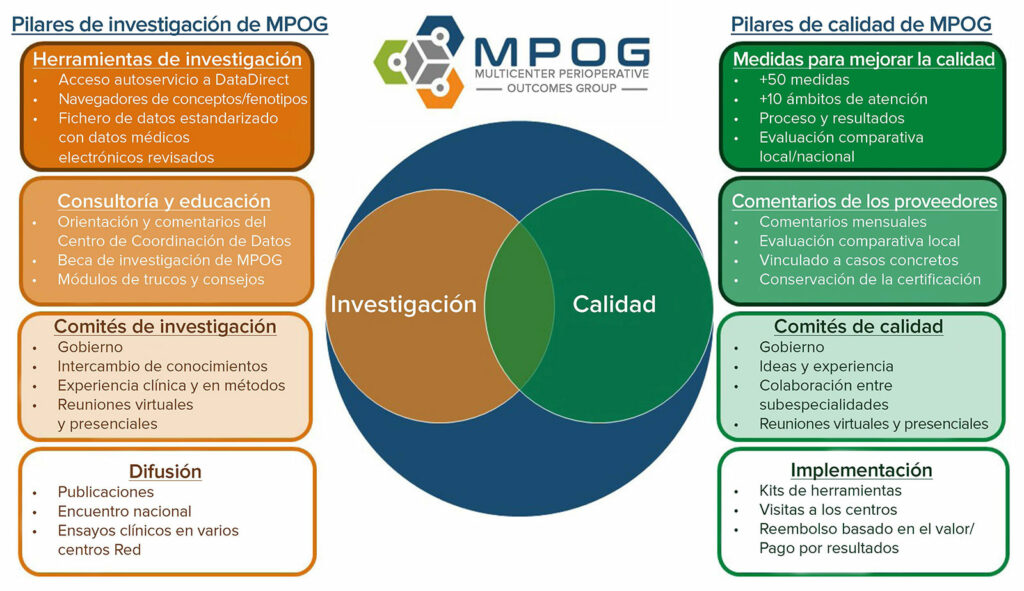
Figura 1: Pilares de la investigación y mejora de la calidad del Multicenter Perioperative Outcomes Group (MPOG).
Los datos del EHR son muy variables entre las instituciones. Como resultado, un componente fundamental del MPOG es la metodología para convertir los datos del EHR de los centros participantes en fenotipos validados y precalculados que se puedan usar para la investigación y la QI14. Este riguroso proceso implica la aplicación de algoritmos para integrar combinaciones de todos los tipos de datos dentro del MPOG para generar inferencias clínicas más confiables. Estas inferencias sirven como componentes que permiten a los investigadores hacer análisis y a los líderes y personal clínico de la QI comprender la variación en los patrones de la atención. Ejemplos de fenotipos que son componentes fundamentales de la investigación del MPOG y la QI incluyen la técnica de anestesia, el estado físico de la Sociedad Americana de Anestesiólogos y el estado de tabaquismo de los pacientes. En cada uno de estos casos, hay miles de formas en que estos datos se documentan en todos los sitos, y los algoritmos de software desarrollados por el MPOG convierten los datos en fenotipos interoperables.
HERRAMIENTAS DEL MPOG PARA TRANSFORMAR DATOS DE EHR PERIOPERATORIOS EN CONOCIMIENTO Y MEDIDAS PARA MEJORAR LA SEGURIDAD DEL PACIENTE
El MPOG creó programas y herramientas para analizar los macrodatos
El MPOG creó programas y herramientas para analizar los macrodatos y permitir inferencias para proyectos de investigación y QI matizados y considerables destinados a mejorar la seguridad del paciente.
El Comité de Calidad, compuesto por profesionales de la anestesia expertos en la QI para cada centro participante, gestiona la misión de la QI del MPOG. Este comité aprueba y mantiene medidas de calidad que reflejan la mejor evidencia disponible con un plan establecido para revisar las medidas de QI a intervalos frecuentes para adaptarse a la base de conocimientos en aumento y evolución del campo. Este comité y los subcomités de subespecialidades centrados en la anestesia pediátrica, obstétrica, geriátrica y cardíaca, compuestos por defensores de la calidad y expertos en el campo de las instituciones participantes, crean ideas para nuevas iniciativas de QI. Estos comités fomentan conversaciones abiertas, colaboración y el intercambio de mejores prácticas y lecciones aprendidas.
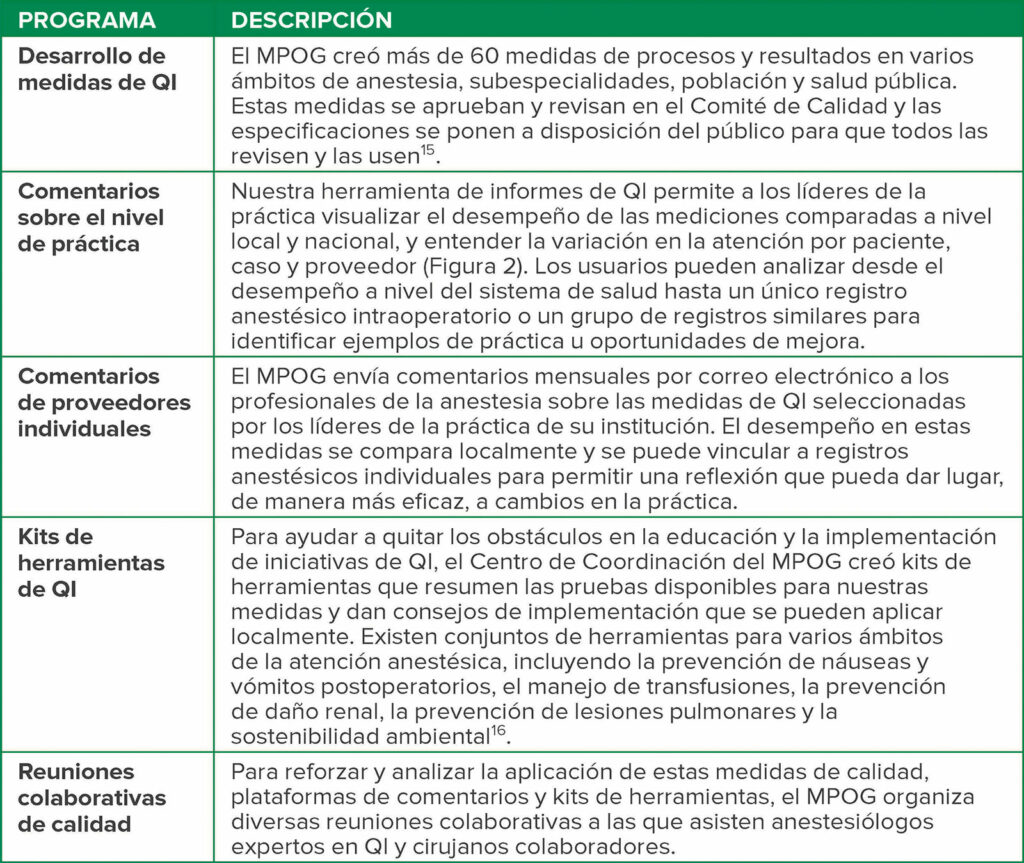
Para que los miembros puedan implementar cambios en sus instituciones, el MPOG desarrolló una serie de programas creados en la base de fenotipos computarizados. Estos programas incluyen el desarrollo de medidas de QI, comentarios a nivel practico, comentarios de proveedores individuales, kits de herramientas de QI y reuniones colaborativas de calidad, como se especifica en la Tabla 1. Encontrará más información que especifica todas las medidas de QI en https://spec.mpog.org/Measures/Public. Se puede hacer un seguimiento del desempeño de cada proveedor y se pueden hacer comentarios a las personas (Figura 2).
Tabla 1: Programas de mejora de la calidad dentro del Multicenter Perioperative Outcomes Group
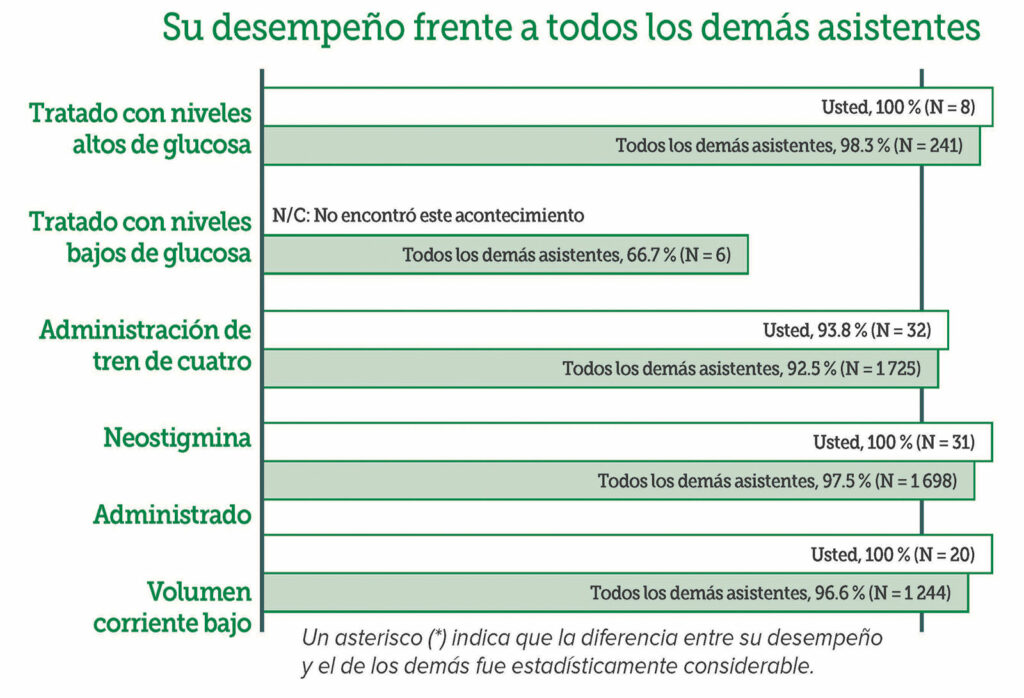
Figura 2: Comentarios de proveedores individuales sobre la calidad perioperatoria: Correos electrónicos de rendimiento personalizados.
Para complementar su misión de QI, la misión de investigación del MPOG está regida por el Comité de Investigación, que coordina los esfuerzos de investigación clínica del MPOG mediante la revisión de las propuestas presentadas y el seguimiento del progreso de los proyectos en curso. Este comité, compuesto por investigadores principales del MPOG de cada centro participante, evalúa todas las propuestas de investigación del MPOG, da orientación fundamental sobre hipótesis y metodología y garantiza la idoneidad científica de la investigación clínica usando datos del MPOG antes de la aprobación de un proyecto. Para permitir una investigación significativa usando datos del MPOG, el grupo creó varios programas y herramientas para aprovechar el Registro. Estos programas incluyen reuniones habituales del comité de investigación, un retiro anual del MPOG y herramientas de software (p. ej., DataDirect®, Ann Arbor, Michigan) para desarrollar cohortes de investigación y agilizar las consultas sobre la investigación.
MEJORA DEL DESEMPEÑO DENTRO DEL ESTADO DE MICHIGAN
En el estado de Michigan, el MPOG es parte de un programa de QI financiado por Blue Cross Blue Shield of Michigan, que funciona como un sistema de salud de aprendizaje17. Este programa financia grupos de QI para diversas especialidades y condiciones médicas18. Mediante los mecanismos que se especifican arriba, las revisiones de desempeño sin cegamiento, las reuniones colaborativas de diversas especialidades y los incentivos económicos impulsadospor los pagadores se obtienen mejoras considerables en la atención. Esto se demuestra en las mejoras en importantes ámbitos de la atención anestésica, como el manejo de la glucemia y la temperatura y en el logro de atención más rentable para los hospitales que participan en este programa (Tabla 2)19.
Tabla 2: Ejemplos de impacto en la mejora de la calidad del Multicenter Perioperative Outcomes Group.
INICIATIVA DE INVESTIGACIÓN: EVALUACIONES DE LA VARIACIÓN EN LA PRÁCTICA MULTICÉNTRICA Y LAS ESTRUCTURAS DEL CUIDADO PERIOPERATORIO
Por la amplitud de la variación en la práctica perioperatoria entre profesionales clínicos y centros, importantes resultados de investigación del MPOG incluyeron estudios que cuantifican el grado en que el profesional clínico o la institución, en lugar del paciente o la cirugía, explican los patrones de la práctica. Se aprovechó esta variación en la práctica, potencialmente indicativa de la formación de los profesionales clínicos, las preferencias de la práctica personal o las estructuras de atención e infraestructura clínica a nivel institucional, para estudiar el impacto en los resultados de los pacientes. En algunos casos, la variación en la práctica (incluyendo las proporciones de personal de anestesia, el cumplimiento de las prácticas de seguridad a nivel del hospital7 y las tasas de fracaso en el rescate8) se relaciona con peores resultados; mientras que en otros casos existe una falta de relación con resultados adversos, incluyendo cirugías superpuestas hechas por un cirujano tratante20 o cirugías que el cirujano hizo en la noche del día anterior21.
OPORTUNIDADES Y DIFICULTADES QUE IMPLICA LA INTELIGENCIA ARTIFICIAL Y EL APRENDIZAJE AUTOMÁTICO EN EL CUIDADO PERIOPERATORIO
Existen dificultades para la adopción segura de la inteligencia artificial
Coincidiendo con el desarrollo de herramientas de macrodatos para procesar datos de expedientes médicos electrónicos (EHR) para hacer investigaciones multicéntricas y de QI, existen oportunidades para aplicar métodos que usan inteligencia artificial y aprendizaje automático para mejorar la calidad de los datos, crear medidas de QI y mejorar la atención clínica mediante el desarrollo de algoritmos predictivos. Por las complejidades y la granularidad de los datos perioperatorios del EHR, los métodos de inteligencia artificial/aprendizaje automático capaces de manejar una gran cantidad de interacciones complejas no lineales entre variables a veces ofrecen ventajas considerables sobre los métodos estadísticos clásicos. Sin embargo, existen dificultades en la adopción segura de métodos basados en inteligencia artificial/aprendizaje automático en los sistemas de salud de aprendizaje perioperatorio. Estas incluyen: (i) amplias variaciones en la base de conocimientos médicos disponibles con respecto a las fortalezas y limitaciones; (ii) la necesidad de supervisión y gestión de los algoritmos clínicos; (iii) la necesidad de garantizar la fidelidad de los datos de origen sobre los que se entrenan los algoritmos de inteligencia artificial/aprendizaje automático; y (iv) un método sistemático para reconocer y tratar los sesgos potencialmente propagados en los sistemas de apoyo a las decisiones clínicas basadosen inteligencia artificial/aprendizaje automático (Figura 3).
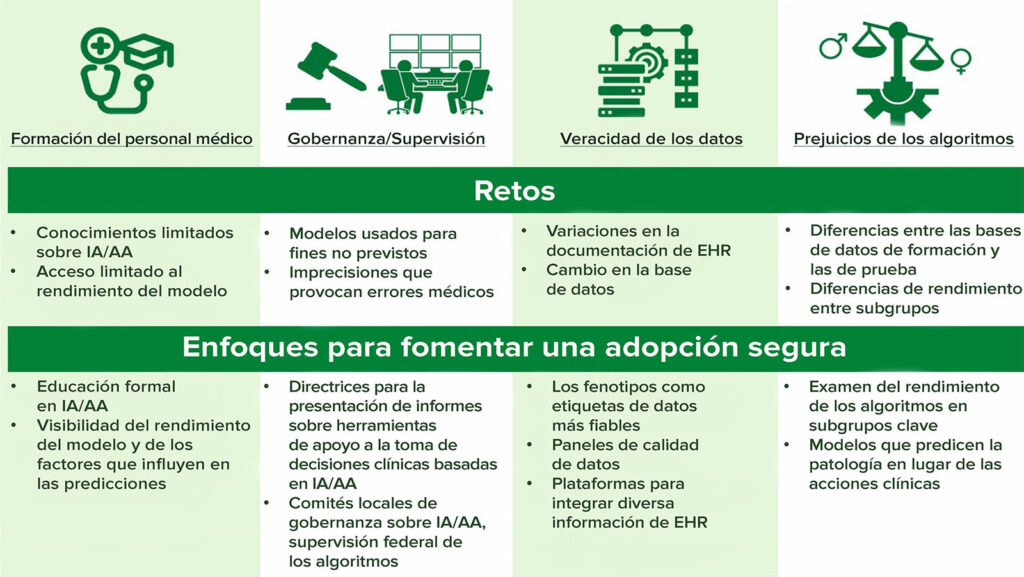
Figura 3: Consideraciones para la adopción segura de la inteligencia artificial (AI) y el aprendizaje automático (ML) en el cuidado perioperatorio.
En relación con el conocimiento clínico, la educación sobre inteligencia artificial/aprendizaje automático se está incorporando a los planes de estudios médicos y a las oportunidades de educación médica continua en el ámbito de la atención médica22. En relación con la gestión y la supervisión de los algoritmos, los esfuerzos de QI y de seguridad del paciente proponen marcos para que los comités supervisen los modelos de inteligencia artificial/aprendizaje automático implementados en un sistema de salud23. Con respecto a la fidelidad de los datos, se proponen métodos para identificar y superar los cambios en la calidad de los datos del EHR (“cambio de conjunto de datos”)24, centrándose en mantener una comunicación de circuito cerrado entre los profesionales clínicos de primera línea y los comités de gestión de algoritmos, lo que podría mejorar la seguridad del paciente promoviendo la conciencia sobre el bajo rendimiento del modelo y, por lo tanto, capacitando a los profesionales clínicos sobre los contextos en los que se puede confiar en el modelo de predicción en lugar de ignorarlo. Finalmente, como continúan las preocupaciones sobre el sesgo algorítmico, las oportunidades para tratar el desempeño diferencial del modelo entre diversos subgrupos clínicos—sobre todo cuando se basan en raza, origen étnico y sexo25—incluyen examinar explícitamente el desempeño del modelo de inteligencia artificial/aprendizaje automático en dichos subgrupos.
CONCLUSIÓN
Hay oportunidades propicias para fusionar datos del EHR perioperatorio entre pacientes, profesionales clínicos, instituciones y regiones para hacer investigaciones de eficacia comparativa y mejorar la calidad y seguridad de la atención anestésica. Los sistemas de salud de aprendizaje perioperatorio equipados con herramientas de macrodatos con el incentivo adecuado de nuevos métodos basados en inteligencia artificial/aprendizaje automático ofrecen una plataforma para que las comunidades médicas compartan datos, intercambien ideas y difundan las mejores prácticas en evolución en un sistema de salud de aprendizaje.
Michael R. Mathis es profesor adjunto de anestesiología y miembro afiliado del cuerpo docente del Departamento de Bioinformática Computacional de Michigan Medicine, University of Michigan, Ann Arbor, MI.
Robert B. Schonberger es profesor adjunto y vicepresidente de asuntos académicos en anestesiología en la Facultad de Medicina de Yale, New Haven, CT.
Anthony L. Edelman es profesor adjunto de anestesiología y director asociado de anestesiología de adultos en Michigan Medicine, University of Michigan, Ann Arbor, MI.
Allison M. Janda, MD, es profesora adjunta de anestesiología en Michigan Medicine, University of Michigan, Ann Arbor, MI.
Douglas A. Colquhoun, MB ChB, MSc, MPH, es profesor adjunto de anestesiología en Michigan Medicine, University of Michigan, Ann Arbor, MI.
Michael L. Burns, MD, es profesor adjunto de anestesiología en Michigan Medicine, University of Michigan, Ann Arbor, MI.
Nirav J. Shah es profesor adjunto de anestesiología en Michigan Medicine, University of Michigan, Ann Arbor, MI.
Michael Mathis, MD, recibió becas de investigación de los Institutos Nacionales de Salud de EE. UU. (NHLBI, NIDDK, AHRQ) y apoyo de investigación pagado a la University of Michigan desde Chiesi, EE. UU., que no se relacionan con el presente trabajo. Robert Schoenberger, MD, MCDHS, informa de que tiene acciones de Johnson and Johnson que no se relacionan con el presente trabajo. Anthony Edelman, MD, recibió financiación (pagada a la University of Michigan) de los Institutos Nacionales de Salud de EE. UU. (AHRQ), que no se relaciona con el presente trabajo. Allison Janda, MD, recibió una subvención de investigación de los Institutos Nacionales de Salud de EE. UU. (NHLBI) y el Instituto de Investigación de Resultados Centrados en el Paciente, que no se relaciona con el presente trabajo. Douglas Colquhoun, MB ChB, MSc, MPH, recibió una subvención de investigación de los Institutos Nacionales de Salud de EE. UU. (NHLBI) y apoyo de investigación pagado a la University of Michigan de Merck & Co y Chiesi, EE. UU., que no se relacionan con el presente trabajo. Michael Burns, MD, recibió una subvención de investigación de Blue Cross Blue Shield of Michigan (BCBSM) y el Patient-Centered Outcomes Research Institute, que no se relaciona con el presente trabajo; y es cofundador de Decimal Code, Inc., que no se relaciona con el presente trabajo. Nirav Shah, MD, recibió financiación (pagada a la University of Michigan) de los Institutos Nacionales de Salud de EE. UU. (NLM, NIA), el Patient Centered Outcomes Research Institute, Blue Cross Blue Shield Michigan, Edwards Lifesciences y Apple, Inc., que no se relaciona con el presente trabajo. No hay ninguna otra relación o actividad que podría parecer haber influido en el trabajo presentado.
Todo el trabajo y la financiación parcial se atribuyen al Departamento de Anestesiología, Michigan Medicine, University of Michigan (Ann Arbor, Michigan, EE. UU.). El proyecto descrito recibió una parte del apoyo de los Institutos Nacionales de Salud de EE. UU. (NIDDK R01DK133226; NHLBI R01HL167790, NIA R01AG059607, NHLBI K08HL159327, NHLBI K23HL166685, Bethesda, MD). Además, Blue Cross Blue Shield of Michigan/Blue Care Network dio financiación parcial para respaldar la recopilación de datos de expedientes médicos electrónicos subyacentes en el registro del Multicenter Perioperative Outcomes Group como parte del programa Blue Cross Blue Shield of Michigan/Blue Care Network Value Partnerships. Aunque Blue Cross Blue Shield of Michigan/Blue Care Network y Multicenter Perioperative Outcomes Group trabajan en colaboración, las opiniones, creencias y puntos de vista que expresan los autores no reflejan necesariamente las opiniones, creencias y puntos de vista de Blue Cross Blue Shield of Michigan/Blue Care Network o cualquiera de sus empleados. Además, las opiniones, creencias y puntos de vista que expresan los autores no reflejan necesariamente las opiniones, creencias y puntos de vista de los Institutos Nacionales de Salud o cualquiera de sus empleados. Los contribuyentes de la industria no participaron en el estudio.
REFERENCIAS
- Roberts DJ, Mor R, Rosen MN, et al. Hospital-, anesthesiologist-, surgeon-, and patient-level variations in neuraxial anesthesia use for lower limb revascularization surgery: a population-based cross-sectional study. Anesth Analg. 2022;135:1282–1292. PMID: 36219577.
- Janda AM, Spence J, Dubovoy T, et al. Multicentre analysis of practice patterns regarding benzodiazepine use in cardiac surgery. Br J Anaesth. 2022;128:772–784. PMID: 35101244.
- Mathis MR, Janda AM, Kheterpal S, et al. Patient-, clinician-, and institution-level variation in inotrope use for cardiac surgery: a multicenter observational analysis. Anesthesiology. 2023;139:122–141. PMID: 37094103.
- Burns ML, Saager L, Cassidy RB, et al. Association of anesthesiologist staffing ratio with surgical patient morbidity and mortality. JAMA Surg. 2022;157:807–815. PMID: 35857304.
- Sutherland K, Levesque JF. Unwarranted clinical variation in health care: definitions and proposal of an analytic framework. J Eval Clin Pract. 2020;26:687–696. PMID: 31136047.
- Sessler DI. Implications of practice variability. Anesthesiology. 2020;132:606–608. PMID: 32053562.
- Brooke BS, Dominici F, Pronovost PJ, et al. Variations in surgical outcomes associated with hospital compliance with safety practices. Surgery. 2012;151:651–659. PMID: 22261296.
- Portuondo JI, Farjah F, Massarweh NN. Association between hospital perioperative quality and long-term survival after noncardiac surgery. JAMA Surg. 2022;157:258–268. PMID: 35044437.
- Casey JD, Courtright KR, Rice TW, Semler MW. What can a learning healthcare system teach us about improving outcomes? Curr Opin Crit Care. 2021;27:527–536. PMID: 34232148.
- Foley T, Vale L. A framework for understanding, designing, developing and evaluating learning health systems. Learn Health Syst. 2023;7:e10315. PMID: 36654802.
- Sheetz KH, Englesbe MJ. Expanding the quality collaborative model as a blueprint for higher-value care. JAMA Health Forum. 2020;1:e200413-e200413. PMID: 36218502.
- Smith M, Saunders R, Stuckhardt L, McGinnis JM. Committee on the Learning Health Care System in America; Institute of Medicine. Best care at lower cost: the path to continuously learning health care in America. National Academies Press (US); 2013 May 10. PMID: 24901184.
- Olsen L, Aisner D, Mcginnis JM, eds. The Learning Healthcare System: Workshop Summary. National Academies Press; 2007. PMID: 21452449.
- Colquhoun DA, Shanks AM, Kapeles SR, et al. Considerations for integration of perioperative electronic health records across institutions for research and quality improvement: the approach taken by the Multicenter Perioperative Outcomes Group. Anesth Analg. 2020;130:1133–1146. PMID: 32287121.
- MPOG Measure Specs—Measure List. https://spec.mpog.org/Measures/Public. Accessed February 16, 2024.
- Toolkits. MPOG. Published July 24, 2019. https://mpog.org/toolkits/. Accessed February 16, 2024.
- Howard R, Grant J, Leyden T, Englesbe M. Improving the quality of health care through 25 years of statewide collaboration in Michigan. NEJM Catalyst. 3:CAT.22.0153. doi: 10.1056/CAT.22.0153.
- Collaborative quality initiatives—value partnerships.com — blue cross blue shield of Michigan. https://www.valuepartnerships.com/programs/collaborative-quality-initiatives/. Accessed February 16, 2024.
- Janda AM, Vaughn MT, Colquhoun DA, et al. Does anesthesia quality improvement participation lead to incremental savings in a surgical quality collaborative population? A retrospective observational study. Anesth Analg. 2023;137:1093–1103. PMID: 37678254.
- Sun E, Mello MM, Rishel CA, et al. Association of overlapping surgery with perioperative outcomes. JAMA. 2019;321:762–772. PMID: 30806696.
- Sun EC, Mello MM, Vaughn MT, et al. Assessment of perioperative outcomes among surgeons who operated the night before. JAMA Intern Med. 2022;182:720–728. PMID: 35604661.
- Howell MD, Corrado GS, DeSalvo KB. Three epochs of artificial intelligence in health care. JAMA. 2024;331:242–244. PMID: 38227029.
- Reddy S, Allan S, Coghlan S, Cooper P. A governance model for the application of AI in health care. J Am Med Inform Assoc. 2020;27:491–497. PMID: 31682262.
- Finlayson SG, Subbaswamy A, Singh K, et al. The clinician and dataset shift in artificial intelligence. N Engl J Med. 2021;385:283–286. PMID: 34260843.
- Chin MH, Afsar-Manesh N, Bierman AS, et al. Guiding principles to address the impact of algorithm bias on racial and ethnic disparities in health and health care. JAMA Netw Open. 2023;6:e2345050. PMID: 38100101.


 Issue PDF
Issue PDF