La depresión respiratoria inducida por opiáceos puede ser una complicación potencialmente mortal, aunque prevenible, para la población infantil. Es fundamental identificar a las personas que corren el riesgo de sufrir depresión respiratoria inducida por opiáceos y establecer prácticas más seguras, como el uso de coadyuvantes con efecto ahorrador de opioides, la evaluación frecuente de la sedación y el monitoreo exhaustivo. Lamentablemente, en la actualidad no existen modelos diseñados para predecir el riesgo de descompensación respiratoria inducida por opiáceos en niños; sin embargo, el uso de monitores múltiples y complementarios puede ayudar a disminuir los acontecimientos graves relacionados con los opiáceos.
 Después de la cirugía, la depresión respiratoria puede ocurrir por diversos motivos y resulta en complicaciones potencialmente catastróficas 1. Una de las causas recurrentes de la depresión respiratoria en el período postoperatorio es el uso perioperatorio de opioides 2. Por eso, instituciones y sociedades profesionales, incluyendo la Fundación para la Seguridad del Paciente de Anestesia (APSF), han desarrollado recomendaciones sobre el monitoreo de los pacientes 3,4 y han publicado artículos que defienden que las decisiones sobre el nivel adecuado de monitoreo posoperatorio se guíen por la evaluación preoperatoria de los factores de riesgo específicos del paciente 5. Al igual que con los adultos, las complicaciones respiratorias perioperatorias ocurren en pacientes pediátricos y constituyen una causa común de eventos adversos posoperatorios 6. Sin embargo, los niños no son “pequeños adultos”. Por lo tanto, la extrapolación de directrices y estudios publicados anteriormente debe hacerse con cautela.
Después de la cirugía, la depresión respiratoria puede ocurrir por diversos motivos y resulta en complicaciones potencialmente catastróficas 1. Una de las causas recurrentes de la depresión respiratoria en el período postoperatorio es el uso perioperatorio de opioides 2. Por eso, instituciones y sociedades profesionales, incluyendo la Fundación para la Seguridad del Paciente de Anestesia (APSF), han desarrollado recomendaciones sobre el monitoreo de los pacientes 3,4 y han publicado artículos que defienden que las decisiones sobre el nivel adecuado de monitoreo posoperatorio se guíen por la evaluación preoperatoria de los factores de riesgo específicos del paciente 5. Al igual que con los adultos, las complicaciones respiratorias perioperatorias ocurren en pacientes pediátricos y constituyen una causa común de eventos adversos posoperatorios 6. Sin embargo, los niños no son “pequeños adultos”. Por lo tanto, la extrapolación de directrices y estudios publicados anteriormente debe hacerse con cautela.
FACTORES DE RIESGO PEDIÁTRICOS PARA LA DEPRESIÓN RESPIRATORIA INDUCIDA POR OPIOIDES
Hay escasa literatura disponible en la que se traten los factores de riesgo de la depresión respiratoria inducida por opioides (OIRD) en niños. Aunque las comorbilidades, como la diabetes mellitus y las enfermedades cardíacas, son factores de riesgo importantes para los eventos respiratorios críticos en adultos después del tratamiento con opioides parenterales7,8, por su baja incidencia en los niños, es poco probable que sean los principales factores en el entorno pediátrico. En cambio, la evidencia de las auditorías de pacientes y el seguimiento de datos de la administración de naloxone, un indicador sustituto de la OIRD, ha ayudado a identificar factores de riesgo (Figura 1). Por ejemplo, se han identificado enfermedades respiratorias subyacentes y retrasos en el desarrollo como comorbilidades que podrían cumplir una función en el aumento del riesgo de la OIRD pediátrica9-11.
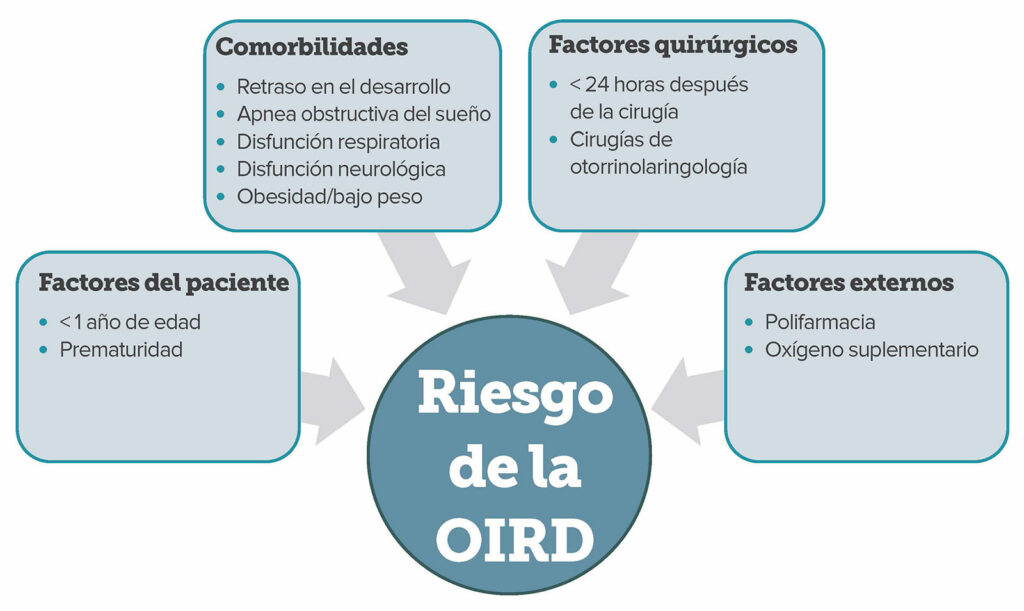
Figura 1. Resumen de los factores de riesgo asociados con un mayor riesgo de depresión respiratoria inducida por opioides (OIRD) en niños4,10.
Otro factor de riesgo de la OIRD en la población pediátrica es la edad temprana. En una revisión retrospectiva de pacientes pediátricos que necesitaron naloxone por eventos respiratorios críticos, el aumento de la incidencia se relacionó con una edad más temprana y con la prematuridad10. El mayor riesgo podría atribuirse a diferencias fisiológicas con respecto al metabolismo y la excreción de opioides entre infantes jóvenes, niños mayores y adultos. Por ejemplo, la vida media de la morfina es prolongada y su eliminación es menor en los recién nacidos. Por lo tanto, dependiendo de la dosis, los infantes menores de un mes de edd podrían alcanzar niveles séricos más altos que disminuyen más lentamente comparado con niveles en niños mayores y adultos, lo que los pone en riesgo elevado12.
El mayor riesgo de depresión respiratoria posoperatoria con apnea obstructiva del sueño (OSA)13 también se informó en niños. Después de una amigdalectomía, los niños con OSA grave son más sensibles a la depresión respiratoria inducida por morfina y necesitan menos morfina que los que tienen apnea del sueño leve14. La OSA es relativamente frecuente en pediatría y ocurre en 1 a 5% de los niños15. Sin embargo, la detección preoperatoria puede ser algo desafiante. La polisomnografía es el estándar de oro en el diagnóstico, pero no está disponible para la mayoría de los pacientes pediátricos. No existe un cuestionario validado de evaluación de riesgos que se aplique a niños de todas las edades; sin embargo, se han informado de factores de riesgo y síntomas pediátricos específicos de la OSA16.
La obesidad infantil también es un factor de riesgo para la administración de naloxona10. Esto podría atribuirse a la fuerte relación entre obesidad y OSA o podría reflejar una dosificación inexacta relacionada con la obesidad. A diferencia de los adultos, la dosificación basada en el peso es una práctica habitual para muchos medicamentos pediátricos, pero la dosis de opiáceos según el peso total puede causar una depresión respiratoria peligrosa. Por lo tanto, la dosis debe basarse en la masa corporal ideal o magra17. Curiosamente, en los niños, el bajo peso también es un factor de riesgo de tener episodios respiratorios10.
La sedación excesiva se ha observado antes de la morbilidad relacionada con los opioides en la mayoría de los niños4. Aunque los efectos sedantes de los opioides en pacientes que nunca tomaron opioides son muy conocidos, la depresión del sistema nervioso central (SNC) podría agravarse por la administración conjunta de ansiolíticos, relajantes musculares, anticonvulsivos y otros medicamentos sedantes. Estas combinaciones pueden causar eventos respiratorios potencialmente mortales y un mayor riesgo de intervenciones con naloxona10. Esto es particularmente importante ya que se ha informado de que la administración conjunta de opioides y otros depresores del SNC es habitual en la práctica pediátrica con más del 40% de los encuestados permitiendo la administración conjunta de estos medicamentos según una encuesta del 2010 sobre la práctica del manejo del dolor pediátrico 18. Aunque la práctica podría haber cambiado en la década transcurrida por el reciente enfoque en el ahorro de opioides con regímenes analgésicos multimodales, es poco probable que esta polifarmacia haya disminuido dramáticamente.
Después de la cirugía, el mayor riesgo de depresión respiratoria ocurre dentro del primer día postoperatorio. De hecho, el 75% de los episodios en niños que recibieron naloxone por eventos respiratorios críticos se observaron en las primeras 24 horas después de la cirugía. Los eventos ocurrieron en pacientes que recibieron opioides por vía intravenosa, oral y neuroaxial, lo que sugiere que ningún método de administración está intrínsecamente exento de riesgos10.
RECOMENDACIONES ACTUALES PARA EL MONITOREO DE PACIENTES PEDIÁTRICOS
Los expertos sugieren un monitoreo continuo de la oxigenación y ventilación por lo menos 24 horas posoperatorias en pacientes pediátricos que reciben opioides
Para minimizar el riesgo de depresión respiratoria, la APSF ha defendido por mucho tiempo el uso del monitoreo electrónico continuo de la oxigenación y ventilación, cuando se proporciona oxígeno suplementario, debe ser usado para identificar de forma preventiva y potencialmente prevenir la OIRD3. Aunque no hay estudios que diferencien específicamente los requisitos de monitoreo de los pacientes pediátricos, una declaración de consenso de la Society for Pediatric Anesthesia respalda una vigilancia adicional en la atención de pacientes selectos, incluyendo recién nacidos, niños con OSA y los que tienen enfermedades neuromusculares subyacentes o deterioro cognitivo que pueda afectar a la función de los músculos respiratorios o impedir la evaluación del nivel de dolor o conciencia del paciente. Además, los pacientes pediátricos que inician un tratamiento con opioides sobre todo en el período postoperatorio inicial, aquellos que reciben dosis crecientes de opioides parenterales y aquellos que reciben opioides junto con otros depresores del SNC, merecen una mayor supervisión4.
La opinión de los expertos respalda el monitoreo de los pacientes pediátricos que reciben dosis iniciales de opioides parenterales u opioides mediante analgesia controlada por el paciente (PCA), PCA en modo proxy y/o infusión continua, recomendando específicamente el monitoreo continuo de la frecuencia respiratoria y la oximetría de pulso en las primeras 24 horas a menos que el paciente esté despierto y siendo observado activamente4,12. Investigaciones anteriores respaldan la utilización de un monitoreo continuo más frecuente en niños. En una encuesta del 2010 sobre la práctica del manejo del dolor pediátrico, los encuestados informaron de que el monitoreo continuo de la oximetría de pulso era habitual cuando se administraba opioide por PCA18. Sin embargo, el monitoreo continuo de la frecuencia respiratoria se usó de manera menos consistentemente (Figura 2).
![Figura 2: Tipo de monitoreo del paciente usado cuando se administran opioides a pacientes pediátricos. (Número total de encuestados que respondieron a la pregunta, 149; número total de encuestados que administraron analgesia IV controlada por el paciente [IVPCA] en modo proxy, 95). El noventa por ciento de los encuestados informaron el uso de monitoreo con oximetría de pulso cuando se administraba PCA a los pacientes. El monitoreo electrocardiográfico y la capnografía siempre se usaban junto con la oximetría de pulso, mientras que la pletismografía inductiva respiratoria (Respitrace) casi siempre se hizo junto con la oximetría de pulso (> 90 %), pero ocasionalmente se usaba como único tipo de monitoreo<sup>17</sup>. Reimpreso con permiso de Anesthesia & Analgesia y Wolters Kluwer Health, Inc. Nelson KL, Yaster M, Kost-Byerly S, Monitto CL. Encuesta nacional de anestesiólogos pediátricos americanos: Analgesia controlada por el paciente y otras terapias intravenosas con opiáceos en el tratamiento del dolor agudo en pediatría. Anesth Analg.110:754–760.<sup>18</sup>](https://www.apsf.org/wp-content/uploads/newsletters/2024/0702-es/figure2-monitoring-es-1024x732.jpg)
Figura 2: Tipo de monitoreo del paciente usado cuando se administran opioides a pacientes pediátricos. (Número total de encuestados que respondieron a la pregunta, 149; número total de encuestados que administraron analgesia IV controlada por el paciente [IVPCA] en modo proxy, 95). El noventa por ciento de los encuestados informaron el uso de monitoreo con oximetría de pulso cuando se administraba PCA a los pacientes. El monitoreo electrocardiográfico y la capnografía siempre se usaban junto con la oximetría de pulso, mientras que la pletismografía inductiva respiratoria (Respitrace) casi siempre se hizo junto con la oximetría de pulso (> 90 %), pero ocasionalmente se usaba como único tipo de monitoreo17. Reimpreso con permiso de Anesthesia & Analgesia y Wolters Kluwer Health, Inc. Nelson KL, Yaster M, Kost-Byerly S, Monitto CL. Encuesta nacional de anestesiólogos pediátricos americanos: Analgesia controlada por el paciente y otras terapias intravenosas con opiáceos en el tratamiento del dolor agudo en pediatría. Anesth Analg.110:754–760.18
MONITOREO RESPIRATORIO PEDIÁTRICO Y DESAFÍOS RELACIONADOS
La desaturación puede ser una señal tardía de alerta de insuficiencia respiratoria cuando los pacientes reciben oxígeno
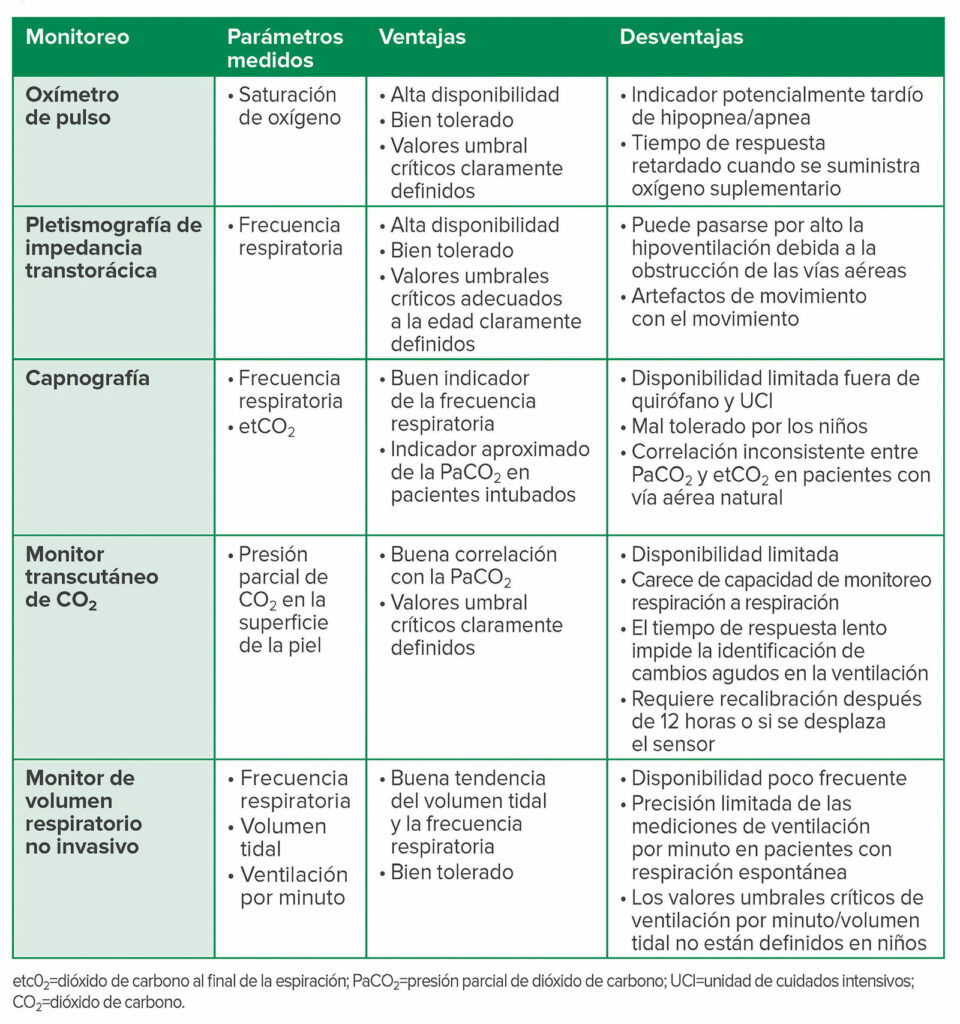
Al igual que con los adultos, el monitoreo respiratorio en niños debe identificar de forma preventiva la OIRD a tiempo para intervenir y prevenir la aparición de eventos críticos. Idealmente, el monitoreo respiratorio debería medir de forma continua y precisa la oxigenación, la frecuencia respiratoria, la tensión del dióxido de carbono (CO2) y el flujo de aire. Actualmente existen monitores para hacer un seguimiento de cada parámetro; sin embargo, cada uno tiene limitaciones como predictor de falla respiratoria inminente (Tabla 1).
Tabla 1: Resumen de las modalidades de monitoreo respiratorio para la detección de OIRD2,4,6,7,20-23
Los métodos de monitoreo más habituales en la práctica pediátrica son la oximetría de pulso continua y la pletismografía de impedancia transtorácica. Desde su introducción en la práctica pediátrica en la década de 1980, la oximetría de pulso ha proporcionado información fundamental sobre la adecuación de la oxigenación en bebés y niños. El monitoreo por oximetría de pulso suele estar disponible en las unidades pediátricas y la monitorización en sí es bien tolerada por pacientes de todas las edades. Sin embargo, la desaturación puede ser una señal de advertencia tardía de insuficiencia respiratoria, particularmente cuando los pacientes reciben oxígeno suplementario4. Lamentablemente, por la complejidad quirúrgica, las comorbilidades del paciente o la administración de analgésicos, los estudios informan de una necesidad frecuente de oxígeno suplementario para mantener una oxigenación adecuada postoperatoria11,18. Esta necesidad pone a los niños en mayor riesgo de hipoventilación no reconocida porque aumenta el tiempo entre la apnea/hipopnea y la desaturación.
El monitoreo de la frecuencia respiratoria mediante pletismografía de impedancia transtorácica, una técnica que puede identificar el apnea y la hipopnea, características distintivas de los efectos de los opioides en los centros respiratorios del tronco encefálico, también está disponible con frecuencia y se tolera bien. Sin embargo, se debe tener cuidado de usar parámetros respiratorios apropiados para la edad. Lamentablemente, el monitoreo de la frecuencia respiratoria usando esta técnica podría ser inexacta por una colocación subóptima de los electrodos del ECG, artefactos de movimiento y eventos fisiológicos que causan el movimiento de la pared torácica como la tos y el llanto. Además, es posible que no pueda identificar la insuficiencia respiratoria en una obstrucción de las vías aéreas no diagnosticada.
La medición de la PaCO arterial2 da una evaluación bien validada de la ventilación, pero necesita acceso arterial y no da información continua. Las medidas sustitutas no invasivas de la PaCO2 que sí dan datos continuos incluyen el monitoreo transcutáneo y la PCO al final de la espiración2 (etCO2). El monitoreo transcutáneo de gases dejó de usarse en la década de 1980, en parte por las dificultades técnicas, incluyendo el riesgo de quemaduras en la piel cuando se usa en recién nacidos. Sin embargo, como resultado de los avances tecnológicos, el monitoreo transcutáneo de la PCO2 ahora es clínicamente factible y seguro. Estos monitores han sido evaluados en poblaciones pediátricas20, pero han sido estudiados en infantes y niños que reciben medicamentos opioides en el contexto postoperatorio. Aunque la correlación es buena con la PaCO en estado estacionario2, el tiempo de respuesta impide la identificación rápida de cambios agudos en la ventilación, limitando su uso como monitor de alerta temprana.
La capnografía debe usarse cuando los pacientes posoperatorios que reciben opiáceos reciben oxígeno suplementario
Alternativamente, el monitoreo de CO al final de la espiración2 (etCO2) ofrece alertas tempranas y fiables de insuficiencia ventilatoria cuando se usa para monitorear pacientes intubados, anestesiados o profundamente sedados. La capnografía con toma de muestras nasales y orales se ha estudiado en adultos no intubados que reciben PCA2,7 y es un indicador más sensible del compromiso respiratorio que el monitoreo de la saturación, lo que respalda el uso potencial de la capnografía como monitor de alerta temprana de insuficiencia respiratoria inminente. En vista de estos hallazgos, la APSF ha recomendado que se use la capnografía para monitorear la ventilación cuando se administre oxígeno suplementario a pacientes posoperatorios que reciban opioides. Sin embargo, el uso adecuado requiere la cooperación del paciente para llevar la cánula de capnografía especialmente diseñada por períodos prolongados para detectar volúmenes tidales bajos exhalados tanto por la boca como por la nariz. Estas cánulas pueden resultar incómodas o interferir con actividades como comer o hablar, lo que afecta al cumplimiento del paciente. Y cuando se estudió en pacientes pediátricos posoperatorios no intubados y no sedados, la capnografía fue, de hecho, a menudo mal tolerada por estas mismas razones, limitando la implementación en los paradigmas de monitoreo pediátrico21.
Es esencial una comprensión clara de la información proporcionada por el monitoreo capnográfico. Mientras que la capnografía facilita una medida precisa de la frecuencia respiratoria, el significado de los valores de etCO2 puede diferir sustancialmente entre pacientes con una vía aérea natural o artificial. Como se observó en el ensayo PRODIGY, más del 60% de los pacientes monitoreados tenían episodios de etCO2 < 15 mm Hg (> 50% tenían etCO baja2 y frecuencia respiratoria baja), pero ningún paciente tenía una etCO2 > 60 mm Hg7. Estos resultados sugieren que en muchos casos los valores de etCO2 no reflejaban la PaCO2, sino que eran un indicador indirecto de un flujo aéreo deficiente debido a una obstrucción no reconocida.
Las tecnologías más nuevas, como el monitoreo del volumen respiratorio no invasivo, pueden dar una evaluación más sensible del flujo aéreo, concretamente del volumen corriente y ventilación por minuto. Los monitores han sido validados tanto en adultos como en infantes intubados y ventilados mecánicamente y en niños bajo anestesia general6,22. Sin embargo, en adultos que respiran espontáneamente la tendencia del volumen corriente y la frecuencia respiratoria fue buena, pero la precisión de las mediciones de la ventilación minuto fue limitada en comparación con el estándar de oro, la espirometría23. No obstante, el monitoreo de tendencias que pueden ofrecer estos dispositivos puede apoyar su incorporación a futuras estrategias de monitoreo. Los datos preliminares de un estudio piloto en adolescentes que reciben opioides por PCA después de una cirugía de fusión espinal posterior (Figura 3) sugieren que los monitores son tolerados en adolescentes (comunicación personal de C. Monitto), lo que implica que su uso en paradigmas de monitoreo pediátrico es factible. Dicho esto, aún no se han definido claramente en los niños los valores umbrales ventilatorios críticos que podrían usarse para predecir un compromiso respiratorio inminente o detectar uno presente no reconocido.
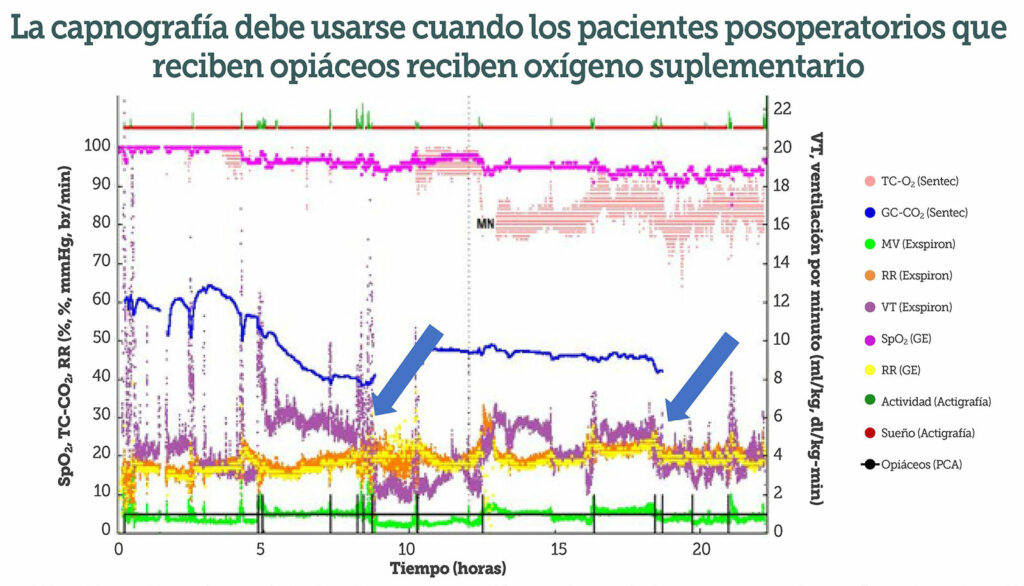
Figura 3: Flujo de datos de 24 horas de saturación de oxígeno, frecuencia respiratoria, CO2 transcutáneo, ventilación minuto, volumen tidal, actigrafía y uso de opioides por PCA en un paciente adolescente después de una fusión espinal posterior. La disminución del volumen tidal (VT) después del uso de bolo de PCA se demuestra con flechas azules. MN indica medianoche. (Datos no publicados de Constance Monitto).
En conclusión, actualmente no existen modelos diseñados para predecir el riesgo de descompensación respiratoria inducida por opiáceos en niños. Cuando se estratifican riesgos, se deben incluir los factores particulares de cada paciente, propios de los niños, en lugar de extrapolar los resultados de estudios en adultos. Se reporta que el monitoreo respiratorio electrónico continuo de los niños se utiliza con más frecuencia que en la atención a adultos, pero ninguna tecnología aporta por sí sola una solución integral para monitorear a los que tienen una vía aérea natural. En el futuro, el uso de monitores múltiples y complementarios junto con paradigmas diseñados para incluir parámetros de alarma de umbral específicos para pediatría puede permitir una identificación más temprana de los episodios de insuficiencia respiratoria en esta población vulnerable.
Tricia Vecchione, MD, MPH, es profesora asistente de anestesiología en la Facultad de Medicina de la Universidad Johns Hopkins, Baltimore, MD.
Constance L. Monitto, MD, es profesora asociada de anestesiología en la Facultad de Medicina de la Universidad Johns Hopkins, Baltimore, MD.
Los autores no tienen conflictos de intereses.
REFERENCIAS
- Lee LA, Caplan RA, Stephens LS, et al. Postoperative opioid-induced respiratory depression: a closed claims analysis. Anesthesiology. 2015;122:659–665. PMID: 25536092.
- Overdyk FJ, Carter R, Maddox RR, et al. Continuous oximetry/capnometry monitoring reveals frequent desaturation and bradypnea during patient-controlled analgesia. Anesth Analg. 2007;105:412–418. PMID: 17646499.
- Weinger MB, Lee LA. “No patient shall be harmed by opioid-induced respiratory depression.” APSF Newsletter. 2011;26:21–40. https://www.apsf.org/article/no-patient-shall-be-harmed-by-opioid-induced-respiratory-depression/. Accessed February 28, 2024.
- Cravero JP, Agarwal R, Berde C, et al. The Society for Pediatric Anesthesia recommendations for the use of opioids in children during the perioperative period. Paediatr Anaesth. 2019;29:547–571. PMID: 30929307.
- Weingarten TN. Opioid-induced respiratory depression–beyond sleep disordered breathing. APSF Newsletter. 2023;38:2,42–45. https://www.apsf.org/article/opioid-induced-respiratory-depression-beyond-sleep-disordered-breathing/. Accessed February 28, 2024.
- Gomez-Morad AD, Cravero JP, Harvey BC, et al. The evaluation of a noninvasive respiratory volume monitor in pediatric patients undergoing general anesthesia. Anesth Analg. 2017;125:1913–1919. PMID: 28759491.
- Khanna AK, Bergese SD, Jungquist CR, et al. PRediction of Opioid-induced respiratory Depression In patients monitored by capnoGraphY (PRODIGY) group collaborators. prediction of opioid-induced respiratory depression on inpatient wards using continuous capnography and oximetry: an international prospective, observational trial. Anesth Analg. 2020;131:1012–1024. PMID: 32925318.
- Ramachandran SK, Haider N, Saran KA, et al. Life threatening critical respiratory events: a retrospective study of postoperative patients found unresponsive during analgesic therapy. J Clin Anesth. 2011;23:207–213. PMID: 21570616.
- Morton NS, Errera A. APA national audit of pediatric opioid infusions. Paediatr Anaesth. 2010;20:119–125. PMID: 19889193.
- Chidambaran V, Olbrecht V, Hossain M, et al. Risk predictors of opioid-induced critical respiratory events in children: naloxone use as a quality measure of opioid safety. Pain Med. 2014;15:2139–2149. PMID: 25319840.
- Voepel-Lewis T, Marinkovic A, Kostrzewa A, et al. The prevalence of and risk factors for adverse events in children receiving patient-controlled analgesia by proxy or patient-controlled analgesia after surgery. Anesth Analg. 2008; 107:70–75. PMID: 18635469.
- Monitto CL, George JA, Yaster M: Pediatric acute pain management. In: Davis PJ, Cladis FP (eds). Smith’s anesthesia for infants and children. 10th edition. Elsevier, Philadelphia, PA, 481–518, 2022.
- Chung F, Liao P, Elsaid H, et al. Factors associated with postoperative exacerbation of sleep-disordered breathing. Anesthesiology. 2014;120:299–311. PMID: 24158050.
- Brown KA, Laferriere A, Moss IR. Recurrent hypoxemia in young children with obstructive sleep apnea is associated with reduced opioid requirement for analgesia. Anesthesiology. 2004;100:806–810. PMID: 15087614.
- Marcus CL, Brooks LJ, Draper KA, et al. Diagnosis and management of childhood obstructive sleep apnea syndrome. Pediatrics. 2012;130:576–584. PMID: 22926173.
- Coté CJ, Posner KL, Domino KB. Death or neurologic injury after tonsillectomy in children with a focus on obstructive sleep apnea: Houston, we have a problem! Anesth Analg. 2014;118:1276–1283. PMID: 23842193.
- Mortensen A, Lenz K, Abildstrom H, Lauritsen TL. Anesthetizing the obese child. Paediatr Anaesth. 2011;21:623–629. PMID: 21429056.
- Nelson KL, Yaster M, Kost-Byerly S, Monitto CL. A national survey of American pediatric anesthesiologists: patient-controlled analgesia and other intravenous opioid therapies in pediatric acute pain management. Anesth Analg. 2010;110:754–760. PMID: 20185654.
- Quinlan-Colwell A, Thear G, Miller-Baldwin E, Smith A. Use of the Pasero Opioid-induced Sedation Scale (POSS) in pediatric patients. J Pediatr Nurs. 2017;33:83–87. PMID: 28209260.
- Berkenbosch JW, Tobias JD. Transcutaneous carbon dioxide monitoring during high-frequency oscillatory ventilation in infants and children. Crit Care Med. 2002;30:1024–1027. PMID: 12006797.
- Miller KM, Kim AY, Yaster M, et al. Long-term tolerability of capnography and respiratory inductance plethysmography for respiratory monitoring in pediatric patients treated with patient-controlled analgesia. Paediatr Anaesth. 2015; 25:1054–1059. PMID: 26040512.
- Atkinson DB, Sens BA, Bernier RS, et al. The evaluation of a noninvasive respiratory volume monitor in mechanically ventilated neonates and infants. Anesth Analg. 2022; 134:141–148. PMID: 33929346.
- Gatti S, Rezoagli E, Madotto F, et al. A non-invasive continuous and real-time volumetric monitoring in spontaneous breathing subjects based on bioimpedance-ExSpiron®Xi: a validation study in healthy volunteers. J Clin Monit Comput. 2024;38:539–551. PMID: 38238635.


 Issue PDF
Issue PDF