Consulte el artículo original en línea en https://www.apsf.org/article/monitoring-of-neuromuscular-blockade-what-would-you-expect-if-you-were-the-patient/.
El cuidadoso manejo intraoperatorio del bloqueo neuromuscular puede optimizar la recuperación del paciente y mejorar los resultados postoperatorios. En cuatro artículos importantes del Boletín informativo de la APSF de febrero de 2016, se explicó por qué el bloqueo neuromuscular residual postoperatorio (PRNB) era un problema importante para la seguridad del paciente y cómo la dosificación, el control y la reversión adecuados de los bloqueadores neuromusculares podían reducir la incidencia de esta complicación después de la anestesia y la cirugía.
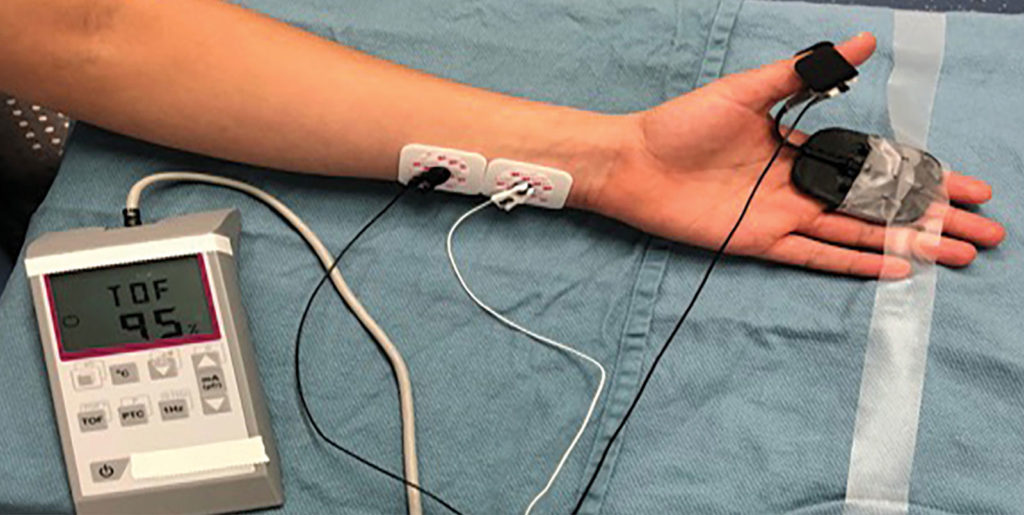
Figura 1: Representación de un monitor cuantitativo de bloqueo neuromuscular aplicándose en el nervio cubital del sujeto.
En el primer artículo, Robert Stoelting, MD, resumió las opiniones de la APSF en relación con el uso del monitoreo cualitativo (estimulador de los nervios periféricos) y el monitoreo cuantitativo (dispositivos que miden objetivamente la función muscular y muestran los resultados) en el período perioperatorio (figura 1).1 La APSF recomendó que cada paciente que recibía relajantes musculares debía hacerse, al menos, un monitoreo cualitativo y, preferentemente, uno cuantitativo, para evaluar la necesidad de reversores y la suficiencia de la función neuromuscular antes de la extubación traqueal. Se repasó la bibliografía para documentar que el PRNB era un problema muy subestimado que ocurría en hasta el 40 % de los pacientes. Los sujetos con una relación del tren de cuatro (TOF) < 0,9 (el límite de recuperación neuromuscular suficiente) estaban en riesgo de sufrir una gran cantidad de efectos adversos, incluyendo hipoxemia, obstrucción de las vías aéreas, deterioro de la función faríngea y mayor riesgo de aspiración, retrasos en el alta de la unidad de cuidados postanestésicos (PACU), complicaciones pulmonares postoperatorias y necesidad de reintubación. Aunque había pruebas que documentaban con claridad que el monitoreo cuantitativo reducía considerablemente el riesgo de PRNB, estos dispositivos se aplicaban con poca frecuencia en la práctica clínica. Los posibles motivos por los que los médicos clínicos tardaron en adoptar el monitoreo cuantitativo fueron la creencia incorrecta de que el PRNB era un problema poco frecuente, la inaccesibilidad a dispositivos simples y fáciles de usar, y la dependencia excesiva de indicadores insensibles de recuperación neuromuscular (levantamiento de cabeza durante 5 segundos y sin fenómeno de debilitamiento observado en la estimulación del TOF). Robert Stoelting concluyó diciendo que las asociaciones de profesionales de la anestesia en América del Norte deberían recomendar el uso de monitoreo neuromuscular (cualitativo e, idealmente, cuantitativo) cada vez que se administren relajantes musculares.
En el segundo artículo, los investigadores de Massachusetts General Hospital, Boston, MA, informaron de una iniciativa basada en la evidencia establecida en su hospital para disminuir la incidencia de PRNB.2 Esta iniciativa consistía en cuatro componentes: la implementación de un programa educativo; la distribución de una ayuda cognitiva; la formulación de comentarios sobre el progreso de cada departamento, y la adopción de un requisito de documentación sobre el TOF para el bono de incentivo trimestral de mejora de calidad (QI) correspondiente a cada departamento. En las presentaciones a nivel del departamento, se incluía información sobre la incidencia de PRNB y los resultados clínicos correspondientes. La ayuda cognitiva, que era una guía de dosificación de neostigmina basada en el TOF, se distribuyó a todos los miembros del departamento. Por último, los bonos trimestrales de QI estaban vinculados a la tasa de documentación de cantidad de respuestas contráctiles (recuento de TOF) en un plazo de 15 minutos después de la administración de neostigmina. Esta iniciativa fue el ejemplo de un enfoque interdisciplinario integrado para fomentar la adopción continua de mejores prácticas asociadas al manejo neuromuscular, que se fijaron con el objetivo de reducir el PRNB y mejorar la seguridad del paciente.
En un tercer artículo, se trataron el desarrollo y la historia regulatoria del sugammadex en los Estados Unidos.3 Anton Bom, MD, del Neuromuscular Research Group en Organon (Newhouse, Escocia), determinó que las ciclodextrinas (cyclodextrins) modificadas no se enlazarían a los relajantes musculares esteroideos. El primer estudio en humanos con este nuevo fármaco se hizo y publicó en 2005, y el sugammadex recibió la aprobación de las autoridades reguladoras de la Unión Europea en 2008. Al mismo tiempo en los Estados Unidos, la FDA emitió una carta de rechazo debido a preocupaciones relacionadas con posibles reacciones anafilácticas, así como los posibles efectos del medicamento sobre la coagulación y el intervalo QT en los ECG. Después de hacer más estudios y más presentaciones ante la FDA, el sugammadex recibió la aprobación de esta autoridad el 16 de diciembre de 2015.
En el cuarto artículo, Karl Hammermeister, MD, y colegas expusieron brevemente la bibliografía que examinaba el impacto de las estrategias de manejo neuromuscular sobre los resultados postoperatorios.4 En una investigación temprana a gran escala de Beecher y Todd (1954), se informó de que la mortalidad postoperatoria era seis veces mayor en pacientes a los que se les administraba relajantes musculares, comparada con una cohorte a la que no se le había administrado dichos fármacos.5 Hammermeister y otros destacaron que solo había algunos estudios publicados en los que se comparaban los resultados de pacientes que recibían reversores frente a los que no recibían ninguno. En un ensayo clínico a gran escala de Debaene y otros, se examinó el riesgo de PRNB en pacientes que recibieron una sola dosis de relajantes musculares sin reversores por intubación. Los investigadores informaron de que después de dos o más horas de haber recibido relajantes musculares, el 37 % de los pacientes tuvieron relación del TOF < 0,9.6 El estudio concluyó con una declaración de que hubo un consenso en la bibliografía en cuanto a que el PRNB era frecuente y estaba asociado a un mayor riesgo de resultados adversos, particularmente respiratorios. Además, el monitoreo neuromuscular y la reversión correspondiente con neostigmina variaban mucho entre los profesionales de la anestesia, y es probable que estas prácticas representaran la alta incidencia de PRNB.
¿Qué es lo que sabemos ahora del manejo neuromuscular y los resultados postoperatorios?
Desde la publicación del Boletín informativo de la APSF en febrero de 2016, se han publicado una gran cantidad de estudios clínicos en los que se examinaron la incidencia de PRNB en las prácticas clínicas, las complicaciones asociadas al PRNB, el efecto de las estrategias de reversión sobre los resultados después de la cirugía y el desarrollo de nuevos monitores cuantitativos.
Incidencia de PRNB
Mediante las investigaciones, se ha continuado documentando una alta incidencia de PRNB en las prácticas de anestesia a nivel mundial. El estudio RECITE-US calculó las proporciones del TOF en 255 pacientes que se hicieron una cirugía abdominal en los Estados Unidos.7 Los investigadores observaron que la mayoría de los pacientes (64,7 %) tuvieron proporciones del TOF < 0,9 en el momento de la extubación traqueal, a pesar de la reversión de rocuronio con neostigmina y el uso de estimulación nerviosa periférica cualitativa. Se observaron hallazgos similares en los ensayos RECITE hechos en Canadá8 y China.9 Estos hallazgos indican que el PRNB continúa siendo una complicación frecuente de la anestesia cuando no se usan el monitoreo cuantitativo ni el sugammadex.
Complicaciones asociadas al PRNB
Los pacientes con proporciones del TOF < 0,9 en la PACU tienen un mayor riesgo de resultados respiratorios adversos. En un estudio multicéntrico a gran escala de España, se informó de que los pacientes con proporciones del TOF < 0,9 en la PACU tenían un mayor riesgo de sufrir eventos respiratorios adversos después de la cirugía (cociente de posibilidades [OR]: 2,57) y una mayor incidencia de reintubación.10 En otra investigación, se determinó que el único factor de predicción independiente más importante para los eventos respiratorios adversos durante la primera etapa de recuperación de la anestesia y la cirugía era el PRNB (OR: 6,4).11 En un estudio retrospectivo de cohortes, en el que se evaluó el efecto del PRNB sobre las tasas de ingreso en la UCI, los costos hospitalarios y la duración de la hospitalización, se informó de que los pacientes con proporciones del TOF < 0,9 tenían tres veces más riesgo de ingresar a la UCI que aquellos con proporciones del TOF ≥ 0,9.12
Efecto de las estrategias de reversión sobre los resultados postoperatorios
Si no se revierte el bloqueo neuromuscular, este puede aumentar el riesgo de complicaciones pulmonares postoperatorias. En una investigación basada en datos a gran escala, Bulka y otros observaron que los pacientes que no recibieron reversores tenían un riesgo 2,3 veces más alto de sufrir neumonía postoperatoria en comparación con aquellos que recibieron neostigmina.13 En una gran investigación similar en 11 355 pacientes quirúrgicos, la incidencia de complicaciones respiratorias postoperatorias (definidas como extubaciones fallidas, neumonía o reintubación) fue considerablemente superior en pacientes que no tuvieron reversión frente a aquellos que recibieron neostigmina.14 En una tercera investigación basada en datos, se determinó que los pacientes que no tuvieron reversión (frente a los que recibieron neostigmina como reversor) tuvieron mayores incidencias de sufrir complicaciones graves (6,05 % frente al 1,7 %), necesitaron reintubación (4,6 % frente al 0,8 %) y tuvieron ingresos no planificados en la UCI (3,2 % frente al 0,8 %).15
En estudios recientes, se ha documentado que el sugammadex puede reducir considerablemente el riesgo de PRNB y tener un efecto favorable en los resultados asociados al PRNB. Oh y cols. recopilaron retrospectivamente los datos en 1479 pacientes sometidos a cirugía abdominal y cuyo bloqueo neuromuscular se revirtió con neostigmina o sugammadex.16 Los pacientes del grupo de sugammadex tuvieron una tasa de reingreso no planificado a 30 días un 34 % inferior, hospitalizaciones un 20 % más cortas y una reducción del 24 % de gastos hospitalarios. En un estudio observacional prospectivo (558 pacientes), se informó de que las complicaciones respiratorias graves (neumonía o atelectasia) ocurrieron en el 1,1 % de los pacientes que recibieron sugammadex como reversor frente a un 7,2 % a 9,7 % de todos los pacientes que no recibieron neostigmina ni otra terapia de reversión.17 Se usó monitoreo neuromuscular solo en aproximadamente el 30 % de los pacientes de cada grupo, lo que podría haber explicado la falta de beneficios observados con la reversión con neostigmina (este fármaco no es eficaz si se administra en un grado de bloqueo más profundo). En un estudio observacional multicéntrico a gran escala con cohortes emparejadas, se examinó el efecto de la opción de usar reversores (neostigmina o sugammadex) para complicaciones pulmonares postoperatorias graves (neumonía, insuficiencia respiratoria u otras complicaciones pulmonares).18 En el estudio, se emparejó a 22 856 pacientes que recibían sugammadex con 22 856 pacientes que recibían neostigmina. Los investigadores observaron que la administración de sugammadex estaba asociada a una reducción del 30 % del riesgo de tener complicaciones pulmonares, a una reducción del 47 % del riesgo de tener neumonía y a una reducción del 55 % del riesgo de tener insuficiencia respiratoria. A diferencia de estos estudios, en un estudio observacional multicéntrico a gran escala (POPULAR), no se halló que la administración de reversores estuviera asociada a la reducción del riesgo de complicaciones pulmonares postoperatorias.19 Tampoco se observaron mejores resultados pulmonares en pacientes que recibieron sugammadex frente a aquellos que recibieron neostigmina. Sin embargo, posteriormente se publicaron varias cartas al editor en las que se exponían preocupaciones relacionadas con el estudio, que incluían limitaciones inherentes en muchos estudios observacionales, entre ellas, la falta de estandarización del manejo de anestésicos, ventilación o fluidos; el manejo inadecuado del monitoreo y la reversión del bloqueo neuromuscular, y la incapacidad para supervisar posibles incumplimientos del protocolo u otros factores que provoquen sesgos.
Nuevos monitores cuantitativos
En una reciente declaración de consenso sobre el uso del monitoreo perioperatorio, se recomendaba el uso de monitores cuantitativos siempre que se administraran relajantes musculares no despolarizantes.20 Sin embargo, para que los monitores objetivos tengan una aceptación generalizada en la práctica clínica, se necesitan mejorar los diseños de los dispositivos de manera que su función no se vea afectada por la posición de las manos del paciente, los monitores puedan autocalibrarse, se puedan obtener resultados confiables y reproducibles, y los tiempos de configuración del monitor sean mínimos.16 A diferencia de la tecnología de primera generación, los monitores cuantitativos recientemente desarrollados aparentan cumplir la mayoría de estos criterios. Hace poco, se incorporó la tecnología aceleromiográfica tridimensional (AMG) a los monitores cuantitativos desarrollados para uso intraoperatorio de rutina. Se ha observado una buena armonía entre el dispositivo TOF-Watch SX con calibración y aplicación de precarga (“estándar de referencia” clínico) y el monitor de aceleromiografía tridimensional no calibrado en todas las etapas de recuperación neuromuscular.21 Los dispositivos electromiográficos portátiles (EMG) también se han desarrollado y aprobado recientemente para la atención clínica de rutina. Los datos de las proporciones del tren de cuatro pueden obtenerse rápidamente colocando una tira de electrodo sobre la mano y conectándola al cable. Los monitores de EMG aportan datos cuantitativos precisos sin la necesidad de inmovilizar el músculo estudiado, de tener la aplicación de precarga ni de mantener el movimiento libre del pulgar (los brazos pueden ubicarse a los costados).20 Sin embargo, se necesitan más estudios para evaluar la precisión y la confiabilidad de estos nuevos monitores cuantitativos en las prácticas clínicas.
Conclusiones
Pese a los avances en la farmacología y la tecnología con el paso del tiempo, el PRNB continúa siendo frecuente en la práctica clínica y su tasa se mantiene básicamente sin cambios desde hace cuatro décadas. Estos artículos importantes publicados en el Boletín informativo de la APSF en febrero de 2016 ayudaron a tomar conciencia de este grave problema de seguridad del paciente y a preparar el camino para continuar investigando y haciendo mejoras en la atención clínica. Con el uso creciente del sugammadex (las dosis adecuadas se basan en el monitoreo neuromuscular) y del monitoreo cuantitativo por parte de los equipos de atención anestésica, es probable que el riesgo de que los pacientes sufran complicaciones asociadas al PRNB se reduzca en la próxima década.
Glenn Murphy, MD, actualmente es profesor clínico en el Departamento de Anestesia y Cuidados Intensivos de la University of Chicago y director de Investigación Clínica en el Departamento de Anestesiología, Cuidados Intensivos y Medicina del Dolor del NorthShore University HealthSystem.
El Dr. Murphy también es orador de Merck.
Referencias
- Stoelting RK. Monitoring of neuromuscular blockade: what would you expect if you were the patient? APSF Newsletter. 2016;30:45,47. https://www.apsf.org/article/monitoring-of-neuromuscular-blockade-what-would-you-expect-if-you-were-the-patient/ Accessed August 25, 2020.
- van Pelt M, Chitilian HV, Eikermann M. Multi-faceted initiative designed to improve safety of neuromuscular blockade. APSF Newsletter. 2016;30:51–52. https://www.apsf.org/article/multi-faceted-initiative-designed-to-improve-safety-of-neuromuscular-blockade/ Accessed August 25, 2020.
- Murphy GS. The development and regulatory history of sugammadex in the United States. APSF Newsletter. 2016; 53–54. https://www.apsf.org/article/the-development-and-regulatory-history-of-sugammadex-in-the-united-states/ Accessed August 25, 2020.
- Hammermeister KC, Bronsert M, Richman JS, Hensderson WG. Residual neuromuscular blockade (RNB), reversal, and perioperative outcomes. APSF Newsletter. 2016;30:74-75. https://www.apsf.org/article/residual-neuromuscular-blockade-nmb-reversal-and-perioperative-outcomes/ Accessed August 28,2020.
- Beecher HK, Todd DP. A Study of deaths associated with anesthesia and surgery. 1954. Int Anesthesiol Clin. 2007;45:1–6.
- Debaene B, Plaud B, Dilly M-P, et al. Residual paralysis in the PACU after a single intubating dose of nondepolarizing muscle relaxant with an intermediate duration of action. Anesthesiology. 2003;98:1042–1048.
- Saager L, Maiese EM, Bash LD, et al. Incidence, risk factors, and consequences of residual neuromuscular block in the United States: The prospective, observational, multicenter RECITE-US study. J Clin Anesth. 2019;55:33–41.
- Fortier LP, McKeen D, Turner K, et al. The RECITE Study: a Canadian prospective, multicenter study of the incidence and severity of residual neuromuscurlar blockade. Anesth Analg. 2015;121:366–72.
- Yu B, Ouyang B, Ge S, et al. RECITE–China Investigators. Incidence of postoperative residual neuromuscular blockade after general anesthesia: a prospective, multicenter, anesthetist-blind, observational study. Curr Med Res Opin. 2016;32:1–9.
- Errando CL, Garutti I, Mazzinari G, et al. Residual neuromuscular blockade in the postanesthesia care unit: observational cross-sectional study of a multicenter cohort. Minerva Anestesiol. 2016;82:1267–1277.
- Xará D, Santos A, Abelha F. Adverse respiratory events in the post-anesthesia care unit. Arch Bronconeumol. 2015;51:69–75.
- Grabitz SD, Rajaratnam N, Chhagani K, et al. The effects of postoperative residual neuromuscular blockade on hospital costs and intensive care unit admission: a population-based cohort study. Anesth Analg. 2019;128:1129–1136.
- Bulka CM, Terekhov MA, Martin BJ, et al. Nondepolarizing neuromuscular blocking agents, reversal, and risk of postoperative pneumonia. Anesthesiology. 2016;125:647–55.
- Bronsert MR, Henderson WG, Monk TG, et al. Intermediate-acting nondepolarizing neuromuscular blocking agents and risk of postoperative 30-day morbidity and mortality, and long-term survival. Anesth Analg. 2017;124:1476–1483.
- Belcher AW, Leung S, Cohen B, et al. Incidence of complications in the post-anesthesia care unit and associated healthcare utilization in patients undergoing non-cardiac surgery requiring neuromuscular blockade 2005–2013: a single center study. J Clin Anesth. 2017;43:33–38.
- Oh TK, Oh AY, Ryu JH, et al. Retrospective analysis of 30-day unplanned readmission after major with reversal by sugammadex or neostigmine. Br J Anaesth. 2019;122:370–378.
- Martinez-Ubieto J, Ortega-Lucea S, Pascual-Bellosta A, et al. Prospective study of residual neuromuscular block and postoperative respiratory complications in patients reversed with neostigmine versus sugammadex. Minerva Anestesiol. 2016;82:735–742.
- Kheterpal S, Vaughn MT, Dubovoy TZ, et al. Sugammadex versus neostigmine for reversal of neuromuscular blockade and postoperative pulmonary complications (STRONGER): a multicenter matched control cohort analysis. Anesthesiology. 2020;132:1371–1381.
- Kirmeier E, Eriksson LI, Lewald H, et al. POPULAR Contributors. Post-anaesthesia pulmonary complications after use of muscle relaxants (POPULAR): a multicentre, prospective observational study. Lancet Respir Med. 2019;7:129–140.
- Naguib M, Brull SJ, Kopman AF, et al. Consensus statement on perioperative use of neuromuscular monitoring. Anesth Analg. 2018; 127:71–80.
- Murphy GS, Szokol JW, Avram MJ, et al. Comparison of the TOFscan and the TOF-Watch SX during recovery of neuromuscular function. Anesthesiology. 2018;129:880–888.


 Issue PDF
Issue PDF