元の記事はオンラインで参照可能:https://www.apsf.org/article/monitoring-of-neuromuscular-blockade-what-would-you-expect-if-you-were-the-patient/
神経筋遮断の注意深い術中管理は、患者の回復を最適化し、術後転帰を改善する可能性がある。2016年2月のAPSFニュースレターの4つの重要な記事は、術後の残存神経筋遮断薬(PRNB)が患者安全における重要な問題である理由、神経筋遮断薬の適切な投与、モニタリングの方法、そして回復が麻酔と術後合併症の発生率を減少させられることについて示している。
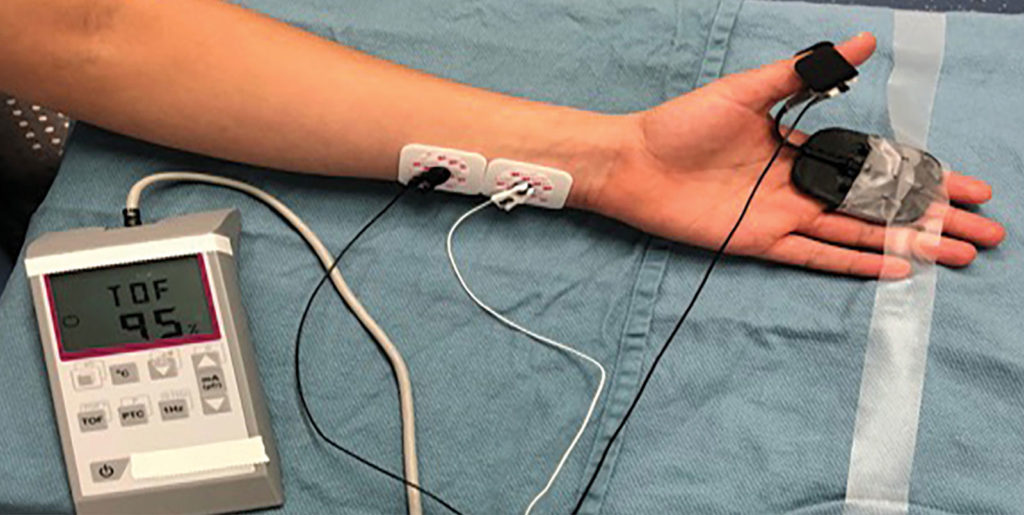
最初の記事では、Robert Stoelting、MDが周術期における定性的モニタリング(末梢神経刺激装置)および定量的モニタリング(筋肉機能を客観的に測定し結果を表示するデバイス)の使用に関するAPSFの意見を要約した。 (図1)。1 APSFは、筋弛緩薬を投与されているすべての患者が、抜管前に回復薬の必要性と神経筋機能が十分であるかを評価するために、少なくとも定性的モニタリングを、可能であれば定量的モニタリングを行うことを推奨している。ここでは、PRNBが著しく過小評価されている問題であり、患者の40%にも発生しうると述べた文献が引用されている。トレインオブフォー(train-of-four: TOF)比が0.9未満(適切な神経筋遮断の回復に対する閾値)の患者は、低酸素血症、気道閉塞、咽頭機能障害、誤嚥リスクの増加、PACU退室の遅延、術後肺合併症、再挿管の増加など、多くの有害事象のリスクとなることが示された。定量的モニタリングがPRNBのリスクを有意に低減できることが明確に示されているにもかかわらず、これらのデバイスが臨床で使用されることは稀である。臨床医が定量的モニタリングを採用する動きが鈍い理由として考えられるのは、PRNBは稀な出来事であるという誤認、シンプルで使いやすいデバイスが利用できないこと、神経筋遮断の回復に対して感度の低い指標(5秒間の頭部挙上とTOF刺激でフェードがない状況)への過信などであろう。Robert Stoeltingは、北米麻酔専門職会が筋弛緩薬を投与する場合には常に筋弛緩モニタリング(定性的、理想的には定量的)を使用することを推奨する必要があると結んでいる。
2番目の記事では、マサチューセッツ州ボストンのマサチューセッツ総合病院の研究者が、PRNBの発生率を減らすために病院で開始されたエビデンスに基づくイニシアチブについて報告した。2 このイニシアチブは、次の4つの要素で構成されている。教育プログラムの実施;PRNB認知の助けとなるものの配布;部門の進捗状況に関するフィードバックの提供; TOFを記録することを部門における四半期ごとのクオリティインプルーブメント(QI)インセンティブボーナスを得るための必要条件とすること。部門全体のプレゼンテーションによって、PRNBの発生率と関連する臨床転帰に関する情報を共有できた。認知の助けとなるものとしてTOFベースのネオスチグミン投与量ガイドが作られ、これは部門のすべてのメンバーに配布された。最後に、四半期ごとのQIボーナスを、ネオスチグミン投与から15分以内の単収縮数(TOFカウント)の記録率に関連付けることとした。このイニシアチブは、PRNBの削減と患者安全の向上を目的として開始され、神経筋管理に関連するベストプラクティスを持続的に行うことを促進するための統合された学際的アプローチの一例であった。
3番目の記事では、米国におけるスガマデクスの開発と規制の歴史について概説した。3 ScotlandのNewhouseにあるOrganonのNeuromuscular Research GroupのAnton Bom, MDは、修飾されたシクロデキストリンがステロイド性筋弛緩薬に結合することを見出した。この新しい薬剤を用いたヒトにおける最初の研究は2005年に実施・公表され、スガマデクスとして2008年に欧州連合で規制当局の承認を受けた。同時期に、米国では、FDAがアナフィラキシー反応の可能性、および凝固とEKGのQT間隔に対する薬剤の潜在的な影響に関する懸念をもとに承認不可とした。追加の研究を行いFDAへ再度承認申請を行った結果、スガマデクスは2015年12月16日にFDAの承認を受けている。
4番目の記事では、Karl Hammermeister, MDらが、神経筋遮断管理戦略の術後合併症に対する影響を調べた文献を簡潔にレビューした。4 BeecherとTodd(1954)による初期の大規模調査では、筋弛緩薬なしで管理されたコホートと比較して、これらの薬剤を投与された患者では術後死亡率が6倍高かったことが報告された。5 Hammermeisterらは、回復薬を投与された患者と投与されなかった患者の転帰を比較した研究はわずかしか発表されていないことを指摘している。Debaeneらによる大規模な臨床試験では、気管挿管時の筋弛緩薬の単回投与のみを受け、回復薬の投与を受けていない患者におけるPRNBのリスクが調べられた。この研究では筋弛緩薬の投与から2時間以上経過した患者の37%がTOF比<0.9であった。6 このレビューでは、PRNBが決して稀なものではなく、有害事象、特に呼吸器系合併症のリスク増加に関連しているという文献的コンセンサスが得られていると結ばれている。付け加えると、筋弛緩モニタリングとネオスチグミンによる適切な拮抗は、麻酔専門職間で非常にばらつきがあり、このばらつきがPRNBの発生率の高さの原因かもしれない。
神経筋遮断の管理と術後転帰についての現在の知見
2016年2月に発行されたAPSFニュースレター以来、多数の臨床研究が発行されている。これらのうち臨床におけるPRNBの発生率、PRNBに関連する合併症、神経筋遮断の回復戦略がその術後予後に与える影響、および新しい定量的モニターの開発に関してを取り上げる。
PRNBの発生率
様々な研究により世界中の麻酔臨床現場でPRNB発生率が高止まりしていることが明らかになっている。RECITE-US研究では、米国で腹部手術を受けた255人の患者のTOF比を測定した。7 この研究では、ネオスチグミンによるロクロニウムの拮抗と定性的な末梢神経刺激の使用にもかかわらず、患者の大多数(64.7%)が抜管時にTOF比が0.9未満であったことが観察された。カナダ8 と中国で実施されたRECITE試験でも同様の結果が得られた。9 これらの所見は、定量的モニタリングとスガマデクスを使用しない場合、PRNBが一般的な麻酔合併症であり続けることを示唆している。
PRNBに関連する合併症
PACUでTOF比が0.9未満の患者は、呼吸器系合併症のリスクが増加することが明らかになっている。スペインの大規模な多施設共同研究で、PACUでTOF比が0.9未満の患者は、術後の呼吸器有害事象のリスクが高く(オッズ比 [OR] 2.57)、再挿管率が高いことが報告された。10 別の研究では、術後早期の呼吸器有害事象に関する単一の最も重要な独立した予測因子がPRNB(OR 6.4)であった。11 PRNBがICU入室率、入院費用、在院日数に与える影響を評価した後ろ向きコホート研究では、TOF比0.9以上の患者と比較しTOF比が0.9未満の患者はICU入室のリスクが3倍高いことが報告された。12
神経筋遮断の回復戦略がその術後予後に与える影響
神経筋遮断の回復に失敗すると、術後の肺合併症のリスクが高まる可能性がある。Bulkaらは大規模データベース研究で、ネオスチグミンを投与された患者と比較して、拮抗薬を投与されなかった患者は術後肺炎のリスクが2.3倍高いことを明らかにした。13 11,355人の外科患者を対象とした同様の大規模研究では、術後呼吸器合併症(呼吸器離脱不能、肺炎、再挿管と定義)の発生率は、ネオスチグミンを投与された患者と比較して、拮抗しなかった患者で有意に高かった。14 3番目のデータベース研究では、(ネオスチグミンによる拮抗と比較し)拮抗しなかった患者は、主要合併症の発生率(6.05%対1.7%)、再挿管率(4.6%対0.8%)、および計画外のICU入室率(3.2%対0.8%)のそれぞれが高くなっていた。15
最近の研究では、スガマデクスがPRNBのリスクを大幅に低減し、PRNBに関連する有害事象に対して良い影響を与える可能性があることが報告されている。Ohらは、ネオスチグミンまたはスガマデクスのいずれかで神経筋遮断の回復が行われた腹部手術を受けた1,479人の患者について後ろ向きの解析を行った。16 この研究のスガマデクス群の患者において、30日間の計画外再入院率の34%低減、在院日数の20%短縮、入院費の24%削減を認めた。別の前向き観察研究(558人の患者)において、主要な呼吸器合併症(肺炎または無気肺)の発生率がスガマデクスで回復させた患者で1.1%であったのに対し、ネオスチグミンで拮抗した患者あるいは拮抗自体をしなかった患者で7.2%から9.7%であった。17 筋弛緩モニタリングは、各グループの患者の約30%でしか使用されず、これがネオスチグミンによる拮抗ではbenefitがみられなかったことの原因かもしれない(ネオスチグミンは、より深いレベルの遮断で投与された場合は効果を認めない)。別の大規模多施設マッチドコホート観察研究では、術後主要肺合併症(肺炎、呼吸不全、またはその他の肺合併症)に回復薬(ネオスチグミンまたはスガマデクス)の選択がどう影響するかが検討された。18 この研究では、スガマデクスを投与された患者22,856人に対し、22,856人のネオスチグミンを投与された患者をマッチさせた。本研究では、肺合併症リスクの30%減少、肺炎発症リスクの47%減少、呼吸不全リスクの55%減少がスガマデクス投与に関連しているとの結果が得られた。これらの研究とは対照的に、POPULARという大規模多施設観察研究では、回復薬の投与が術後肺合併症のリスク低下と関連していることは認められなかった。19 さらに、ネオスチグミンを投与された患者との比較において、スガマデクスを投与された患者で肺合併症率は同様であった。しかし、その後多数のLetters to the Editorによって、麻酔薬・換気条件・輸液管理の標準化の欠如、神経筋モニタリングと神経筋遮断の回復における不適切な管理、潜在的なプロトコル違反・バイアスをもたらす他の要因をチェックできないなどといった観察研究にありがちな観察研究固有の制限などの研究に関連する懸念が指摘された。
新しい定量的モニター
周術期モニタリングの使用に関する最近のコンセンサスステートメントでは、非脱分極性筋弛緩薬が投与された場合は常に定量的モニターを使用することが推奨されている。20 ただし、客観的なモニターが臨床診療に広く受け入れられるためには、以下の条件が求められる。デバイスの機能が患者の手の位置に影響されないような設計の改善、モニターの自己校正機能および信頼性および再現性の高さ、最小限のセットアップ時間であること、この三つである。16 第一世代の技術とは異なり、最近開発された定量的モニターはこれらの基準をほぼ満たしているようだ。三次元加速度筋運動記録(AMG)技術は、最近になって定められた術中の基本的な使用のための定量的モニターに組み込まれた。神経筋遮断の回復のすべての段階で、予め設置しキャリブレーションしたTOF-Watch SX(臨床的「ゴールドスタンダード」)と、キャリブレーションされていない3次元加速度筋運動記録モニターの間の良好な一致が確認されている。21 ポータブル筋電図(EMG)デバイスも最近開発・承認されている。手に電極を設置し、ケーブルに接続することでTOF比データはすぐに取得できる。EMGモニターは、筋肉を固定したり、予め設置しておいたり、親指を自由に動かせるようにしておいたりする必要なし(腕を巻き込むことができる)に、正確な定量的データを提供する。20 ただし、臨床診療におけるこれらの新しい定量的モニターの精度と信頼性を評価するには、さらなる研究が必要である。
結語
薬理学と技術が経時的に進歩しているにもかかわらず、PRNBは臨床現場で頻繁に発生し続けており、その頻度は40年間基本的に変化していない。2016年2月に発行されたAPSFニュースレターの重要な記事は、この重要な患者安全の問題に対する認識を高め、さらなる研究と臨床ケアの改善の道を開くのに役立った。麻酔ケアチームによるスガマデクス(神経筋モニタリングに基づいて適切に投与)の使用と定量的モニタリングの適用が増えるにしたがって、PRNBによる合併症で苦しむ患者は遠くない未来に減少するだろう。
Glenn Murphy, MDは現在、シカゴ大学の麻酔・救命救急科の臨床教授であり、ノースショア大学ヘルスシステムの麻酔・救命救急・疼痛医学の臨床研究部門責任者である。
Dr. Murphyは現在、Merckの講演を行っている。
参考文献
- Stoelting RK. Monitoring of neuromuscular blockade: what would you expect if you were the patient? APSF Newsletter. 2016;30:45,47. https://www.apsf.org/article/monitoring-of-neuromuscular-blockade-what-would-you-expect-if-you-were-the-patient/ Accessed August 25, 2020.
- van Pelt M, Chitilian HV, Eikermann M. Multi-faceted initiative designed to improve safety of neuromuscular blockade. APSF Newsletter. 2016;30:51–52. https://www.apsf.org/article/multi-faceted-initiative-designed-to-improve-safety-of-neuromuscular-blockade/ Accessed August 25, 2020.
- Murphy GS. The development and regulatory history of sugammadex in the United States. APSF Newsletter. 2016; 53–54. https://www.apsf.org/article/the-development-and-regulatory-history-of-sugammadex-in-the-united-states/ Accessed August 25, 2020.
- Hammermeister KC, Bronsert M, Richman JS, Hensderson WG. Residual neuromuscular blockade (RNB), reversal, and perioperative outcomes. APSF Newsletter. 2016;30:74-75. https://www.apsf.org/article/residual-neuromuscular-blockade-nmb-reversal-and-perioperative-outcomes/ Accessed August 28,2020.
- Beecher HK, Todd DP. A Study of deaths associated with anesthesia and surgery. 1954. Int Anesthesiol Clin. 2007;45:1–6.
- Debaene B, Plaud B, Dilly M-P, et al. Residual paralysis in the PACU after a single intubating dose of nondepolarizing muscle relaxant with an intermediate duration of action. Anesthesiology. 2003;98:1042–1048.
- Saager L, Maiese EM, Bash LD, et al. Incidence, risk factors, and consequences of residual neuromuscular block in the United States: The prospective, observational, multicenter RECITE-US study. J Clin Anesth. 2019;55:33–41.
- Fortier LP, McKeen D, Turner K, et al. The RECITE Study: a Canadian prospective, multicenter study of the incidence and severity of residual neuromuscurlar blockade. Anesth Analg. 2015;121:366–72.
- Yu B, Ouyang B, Ge S, et al. RECITE–China Investigators. Incidence of postoperative residual neuromuscular blockade after general anesthesia: a prospective, multicenter, anesthetist-blind, observational study. Curr Med Res Opin. 2016;32:1–9.
- Errando CL, Garutti I, Mazzinari G, et al. Residual neuromuscular blockade in the postanesthesia care unit: observational cross-sectional study of a multicenter cohort. Minerva Anestesiol. 2016;82:1267–1277.
- Xará D, Santos A, Abelha F. Adverse respiratory events in the post-anesthesia care unit. Arch Bronconeumol. 2015;51:69–75.
- Grabitz SD, Rajaratnam N, Chhagani K, et al. The effects of postoperative residual neuromuscular blockade on hospital costs and intensive care unit admission: a population-based cohort study. Anesth Analg. 2019;128:1129–1136.
- Bulka CM, Terekhov MA, Martin BJ, et al. Nondepolarizing neuromuscular blocking agents, reversal, and risk of postoperative pneumonia. Anesthesiology. 2016;125:647–55.
- Bronsert MR, Henderson WG, Monk TG, et al. Intermediate-acting nondepolarizing neuromuscular blocking agents and risk of postoperative 30-day morbidity and mortality, and long-term survival. Anesth Analg. 2017;124:1476–1483.
- Belcher AW, Leung S, Cohen B, et al. Incidence of complications in the post-anesthesia care unit and associated healthcare utilization in patients undergoing non-cardiac surgery requiring neuromuscular blockade 2005–2013: a single center study. J Clin Anesth. 2017;43:33–38.
- Oh TK, Oh AY, Ryu JH, et al. Retrospective analysis of 30-day unplanned readmission after major with reversal by sugammadex or neostigmine. Br J Anaesth. 2019;122:370–378.
- Martinez-Ubieto J, Ortega-Lucea S, Pascual-Bellosta A, et al. Prospective study of residual neuromuscular block and postoperative respiratory complications in patients reversed with neostigmine versus sugammadex. Minerva Anestesiol. 2016;82:735–742.
- Kheterpal S, Vaughn MT, Dubovoy TZ, et al. Sugammadex versus neostigmine for reversal of neuromuscular blockade and postoperative pulmonary complications (STRONGER): a multicenter matched control cohort analysis. Anesthesiology. 2020;132:1371–1381.
- Kirmeier E, Eriksson LI, Lewald H, et al. POPULAR Contributors. Post-anaesthesia pulmonary complications after use of muscle relaxants (POPULAR): a multicentre, prospective observational study. Lancet Respir Med. 2019;7:129–140.
- Naguib M, Brull SJ, Kopman AF, et al. Consensus statement on perioperative use of neuromuscular monitoring. Anesth Analg. 2018; 127:71–80.
- Murphy GS, Szokol JW, Avram MJ, et al. Comparison of the TOFscan and the TOF-Watch SX during recovery of neuromuscular function. Anesthesiology. 2018;129:880–888.


 Issue PDF
Issue PDF