Voir l’article initial en ligne à : https://www.apsf.org/article/monitoring-of-neuromuscular-blockade-what-would-you-expect-if-you-were-the-patient/
Une gestion peropératoire attentive du bloc neuromusculaire peut permettre d’optimiser la récupération des patients et d’améliorer les résultats postopératoires. Quatre articles importants dans le numéro de février 2016 du Bulletin d’information de l’APSF ont décrit les raisons pour lesquelles la curarisation résiduelle postopératoire (CuRP) était une question importante de sécurité des patients et comment des doses, une surveillance et une décurarisation appropriées pouvaient réduire l’incidence de cette complication après une anesthésie et une chirurgie.
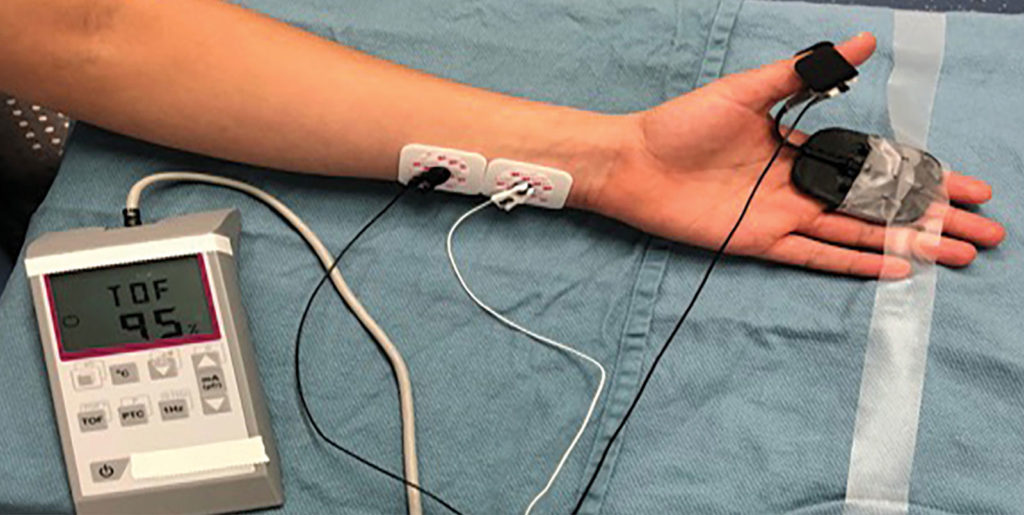
Figure 1 : Description d’un moniteur quantitatif de bloc neuromusculaire appliqué au nerf ulnaire d’un patient.
Dans le premier article, Robert Stoelting, MD, a résumé les opinions de l’APSF concernant l’utilisation du monitorage qualitatif (neurostimulateur périphérique) et du monitorage quantitatif (dispositifs qui mesurent objectivement la fonction musculaire et affichent les résultats) dans la période périopératoire (Figure 1).1 L’APSF recommandait que chaque patient auquel était administré un curare bénéficie au moins du monitorage qualitatif et aussi, de préférence, du monitorage quantitatif, afin d’évaluer les besoins en antagonistes et l’adéquation de la fonction neuromusculaire avant l’extubation trachéale. Des recherches ont été menées dans la littérature, permettant de documenter le fait que la CuRP était un problème extrêmement sous-estimé, qui survenait jusque dans 40 % des cas. Les sujets présentant un ratio TOF (train-de-quatre) < 0,9 (le seuil de récupération neuromusculaire adéquat) couraient le risque de plusieurs conséquences défavorables, notamment une hypoxémie, une obstruction des voies respiratoires, une dysfonction pharyngée et un plus grand risque d’inhalation, de retard de sortie de SSPI, de complications pulmonaires postopératoires et de la nécessité d’une réintubation. Bien que les faits aient documenté clairement que le monitorage quantitatif pouvait permettre de réduire considérablement le risque de CuRP, ces dispositifs étaient peu souvent utilisés dans la pratique clinique. Les raisons possibles pour lesquelles les cliniciens n’ont pas adopté rapidement le monitorage quantitatif étaient la croyance erronée que la CuRP était un problème peu courant, le manque de dispositifs simples et faciles d’emploi, et l’excès de confiance vis-à-vis des indicateurs peu sensibles de la récupération neuromusculaire (relevé de tête pendant 5 secondes et l’absence de diminution visible des réponses après stimulation avec un TOF). Robert Stoelting a conclu en déclarant que les associations des anesthésistes d’Amérique du Nord devraient recommander l’utilisation du monitorage neuromusculaire (qualitatif et dans l’idéal, quantitatif) à chaque fois que des curares étaient administrés.
Dans le deuxième article, les chercheurs du Massachusetts General Hospital, Boston, dans le Massachusetts, ont dressé un rapport sur une initiative fondée sur des faits, instaurée dans leur hôpital pour faire baisser le nombre de CuRP.2 Cette initiative s’articulait autour de quatre éléments : mise en œuvre d’un programme éducatif, distribution d’une aide cognitive, feedback concernant les progrès réalisés dans le département et adoption d’une exigence de documentation du TOF pour la prime incitative trimestrielle visant à l’amélioration de la qualité du Département. Des présentations effectuées à travers l’ensemble du Département ont permis de donner des informations à propos de l’incidence des CuRP et des conséquences cliniques associées. L’aide cognitive, qui était un guide sur le dosage de la néostigmine en fonction du TOF, a été distribuée à tous les membres du Département. Enfin, les primes trimestrielles d’amélioration de la qualité ont été liées au taux de documentation du nombre de contraction musculaire (compte TOF) dans les 15 minutes suivant l’administration de la néostigmine. Cette initiative était un exemple d’une approche interdisciplinaire intégrée visant à promouvoir l’adoption durable de bonnes pratiques au titre de la gestion de la curarisation, instaurées dans le but de réduire le nombre de CuRP et d’améliorer la sécurité des patients.
Un troisième article a évalué le développement et l’historique réglementaire du sugammadex aux États-Unis.3 Anton Bom, MD, du Groupe de recherche neuromusculaire à Organon Newhouse Scotland, a déterminé que les cyclodextrines modifiées inhiberaient les curares stéroïdiens. La première étude sur les humains avec ce nouvel agent a été réalisée et publiée en 2005, et le sugammadex a été autorisé par les autorités réglementaires de l’Union européenne en 2008. Au même moment aux États-Unis, la FDA a publié une lettre de non-approbation concernant les inquiétudes liées à de possibles réactions anaphylactiques, ainsi qu’aux effets potentiels du médicament sur la coagulation et l’intervalle QT de l’électrocardiogramme. Après avoir mené plusieurs autres études et avoir fait d’autres propositions à la FDA, le sugammadex a reçu l’approbation de la FDA le 16 décembre 2015.
Dans le quatrième article, Karl Hammermeister, MD, et ses collègues ont passé brièvement la littérature en revue, pour examiner l’impact des stratégies de gestion de la curarisation sur les conséquences postopératoires.4 Une investigation précoce à grande échelle de Beecher et Todd (1954) signalait que le taux de mortalité postopératoire était six fois plus élevé chez des patients auxquels avaient été administrés des curares, par rapport à une cohorte gérée sans ces agents.5 Hammermeister et al. ont noté qu’il existait seulement une poignée d’études publiées qui comparaient les conséquences chez les patients qui avaient reçu des antagonistes par rapport à ceux qui n’en avaient pas bénéficié. Dans un grand essai clinique de Debaene et al., le risque de CuRP a été étudié chez des patients auxquels avait été administrée une seule dose d’intubation d’un curare sans antagoniste. Les chercheurs ont signalé que chez les patients pour lesquels au moins deux heures s’étaient écoulées depuis l’administration du curare, 37 % avait un ratio < 0,9.6 L’étude a conclu à un consensus dans la littérature disant que la CuRP était courante et était associée à un risque accru de conséquences défavorables, en particulier respiratoires. En outre, le monitorage neuromusculaire et la décurarisation appropriée par la néostigmine étaient extrêmement variables parmi les anesthésistes et ces pratiques expliquaient probablement la forte incidence des CuRP.
Que savons-nous désormais de la gestion de la curarisation et des conséquences postopératoires ?
Depuis la publication dans le numéro de février 2016 du Bulletin d’information de l’APSF, un grand nombre d’études cliniques ont été publiées, examinant l’incidence des CURP dans les pratiques cliniques, les complications associées au CuRP, l’impact des stratégies de décurarisation sur le devenir du patient après la chirurgie et le développement de nouveaux moyens de monitorage quantitatif.
Incidence des CuRP
Les recherches ont continué de documenter une forte incidence des CuRP dans les pratiques de l’anesthésie à travers le monde. L’étude RECITE-US a mesuré les ratios TOF chez 255 patients qui subissaient une chirurgie abdominale aux États-Unis.7 Les chercheurs ont observé que la majorité des patients (64,7 %) avaient un ratio TOF < 0,9 au moment de l’extubation trachéale, malgré une décurarisation du rocuronium à la néostigmine et l’utilisation d’une neurostimulation périphérique qualitative. Les essais RECITE réalisés au Canada8 et en Chine9 ont permis de faire les mêmes constatations, qui suggèrent que les CuRP sont toujours une complication courante de l’anesthésie, en l’absence de l’utilisation d’un monitorage quantitatif et de sugammadex.
Complications associées aux CuRP
Les patients dont le ratio TOF est < 0,9 quand ils sont en SSPI ont plus de risque de conséquences respiratoires défavorables. Une grande étude multicentrique menée en Espagne a signalé que les patients avec un ratio TOF < 0,9 en SSPI avaient plus de risque de subir des évènements respiratoires postopératoires défavorables (odds ratio [OR] 2,57) et présentaient une incidence plus grande de réintubation.10 Une autre étude a déterminé que l’indicateur indépendant le plus important d’évènements respiratoires défavorables pendant la phase de réveil initiale après une anesthésie et une chirurgie était la CuRP (OR 6,4).11 Une étude de cohorte rétrospective, qui a évalué l’impact des CuRP sur les taux d’admission en USI, les coûts hospitaliers et la durée de l’hospitalisation a permis de constater que les patients avec un ratio TOF < 0,9 courraient trois fois plus de risque d’être admis en USI que ceux dont le ratio TOF était ≥ 0,9.12
Effet des stratégies de décurarisation sur les suites postopératoires
L’échec de la décurarisation peut faire augmenter le risque de complications pulmonaires postopératoires. Dans une étude d’une grande base de données, Bulka et al. ont observé que les patients auxquels un antagoniste n’avait pas été administré avaient un risque 2,3 fois plus élevé de souffrir d’une pneumonie postopératoire, par rapport à ceux auxquels on avait administré de la néostigmine.13 Dans une grande étude semblable de 11 355 patients chirurgicaux, l’incidence des complications respiratoires postopératoires (définies comme un échec de sevrage, une pneumonie ou une réintubation) était considérablement plus élevée chez les patients qui n’avaient pas bénéficié d’un antagoniste par rapport à ceux qui avaient reçu de la néostigmine.14 Une troisième étude d’une base de données a permis de déterminer que les patients qui n’avaient pas reçu d’antagoniste (par rapport à une décurarisation à la néostigmine) présentaient plus d’incidences de complications majeures (6,05 % contre 1,7 %), de nécessité d’une réintubation (4,6 % contre 0,8 %), et d’admissions imprévues en USI (3,2 % contre 0,8 %).15
Des études récentes ont documenté que le sugammadex pouvait considérablement réduire le risque de CuRP et avoir un impact bénéfique sur le devenir des patients par rapport aux CuRP. Oh et al., dans une étude rétrospective, ont recueilli des données sur 1479 patients qui avaient subi une chirurgie abdominale, dont la décurarisation a été réalisée au moyen de néostigmine ou de sugammadex.16 Les patients du groupe sugammadex présentaient un taux de réadmissions imprévues en USI à 30 jours inférieur de 34 %, une durée d’hospitalisation plus courte de 20 % et une réduction de 24 % des frais hospitaliers. Une étude observationnelle prospective (558 patients) a signalé que les complications respiratoires graves (pneumonie ou atélectasie) survenaient chez 1,1 % des patients traités au sugammadex, contre 7,2 % à 9,7 % de tous les patients qui n’avaient pas été décurarisés ou avaient été décurarisés à la néostigmine.17 Le monitorage neuromusculaire avait été utilisé chez seulement 30 % des patients dans chaque groupe, pouvant éventuellement expliquer l’absence de bénéfices observés avec la décurarisation à la néostigmine (la néostigmine est inefficace si elle est administrée pour décurariser un bloc profond). Une grande étude de cohorte appariée, observationnelle et multicentrique a examiné l’effet du choix de l’antagoniste (néostigmine ou sugammadex) sur les complications pulmonaires postopératoires graves (pneumonie, insuffisance respiratoire ou autres complications pulmonaires).18 Dans le cadre de cette étude, 22 856 patients traités au sugammadex ont été appariés à 22 856 patients traités à la néostigmine. Les chercheurs ont observé que l’administration du sugammadex était associée à une réduction de 30 % du risque de complications pulmonaires, une baisse de 47 % du risque de pneumonie et une réduction de 55 % du risque d’insuffisance respiratoire. En revanche, une grande étude observationnelle multicentrique (POPULAR) n’a pas permis de constater que l’administration d’antagonistes était associée à une réduction du risque de complications pulmonaires postopératoires.19 En outre, les résultats en termes pulmonaires n’étaient pas meilleurs chez les patients traités au sugammadex par rapport à ceux traités à la néostigmine. Cependant, plusieurs Lettres au rédacteur ont été publiées ultérieurement, soulignant les inquiétudes concernant cette étude, à savoir des limitations inhérentes communes à de nombreuses études observationnelles, telles que l’absence de normalisation de la gestion de l’anesthésie, de la ventilation ou des fluides, la mauvaise gestion du monitorage et de la décurarisation et une incapacité à surveiller des violations potentielles des protocoles ou d’autres facteurs causant un biais.
Nouveaux moniteurs quantitatifs
Un consensus récent sur l’utilisation du monitorage périopératoire recommandait l’utilisation du monitorage quantitatif à chaque fois qu’était administré un curare non dépolarisant.20 Cependant, avant que des moniteurs objectifs puissent être couramment acceptés dans les pratiques cliniques, il faudra améliorer la conception des appareils afin que leur fonctionnement ne soit pas affecté par la position de la main du patient, qu’ils effectuent une calibration automatique, qu’ils fournissent des résultats fiables et répétables, et que les temps de paramétrage soient réduits au minimum.16 Contrairement à la technologie de première génération, les moniteurs quantitatifs développés récemment semblent remplir la majorité de ces critères. La technologie de l’accéléromyographie (AMG) en trois dimensions a été récemment intégrée aux moniteurs quantitatifs développés pour une utilisation peropératoire systématique. Il a été observé à toutes les étapes de la récupération neuromusculaire que le TOF-Watch SX avec calibration et application de précharge (« gold standard » clinique) et une accéléromyographie en trois dimensions non calibrée s’accordaient parfaitement.21 Des dispositifs d’électromyographie (EMG) portables ont également été développés récemment et approuvés pour des soins cliniques courants. Les données du ratio TOF (train-de-quatre) sont obtenues rapidement après la pose d’une bande d’électrode sur la main et la connexion de la bande à un câble. Les moniteurs EMG fournissent des données quantitatives précises sans besoin d’immobilisation du muscle étudié, l’application de précharge ou le mouvement libre du pouce (les bras peuvent être serrés sur les côtés).20 Cependant, il faudra d’autres études pour évaluer la précision et la fiabilité de ces nouveaux moniteurs quantitatifs dans les pratiques cliniques.
Conclusions
Malgré les progrès pharmacologiques et technologiques qui sont intervenus au fil du temps, la CuRP continue à survenir fréquemment dans les pratiques cliniques, avec un taux qui est resté essentiellement stable depuis quarante ans. Ces articles importants publiés dans le numéro de février 2016 du Bulletin d’information de l’APSF ont contribué à renforcer la sensibilisation à propos de cette importante question de sécurité et à ouvrir la voie pour des études complémentaires et des améliorations des soins cliniques. Avec l’utilisation croissante du sugammadex (en doses appropriées en fonction du monitorage neuromusculaire) et le monitorage quantitatif par les équipes d’anesthésie, il est probable que le risque de patients souffrant de complications liées à la CuRP réduira dans la dizaine d’années à venir.
Glenn Murphy, MD est actuellement professeur clinique à l’Université de Chicago, dans le Département d’anesthésie, réanimation et directeur de la recherche clinique dans le Département d’anesthésie-réanimation et médecine de la douleur de NorthShore University HealthSystem.
Le Dr Murphy est actuellement conférencier pour Merck.
Documents de référence
- Stoelting RK. Monitoring of neuromuscular blockade: what would you expect if you were the patient? APSF Newsletter. 2016;30:45,47. https://www.apsf.org/article/monitoring-of-neuromuscular-blockade-what-would-you-expect-if-you-were-the-patient/ Accessed August 25, 2020.
- van Pelt M, Chitilian HV, Eikermann M. Multi-faceted initiative designed to improve safety of neuromuscular blockade. APSF Newsletter. 2016;30:51–52. https://www.apsf.org/article/multi-faceted-initiative-designed-to-improve-safety-of-neuromuscular-blockade/ Accessed August 25, 2020.
- Murphy GS. The development and regulatory history of sugammadex in the United States. APSF Newsletter. 2016; 53–54. https://www.apsf.org/article/the-development-and-regulatory-history-of-sugammadex-in-the-united-states/ Accessed August 25, 2020.
- Hammermeister KC, Bronsert M, Richman JS, Hensderson WG. Residual neuromuscular blockade (RNB), reversal, and perioperative outcomes. APSF Newsletter. 2016;30:74-75. https://www.apsf.org/article/residual-neuromuscular-blockade-nmb-reversal-and-perioperative-outcomes/ Accessed August 28,2020.
- Beecher HK, Todd DP. A Study of deaths associated with anesthesia and surgery. 1954. Int Anesthesiol Clin. 2007;45:1–6.
- Debaene B, Plaud B, Dilly M-P, et al. Residual paralysis in the PACU after a single intubating dose of nondepolarizing muscle relaxant with an intermediate duration of action. Anesthesiology. 2003;98:1042–1048.
- Saager L, Maiese EM, Bash LD, et al. Incidence, risk factors, and consequences of residual neuromuscular block in the United States: The prospective, observational, multicenter RECITE-US study. J Clin Anesth. 2019;55:33–41.
- Fortier LP, McKeen D, Turner K, et al. The RECITE Study: a Canadian prospective, multicenter study of the incidence and severity of residual neuromuscurlar blockade. Anesth Analg. 2015;121:366–72.
- Yu B, Ouyang B, Ge S, et al. RECITE–China Investigators. Incidence of postoperative residual neuromuscular blockade after general anesthesia: a prospective, multicenter, anesthetist-blind, observational study. Curr Med Res Opin. 2016;32:1–9.
- Errando CL, Garutti I, Mazzinari G, et al. Residual neuromuscular blockade in the postanesthesia care unit: observational cross-sectional study of a multicenter cohort. Minerva Anestesiol. 2016;82:1267–1277.
- Xará D, Santos A, Abelha F. Adverse respiratory events in the post-anesthesia care unit. Arch Bronconeumol. 2015;51:69–75.
- Grabitz SD, Rajaratnam N, Chhagani K, et al. The effects of postoperative residual neuromuscular blockade on hospital costs and intensive care unit admission: a population-based cohort study. Anesth Analg. 2019;128:1129–1136.
- Bulka CM, Terekhov MA, Martin BJ, et al. Nondepolarizing neuromuscular blocking agents, reversal, and risk of postoperative pneumonia. Anesthesiology. 2016;125:647–55.
- Bronsert MR, Henderson WG, Monk TG, et al. Intermediate-acting nondepolarizing neuromuscular blocking agents and risk of postoperative 30-day morbidity and mortality, and long-term survival. Anesth Analg. 2017;124:1476–1483.
- Belcher AW, Leung S, Cohen B, et al. Incidence of complications in the post-anesthesia care unit and associated healthcare utilization in patients undergoing non-cardiac surgery requiring neuromuscular blockade 2005–2013: a single center study. J Clin Anesth. 2017;43:33–38.
- Oh TK, Oh AY, Ryu JH, et al. Retrospective analysis of 30-day unplanned readmission after major with reversal by sugammadex or neostigmine. Br J Anaesth. 2019;122:370–378.
- Martinez-Ubieto J, Ortega-Lucea S, Pascual-Bellosta A, et al. Prospective study of residual neuromuscular block and postoperative respiratory complications in patients reversed with neostigmine versus sugammadex. Minerva Anestesiol. 2016;82:735–742.
- Kheterpal S, Vaughn MT, Dubovoy TZ, et al. Sugammadex versus neostigmine for reversal of neuromuscular blockade and postoperative pulmonary complications (STRONGER): a multicenter matched control cohort analysis. Anesthesiology. 2020;132:1371–1381.
- Kirmeier E, Eriksson LI, Lewald H, et al. POPULAR Contributors. Post-anaesthesia pulmonary complications after use of muscle relaxants (POPULAR): a multicentre, prospective observational study. Lancet Respir Med. 2019;7:129–140.
- Naguib M, Brull SJ, Kopman AF, et al. Consensus statement on perioperative use of neuromuscular monitoring. Anesth Analg. 2018; 127:71–80.
- Murphy GS, Szokol JW, Avram MJ, et al. Comparison of the TOFscan and the TOF-Watch SX during recovery of neuromuscular function. Anesthesiology. 2018;129:880–888.


 Issue PDF
Issue PDF