元の記事はオンラインで参照可能:https://www.apsf.org/article/induced-hypotension-tied-to-possible-vision-impairments/
おそらく、APSFの最大の強みは、複数の医療分野およびそれらに関連する学会、組織、医療産業種を集めて、患者の安全性の問題について協力できることだろう。重篤な合併症である術後視力障害(postoperative visual loss, POVL)をきたす症例が、特に腹臥位での脊椎手術後に明らかに増加していることを、1998年に医療者に向けて警告したこともまた、APSFがその非公式ネットワークによって役割を発揮した一例である。1 これらの症例は、器具を用いた脊椎固定術が急増した中で発生し、出血量の多さと手術時間の長さに関連していた。POVLは、文献的には1950年代と古くから認識されてきたが、ほとんどの医療者が大脳皮質視覚野の梗塞(皮質盲)、眼球の圧迫、網膜中心動脈の閉塞(central retinal artery occlusion, CRAO、図1 )のいずれかに関連していると考えていた。1990年代の初頭から中頃にかけて、腹臥位での脊椎手術後のPOVL症例の報告が増えて、虚血性視神経障害(ischemic optic neuropathy, ION、図1)として知られる視神経の損傷に関連していると考えられた。しかし、この合併症に対する一般的な認識はまだ低かった。この時点では、皮質梗塞や眼球圧迫がなくても失明する可能性があることを認識している麻酔科医はほとんどいなかった。2 認識が不十分であったことは、脊椎固定術後のION発生率に施設間でばらつきがあったことに間違いなく影響していた。複数の小規模多施設共同研究で発生率が0.1%と高いことがわかったが、3 1996~2005年の全国データでは発生率が0.017%とはるかに低かった。4
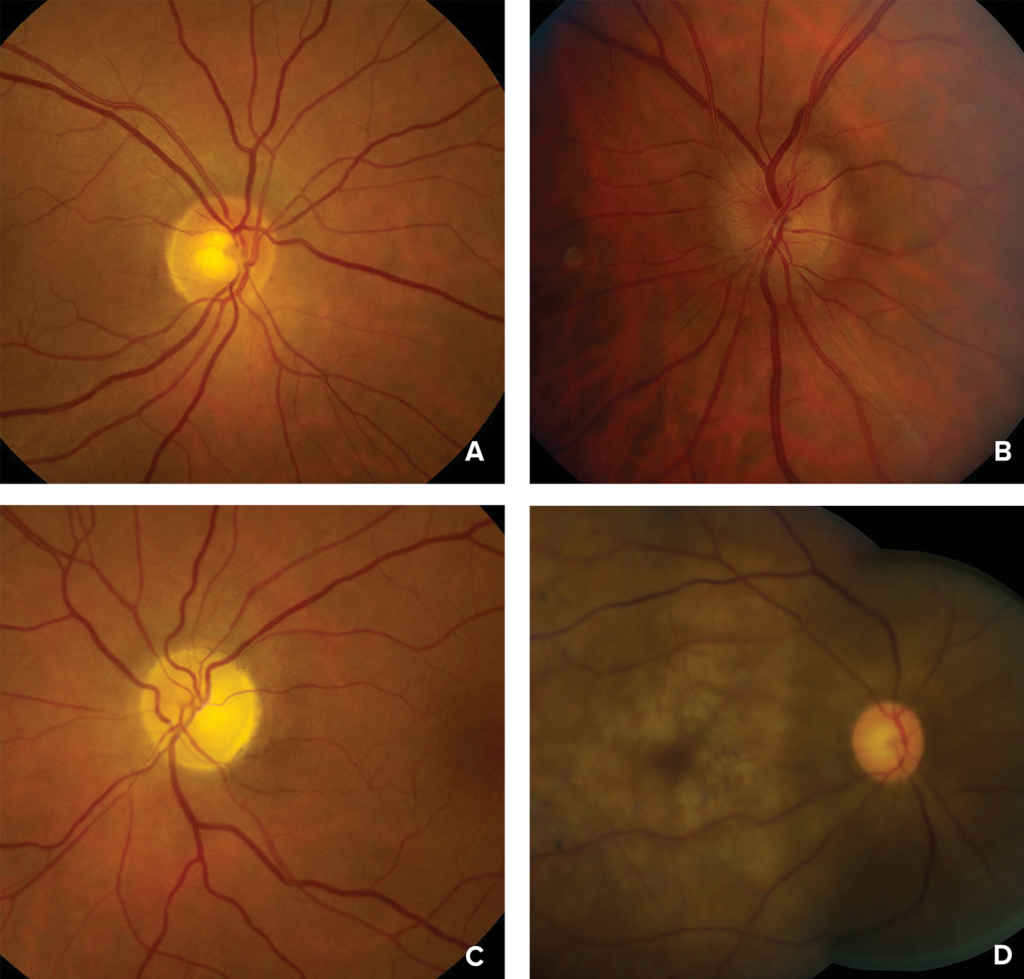
図 1:A)正常な視神経乳頭または初期の後部虚血性視神経障害を示す眼底の写真。 B)初期の前部虚血性視神経障害での軽度の視神経乳頭浮腫; C)末期の前部または後部虚血性視神経障害での視神経萎縮; D)急性網膜中心動脈閉塞での網膜白化、チェリーレッドスポット(紅実斑点)と減衰した動脈。
写真は、ジョージア州アトランタのエモリー大学医学部のValerie BiousseとNancy J. Newmanの好意による。
APSF実行委員会の前コンサルタントである麻酔科医のAnn Lofskyと、内科医のMark Gorneyは、1998年にPOVLに関するAPSFニュースレターの記事を共同執筆した。1 彼らは専門職賠償責任会社であるThe Doctors Companyと請求の審査官として提携していたので、麻酔管理に伴う周術期合併症が様々な全国データベースで分析できるようになるずっと前から、それら合併症の傾向を把握する機会があったのだ。彼らは、腹臥位での脊椎手術後に発生したIONによるPOVLの2症例(同様の12症例の複合として)の要点を発表した。そして、意図的な低血圧、貧血、静脈圧が上昇する長時間腹臥位の組み合わせが、この合併症の要因として最も可能性が高いと示唆した。また彼らは頭部固定をメイフィールドピンで行ってもPOVLが発生した一例に注目し、この症例では眼球圧迫は原因として除外できるということを発見した。
同じ頃に米国麻酔科学会(ASA)は、ASAのPOVLレジストリを作成して、ASAクローズドクレーム(訳注:法的に決着のついたクレーム)プロジェクトとASA専門職賠償責任委員会を通じてこの問題に取り組んでいた。このレジストリは、憂慮すべきPOVL症例に関する詳細なデータを可能な限り迅速に集積できるように、症例を匿名化されたデータとして自主的に登録する形で設計された。その後にAPSFニュースレターおよびASAニュースレターに掲載された記事で、このレジストリの中間結果が発表された。これらの記事では、POVLに関する最新情報を周知しただけではなく、すべての症例をこのレジストリに自発的に登録するよう医療者たちに勧めた。このAPSFニュースレターおよびASAニュースレターが麻酔科界にもたらした影響は、ASAのPOVLレジストリの成功に一部貢献したと言える。
2006年までに、ASAのPOVLレジストリには脊椎手術後のPOVL症例が93例集積したが、そのうちIONと診断されたのが83例でCRAOと診断されたのが10例だった。5 CRAO症例とION症例で周術期の特性は著しく異なっていた。CRAO症例は全例が片側性の視覚障害であり、70%で眼周囲の外傷を認め、メイフィールドピンで頭部固定されていた症例はなかった。対照的に、ION症例の55%は両側性の視覚障害であり、約5分の1はメイフィールドピンによる頭部固定であり、眼周囲の外傷を認めたのは83例中1例だけだった。出血量、輸液量、手術時間は、CRAO症例よりION症例で著しくかつ有意に多かった。この発見は、IONが全身性の要因に起因しており、ヘッドレストによる直接の圧迫が原因ではないという現時点での理論と一致したものである。さらに、ION症例の3分の2は、ASAの身体状態が1〜2の比較的健常な患者で、最も若い患者は16歳だったことから、この悲惨な合併症は誰にでも起こり得るようだった。低血圧と貧血は、原因として除外することはできなかったものの、ION症例で一貫して特定されたわけでもなかった。
医療標準および診療パラメーターに関するASA委員会は、この情報を迅速に利用して、POVLに関する最初の診療勧告を作成し、その後2012年と2019年に改訂した。6-8 この診療勧告を作成するタスクフォースには、神経眼科医、麻酔科医、神経外科医、整形外科の脊椎外科医という専門家たちが参加した。注目すべきことに、最初の推奨事項の1つは、この合併症について患者から同意を得ることを検討することであった。これは、脊椎外科医と麻酔専門職の間で大いに物議を醸す問題となった。多くの外科医がそのキャリアの中で遭遇したことがないような合併症のために、患者を不必要に怖がらせることを外科医たちが懸念したためである。この合併症の認識が高まるにつれて、ASA、APSF、脊椎手術を専門とする脳神経外科の学会および整形外科の学会は、診療勧告で取り上げられた同意の問題に協力して対処した。その後、APSFは、脊椎手術を受ける患者のPOVLリスクの術前同意に焦点を当てて、POVLに関する特別な集学的会議を2012年に開催し、この会議のコンセンサスステートメントを2013年に公開した。さらに2014年にAPSFは2つの教育ビデオを作成し、この合併症に対する術前同意取得の背景にある理論的根拠と、外科医および麻酔専門職が患者からPOVLリスクの同意を得る方法をシミュレーションで解説した。9,10
このような医療組織の非公式な集まりに新たに加わったのが、IONの病因と予防法を解明することに関心を示したSociety of Neurosurgical Anesthesia and Critical Care(SNACC)(現在のSociety for Neuroscience in Anesthesiology and Critical Care)だった。全国のSNACCメンバーはこの合併症に強い関心を持っており、POVL研究グループを結成した。このグループはASAクローズドクレームプロジェクトと共に、ASAのPOVLレジストリに登録されたPOVL症例(ケース)と、SNACCメンバーそれぞれの所属施設の症例(コントロール)で、ケースコントロール研究を実施した。この研究の結果は2012年に発表され、腹臥位での手術後のIONに関連する6つのリスク因子を特定した。リスク因子は、男性、肥満、ウィルソンフレームの使用、より長い麻酔時間(手術時間の代理値)、より多い出血量、輸血以外の輸液に占めるより低いコロイドの割合とされた(表1)。11 この研究は、同じ手術の術後に眼科診断が行われた多数の症例が集積されているうえ、国のデータベースにはない詳細な周術期のデータが含まれているため、ケースコントロール研究という手法やASAのPOVLレジストリへの症例登録が自発的なものであるといった重大なリミテーションはあるものの、今なおこのトピックに関して得られた最良のデータである。この研究の結果はASAのPOVLに対する診療勧告の改訂にも利用され、最新情報および推奨事項と共に2019年に公開された(https://anesthesiology.pubs.asahq.org/article.aspx?articleid=2718348)。8
表 1:脊椎固定術後の虚血性視神経障害(ION)のリスク因子9
| 1.男性 |
| 2.肥満 |
| 3.ウィルソンフレームの使用 |
| 4.より長い麻酔時間 |
| 5.より多い出血量 |
| 6.輸血以外の輸液に占めるより低いコロイドの割合 |
POVLへの関心は高く、この合併症について多数の症例報告、後方視的な多施設ケースシリーズ、ケースコントロール研究、全国データベースからの研究、文献レビューが発表された。これらの文献により、ASAの診療勧告の改訂にあたって追加の有用な情報が提供され、POVLの病因・予防法・治療法を解明することへの高い関心が維持された。脊椎固定術後のIONの病因に関して最も有力なのは、腹臥位による長時間にわたる静脈圧上昇が主要因であるという説である。11,12 頭がよりぶらさがる位置となるウィルソンフレームの使用と、腹臥位によって腹部が圧迫される肥満患者は、どちらも腹臥位での頭の静脈うっ血を増悪させると考えられ、この合併症のリスク因子として特定されている。11 この証明されていない理論をさらに後押しするのは、両側の根治的頚部郭清術や高度頭低位でのロボット手術など、頭の静脈圧が上昇する他の術式でもIONリスクが増加していることである。
このような多くの領域での多大な努力のあと、我々の成功が全国データから見て取れた。全国入院患者データベースのデータによると、1998年から2012年にかけて脊椎固定術後のION症例は2.7分の1に減少した。13 この改善が、ASA、ASAクローズドクレームプロジェクト、SNACC、APSF、North American Neuro-Ophthalmology Society、American Association of Neurologic Surgeons、North American Spine Society、およびその他多くの医療専門家の取り組みと関連していたかどうかは明らかではない。Michael Toddは、意図的な低血圧の減少、脊椎外科医によるウィルソンフレーム使用の減少、わずかに短くなった手術時間など、この成功を説明しうる変化がこの間にいくつかあった可能性を論文中で示唆している。14 さらに、外科医は出血量を減少させる低侵襲手術を行うことがますます増えている。15
POVLの原因に関するさらなる研究は重要である。しかし、この合併症の発生率が低いことと、ヒトで介入研究を実施することには倫理的制限があり、動物モデルには適切なものがないので、研究には障壁がある。どの患者の周術期にも同様の外科手術や麻酔管理が行われていることを考慮すると、誰しもにこの合併症は発生するのだろうか。あるいは特定の固有の解剖学的、生理学的、遺伝的要因がこの合併症に寄与しているのだろうか。それらの要因は、ケースコントロール研究や他の多くの研究デザインでは特定されないだろう。POVLは、心臓手術、血管手術、頭頚部手術、整形外科手術、一般外科手術、ロボット手術(前立腺切除術や子宮摘出術)など他の多種の手術後や、重度の消化管出血やその他の重症患者の手術後にも発生する可能性があるため、IONおよびPOVLをきたす他の原因の潜在的な治療選択肢の研究も同様に重要である。周術期IONに対する実証された有益な治療法は特定されていないが、多くの神経眼科指導医たちは、血圧の正常化、高度貧血の回避、重度の顔面浮腫が存在する場合の頭高位を推奨している。これまでの部分的な成功は素晴らしいことであるが、やるべきことは明らかにまだ沢山ある。
最後に、この研究と教育の取り組みに参加し推進してくれた仲間たちである、小さな「国」に感謝の意を表する。この取り組みへの貢献者のリストは、この記事の長さを優に超えてしまうため、スペースの制限により一部のみ紹介する;Steven Roth、Michael M. Todd、Karen B. Domino、Karen L. Posner、Nancy J. Newman、Nayak L. Polissar、Frederick W. Cheney、Robert K. Stoelting、Mark A. Warner、Ann Lofsky、Richard T. Connis、Robert A. Caplan、POVL研究グループのSNACCメンバー。
Lorri A. Leeは、ワシントン州リッチランドの現役麻酔科医であり、ASAのPOVLレジストリの元ディレクターであり、POVLに関するASAタスクフォースのメンバーである。
著者にこの記事に関する利益相反はない。
参考文献
- Lofsky AS, Gorney M. Induced hypotension tied to possible vision impairments. APSF Newsletter. 1998;13:16–17. https://www.apsf.org/article/induced-hypotension-tied-to-possible-vision-impairments/ Accessed August 12, 2020.
- Williams EL, Hart WM, Tempelhoff R. Postoperative ischemic optic neuropathy. Anesth Analg. 1995;80:1018–1029.
- Stevens WR, Glazer PA, Kelley SD, et al. Ophthalmic complications after spinal surgery. Spine. 1997;22:1319–1324.
- Shen Y, Drum M, Roth S. The prevalence of perioperative visual loss in the United States: a 10-year study from 1996 to 2005 of spinal, orthopedic, cardiac, and general surgery. Anesth Analg. 2009;109:1534–1545.
- Lee LA, Roth S, Posner KL, et al. The American Society of Anesthesiologists’ Postoperative Visual Loss Registry: analysis of 93 spine surgery cases with postoperative visual loss. Anesthesiology. 2006;105:652–659.
- Warner, MA, Arens, JF, Connis, RT, et al. Practice advisory for perioperative visual loss associated with spine surgery. A report by the American Society of Anesthesiologists Task Force on Perioperative Blindness. Anesthesiology. 2006;104:1319–1328.
- American Society of Anesthesiologists Task Force on Perioperative Visual Loss. Practice advisory for perioperative visual loss associated with spine surgery: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Visual Loss. Anesthesiology. 2012;116:274–285.
- American Society of Anesthesiologists Task Force on Perioperative Visual Loss. Practice advisory for perioperative visual loss associated with spine surgery 2019: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Visual Loss, the North American Neuro-Ophthalmology Society, and the Society for Neuroscience in Anesthesiology and Critical Care. Anesthesiology. 2019;130:12–30.
- APSF Perioperative visual loss (POVL) video. https://www.apsf.org/videos/perioperative-visual-loss-povl-video/. Published 2014. Accessed July 22, 2020.
- APSF Simulated informed consent scenarios for patients at risk for perioperative visual loss (POVL) video. https://www.apsf.org/videos/simulated-informed-consent-scenarios-for-patients-at-risk-for-perioperative-visual-loss-povl-video/. Published 2014. Accessed July 22, 2020.
- The Postoperative Visual Loss Study Group. Risk factors associated with ischemic optic neuropathy after spinal fusion surgery. Anesthesiology. 2012;116:15–24.
- Biousse V, Newman NJ. Ischemic optic neuropathies. N Eng J Med. 2015;272:2428–2436.
- Rubin DS, Parakati I, Lee LA, et al. Perioperative visual loss in spine fusion surgery: ischemic optic neuropathy in the United States from 1998 to 2012 in the nationwide inpatient sample. Anesthesiology. 2016;125:457–464.
- Todd MM. Good news: but why is the incidence of postoperative ischemic optic neuropathy falling? Anesthesiology. 2016;125:445–448.
- Goldstein CL, Macwan K, Sundararajan K, et al. Perioperative outcomes and adverse events of minimally invasive versus open posterior lumbar fusion: meta-analysis and systematic review. J Neurosurg Spine. 2016;24:416–27.


 Issue PDF
Issue PDF