Voir l’article initial en ligne à : https://www.apsf.org/article/induced-hypotension-tied-to-possible-vision-impairments/
Le plus gros atout de l’APSF est probablement sa capacité à réunir de nombreuses disciplines médicales et les sociétés qui leur sont affiliées, organismes et sociétés du secteur de la santé pour collaboration dans le domaine de la sécurité des patients. En 1998, l’APSF a tiré parti de son rôle dans ce réseau informel en alertant les soignants d’une augmentation apparente des cas de complications dévastatrices de la perte de l’acuité visuelle postopératoire (POVL), associées particulièrement aux chirurgies du rachis en position ventrale.1 Ces cas sont survenus à une époque de hausse soudaine du nombre de procédures de fusion rachidienne instrumentée, qui étaient associées à des pertes de sang plus importantes et des durées d’intervention plus longues. La POVL avait été reconnue dans la littérature dès le début des années 50, toutefois la plupart des soignants pensaient qu’elle était liée à des lésions du cortex visuel (cécité corticale) ou à la compression du globe, une lésion qui cause une occlusion de l’artère centrale de la rétine (OACR, Figure 1). Entre le début et le milieu des années 90, des cas de plus en plus nombreux de cas de POVL après une chirurgie rachidienne en position ventrale ont été publiés, associés à une lésion du nerf optique, appelée neuropathie optique ischémique (NOI, Figure 1). Cependant, cette complication était encore assez peu connue. Très peu d’anesthésistes savaient à cette époque-là que la cécité pouvait survenir dans ces cas sans lésion du cortex visuel ou compression du globe.2 Ces lacunes étaient sans aucun doute liées à la variabilité de l’incidence des NOI associées à une fusion rachidienne dans les établissements. Bien que des études multicentriques plus petites aient permis d’identifier une incidence allant jusqu’à 0,1 %,3 les données nationales ont révélé un taux très inférieur de 0,017 % entre 1996 et 2005.4
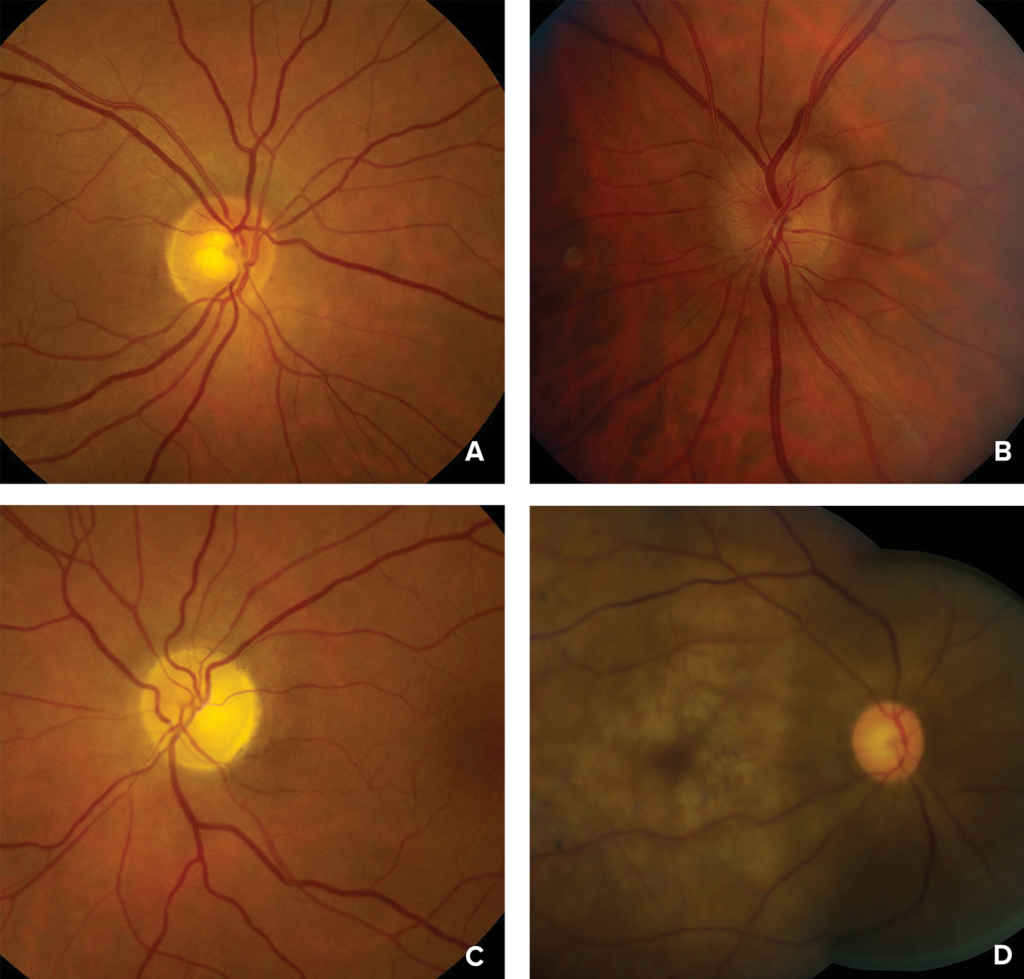
Figure 1 : Photographies du fond d’œil représentant A) une papille optique normale ou une neuropathie optique ischémique postérieure précoce ; B) un gonflement léger de la papille dans une neuropathie optique ischémique antérieure précoce ; C) une atrophie du nerf optique dans une neuropathie optique ischémique antérieure ou postérieure avancée ; et D) une décoloration de la rétine, des taches rouge-cerise (macula) et l’atténuation artérielle dans le cadre d’une occlusion aiguë de l’artère rétinienne centrale.
Photographies avec l’aimable autorisation de Valerie Biousse, MD, et Nancy J. Newman, MD, Emory University School of Medicine, Atlanta, GA.
Ann Lofsky, anesthésiste et ancienne consultante du comité exécutif de l’APSF, et Mark Gorney, un médecin interne, ont rédigé ensemble l’article du Bulletin d’information de l’APSF sur la POVL en 1998.1 Ils étaient affiliés à la société d’assurance professionnelle de The Doctors Company et, en tant qu’experts de l’étude des poursuites en responsabilité professionnelle, ils ont été en mesure d’identifier les tendances des complications périopératoires associées à une anesthésie, bien avant que ces complications ne soient disponibles pour permettre la réalisation d’analyses dans une quelque base de données nationale. Ils ont publié une brève description de deux cas (qui étaient des éléments de 12 affaires semblables) de POVL causée par une NOI survenue dans le cadre d’une chirurgie rachidienne en position ventrale. Ils ont suggéré que l’association d’hypotension délibérée, d’anémie et d’une durée prolongée en position ventrale avec une pression veineuse élevée étaient les facteurs contributifs les plus probables à ce problème. Ils ont noté un cas qui était survenu avec la tête maintenue par un étrier de Mayfield, une constatation qui a permis d’éliminer la compression du globe comme cause contributrice potentielle dans ce cas particulier.
Simultanément, L’American Society of Anesthesiology (ASA), grâce au Closed Claims Project de l’ASA et au comité sur la responsabilité professionnelle de l’ASA, s’attaquait aussi à ce problème en créant le Registre des POVL de l’ASA. Ce registre a été créé afin de permettre le signalement volontaire des cas, avec des données anonymisées, afin que des données très détaillées sur ces cas alarmants de POVL puissent être réunies le plus rapidement possible. Ensuite, des articles publiés dans le Bulletin d’information de l’APSF et le Bulletin d’information de l’ASA ont présenté les résultats préliminaires du Registre des POVL de l’ASA. Non seulement ces articles diffusaient les informations les plus récentes sur cette complication, mais en outre, ils encourageaient les soignants à signaler volontairement leur cas au Registre des POVL de l’ASA. Le succès du Registre des POVL de l’ASA était partiellement lié à la forte influence du Bulletin d’information de l’APSF et du Bulletin d’information de l’ASA dans la communauté des anesthésistes.
En 2006, le Registre des POVL de l’ASA avait réuni des données sur 93 cas de POVL associés à une chirurgie rachidienne, 83 cas diagnostiqués avec une NOI et 10 cas avec une OACR.5 Les caractéristiques périopératoires des patients atteints d’OACR et de NOI présentaient des différences notoires. Parmi les cas d’OACR, tous présentaient une perte unilatérale de l’acuité visuelle, 70 % présentaient un traumatisme péri-oculaire et aucun n’avait été placé dans un étrier de Mayfield. En revanche, 55 % des cas de NOI présentaient une perte bilatérale de l’acuité visuelle, près d’un cinquième étaient placés dans un étrier de Mayfield et seulement 1 cas sur les 83 présentait un quelconque traumatisme péri-oculaire. Le volume de perte sanguine, le volume administré ultérieurement et la durée des procédures étaient considérablement supérieurs dans les cas de NOI, par rapport aux cas d’OACR. Ces constatations étayaient la théorie de l’époque selon laquelle la NOI était associée à des causes systémiques et pas à une compression directe causée par un repose-tête. En outre, deux tiers des patients atteints de NOI avaient un score ASA relativement sain de 1-2, avec des patients âgés d’au moins 16 ans. Il semblait que tous les patients pouvaient subir cette complication catastrophique. L’hypotension et l’anémie n’étaient pas toujours identifiées dans les cas de NOI, toutefois il n’était pas possible d’éliminer ces facteurs en tant que causes contributives.
Le Comité sur les normes et paramètres de pratique de l’ASA a très rapidement utilisé ces informations pour développer son premier guide de bonnes pratiques au titre de cette complication, avec des mises à jour en 2012 et en 2019.6-8 Des experts en neuro-ophtalmologie, anesthésie, neurochirurgie et chirurgie rachidienne orthopédique ont été inclus dans ce groupe de travail pour le développement de ce guide de bonnes pratiques. Il convient de noter que l’une des premières recommandations étaient d’envisager d’obtenir le consentement éclairé des patients par rapport à cette complication. Cette question a été l’objet de nombreuses controverses entre les chirurgiens du rachis et les anesthésistes, car les chirurgiens craignaient que cela risque d’effrayer inutilement les patients à propos d’une complication que très peu d’entre eux avaient rencontrée au cours de leur carrière. Au fur et à mesure que la connaissance de cette complication a progressé, la collaboration entre l’ASA, l’APSF et les sociétés professionnelles de neurochirurgie et d’orthopédie, associées aux chirurgiens du rachis, a permis de s’intéresser à la question du consentement dans les guides de bonnes pratiques. Puis en 2012, l’APSF a organisé une conférence multidisciplinaire spéciale sur le sujet de la POVL, avec un intérêt tout particulier porté au consentement préopératoire des patients subissant une chirurgie du rachis au titre du risque de POVL. La conférence a conduit à la publication d’un consensus en 2013. Deux vidéos éducatives ont été élaborées par l’APSF en 2014, élucidant la logique du consentement préopératoire pour cette complication, ainsi que des simulations de la manière dont les chirurgiens et les anesthésistes peuvent présenter le consentement pour la POVL aux patients.9,10
Une autre partie de ce groupe informel de collaboration entre des organisations de soignants visant à déterminer l’étiologie et la prévention des NOI était la Society of Neurosurgical Anesthesia and Critical Care (SNACC, maintenant la Society for Neuroscience in Anesthesiology and Critical Care). Dans tout le pays, les membres de la SNACC étaient extrêmement intéressés par cette complication et ils ont formé le Groupe d’étude des POVL. Ce groupe a mené une étude cas-témoins avec le Closed Claims Project de l’ASA, utilisant des cas de POVL du Registre des POVL de l’ASA et des témoins des établissements universitaires respectifs des membres de la SNACC. Les conclusions de cette étude ont été publiées en 2012. Elles identifiaient six facteurs de risque associés à la NOI après une chirurgie en position ventrale. Ces facteurs de risque étaient les suivants : le sexe masculin, l’obésité, l’utilisation d’un cadre de Wilson, la durée prolongée de l’anesthésie (une valeur substituée à la durée de la chirurgie), une plus grande perte estimée de sang et un pourcentage inférieur de colloïde utilisé dans l’administration de fluides autres que le sang (Tableau 1).11 Cette étude reste à ce jour les meilleures données à notre disposition à ce sujet, en raison du grand nombre de cas avec un diagnostic ophtalmologique survenant après la même procédure et de l’absence de données périopératoires détaillées dans les bases de données nationales. Cependant, elle est fortement limitée en raison de sa méthodologie liée aux cas-témoins et de la nature volontaire du signalement des cas au Registre des POVL de l’ASA. Les résultats de cette étude ont été utilisés pour orienter les mises à jour des guides de bonnes pratiques de l’ASA au sujet de cette complication, la dernière mise à jour associée à des recommandations étant publiée en 2019 (https://anesthesiology.pubs.asahq.org/article.aspx?articleid=27183482718348).8
Tableau 1 : Facteurs de risque de neuropathie optique ischémique lors d’une chirurgie associée à une fusion rachidienne9
| 1. Sexe masculin |
| 2. Obésité |
| 3. Cadre de Wilson |
| 4. Durée plus longue de l’anesthésie |
| 5. Perte estimée de sang supérieure |
| 6. Pourcentage inférieur de colloïde dans l’administration des fluides autres que le sang |
L’intérêt porté à cette complication était vif et de nombreux signalements de cas, séries d’études de cas rétrospectives multicentriques, études cas-témoins, études des bases de données nationales et évaluations de la littérature ont été publiés sur le sujet des POVL. Ces articles ont permis de glaner des informations complémentaires utiles à propos de cette complication pour les guides de bonnes pratiques de l’ASA et de maintenir le fort degré d’intérêt pour déterminer l’étiologie, la prévention et le traitement des POVL. La théorie principale concernant l’étiologie de la NOI associée à une chirurgie de fusion du rachis est que la pression veineuse élevée en position ventrale pendant une durée de temps prolongée est un facteur contributif majeur.11,12 L’obésité associée à une compression de l’abdomen en position ventrale et l’utilisation du cadre de Wilson, qui place la tête dans une position plus déclive, causent une exacerbation de la congestion veineuse dans la tête en position ventrale et ont été identifiés comme facteurs de risque dans le cadre de cette complication.11 Un autre argument en faveur de cette théorie sans preuve est le risque accru de NOI dans d’autres procédures auxquelles est associée une pression veineuse élevée dans la tête, comme une dissection radicale bilatérale du cou et les procédures robotiques où la tête est en position déclive.
Après ces énormes efforts dans divers domaines, les données nationales ont fini par suggérer que nous avions enfin une réussite. Les données de la Nationwide Inpatient Database (base de données nationale des patients hospitalisés) démontraient que le nombre de cas de NOI associés à une chirurgie de fusion du rachis avait été divisé par 2,7 entre 1998 et 2012.13 On ne sait pas précisément si cette amélioration était liée aux travaux assidus de l’ASA, du Closed Claims Project de l’ASA, de la SNACC, de l’APSF, de la North American Neuro-Ophthalmology Society, de l’American Association of Neurologic Surgeons, de la North American Spine Society et de nombreux autres soignants. Michael Todd, MD, a suggéré dans son éditorial que certains changements survenus éventuellement dans cet intervalle de temps pouvaient expliquer cette réussite, y compris le recours moins fréquent à l’hypotension délibérée, au cadre de Wilson par les chirurgiens du rachis et peut-être des durées opératoires légèrement plus courtes.14 D’autre part, les chirurgiens ont adopté des techniques de moins en moins invasives, associées à des pertes de sang estimées moindres.15
Il est fondamental de mener d’autres recherches dans l’étiologie de cette complication. Cependant, la faible incidence de cette complication, les limites éthiques de la réalisation d’études interventionnelles sur les humains et l’absence d’un modèle animal adapté constituent un obstacle. Est-ce que toute personne est susceptible de subir cette complication si les évènements chirurgicaux périopératoires et la gestion de l’anesthésie sont semblables ou est-ce que certains facteurs anatomiques, physiologiques et génétiques uniques y contribuent ? Ces facteurs ne seraient pas identifiés dans une étude cas-témoins ou de nombreux autres types d’étude. La recherche sur les options de traitement potentiel d’une NOI et d’autres causes d’une POVL est toute aussi importante, car la POVL peut survenir dans de nombreux autres types d’opérations, notamment une chirurgie cardiaque, une chirurgie vasculaire, des dissections au niveau de la tête et du cou, une chirurgie orthopédique, une chirurgie générale et une chirurgie robotique (prostatectomie et hystérectomie), ainsi que chez les patients présentant une hémorragie digestive majeure et d’autres maladies critiques. Aucun traitement bénéfique éprouvé d’une ION périopératoire n’a été identifié, bien que de nombreux consultants en neuro-ophtalmologie aient recommandé la normalisation de la pression artérielle, la prévention d’une anémie importante et la position proclive en cas de présence d’un œdème facial important. Nous devrions nous réjouir de cette réussite partielle, mais il est clair que les travaux ne sont pas terminés dans ce domaine.
Pour conclure, je souhaite remercier le petit « pays » qui a participé à cette recherche et fait avancer les efforts éducatifs. La liste des contributeurs à ces efforts dépasserait facilement la longueur de cet article. Par conséquent, en raison de l’espace restreint, seuls certains d’entre eux pourront être cités, à savoir : Steven Roth, MD, Michael M. Todd, MD, Karen B. Domino, MD, MPH, Karen L. Posner, MD, Nancy J. Newman, MD, Nayak L. Polissar, PhD, Frederick W. Cheney, MD, Robert K. Stoelting, MD, Mark A. Warner, MD, Ann Lofsky, MD, Richard T. Connis, MD, Robert A. Caplan MD et les membres de la SNACC du Groupe d’étude des POVL.
Lorri A. Lee, MD, est anesthésiste en activité à Richland, État de Washington, ancienne directrice du Registre des POVL de l’ASA et membre du Groupe de travail sur la perte d’acuité visuelle périopératoire de l’ASA.
L’auteur ne signale aucun conflit d’intérêt.
Documents de référence
- Lofsky AS, Gorney M. Induced hypotension tied to possible vision impairments. APSF Newsletter. 1998;13:16–17. https://www.apsf.org/article/induced-hypotension-tied-to-possible-vision-impairments/ Accessed August 12, 2020.
- Williams EL, Hart WM, Tempelhoff R. Postoperative ischemic optic neuropathy. Anesth Analg. 1995;80:1018–1029.
- Stevens WR, Glazer PA, Kelley SD, et al. Ophthalmic complications after spinal surgery. Spine. 1997;22:1319–1324.
- Shen Y, Drum M, Roth S. The prevalence of perioperative visual loss in the United States: a 10-year study from 1996 to 2005 of spinal, orthopedic, cardiac, and general surgery. Anesth Analg. 2009;109:1534–1545.
- Lee LA, Roth S, Posner KL, et al. The American Society of Anesthesiologists’ Postoperative Visual Loss Registry: analysis of 93 spine surgery cases with postoperative visual loss. Anesthesiology. 2006;105:652–659.
- Warner, MA, Arens, JF, Connis, RT, et al. Practice advisory for perioperative visual loss associated with spine surgery. A report by the American Society of Anesthesiologists Task Force on Perioperative Blindness. Anesthesiology. 2006;104:1319–1328.
- American Society of Anesthesiologists Task Force on Perioperative Visual Loss. Practice advisory for perioperative visual loss associated with spine surgery: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Visual Loss. Anesthesiology. 2012;116:274–285.
- American Society of Anesthesiologists Task Force on Perioperative Visual Loss. Practice advisory for perioperative visual loss associated with spine surgery 2019: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Visual Loss, the North American Neuro-Ophthalmology Society, and the Society for Neuroscience in Anesthesiology and Critical Care. Anesthesiology. 2019;130:12–30.
- APSF Perioperative visual loss (POVL) video. https://www.apsf.org/videos/perioperative-visual-loss-povl-video/. Published 2014. Accessed July 22, 2020.
- APSF Simulated informed consent scenarios for patients at risk for perioperative visual loss (POVL) video. https://www.apsf.org/videos/simulated-informed-consent-scenarios-for-patients-at-risk-for-perioperative-visual-loss-povl-video/. Published 2014. Accessed July 22, 2020.
- The Postoperative Visual Loss Study Group. Risk factors associated with ischemic optic neuropathy after spinal fusion surgery. Anesthesiology. 2012;116:15–24.
- Biousse V, Newman NJ. Ischemic optic neuropathies. N Eng J Med. 2015;272:2428–2436.
- Rubin DS, Parakati I, Lee LA, et al. Perioperative visual loss in spine fusion surgery: ischemic optic neuropathy in the United States from 1998 to 2012 in the nationwide inpatient sample. Anesthesiology. 2016;125:457–464.
- Todd MM. Good news: but why is the incidence of postoperative ischemic optic neuropathy falling? Anesthesiology. 2016;125:445–448.
- Goldstein CL, Macwan K, Sundararajan K, et al. Perioperative outcomes and adverse events of minimally invasive versus open posterior lumbar fusion: meta-analysis and systematic review. J Neurosurg Spine. 2016;24:416–27.


 Issue PDF
Issue PDF