Los trastornos por consumo de sustancias (SUD) por metanfetaminas han ido en aumento en los Estados Unidos. Los pacientes que tienen este SUD en particular presentan retos para el proveedor de anestesia. El tratamiento de estos pacientes con medicamentos y acciones apropiadas ayudará a reducir el riesgo de que tengan efectos adversos. Este artículo de revisión describe los medicamentos y las acciones más adecuadas para los pacientes con SUD por metanfetaminas que necesitan atención con anestesia.
Los trastornos por consumo de sustancias (SUD) son un tema de preocupación cada vez mayor en los EE. UU. y siguen afectando a familias y comunidades. Del total reportado de 329,9 millones de habitantes de EE. UU. en 2014, se diagnosticó SUD a 21,5 millones de personas.¹ La metanfetamina es responsable de aproximadamente 1,6 millones de los 21,5 millones de personas que abusan de sustancias en este país. Según el Instituto Nacional sobre el Abuso de Drogas (National Institute on Drug Abuse), el 0,6 % de la población reportó estar consumiendo metanfetaminas.² Es muy probable que esa cifra sea mucho mayor que la informada, por la asociación con el delito y el estigma relacionado con las enfermedades que acompañan el consumo de drogas. En una encuesta de 5.000 participantes, se halló que aproximadamente el 81 % de los pacientes daban información falsa a sus proveedores sobre el abuso de sustancias.³ El motivo más habitual que se dio en el estudio fue que los pacientes no querían ser “juzgados”.³ Por lo tanto, sería prudente que los profesionales de la anestesia sepan que los pacientes que se presentan para casos programados en el quirófano podrían estar ocultando la verdad sobre su consumo ilícito de sustancias.
La pandemia de COVID-19 también tiene el potencial de aumentar las probabilidades de que un paciente tenga un desorden de uso de sustancias (SUD). Muchos pacientes que antes se mantenían sobrios están teniendo recaídas por el aumento del estrés, el aislamiento social y la presión económica.⁴ Es importante recordar que los SUD siguen existiendo como epidemia aun en la pandemia. El consumo de sustancias, como la metanfetamina, no ha desaparecido ni disminuido, sino que ha aumentado en frecuencia.⁴ Es importante que cada profesional de la anestesia tenga en cuenta los posibles efectos letales del consumo de metanfetamina en el entorno preoperatorio, con consecuencias que pueden incluir crisis de hipertensión, colapso cardiovascular por hipotensión y la muerte.⁵ Seguir las prácticas según la bibliografía más reciente podría reducir la posible morbilidad y mortalidad, y garantizar la atención más apropiada para los pacientes con este SUD en particular.
Farmacología de las metanfetaminas
El nombre que da la Unión Internacional de Química Pura y Aplicada (International Union of Pure and Applied Chemistry, IUPAC) para la metanfetamina es (2S)-N-metil-1-fenilpropano-2-amina.⁶ Aunque el mecanismo de acción no queda del todo claro, la metanfetamina causa la liberación de las monoaminas endógenas dopamina, norepinefrina y serotonina (figura 1).
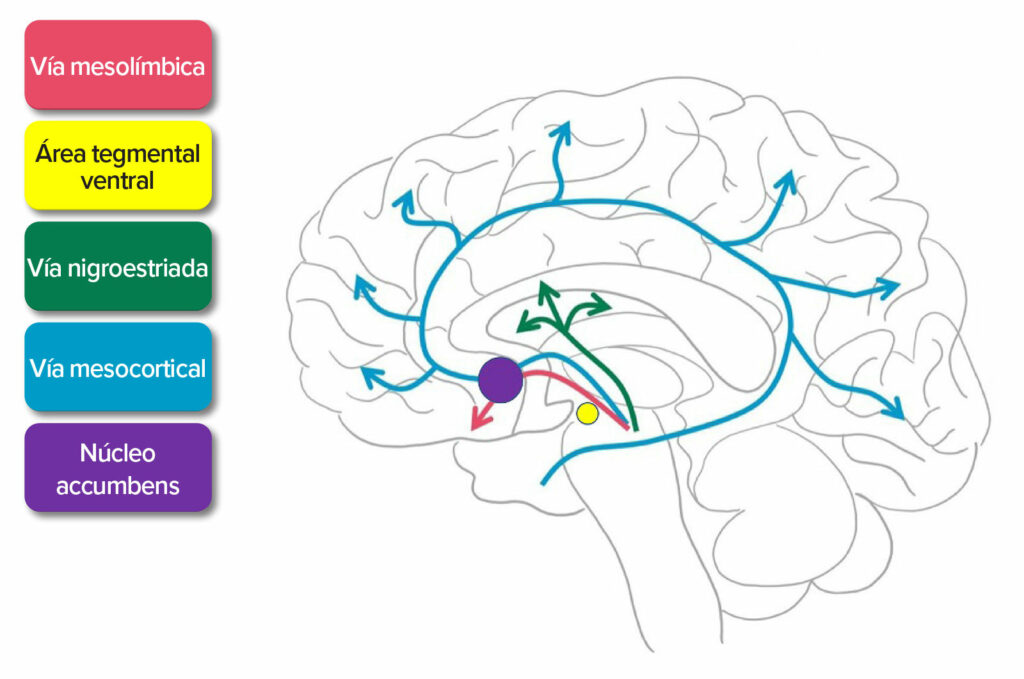
Figura 1: Liberación de dopamina. La dopamina activa la vía mesolímbica, la vía mesocortical y la vía nigroestriada. Esta vía se extiende desde las áreas tegmentales ventrales hasta el núcleo accumbens, que es responsable de la sensación de euforia después de consumir metanfetamina.7
Source: Adaptado de SITNBoston. Haynes y otros, 2018.7
https://sitn.hms.harvard.edu/flash/2018/dopamine-smartphones-battle-time/
Accessed April 16, 2021.
Una vez liberadas, las monoaminas se unen a sus receptores postsinápticos adecuados para producir una respuesta. La liberación de dopamina en el núcleo accumbens sigue la misma ruta para las recompensas naturales como interacción social, sexo, comida y ejercicio, pero la estimulación proveniente de la metanfetamina hace que se liberen entre 2 y 10 veces más de dopamina de los almacenamientos endógenos que con las recompensas naturales, lo que ocasiona una liberación de dopamina por encima del 1000 % de los niveles basales.7-10 La metanfetamina también interactúa con el sistema opioide endógeno y aumenta las endorfinas en el núcleo accumbens, que interviene en los centros de recompensa.11
Por último, la falta de dopamina causada por la incapacidad del cuerpo para recuperarse de la liberación masiva de monoaminas de las vesículas de almacenamiento provoca los sentimientos de depresión y retraimiento que pueden inducir más conductas de búsqueda de drogas.12 Estos cambios fisiológicos combinados crean un estado casi maníaco-depresivo en los pacientes que puede crear un círculo vicioso de uso indebido.
La acción periférica de las monoaminas culmina en una cadena difusa y compleja de eventos sistémicos.11 Las personas intoxicadas con metanfetaminas presentan una variedad de señales y síntomas (tabla 1).
Tabla 1: Señales y síntomas de la intoxicación por metanfetamina.11, 13, 14
| Señales de intoxicación por metanfetamina según la categoría |
| Sistema nervioso central |
| Agitación |
| Inquietud |
| Midriasis |
| Convulsiones |
| Hipertermia |
| Ansiedad |
| Aumento del estado de alerta |
| Alucinaciones |
| Psicosis |
| Cardiotorácicos |
| Hipertensión |
| Taquicardia |
| Disritmia |
| Arritmia maligna |
| Infarto de miocardio |
| Vasoespasmo coronario |
| Disección aórtica |
| Broncodilatación |
| Síndrome de dificultad respiratoria aguda |
| Hipertensión arterial pulmonar |
| Insuficiencia cardíaca derecha |
| Paro cardíaco súbito |
| Muerte |
| Diaforesis |
| Musculoesqueléticos |
| Rabdomiólisis |
| Espasmos musculares graves |
| Otras |
| Colitis isquémica |
| Acidosis metabólica |
| Desprendimiento de la placenta -> muerte fetal |
La hipertermia es un síntoma frecuente que tienen estos pacientes, que parece estar relacionada con la actividad muscular y, por lo tanto, los antipiréticos no hacen efecto para reducir la temperatura corporal.13 Una preocupación médica alarmante con las metanfetaminas es el paro cardíaco abrupto después de un altercado físico. Las contracciones musculares isovolumétricas pueden ocasionar acidosis grave, rabdomiólisis, hiperpotasemia y paro cardíaco asistólico súbito.13, 15
Farmacocinética de las metanfetaminas
La farmacocinética y el metabolismo de la metanfetamina dependen principalmente de la vía de administración y de la dosis, o de las dosis repetidas. La eliminación de la metanfetamina se efectúa mediante el citocromo CYP2D6 en la vía hepática y en varias vías renales. La excreción ocurre en las primeras 20 horas, pero depende en gran medida del pH de la orina. En la orina alcalina, la excreción puede ser tan baja como del 2 %, mientras que en la orina ácida, puede ser tan alta como del 76 %.16, 17 La acción de la metanfetamina generalmente dura 24 horas. Sin embargo, la eliminación y el efecto clínico varían mucho según la persona, y algunos síntomas de abstinencia pueden persistir durante hasta 10 días.13, 16, 18
El análisis de detección de metanfetamina en el entorno clínico se hace en suero o en orina. Si un paciente consume metanfetamina, puede dar un resultado positivo de metanfetamina o de la droga metabolizada en anfetamina.16, 17 Actualmente, no hay análisis de toxicología cuantitativos que puedan equipararse con la intoxicación clínica o la gravedad de las respuestas fisiológicas bajo el efecto de la anestesia. En consecuencia, es difícil determinar los riesgos asociados bajo los efectos de la anestesia para cualquier paciente que tenga un resultado positivo en el análisis de detección de metanfetaminas.
Guías y precauciones
La atención anestésica del paciente que está bajo la influencia de metanfetamina se centra en algunos conceptos fundamentales. Si el paciente tiene una intoxicación aguda y necesita cirugía de emergencia, los proveedores deben evitar la restricción física porque cualquier intervención que ocasione contracciones musculares intensas puede causar un colapso cardiovascular.13, 15 En cambio, la restricción química mediante la sedación con benzodiazepinas es la terapia principal. La bibliografía recomienda administrar midazolam 2 mg por vía intravenosa cada 8 a 10 minutos hasta que el paciente deje de estar agresivo. Algunos pacientes pueden necesitar hasta 20 mg.13 Si las benzodiazepinas no son eficaces para tratar la psicosis, pueden darse medicamentos secundarios, como haloperidol. Las benzodiazepinas y el haloperidol mitigan el efecto recíproco de la metanfetamina antagonizando la actividad de la dopamina en el sistema nervioso central.19
Es muy probable que los pacientes hipertensos vuelvan a sus niveles iniciales después de la administración de sedantes; sin embargo, los profesionales de la anestesia podrían notar hipertensión refractaria en algunos pacientes. En esos casos, puede usarse una variedad de medicamentos para tratar la hipertensión (tabla 2).
Tabla 2: Medicamentos y consideraciones para el tratamiento de la hipertensión asociada con metanfetaminas.13, 14, 19, 20-22
| MEDICAMENTO |
CONSIDERACIONES |
| 1. MIDAZOLAM | Se requieren dosis repetidas para la sedación; las dosis altas de midazolam pueden causar compromiso respiratorio |
| 2. HALOPERIDOL | Riesgo de prolongación del intervalo QT, riesgo de síndrome neuroléptico maligno; puede desencadenar síntomas extrapiramidales |
| 3. DEXMEDETOMIDINA | Pocos estudios sobre la seguridad de las pacientes de obstetricia |
| 4. NITROGLICERINA | Disminuye la presión arterial; puede causar leve taquicardia refleja |
| 5. NITROPRUSIATO | Disminuye la presión arterial con taquicardia refleja; puede causar toxicidad de cianuro |
| 6. FENTOLAMINA | Es posible que los profesionales de la anestesia no tengan fentolamina disponible para usar |
| 7. NICARDIPINA (DIHIDROPIRIDINA CCB) | Reduce la presión arterial con taquicardia refleja |
| 8. VERAPAMILO (NO DIHIDROPIRIDINA CCB) | Tiene un efecto vasodilatador menor con una leve taquicardia refleja o puede causar bradicardia grave |
| 9. LABETALOL | Podría causar espasmo coronario. Puede causar hipertensión relacionada con estimulación alfa sin oposición |
CCB = bloqueadores de los canales de calcio
El concepto de “estimulación alfa sin oposición” con el uso de medicamentos betabloqueadores es cada vez más controvertido. Algunos autores han publicado revisiones sistémicas con escasos resultados adversos y no han observado eventos adversos cuando se usaron medicamentos betabloqueadores no selectivos, como labetalol.22 Además, los betabloqueadores se han usado para tratar otras condiciones hiperadrenérgicas, como tirotoxicosis.22 Sin embargo, la Fundación del Colegio Americano de Cardiología (American College of Cardiology Foundation), junto con la Asociación Americana del Corazón (American Heart Association), ha afirmado en su resumen ejecutivo más reciente, de 2014, que los pacientes que demuestran señales agudas de intoxicación no deben recibir betabloqueadores debido a la posibilidad de potenciar un espasmo coronario.23 Por lo tanto, suprimir el aumento de catecolamina con benzodiazepinas sigue siendo el principal tratamiento para la hipertensión causada por metanfetaminas.13
Se debe vigilar atentamente a los pacientes con SUD por metanfetamina que requieren intervención quirúrgica inmediata en busca de hipotensión relacionada con la disminución de catecolamina. Podría ser prudente colocar una vía arterial. Si se halla hipotensión, puede considerarse el tratamiento con vasopresores de acción directa, como la norepinefrina, la epinefrina, la dopamina o la fenilefrina.13, 24 Aunque la anestesia raquídea o epidural no está contraindicada, muchos profesionales de la anestesia prefieren evitar la anestesia neuroaxial debido a la hipotensión persistente causada por la simpatectomía pese al tratamiento con vasopresores.
Los pacientes con SUD por metanfetamina tienen un mayor riesgo de padecer rabdomiólisis. El problema multifactorial probablemente se debe a una disminución de la ingesta de líquido durante la intoxicación, a la vasoconstricción, a una disminución de la perfusión y a un efecto tóxico directo en el músculo esquelético.25 La succinilcolina podría potenciar la rabdomiólisis y se considera una contraindicación relativa para el manejo de las vías respiratorias. Por lo tanto, el rocuronio o el vecuronio son el paralizante elegido y es incluso más favorable si hay sugammadex disponible para el proveedor clínico.13 Si el paciente presenta rabdomiólisis, es apropiado administrar bolos de líquido IV según lo indicado.13 Además, los profesionales clínicos deben ajustar la configuración del respirador para evitar la acidosis metabólica.13 La imposibilidad de tratar al paciente de manera no agresiva podría ocasionar una progresión irreversible de los síntomas y causar la muerte del paciente.13
Además de la intoxicación aguda, algunos pacientes podrían estar tomando anfetaminas de manera crónica como modalidad de tratamiento para diagnósticos como el trastorno por déficit de atención con hiperactividad. Los investigadores indican que no hay un mayor riesgo de presión arterial lábil bajo los efectos de la anestesia para este subgrupo de pacientes. Por lo tanto, los pacientes que toman anfetaminas como parte de su régimen de tratamiento pueden continuar con sus medicamentos perioperatorios sin pausa.26, 27
Consideraciones para la parturienta
Las mujeres embarazadas que consumen metanfetamina pueden tener hipertensión, rotura prematura de bolsa, hemorragia o desprendimiento de la placenta.28 Si la paciente está demasiado agitada, las benzodiazepinas son la mejor opción de tratamiento, sobre todo comparadas con la restricción física antes de la inducción. En informes de casos previos, de la década de 1960, las benzodiazepinas se catalogaron como factor contribuyente significativo de malformaciones congénitas relacionadas específicamente con labio paladar hendido y defectos del corazón. Pese a las fallas en las investigaciones previas que sugerían una relación entre las benzodiazepinas y las malformaciones congénitas, la fuerte aversión a exponer a las mujeres embarazadas ocasionó una falta de investigaciones.29, 30 Recientemente, han surgido datos más sólidos y varios estudios indicaron que no hay correlación entre la mayoría de las benzodiazepinas y las malformaciones congénitas, tomadas inmediatamente antes de la cirugía o para controlar los síntomas de ansiedad en el embarazo.29, 31-33 Es desaconsejable que los clínicos eviten las benzodiazepinas para parturientas agitadas que toman metanfetamina, ya que la madre sigue con riesgo de tener colapso cardiovascular por el forcejeo, lo que podría ser mortal para ambos pacientes. Sin embargo, el profesional de la anestesia podría preferir recetarles haloperidol a las pacientes en su primer trimestre.34 Generalmente, no se usa ketamina por un posible aumento de catecolamina y la subsiguiente hipertensión.22
Los profesionales de la anestesia a los que les preocupa la presencia de droga en el recién nacido también podrían ser renuentes a administrar benzodiazepinas. Los investigadores han demostrado que el aumento de la disponibilidad biológica puede hacer que los recién nacidos tengan un nivel de benzodiazepinas tres o cuatro veces mayor en su sistema comparados con sus madres.35 Sin embargo, con dosis bajas (0,02–0,025 mg/kg) de midazolam, no hay diferencias en las puntuaciones de Apgar de los recién nacidos después de la administración previa a la cesárea.28, 30 La parturienta también corre el riesgo de sufrir un colapso cardiovascular por la intensa contracción muscular de la restricción física. Debido a que eso podría ser mortal para la madre y para el hijo, sería prudente sedar con restricción química a las pacientes embarazadas agitadas y atender el estado respiratorio del recién nacido después del parto.
Toxicidad de la serotonina
La toxicidad de la serotonina, también llamada síndrome de la serotonina, es un aumento de la actividad serotoninérgica en el sistema nervioso central que tiene el potencial de ser mortal.36 La toxicidad de la serotonina es una consecuencia prevista del exceso de la actividad serotoninérgica en el sistema nervioso central y en los receptores periféricos, que causa una variedad de síntomas por la liberación del exceso de serotonina, como la agitación, la hipertensión, la taquicardia y la diaforesis. Hubo casos de toxicidad de la serotonina por una única ingestión de metanfetamina.37 La toxicidad de la serotonina también puede precipitarse con el uso de tramadol, meperidina, opioides (p. ej., fentanilo) y azul de metileno.36, 38, 39 El fentanilo es de particular importancia para el profesional de la anestesia, ya que es uno de los medicamentos opioides de uso más frecuente en el quirófano.
Si los profesionales de la anestesia tienen a un paciente con SUD y toxicidad de la serotonina, se recomienda el uso de benzodiazepinas como primera línea de tratamiento para ambos. Sin embargo, a diferencia de la intoxicación por metanfetamina, la toxicidad de la serotonina también puede tratarse con antagonistas de la serotonina no selectivos, como ciproheptadina y risperidona. La toxicidad de la serotonina también puede tratarse con un medicamento bloqueador de la dopamina postsináptica, como la clorpromazina.40
Resumen
El SUD por metanfetamina está en aumento, más aún con el incremento del estrés, el aislamiento social y la presión económica por la pandemia de COVID-19. Los pacientes que tienen este SUD en particular presentan retos para el proveedor de anestesia. Como recordatorio, debe usarse la restricción química en lugar de la restricción física para limitar las contracciones musculares, que pueden ocasionar un colapso cardiovascular. Frecuentemente se necesitan vasopresores de acción directa, ya que es probable que haya hipotensión, pero, si el paciente es hipertenso, los betabloqueadores deben usarse con precaución. Por último, los pacientes con SUD por metanfetaminas pueden presentar rabdomiólisis o toxicidad de la serotonina; los proveedores deben evitar la administración de medicamentos desencadenantes.
Jennifer Krogh, MSN, CRNA, es una estudiante de DNP en la Facultad de Medicina de Yale, Orange, CT.
Jennifer Lanzillotta-Rangeley, PhD, CRNA, es profesora auxiliar en la Facultad de Enfermería de la Universidad de Cincinnati, Ohio, EE. UU., y jefa de Anestesiología en el Highland District Hospital, Hillsboro, Ohio.
Elizabeth Paratz, MD, es cardióloga del St. Vincent’s Hospital Melbourne, Victoria, Australia.
Lynn Reede, DNP, CRNA, es profesora clínica asociada en el Programa de Enfermeros Anestesistas de la Facultad de Enfermería de Northeastern University, Boston, MA.
Linda Stone, DNP, CRNA, es administradora auxiliar del programa, profesora clínica auxiliar de la University of North Carolina Greensboro y DNP de Nurse Anesthesia Concentration, Greensboro, NC.
Joseph Szokol, MD, es director de políticas de salud de la Sociedad Americana de Anestesiólogos, profesor clínico de Anestesiología y director ejecutivo de mentoría y desarrollo de médicos en Keck Medicine of USC, Los Ángeles, CA.
Laura Andrews, PhD, es profesora asociada y directora de especialidad en Enfermería de Atención Aguda a Adultos/Gerontología en la Facultad de Enfermería de Yale, Orange, CT.
Joan Kearney, PhD, APRN, FAAN, es profesora asociada de Yale University, West Haven, CT.
Los autores no tienen conflictos de intereses.
Referencias
- Lipari RN, Van Horn SL. Trends in substance use disorders among adults aged 18 or older. The CBHSQ Report. 2017.
- National Institute on Drug Abuse. What is the scope of methamphetamine misuse in the United States? https://www.drugabuse.gov/publications/research-reports/methamphetamine/what-scope-methamphetamine-misuse-in-united-states. Accessed November 6, 2019.
- Levy AG, Scherer AM, Zikmund-Fisher BJ, Larkin K, Barnes GD, Fagerlin A. Prevalence of and factors associated with patient nondisclosure of medically relevant information to clinicians. JAMA Netw Open. 2018;1:1–8
- Wan W, Long H. ‘Cries for help’: drug overdoses are soaring during the coronavirus pandemic. Washington Post. July 1, 2020.
- Gao W, Elkassabany N. Drugs of Abuse. Gupta A, Singh-Radcliff, N. Pharmacology in anesthesia practice. New York, NY: Oxford University Press. 2013;391–411.
- National Center for Biotechnology Information. PubChem compound summary: Methamphetamine. https://pubchem.ncbi.nlm.nih.gov/compound/methamphetamine. Accessed April 29, 2019.
- Haynes T. Dopamine, smartphones, and you: a battle for your time. Science in the News. http://sitn.hms.harvard.edu/flash/2018/dopamine-smartphones-battle-time/. Accessed August 12, 2020.
- Allerton M, Blake W. The “Party Drug” crystal methamphetamine: Risk factor for the acquisition of HIV. Perm J. 2008;12:56–58.
- Beaulieu P. Anesthetic implications of recreational drug use. Can J Anaesth. 2017;64:1236–1264.
- National Institute on Drug Abuse. Methamphetamine. https://www.drugabuse.gov/publications/drugfacts/methamphetamine. Accessed November 6, 2019.
- Courtney KE, Ray LA. Methamphetamine: an update on epidemiology, pharmacology, clinical phenomenology, and treatment literature. Drug Alcohol Depend. 2014;143:11–21.
- Kish SJ. Pharmacologic mechanisms of crystal meth. CMAJ. 2008;178:1679–1682.
- Boyer EW, Seifert SA, Hernon C. Methamphetamine: acute intoxication. UpToDate. Ed. Traub SJ, Burns MM: UpToDate; 2019. https://www.uptodate.com/contents/methamphetamine-acute-intoxication. Accessed October 24, 2019.
- Paratz ED, Cunningham NJ, MacIsaac AI. The cardiac complications of methamphetamines. Heart Lung Cir. 2016;25:325–332.
- National Criminal Justice Reference Service. White paper report on excited delirium syndrome. Updated September 2009. https://www.ncjrs.gov/App/Publications/abstract.aspx?ID-260278. Accessed September 28, 2019.
- Volkow ND, Fowler JS, Wang G, et al. Distribution and pharmacokinetics of methamphetamine in the human body: clinical implications. PLoS One. 2010;5:1–6
- Oyler JM, Cone EJ, Joseph RE, Moolchan ET, Huestis MA. Duration of detectable methamphetamine and amphetamine excretion in urine after controlled oral administration of methamphetamine in humans. Clin Chem. 2002;48:1703–1714
- Huestis MA, Cone EJ. Methamphetamine disposition in oral fluid, plasma, and urine. Ann NY Acad Sci. 2007;1098:104–121.
- Richards JR, Derlet RW, Albertson TE. Methamphetamine toxicity treatment and management. Medscape. https://emedicine.medscape.com/article/820918-treatment#d10. Accessed December 7, 2018.
- Johnson BA, Wells LT, Roache JD, et al. Isradipine decreases the hemodynamic response of cocaine and methamphetamine. Am J Hypertens. 2005;18:813–822.
- Lam v, Shaffer RW. Management of sympathomimetic overdose including designer drugs. Hyzy RC, McSparron J. Evidence-based critical care: a case study approach. 2nd Edition. Switzerland. Springer Nature Switzerland. 2020.
- Richards JR, Albertson TE, Derlet RW, et al. Treatment of toxicity from amphetamines, related derivatives, and analogues: a systematic clinical review. Drug Alcohol Depend. 2015;150:1–13
- Amsterdam EA, Wenger NK, Brindis RG, et al. 2014 AHA/ACC guideline for the management of patients with Non-ST-elevation acute coronary syndromes. J Am Coll Cardiol. 2014;64:e139–e288.
- Selvaggi G, Spagnolol AG, Elander A. A review of illicit psychoactive drug use in elective surgery patients: Detection, effects, and policy. Int J Surg. 2017;48:160–165.
- Eilert RJ, Kliewer ML. Methamphetamine-induced Rhabdomyolysis. Int Anesthesiol Clin. 2011;49:52–56.
- Cartabuke RS, Tobias JD, Rice J, Turmin D. Hemodynamic profile and behavioral characteristics during induction of anesthesia in pediatric patients with attention deficit hyperactivity disorder. Pediatr Anesth. 2017;27:417–424.
- Fischer SP, Schmiesing CA, Guta CG, Brock-Utne JG. General anesthesia and chronic amphetamine use: Should the drug be stopped preoperatively? Anesth Analg. 2006; 103:203-206.
- Pham T, Tinajero Y, Mo L, et al. Obstetrical and perinatal outcomes of patients with methamphetamine positive drug screen on labor and delivery. Am J Obstet MFM. 2020;2:1–7.
- Senel AC, Mergan F. Premedication with midazolam prior to caesarean section has no neonatal adverse effects. Braz J Anesthesiol. 2014;64:16–21.
- Shergill AK. Guidelines for endoscopy in pregnant and lactating women. Gastrointest Endosc. 2012;76:18–24.
- Flölich MA, Burchfield DJ, Euliano T, Canton D. A single dose of fentanyl and midazolam prior to Cesarean section have no adverse neonatal effects. Can J Anesth. 2006;53:79–85.
- Bellantuono C, Tofani S, Sciascio GD, Santone G. Benzodiazepine exposure in pregnancy and risk of major malformations: A critical overview. Gen Hosp Psychiatry. 2013;35:3–8.
- Upadya M, Saneesh P. Anaesthesia for non-obstetric surgery during pregnancy. Indian J Anaesth. 2016;60:234–241.
- Betcher HK, Montiel C, Clark CT. Use of antipsychotic drugs during pregnancy. Clin Schizophr Relat Psychoses. 2019;6:17–31.
- Radojcic MR, Marroun HE, Miljkovic B, et al. Prenatal exposure to anxiolytic and hypnotic medication in relation to behavioral problems in childhood: a population-based cohort study. Neurotoxicol Teratol. 2017;61:58–65.
- Greenier E, Lukyanova V, Reede L. Serotonin syndrome: Fentanyl and selective serotonin reuptake inhibitor interaction. AANA J. 2014;82:340–345.
- Rahmani SH, Hassanian-Moghaddam H, Ahmadi S. Serotonin syndrome following single ingestion of high dose methamphetamine. J Clin Toxicol. 2011;1:1–3.
- Smischney NJ, Pollard EM, Nookala AU, Olatoye OO. Serotonin syndrome in the perioperative setting. ACF Case Rep J. 2018;19:833–835.
- Gillman PK. CNS toxicity involving methylene blue: The exemplar for understanding and predicting drug interactions that precipitate serotonin toxicity. J Psychopharmacol. 2010;23:429–436.
- Moss MJ. Serotonin toxicity: Associated agents and clinical characteristics. J Clin Psychopharmacol. 2019;39:628–633.


 Issue PDF
Issue PDF