El monitoreo neuromuscular cuantitativo es el único medio fiable para confirmar la recuperación correcta de un bloqueo neuromuscular y evitar la debilidad residual posoperatoria. Los anestesistas deben saber sobre las nuevas tecnologías de monitoreo para reducir las complicaciones relacionadas con el manejo deficiente del bloqueo neuromuscular.
La necesidad de monitoreo
Cuando los pacientes sufren hipotensión en el quirófano, los profesionales de anestesia aplican algún tratamiento necesario de inmediato. Ya sean líquidos por vía intravenosa o medicamentos vasoactivos, para así evitar el deterioro clínico. ¿Cómo saben los profesionales de la anestesia que su intervención ha tenido éxito? ¿Suponen que el bolo de fenilefrina fue apropiado porque están familiarizados con la farmacodinámica de este medicamento y esperan que todos los pacientes respondan de manera predecible? ¿Palpan la arteria carótida después de un bolo de líquidos para asegurarse de que han restaurado el volumen intravascular y han conseguido la estabilidad hemodinámica? Por supuesto que no. De hecho, los profesionales de la anestesia hacen todo lo posible para asegurarse de tener dispositivos precisos, como un manguito del tensiómetro del tamaño adecuado o incluso un catéter intraarterial que permita obtener mediciones cuantitativas de la presión en tiempo real. Este grupo de proveedores espera que su intervención tenga el efecto deseado, pero la vigilancia innata los obliga a verificar y a no confiar en la farmacodinámica predictiva ni en las evaluaciones subjetivas como la palpación del pulso.
Este patrón de práctica debe ampliarse y aplicarse al manejo del bloqueo neuromuscular. Administrar un antagonista del bloqueo neuromuscular, como sugammadex o neostigmine, esperar varios minutos y después extubar la tráquea de un paciente sin confirmar una recuperación correcta es similar a administrar un vasoactivo sin volver a medir la presión ni confirmar si la intervención tuvo éxito. Del mismo modo, palpar la respuesta del dedo pulgar a una estimulación en tren de cuatro (TOF) con un neuroestimulador (PNS) y determinar subjetivamente si se ha conseguido una recuperación correcta es una práctica comparable a la palpación de la arteria carótida durante la reposición de la volemia. Los profesionales de la anestesia confían en las tecnologías más avanzadas para mantener la homeostasis de los pacientes y no deben excluir el manejo del bloqueo neuromuscular de monitorización rutinaria.
La reticencia de la comunidad anestésica a adoptar un monitoreo cuantitativo (u objetivo) es un fenómeno curioso que ha dado lugar a su propia colección de bibliografía. Una encuesta internacional a más de 2500 anestesiólogos reveló importantes lagunas de conocimiento sobre los fundamentos del manejo del bloqueo neuromuscular, ya que los encuestados solo respondieron correctamente el 57 % de las preguntas. Aún más preocupante puede ser el hecho de que el 92 % de los encuestados que dieron respuestas incorrectas estaban indebidamente seguros de su respuesta errónea.1 También se está extendiendo la creencia de que la introducción de sugammadex anula la necesidad de monitoreo cuantitativo. Aunque es cierto que esta sustancia ha permitido un antagonismo del bloqueo neuromuscular más rápido y a niveles de bloqueo más profundos, la administración de sugammadex sin monitoreo puede hacer que hasta un 9,4 % de los pacientes tengan debilidad residual en el momento de la extubación.2 Estas lagunas de conocimiento y la confianza errónea sin duda han sido obstáculos, mientras que la inconstancia de las capacitaciones también se ha descrito como una barrera para el monitoreo.3 Por último, históricamente ha habido escasez de monitores neuromusculares cuantitativos fáciles de usar y fiables a los que los clínicos interesados pudieran acceder.4
La falta de monitoreo cuantitativo periódico es un problema que persiste en todo el mundo, pero el impulso de este sigue creciendo con el renovado interés en este tema entre los profesionales de la anestesia. Los paneles de expertos han exigido un monitoreo periódico,5 mientras que las sociedades de anestesia han establecido directrices en las que se recomienda el uso del monitoreo cuantitativo siempre que se administren bloqueantes neuromusculares (NMBA).6-8 La industria ha respondido con nuevos monitores e innovaciones que deberían mejorar la seguridad del paciente. En este artículo, se analizarán algunas de las tecnologías más avanzadas actualmente disponibles para los clínicos que quieren usar el monitoreo neuromuscular cuantitativo.
Modalidades de monitoreo
El uso de un neuroestimulador (PNS) usualmente es cualitativo; pero incluso los profesionales de la anestesia con experiencia son incapaces de detectar de forma confiable el debilitamiento cuando el cociente del tren de cuatro (TOFR) es superior a 0,4.9 Además, los protocolos basados en la evidencia que incorporan la administración selectiva de NMBA, el antagonismo del bloqueo neuromuscular periódico y el “uso óptimo” de un neuroestimulador aún pueden dejar al 35 % de los pacientes con debilidad residual.10 El papel limitado del PNS debe quedar relegado a un dispositivo que se use si no hay acceso a monitores cuantitativos o un dispositivo que dé información cualitativa mientras los profesionales de la anestesia hacen la transición a los monitores cuantitativos.5
Los monitores cuantitativos suelen clasificarse en función de los métodos por los que el dispositivo obtiene mediciones objetivas (también conocidos como su modalidad de monitoreo). Sin embargo, estos dispositivos también pueden clasificarse en función de si son monitores manuales e independientes o si están incorporados a la estación de trabajo de anestesia. Los monitores manuales dan flexibilidad para obtener mediciones objetivas fuera del quirófano. La debilidad residual posoperatoria no es una amenaza para la seguridad intraoperatoria del paciente, y los monitores portátiles permiten el diagnóstico en la sala de recuperación o en la unidad de cuidados intensivos. Los monitores que se incorporan a la estación de trabajo de anestesia tienen módulos integrados que permiten comunicar sin problemas las mediciones objetivas al expediente médico electrónico. Comprender las necesidades de la práctica resultará muy valioso a la hora de elegir una modalidad de monitoreo y saber si necesita un monitor portátil o integrado.
Mecanomiografía
Aunque no esté disponible comercialmente, cada dispositivo nuevo se compara con la mecanomiografía (MMG). Este estándar de referencia histórico tiene una configuración engorrosa que requiere una calibración cuidadosa, ya que obtiene mediciones objetivas midiendo la fuerza de contracción isométrica después de la neuroestimulación. A la hora de interpretar la bibliografía con revisión científica externa sobre las nuevas tecnologías de monitoreo cuantitativo, el mayor nivel de evidencia proviene actualmente de la comparación directa con la MMG.
Aceleromiografía
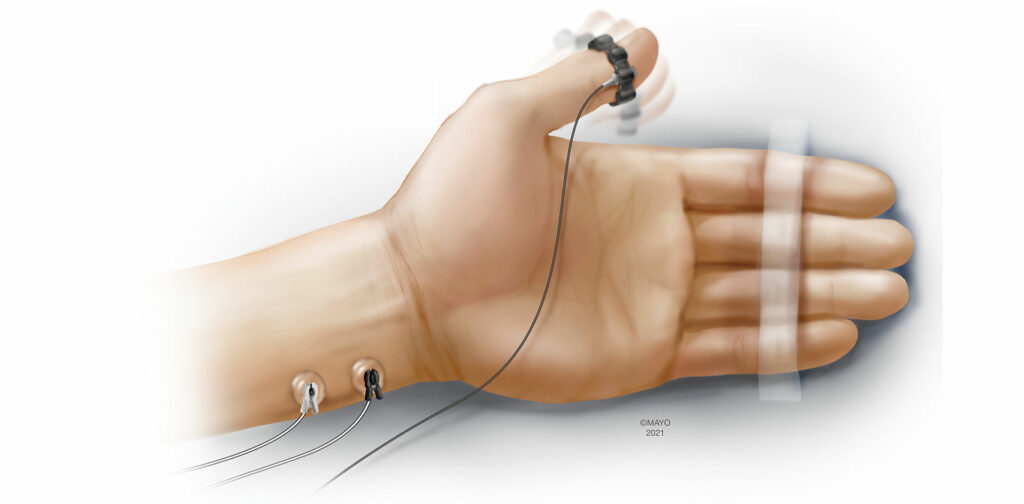
La aceleromiografía (AMG) es una de las formas de monitoreo cuantitativo más investigadas y usadas.4 Basada en la segunda ley del movimiento de Newton (Fuerza = Masa × Aceleración), la AMG mide de manera objetiva la respuesta a la neuroestimulación mediante un transductor que se sujeta al músculo de interés. Tradicionalmente, se ponen electrodos de electrocardiograma (ECG) estándar sobre el nervio cubital y se mide la aceleración del músculo aductor del pulgar después de la neuroestimulación (Figura 1). Esta configuración es muy similar al uso de un neuroestimulador en la mano, excepto por el transductor extra fijado al pulgar. La AMG también se ha usado en lugares de monitoreo alternativos, como el pie (músculo flexor corto del dedo gordo) y la cara (músculo orbicular de los párpados/corrugador superciliar). Aunque la configuración de la AMG puede ser intuitiva, hay advertencias importantes para el uso de esta modalidad de monitoreo. El fenómeno de “debilitamiento inverso” en el que el TOF inicial no paralizado es superior a 1,0 se describió de manera minuciosa cuando se monitoreó con AMG.11 Aunque los mecanismos exactos aún no estén claros, el debilitamiento inverso puede tener implicaciones importantes a la hora de determinar si un paciente ha logrado una recuperación neuromuscular correcta antes de extubar la tráquea. La normalización es un proceso que sitúa todo el TOFR en el contexto del TOFR inicial (TOFR actual/TOFR inicial) y puede explicar el TOFR inicial superior a 1,0. En lugar de definir la recuperación correcta de la función neuromuscular como un TOFR de >0,9, la recuperación correcta se logra verdaderamente cuando el TOFR normalizado es de >0,9, cuando se mide con AMG.
Además, la normalización disminuye los sesgos relacionados con la MMG. El uso de un dispositivo de precarga, que estabiliza el movimiento del pulgar, y la calibración antes de la administración de NMBA, que también puede mejorar la precisión del monitoreo de la AMG, son requisitos cuando se hacen investigaciones en este campo.12 Sin embargo, estos pasos extra no son necesariamente obligatorios en la atención clínica. Por el contrario, la normalización de rutina se recomienda para evitar sobrestimar el grado de recuperación neuromuscular al final de la operación.
Quizá la advertencia más importante que debe tenerse en cuenta cuando se monitorea con AMG es el hecho de que el músculo de interés (por lo general el pulgar) debe poder moverse libremente después de la neuroestimulación. Cubrir los brazos en el posicionamiento quirúrgico puede tener un impacto considerable en la capacidad para obtener mediciones confiables con AMG. Además, el monitoreo con AMG en pacientes despiertos puede ser difícil, ya que el movimiento espontáneo en el lugar monitoreado puede producir artefactos.
Aunque hay matices importantes con los que los profesionales deben estar familiarizados antes de implementar el monitoreo con AMG, los avances recientes en la modalidad hicieron que la AMG sea más accesible. Los transductores tridimensionales incorporados a los nuevos dispositivos de AMG permiten una mejor cuantificación del movimiento complejo del pulgar después de la neuroestimulación. Además, la incorporación de dispositivos de precarga en los dispositivos nuevos mejora la precisión sin tener que obtener ni poner más equipos.13 También se desarrollaron configuraciones inalámbricas de monitores de AMG que usan la tecnología bluetooth para transmitir mediciones cuantitativas del lugar de monitoreo a una pantalla incorporada en la estación de trabajo de anestesia (comunicación personal). Los monitores de AMG están disponibles como unidades manuales o como módulos que pueden incorporarse a la estación de trabajo de anestesia.
Cinemiografía
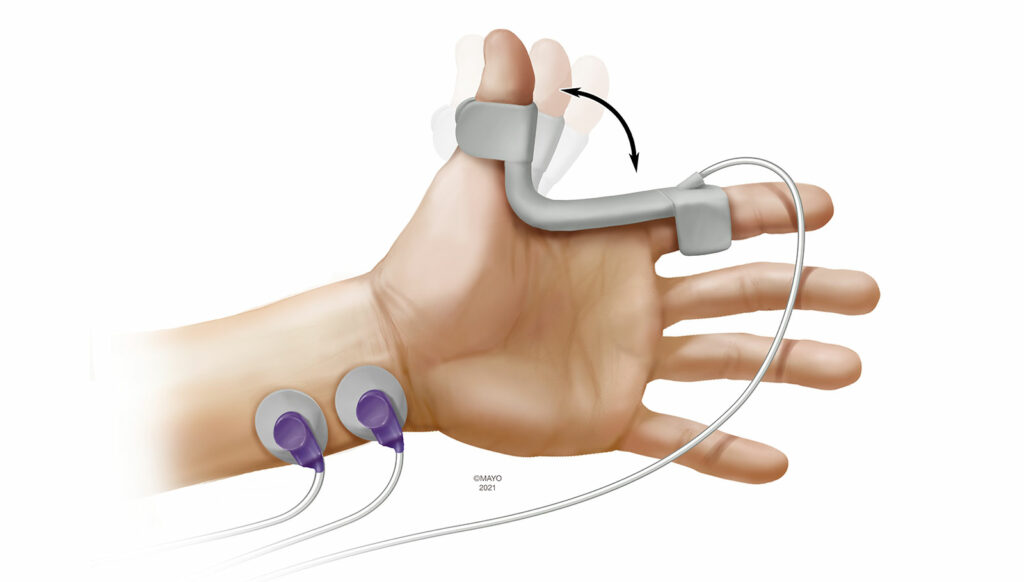
La cinemiografía (KMG) está muy relacionada con la AMG como modalidad de monitoreo. En el monitoreo con KMG, se pone un sensor piezoeléctrico en el surco entre el pulgar y el índice (Figura 2). Después de la estimulación del nervio cubital, el músculo aductor del pulgar se contrae y el sensor piezoeléctrico se inclina. El grado de inclinación se traduce en mediciones objetivas. El sensor funciona como su propio dispositivo de precarga, y la KMG no está sujeta al fenómeno de debilitamiento inverso como la AMG. En informes anteriores, se han demostrado amplios límites de concordancia entre la MMG y la KMG.14 Al igual que la AMG, la KMG también depende de que el pulgar pueda moverse libremente, y cubrir con firmeza los brazos en el posicionamiento quirúrgico puede impedir su uso. El movimiento del paciente en la recuperación también puede afectar al monitoreo con KMG, al igual que el reposicionamiento del sensor en el período perioperatorio. En la actualidad, el único dispositivo disponible basado en la KMG es un módulo que se incorpora a la estación de trabajo de anestesia.
Electromiografía
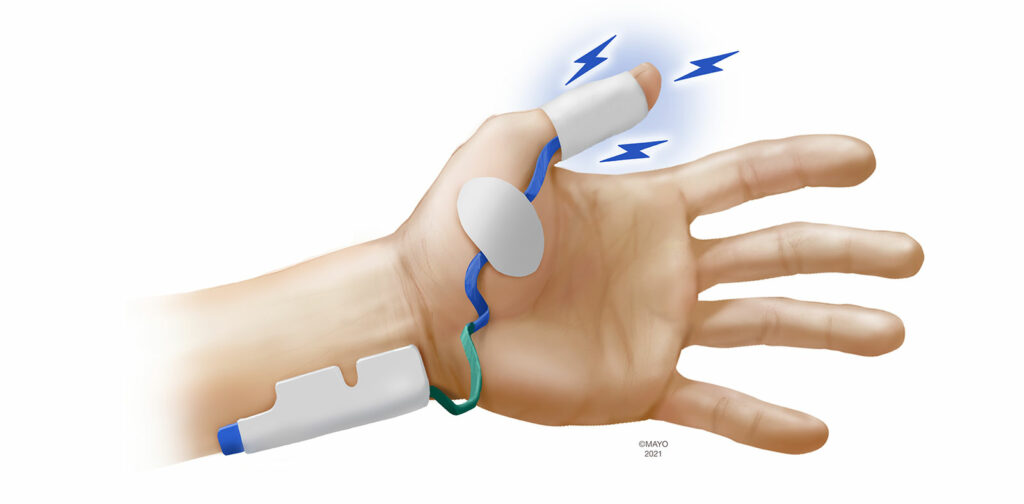
La electromiografía (EMG) ha sido considerada por muchos expertos como el nuevo estándar de referencia, dado su alto nivel de concordancia con la MMG15-17 y el hecho de que la EMG da mediciones cuantitativas confiables incluso cuando los brazos están restringidos en el posicionamiento quirúrgico. La EMG mide los potenciales de acción muscular combinados (CMAP) en toda la unidad neuromuscular en vez del movimiento o cualquier sustituto del movimiento. La amplitud de los CMAP es directamente proporcional al número de fibras musculares activadas (y, por lo tanto, a la fuerza de contracción). La EMG está sujeta a la interferencia de electrocauterio, y la amplitud de los CMAP puede aumentar un 2-3 % por cada 1 °C de disminución de la temperatura de la piel.18
Los dispositivos de EMG están disponibles en unidades portátiles o incorporadas a la estación de trabajo de anestesia. La mayoría de los fabricantes usan electrodos patentados para estimular y medir los CMAP que se ponen sobre la mano. Como el monitoreo con EMG no se interrumpe cuando los brazos están cubiertos, la búsqueda de lugares alternativos no es tan importante para la EMG, aunque se ha descrito el monitoreo en el pie, que es una opción si ninguna mano está disponible.19 Cuando se hizo el monitoreo en la mano, se usaron tres grupos musculares para medir los CMAP después de la estimulación del nervio cubital. Al igual que en la AMG y la KMG, los electrodos de detección pueden ponerse sobre el músculo aductor del pulgar (Figura 3). También se puede monitorear el primer músculo interóseo dorsal, situado en el espacio intermedio entre el pulgar y el índice. Por último, el abductor del dedo meñique (5.º dedo) está inervado por el nervio cubital y es un lugar adecuado para el monitoreo con EMG. Aunque es la modalidad de monitoreo más antigua, ha habido un importante interés reciente en la EMG, como lo demuestra la introducción al mercado de varios monitores basados en EMG.
Monitoreo con manguito
Recientemente, se ha desarrollado un nuevo dispositivo que incorpora el monitoreo objetivo en el manguito del tensiómetro.20 También conocido como técnica de manguito modificado, el monitoreo con manguito parece estar inspirado en la compresomiografía, una modalidad de monitoreo ya desaparecida que fue prometedora en sus inicios.21 El monitoreo con manguito implica el inflado del manguito del tensiómetro hasta aproximadamente 60 mmHg, seguido de electrodos en el manguito que producen neuroestimulación. Los cambios en la presión se detectan después de la contracción muscular, y estos cambios se usan para dar a los profesionales información objetiva sobre el nivel de bloqueo neuromuscular. Las primeras investigaciones han mostrado que el monitoreo del brazo puede tener propiedades neuromusculares diferentes a las de los músculos distales de la mano y que el monitoreo con manguito puede no ser intercambiable con el monitoreo con EMG o AMG en la mano.22 Aunque la tecnología de monitoreo con manguito es atractiva porque monitorea dos parámetros importantes (la presión y el nivel de bloqueo neuromuscular), se justifica una mayor investigación para delinear su repetibilidad y reproducibilidad en diversos escenarios clínicos.
Cómo implementar el monitoreo en la práctica
Sin duda, hay obstáculos a la hora de aplicar cambios significativos en la práctica, en particular cuando muchos miembros de la comunidad de la anestesia no reconocen el problema persistente que supone la debilidad residual postoperatoria. La decisión de hacer un cambio e introducir el monitoreo en la práctica puede ser intimidante, ya que implica salir de “la zona de comfort”, dedicar más tiempo e incorporar una competencia nueva. Puede surgir la preocupación de que este cambio afecte al flujo de trabajo y a la eficiencia. Afortunadamente, se ha demostrado que la aplicación de monitores cuantitativos solo agrega 19 segundos al inicio de un caso.23 Una vez tomada la decisión de implementar el monitoreo, la decisión sobre cómo proceder también puede parecer desalentadora. Desde luego, comprender la cultura de su práctica es fundamental, como lo describieron Todd et al. cuando este grupo implementó el monitoreo con EMG en todo el departamento después de observar una cantidad inaceptable de pacientes que sufrían dificultades respiratorias en la sala de recuperación.24
Familiarizarse con las tecnologías de monitoreo emergentes mejorará, sin duda, las posibilidades de implementarlas con éxito y cambiar la práctica. El monitor o la modalidad específicos son solo una parte del cambio, ya que la decisión de cambiar la práctica es mucho más importante y, a menudo, supone un reto mucho mayor. Este cambio indudablemente requerirá más trabajo; sin embargo, debemos dar a nuestros pacientes una atención de vanguardia.
Ross Renew, MD, FASA, FASE actualmente es profesor auxiliar en el Departamento de Anestesiología y Medicina Perioperatoria de Mayo Clinic en Jacksonville, Florida.
Recibió financiación de la industria para hacer investigaciones, incluyendo de Merck & Co., y todos los fondos se destinaron a Mayo Clinic.
Referencias
- Naguib M, Brull SJ, Hunter JM, et al. Anesthesiologists’ overconfidence in their perceived knowledge of neuromuscular monitoring and its relevance to all aspects of medical practice: an international survey. Anesth Analg. 2019;128:1118–1126.
- Kotake Y, Ochiai R, Suzuki T, et al. Reversal with sugammadex in the absence of monitoring did not preclude residual neuromuscular block. Anesth Analg. 2013;117:345–351.
- Thomsen JLD, Marty AP, Wakatsuki S, et al. Barriers and aids to routine neuromuscular monitoring and consistent reversal practice—a qualitative study. Acta Anaesthesiol Scand. 2020;64:1089–1099.
- Soderstrom CM, Eskildsen KZ, Gatke MR, Staehr-Rye AK. Objective neuromuscular monitoring of neuromuscular blockade in Denmark: an online-based survey of current practice. Acta Anaesthesiol Scand. 2017;61:619–626.
- Naguib M, Brull SJ, Kopman AF, et al. Consensus statement on perioperative use of neuromuscular monitoring. Anesth Analg. 2018;127:71–80.
- Lucas DN, Russell R, Bamber JH, Elton CD. Recommendations for standards of monitoring during anaesthesia and recovery 2021. Anaesthesia. 2021 Jun 18. doi: 10.1111/anae.15528.
- Dobson G, Chow L, Filteau L, et al. Guidelines to the practice of anesthesia—revised edition 2020. Can J Anaesth. 2019;64:75–91.
- Indications of neuromuscular blockade in anaesthesia. Short text. Ann Fr Anesth Reanim. 2000;19 2:352s–355s.
- Viby-Mogensen J, Jensen NH, Engbaek J, et al. Tactile and visual evaluation of the response to train-of-four nerve stimulation. Anesthesiology. 1985;63:440–443.
- Thilen SR, Ng IC, Cain KC, Treggiari MM, Bhananker SM. Management of rocuronium neuromuscular block using a protocol for qualitative monitoring and reversal with neostigmine. Br J Anaesth. 2018;121:367–377.
- Claudius C, Skovgaard LT, Viby-Mogensen J. Is the performance of acceleromyography improved with preload and normalization? A comparison with mechanomyography. Anesthesiology. 2009;110:1261–70.
- Fuchs-Buder T, Claudius C, Skovgaard LT, et al. Good clinical research practice in pharmacodynamic studies of neuromuscular blocking agents II: the Stockholm revision. Acta Anaesthesiol Scand. 2007;51:789–808.
- Murphy GS, Szokol JW, Avram MJ, et al. Comparison of the TOFscan and the TOF-Watch SX during Recovery of Neuromuscular Function. Anesthesiology. 2018;129:880–888.
- Motamed C, Kirov K, Combes X, Duvaldestin P. Comparison between the Datex-Ohmeda M-NMT module and a force-displacement transducer for monitoring neuromuscular blockade. Eur J Anaesthesiol. 2003;20:467–469.
- Engbaek J, Ostergaard D, Viby-Mogensen J, Skovgaard LT. Clinical recovery and train-of-four ratio measured mechanically and electromyographically following atracurium. Anesthesiology. 1989;71:391–395.
- Kopman AF. The relationship of evoked electromyographic and mechanical responses following atracurium in humans. Anesthesiology. 1985;63:208–211.
- Harper NJ, Bradshaw EG, Healy TE. Evoked electromyographic and mechanical responses of the adductor pollicis compared during the onset of neuromuscular blockade by atracurium or alcuronium, and during antagonism by neostigmine. Br J Anaesth. 1986;58:1278–1284.
- Engbaek J. Monitoring of neuromuscular transmission by electromyography during anaesthesia. A comparison with mechanomyography in cat and man. Dan Med Bull. 1996;43:301–316.
- Kern SE, Johnson JO, Orr JA, Westenskow DR. Clinical analysis of the flexor hallucis brevis as an alternative site for monitoring neuromuscular block from mivacurium. J Clin Anesth. 1997;9:383–387.
- Veiga Ruiz G, Garcia Cayuela J, Orozco Montes J, et al. Monitoring intraoperative neuromuscular blockade and blood pressure with one device (TOF-Cuff): a comparative study with mechanomyography and invasive blood pressure. Rev Esp Anestesiol Reanim. 2017;64:560–567.
- Dahaba AA, Bornemann H, Holst B, Wilfinger G, Metzler H. Comparison of a new neuromuscular transmission monitor compressomyograph with mechanomyograph. Br J Anaesth. 2008;100:344–350.
- Krijtenburg P, Honing G, Martini C, et al. Comparison of the TOF-Cuff® monitor with electromyography and acceleromyography during recovery from neuromuscular block. Br J Anaesth. 2019;122:e22–e24.
- Renew JR, Hex K, Johnson P, et al. Ease of application of various neuromuscular devices for routine monitoring. Anesth Analg. 2021;132:1421–1428.
- Todd MM, Hindman BJ, King BJ. The implementation of quantitative electromyographic neuromuscular monitoring in an academic anesthesia department. Anesth Analg. 2014;119:323–331.


 Issue PDF
Issue PDF