O monitoramento neuromuscular quantitativo é o único meio confiável de confirmar a recuperação adequada do bloqueio neuromuscular e evitar fraqueza residual pós-operatória. Os anestesiologistas devem se familiarizar com as novas tecnologias de monitoramento em um esforço para reduzir as complicações relacionadas ao manejo abaixo do ideal do bloqueio neuromuscular.
A necessidade de monitoramento
Quando os pacientes ficam hipotensos na sala de cirurgia, o anestesiologista imediatamente administra o tratamento necessário. Sejam fluidos intravenosos ou medicamentos vasoativos, os médicos foram treinados para intervir de maneira aguda e evitar a deterioração clínica. Como os anestesiologistas sabem que sua intervenção foi bem-sucedida? Eles presumem que o bolus de fenilefrina foi adequado porque estão familiarizados com a farmacodinâmica desse medicamento e esperam que todos os pacientes respondam de maneira previsível? Eles apalpam a artéria carótida após um bolus de fluidos intravenosos para garantir que restauraram o volume intravascular e alcançaram a estabilidade hemodinâmica? Claro que não. Na verdade, os anestesiologistas não medem esforços para garantir que têm dispositivos precisos, como um manguito de pressão arterial de tamanho adequado ou até mesmo um cateter intra-arterial que fornece medições quantitativas da pressão arterial em tempo real. Esse grupo de profissionais de saúde espera que sua intervenção tenha o efeito desejado, mas a vigilância inata os obriga a verificar e não confiar em farmacodinâmica preditiva ou avaliações subjetivas, como apalpar o pulso.
Esse padrão de prática médica deve ser ampliado para o manejo do bloqueio neuromuscular. Administrar um antagonista do bloqueio neuromuscular, como sugamadex ou neostigmina, esperar vários minutos e, em seguida, extubar a traqueia de um paciente sem confirmar a recuperação adequada é análogo a administrar fenilefrina sem verificar novamente a pressão arterial e confirmar que a intervenção foi bem-sucedida. Da mesma forma, apalpar a resposta do polegar a uma estimulação em sequência de quatro com um estimulador de nervo periférico (ENP) e determinar subjetivamente se a recuperação adequada foi alcançada é uma prática comparável a apalpar a artéria carótida durante a administração de volume. Os anestesiologistas contam com tecnologias de ponta para manter a homeostase dos pacientes e não devem excluir o manejo do bloqueio neuromuscular desses esforços.
A relutância da comunidade de anestesistas em adotar monitoramento quantitativo (ou objetivo) é um fenômeno curioso que deu início à sua própria coleção de literatura. Uma pesquisa internacional com mais de 2.500 anestesiologistas revelou lacunas significativas no conhecimento sobre os fundamentos do manejo do bloqueio neuromuscular, uma vez que os entrevistados responderam corretamente apenas 57% das questões. Mais preocupante pode ser o fato de que 92% dos entrevistados que forneceram respostas incorretas estavam inadequadamente confiantes em suas respostas erradas.1 Há também uma crença emergente de que a introdução de sugamadex dispensa a necessidade de monitoramento quantitativo. Embora esse agente de reversão certamente tenha permitido um antagonismo do bloqueio neuromuscular mais rápido e em níveis mais profundos de bloqueio, a administração de sugamadex sem monitoramento ainda pode resultar em até 9,4% dos pacientes apresentarem fraqueza residual no momento da extubação.2 Essas lacunas de conhecimento e confiança enganosa certamente têm sido obstáculos, enquanto o treinamento inconsistente também foi descrito como uma barreira para o monitoramento.3 Por fim, historicamente tem havido uma escassez de monitores neuromusculares quantitativos confiáveis e fáceis de usar que os médicos interessados possam acessar.4
A falta de monitoramento quantitativo de rotina é um problema que persiste em todo o mundo, mas continuamos a fazer avanços com interesse renovado nesse tópico entre os anestesiologistas. Painéis de especialistas pediram monitoramento de rotina,5 enquanto sociedades de anestesia estabeleceram diretrizes recomendando o uso de monitoramento quantitativo sempre que agentes bloqueadores neuromusculares forem administrados.6-8 O setor respondeu com novos monitores e inovações que devem aumentar a segurança do paciente. Este artigo revisará algumas das tecnologias de ponta que estão disponíveis atualmente para os médicos que buscam utilizar o monitoramento neuromuscular quantitativo.
Modalidades de monitoramento
O uso de um estimulador de nervo periférico (ENP) é qualitativo e até mesmo anestesiologistas experientes são incapazes de detectar o desvanecimento de modo confiável quando a razão de sequência de quatro estímulos (TOFR) excede 0,4.9 Além disso, protocolos baseados em evidências que incorporam a administração de bloqueadores neuromusculares direcionados, antagonismo do bloqueio neuromuscular de rotina e o “uso ideal” de um estimulador de nervo periférico ainda podem deixar 35% dos pacientes com fraqueza residual.10 O papel limitado do ENP deve ser relegado a um dispositivo que é usado se não houver acesso a monitores quantitativos ou como um dispositivo que fornece informações qualitativas enquanto os anestesiologistas fazem a transição para monitores quantitativos.5
Monitores quantitativos são normalmente classificados com base nos métodos pelos quais o dispositivo obtém medições objetivas (também conhecidas como sua modalidade de monitoramento). No entanto, esses dispositivos também podem ser classificados com base no fato de serem monitores portáteis autônomos ou incorporados à estação de trabalho de anestesia. Monitores portáteis oferecem flexibilidade para obter medições objetivas fora da sala de cirurgia. A fraqueza residual pós-operatória certamente não é uma ameaça específica para a segurança do paciente no intraoperatório, e os monitores portáteis permitem o diagnóstico na sala de recuperação ou unidade de terapia intensiva. Os monitores incorporados à estação de trabalho de anestesia consistem em módulos integrados que permitem a informação contínua das medições objetivas no prontuário eletrônico. Compreender as necessidades de sua prática médica será inestimável ao escolher uma modalidade de monitoramento, além de saber se você precisa de um monitor portátil ou integrado.
Mecanomiografia
Embora não esteja disponível comercialmente, cada novo dispositivo é comparado à mecanomiografia (MMG). Esse padrão ouro histórico tem uma configuração complicada que exige calibração cuidadosa, pois obtém medições objetivas medindo a força de contração isométrica após a neuroestimulação. Ao interpretar a literatura revisada por pares sobre novas tecnologias de monitoramento quantitativo, o mais alto nível de evidências atualmente resulta da comparação direta com a MMG.
Aceleromiografia
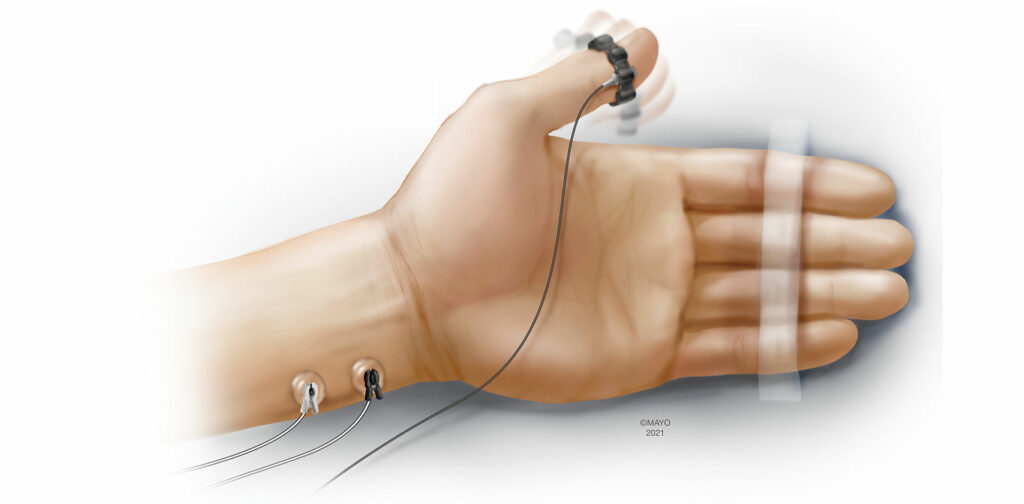
A aceleromiografia (AMG) é uma das formas de monitoramento quantitativo mais investigadas e utilizadas.4 Com base na segunda lei do movimento de Newton (Força = Massa × Aceleração), a AMG mede objetivamente a resposta à neuroestimulação usando um transdutor que é fixado ao músculo de interesse. Tradicionalmente, os eletrodos do eletrocardiograma (ECG) padrão são colocados sobre o nervo ulnar e a aceleração do músculo adutor do polegar é medida após a neuroestimulação (Figura 1). Essa configuração é muito semelhante ao emprego de um estimulador de nervo periférico na mão, exceto pelo transdutor adicional fixado no polegar. A AMG também tem sido usada em locais alternativos de monitoramento, como o pé (flexor curto do hálux) e a face (músculo orbicular do olho/músculo corrugador do supercílio). Embora a configuração da AMG possa ser intuitiva, existem ressalvas importantes para o uso dessa modalidade de monitoramento. O fenômeno de “desvanecimento reverso” no qual a TOFR basal e não paralisada excede 1,0 foi bem descrito durante o monitoramento com AMG.11 Embora os mecanismos exatos permaneçam obscuros, o desvanecimento reverso pode ter implicações significativas ao determinar se um paciente obteve recuperação neuromuscular adequada antes de extubar a traqueia. A normalização é um processo que coloca todas as TOFRs no contexto da TOFR basal (TOFR atual/TOFR basal) e pode ser responsável por TOFR basais que excedem 1,0. Em vez de definir a recuperação adequada da função neuromuscular como uma TOFR > 0,9, a recuperação adequada é realmente alcançada quando a TOFR normalizada > 0,9, quando medida com AMG.
Além disso, a normalização diminui o viés em relação à mecanomiografia (MMG). O uso de um dispositivo de pré-carga, que estabiliza o movimento do polegar, e a realização da calibração antes da administração do agente bloqueador neuromuscular, que também pode aumentar a precisão do monitoramento da AMG, são obrigatórios na realização de pesquisas nessa área.12 No entanto, essas etapas adicionais não são necessariamente exigidas durante o curso do atendimento clínico. Em contraste, a normalização de rotina é fortemente encorajada para evitar superestimar o grau de recuperação neuromuscular no final da operação.
Talvez a advertência mais importante a se considerar no monitoramento com AMG é o fato de que o músculo de interesse (normalmente o polegar) deve ser capaz de se mover livremente após a neuroestimulação. Dobrar os braços durante o posicionamento cirúrgico pode ter um impacto significativo na capacidade do médico de obter medições confiáveis com AMG. Além disso, o monitoramento com AMG em pacientes acordados pode ser desafiador, pois o movimento espontâneo no local monitorado pode produzir artefato.
Embora existam nuances importantes com as quais os médicos devem estar familiarizados antes de implementar o monitoramento com AMG, os avanços recentes na modalidade tornaram a AMG mais acessível. Transdutores tridimensionais estão incorporados a dispositivos de AMG mais novos que permitem uma melhor quantificação do movimento complexo do polegar após a neuroestimulação. Além disso, a incorporação de dispositivos de pré-carga a dispositivos mais novos melhora a precisão sem ter que obter e colocar equipamento extra.13 Além disso, foram desenvolvidas configurações sem fio de monitores de AMG que utilizam a tecnologia bluetooth para transmitir medições quantitativas do local de monitoramento para um visor incorporado à estação de trabalho de anestesia (comunicação pessoal). Os monitores de AMG estão disponíveis como unidades portáteis ou módulos que podem ser incorporados à estação de trabalho de anestesia.
Cinemiografia
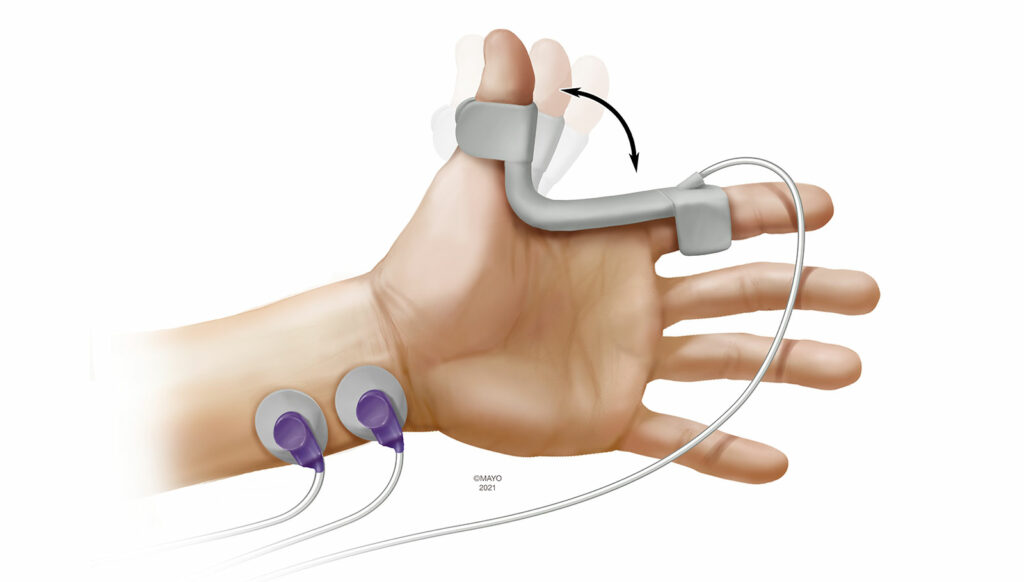
A cinemiografia (KMG) está intimamente relacionada à AMG como uma modalidade de monitoramento. Durante o monitoramento por KMG, um sensor piezoelétrico é colocado no espaço entre o polegar e o indicador (Figura 2). Após a estimulação do nervo ulnar, o músculo adutor do polegar se contrai e o sensor piezoelétrico se curva. O grau de curvatura é então traduzido em medições objetivas. O sensor serve como seu próprio dispositivo de pré-carga e a KMG não está sujeita ao fenômeno de desvanecimento reverso como na AMG. Relatórios anteriores demonstraram amplos limites de concordância entre MMG e KMG.14 Como a AMG, a KMG também depende do polegar ser capaz de se mover livremente, e dobrar os braços com firmeza durante o posicionamento cirúrgico pode impedir seu uso. O movimento do paciente durante o despertar também pode afetar o monitoramento por KMG, assim como o reposicionamento do sensor ao longo do período perioperatório. Atualmente, o único dispositivo baseado em KMG disponível é um módulo incorporado à estação de trabalho de anestesia.
Eletromiografia
A eletromiografia (EMG) tem sido considerada por muitos especialistas o novo padrão ouro, devido ao seu alto nível de concordância com a MMG15-17 e o fato de a EMG fornecer medidas quantitativas confiáveis mesmo quando os braços estão restritos durante o posicionamento cirúrgico. A EMG mede potenciais de ação muscular compostos (PAMCs) em toda a unidade neuromuscular, em vez de movimento ou qualquer substituto para o movimento. A amplitude dos PAMCs é diretamente proporcional ao número de fibras musculares ativadas (e, portanto, à força de contração). A EMG está sujeita à interferência de eletrocauterização, e a amplitude dos PAMCs pode aumentar 2-3% para cada diminuição de 1 °C na temperatura da pele.18
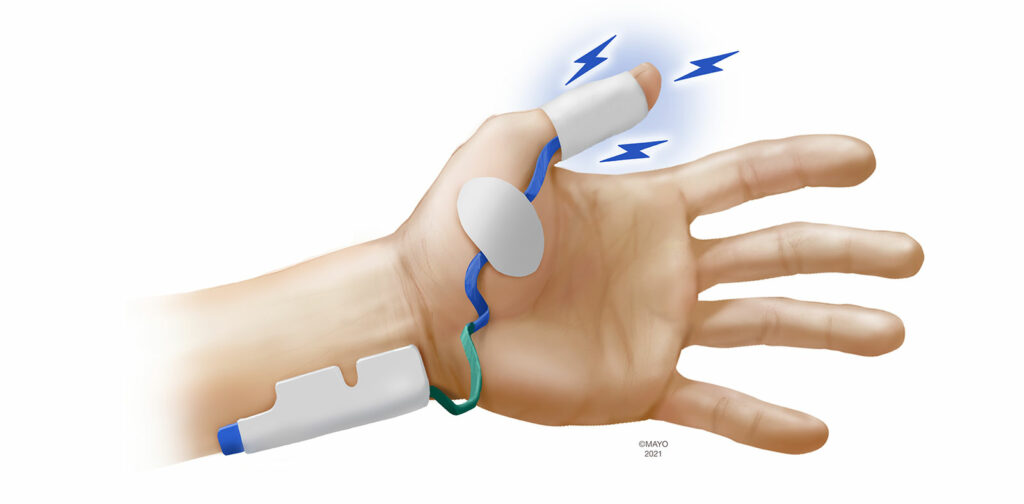
Os dispositivos de EMG estão disponíveis como unidades portáteis ou incorporados à estação de trabalho de anestesia. A maioria dos fabricantes utiliza eletrodos proprietários para estimular e medir os PAMCs colocados sobre a mão. Como o monitoramento por EMG não é interrompido quando os braços estão dobrados, buscar locais alternativos não é tão importante com EMG, embora o monitoramento no pé tenha sido descrito e seja uma opção caso nenhuma mão esteja disponível.19 Ao fazer o monitoramento na mão, três grupos de músculos foram utilizados para medir os PAMCs após a estimulação do nervo ulnar. Semelhante à AMG e à KMG, os eletrodos sensores podem ser colocados sobre o músculo adutor do polegar (Figura 3). O primeiro músculo interósseo dorsal, localizado no espaço entre o polegar e o dedo indicador, também pode ser monitorado. Por fim, o músculo adutor do dedo mínimo (5º dígito) é inervado pelo nervo ulnar, sendo um local adequado de monitoramento com EMG. Apesar de ser a modalidade de monitoramento mais antiga, há um interesse recente significativo na EMG, conforme evidenciado por vários novos monitores baseados em EMG que estão sendo introduzidos no mercado.
Monitoramento baseado em manguito
Um novo dispositivo que incorpora monitoramento objetivo dentro do manguito de pressão arterial foi desenvolvido recentemente.20 Também conhecida como técnica de manguito modificado, o monitoramento baseado em manguito parece ser inspirado na compressomiografia, uma modalidade de monitoramento já extinta que se mostrou inicialmente promissora.21 O monitoramento com base no manguito envolve a insuflação do manguito de pressão arterial para cerca de 60 mmHg, seguido por eletrodos dentro do manguito que promovem neuroestimulação. As mudanças de pressão são detectadas após a contração muscular e essas mudanças de pressão são usadas para fornecer aos médicos dados objetivos sobre o nível de bloqueio neuromuscular. Investigações iniciais mostraram que o monitoramento do braço pode ter propriedades neuromusculares diferentes dos músculos distais da mão e o monitoramento baseado em manguito pode não ser intercambiável com o monitoramento baseado em EMG ou AMG na mão.22 Embora a tecnologia de monitoramento com base em manguito seja atraente, pois monitora dois parâmetros importantes (pressão arterial e nível de bloqueio neuromuscular), uma investigação mais aprofundada é necessária para delinear sua repetibilidade e reprodutibilidade em vários cenários clínicos.
Como implementar monitoramento em sua prática médica
Certamente existem obstáculos ao implementar mudanças significativas na prática médica, particularmente quando muitos da comunidade de anestesia deixam de reconhecer o problema persistente que é a fraqueza residual pós-operatória. A decisão de mudar e introduzir o monitoramento em sua prática médica pode ser intimidante, pois envolve sair da zona de conforto, dedicar mais tempo e aprender uma nova habilidade. Preocupações podem surgir em relação a essas mudanças que afetam negativamente o fluxo de trabalho e a eficiência. Felizmente, a aplicação de monitores quantitativos demonstrou adicionar apenas 19 segundos adicionais ao início de um caso.23 Uma vez tomada a decisão de implementar o monitoramento, a decisão sobre como proceder também pode parecer assustadora. Não há dúvidas de que compreender a cultura de sua prática médica é fundamental, conforme descrito por Todd et al., quando esse grupo implementou o monitoramento por EMG em todo o departamento depois de observar um número inaceitável de pacientes com dificuldade respiratória na sala de recuperação.24
Familiarizar-se com as tecnologias de monitoramento emergentes certamente aumentará as chances de uma implementação bem-sucedida e de mudanças nas práticas médicas. O monitor ou a modalidade específica é apenas uma parte da mudança, pois a decisão de mudar a prática é muito mais importante e, muitas vezes, muito mais desafiadora. Essa mudança, sem dúvida, exigirá trabalho adicional; no entanto devemos aos nossos pacientes a oferta de atendimento de ponta.
Ross Renew MD, FASA, FASE, é professor assistente no Departamento de anestesiologia e medicina perioperatória da Mayo Clinic em Jacksonville, FL, EUA
Ele recebeu financiamento da indústria para pesquisas, inclusive da Merck & Co., com todo o financiamento para a Mayo Clinic.
Referências
- Naguib M, Brull SJ, Hunter JM, et al. Anesthesiologists’ overconfidence in their perceived knowledge of neuromuscular monitoring and its relevance to all aspects of medical practice: an international survey. Anesth Analg. 2019;128:1118–1126.
- Kotake Y, Ochiai R, Suzuki T, et al. Reversal with sugammadex in the absence of monitoring did not preclude residual neuromuscular block. Anesth Analg. 2013;117:345–351.
- Thomsen JLD, Marty AP, Wakatsuki S, et al. Barriers and aids to routine neuromuscular monitoring and consistent reversal practice—a qualitative study. Acta Anaesthesiol Scand. 2020;64:1089–1099.
- Soderstrom CM, Eskildsen KZ, Gatke MR, Staehr-Rye AK. Objective neuromuscular monitoring of neuromuscular blockade in Denmark: an online-based survey of current practice. Acta Anaesthesiol Scand. 2017;61:619–626.
- Naguib M, Brull SJ, Kopman AF, et al. Consensus statement on perioperative use of neuromuscular monitoring. Anesth Analg. 2018;127:71–80.
- Lucas DN, Russell R, Bamber JH, Elton CD. Recommendations for standards of monitoring during anaesthesia and recovery 2021. Anaesthesia. 2021 Jun 18. doi: 10.1111/anae.15528.
- Dobson G, Chow L, Filteau L, et al. Guidelines to the practice of anesthesia—revised edition 2020. Can J Anaesth. 2019;64:75–91.
- Indications of neuromuscular blockade in anaesthesia. Short text. Ann Fr Anesth Reanim. 2000;19 2:352s–355s.
- Viby-Mogensen J, Jensen NH, Engbaek J, et al. Tactile and visual evaluation of the response to train-of-four nerve stimulation. Anesthesiology. 1985;63:440–443.
- Thilen SR, Ng IC, Cain KC, Treggiari MM, Bhananker SM. Management of rocuronium neuromuscular block using a protocol for qualitative monitoring and reversal with neostigmine. Br J Anaesth. 2018;121:367–377.
- Claudius C, Skovgaard LT, Viby-Mogensen J. Is the performance of acceleromyography improved with preload and normalization? A comparison with mechanomyography. Anesthesiology. 2009;110:1261–70.
- Fuchs-Buder T, Claudius C, Skovgaard LT, et al. Good clinical research practice in pharmacodynamic studies of neuromuscular blocking agents II: the Stockholm revision. Acta Anaesthesiol Scand. 2007;51:789–808.
- Murphy GS, Szokol JW, Avram MJ, et al. Comparison of the TOFscan and the TOF-Watch SX during Recovery of Neuromuscular Function. Anesthesiology. 2018;129:880–888.
- Motamed C, Kirov K, Combes X, Duvaldestin P. Comparison between the Datex-Ohmeda M-NMT module and a force-displacement transducer for monitoring neuromuscular blockade. Eur J Anaesthesiol. 2003;20:467–469.
- Engbaek J, Ostergaard D, Viby-Mogensen J, Skovgaard LT. Clinical recovery and train-of-four ratio measured mechanically and electromyographically following atracurium. Anesthesiology. 1989;71:391–395.
- Kopman AF. The relationship of evoked electromyographic and mechanical responses following atracurium in humans. Anesthesiology. 1985;63:208–211.
- Harper NJ, Bradshaw EG, Healy TE. Evoked electromyographic and mechanical responses of the adductor pollicis compared during the onset of neuromuscular blockade by atracurium or alcuronium, and during antagonism by neostigmine. Br J Anaesth. 1986;58:1278–1284.
- Engbaek J. Monitoring of neuromuscular transmission by electromyography during anaesthesia. A comparison with mechanomyography in cat and man. Dan Med Bull. 1996;43:301–316.
- Kern SE, Johnson JO, Orr JA, Westenskow DR. Clinical analysis of the flexor hallucis brevis as an alternative site for monitoring neuromuscular block from mivacurium. J Clin Anesth. 1997;9:383–387.
- Veiga Ruiz G, Garcia Cayuela J, Orozco Montes J, et al. Monitoring intraoperative neuromuscular blockade and blood pressure with one device (TOF-Cuff): a comparative study with mechanomyography and invasive blood pressure. Rev Esp Anestesiol Reanim. 2017;64:560–567.
- Dahaba AA, Bornemann H, Holst B, Wilfinger G, Metzler H. Comparison of a new neuromuscular transmission monitor compressomyograph with mechanomyograph. Br J Anaesth. 2008;100:344–350.
- Krijtenburg P, Honing G, Martini C, et al. Comparison of the TOF-Cuff® monitor with electromyography and acceleromyography during recovery from neuromuscular block. Br J Anaesth. 2019;122:e22–e24.
- Renew JR, Hex K, Johnson P, et al. Ease of application of various neuromuscular devices for routine monitoring. Anesth Analg. 2021;132:1421–1428.
- Todd MM, Hindman BJ, King BJ. The implementation of quantitative electromyographic neuromuscular monitoring in an academic anesthesia department. Anesth Analg. 2014;119:323–331.


 Issue PDF
Issue PDF