介绍
 贫血是产科经常遇到的临床症状。加之围产期存在大量失血的可能,因此孕产妇贫血的管理对确保母婴安全至关重要。产前贫血与不良的孕产妇和新生儿结局相关,包括早产、流产、生长受限、剖宫产和宫内感染等。1,2 产后贫血与抑郁、疲劳和认知受损有关。3
贫血是产科经常遇到的临床症状。加之围产期存在大量失血的可能,因此孕产妇贫血的管理对确保母婴安全至关重要。产前贫血与不良的孕产妇和新生儿结局相关,包括早产、流产、生长受限、剖宫产和宫内感染等。1,2 产后贫血与抑郁、疲劳和认知受损有关。3
缺铁是围产期贫血最常见的原因。我们已对铁替代疗法进行了广泛研究,研究结果均显示铁替代疗法可改善血液学指标。4但迄今为止,没有任何研究表明孕产妇或新生儿临床结果的持续改善。这就需要我们提出这样一个问题:我们如何在孕产妇贫血的治疗和管理方面做出有意义的改变,从而改善临床结果?作为麻醉专业人员,我们如何与产科同事合作,以减少贫血对分娩的影响?这里重点介绍了我们目前对孕产妇贫血的认识,包括治疗手段、管理策略,以及未来的研究领域。
利用围手术期之家
麻醉专业人员准备充分,以应对患者择期术中失血过多的情况,协会层面的指南确立了各种围手术期的贫血治疗建议。5 不过,这些建议中很少有专门针对怀孕人群的。医生常因血液疾病(如血小板减少症或先天性凝血疾病等)而与麻醉专业人员进行产前会诊,但很少会因贫血而进行会诊。当贫血产妇受到麻醉专业人员的照护时,往往已经过了治疗的窗口期。产科医生、血液科医生和麻醉专业人员之间建立伙伴关系可以帮助及时诊断和管理孕产妇缺铁性贫血(Iron Deficiency Anemia, IDA)。
问题的范围
贫血是怀孕期间最常见的疾病之一,影响着全球近三分之一的孕妇。6 IDA 的发生率和程度在妊娠过程和不同人群之间存在显著差异,反映了基础性营养缺乏和妊娠期间铁稳态的复杂相互作用。例如,在中低收入国家,无论孕龄如何,IDA 都可能影响多达一半的孕妇。7,8 即使是在发达国家,也存在着明显的种族差异:在一项研究中,非洲裔美国女性患 IDA 的比例是非西班牙裔白人女性的三倍多。9 不难想象 IDA 与不良妊娠结局之间的联系:失血性休克、心血管衰竭、围产期输血发生率增加和更高的感染发生率都与孕产妇贫血有关。10-12 此外,新兴研究开始表明,围产期 IDA 不仅影响母亲,也影响胎儿。最近一项针对 50 多万儿童进行的大型队列研究表明,孕产妇贫血与神经发育障碍之间存在关联。13 这些发现说明了管理这种常见病的重要性。
缺铁性贫血的治疗
妊娠期 IDA 治疗的主要方法是口服补铁。口服铁补充剂价格便宜、容易获得、储存要求简单,安全可靠。但是,口服铁补充剂常会因为胃肠道副作用而受到限制,如恶心、消化不良或便秘等,这些可能发生在一多半的患者中。14侧重于改善产妇血液学参数(如血红蛋白、铁蛋白等)的研究发现,口服补铁后这些值有适度改善。4不过,研究未能证明其他孕产妇或胎儿结局的持续改善,如输血需求减少、加速康复或胎儿出生体重增加等。
原因可能是多方面的。孕期缺铁性贫血的诊断可能会被延迟:最初三个月访视时的首次全血细胞计数 (Complete Blood Count, CBC) 显示的贫血可能不会被随访,直到后续访视时才进行铁检测,这可能是在一个月或两个月以后。早期干预具有临床合理性,或将对孕产妇和胎儿的结局产生更大的影响。此外,这一领域的研究通常规模较小,且缺乏一致的方法。15 另外使用一致性治疗方案进行的大规模研究可能有助于确立早期治疗孕产妇铁缺乏症的临床益处。
静脉补铁的安全性
对于不能耐受口服补充剂、疗效不充分、需要迅速纠正缺乏症或有吸收障碍的 IDA 患病妇女,静脉注射铁剂已成为一种替代疗法。随着较新的、较低分子量的右旋糖酐铁和非右旋糖酐铁制剂的问世,已确立的妊娠安全记录取代了人们对以往的肠外铁剂过敏反应的担忧。15 不良反应的发生频率低于口服补铁,且通常比较轻微(例如,皮肤着染、一过性支气管痉挛等)。16 但是,由于这些是肠外制剂,因此,患者需要至少一次临床访视,而且费用比口服补铁贵很多。此外,还没有关于在输注这些化合物时是否应进行胎儿心率监测的指南,而且很少有研究考察这些药物用于孕妇时是否应对胎儿心率进行监测。17一项病例研究描述了在输注静脉铁剂(异麦芽糖酐铁)过程中发生严重的胎儿心动过缓,需要紧急施行剖腹产的病例。18尽管很多研究已经证明了这类药物的安全性,但需要开展更多的研究来确定治疗方案,以确保孕产妇和胎儿在给药期间的安全。
我们应承担的责任
产科医生可通过麻醉前在诊所进行的铁含量测定结果19 来帮助提早诊断和治疗孕期 IDA。产科医生可以将需要静脉补铁的患者转诊至拥有监测和临床基础设施的围手术期贫血诊所。已发现对贫血的心脏手术患者进行超短期治疗,围手术期输血量有望减少。20 对孕妇采用这些治疗可能有限制贫血的围产期影响。一些医疗机构已经开始在围手术期补铁诊所治疗孕妇,这为临床研究评估这种照护模式的效果提供了额外的机会。
产前贫血的治疗并不一定能成功,即使在没有基础性贫血的患者中,也可能会发生围产期意外出血。这就需要麻醉专业人员和产科医生共同决定何时为围产期患者进行输血。在对非产科患者开展的大规模研究中,非限制性输血策略没有任何益处(反而增加了伤害)。21 已在围产期患者中观察到了相似的结果。22 这使得美国麻醉师协会和美国血库协会都发布了支持保守性输血策略的建议(即,输血阈值 Hb < 7 对比 <10)。23,24 不过,基于阈值的输血方法有限制。产后出血通常发生得很快,需要麻醉专业人员权衡输血效益(即改善组织灌注)和潜在风险(如感染、TACO、TRALI)。其他的围手术期策略(如使用血液回收方法、25抗纤溶治疗等26)有可能进一步降低围产期输血的发生率。
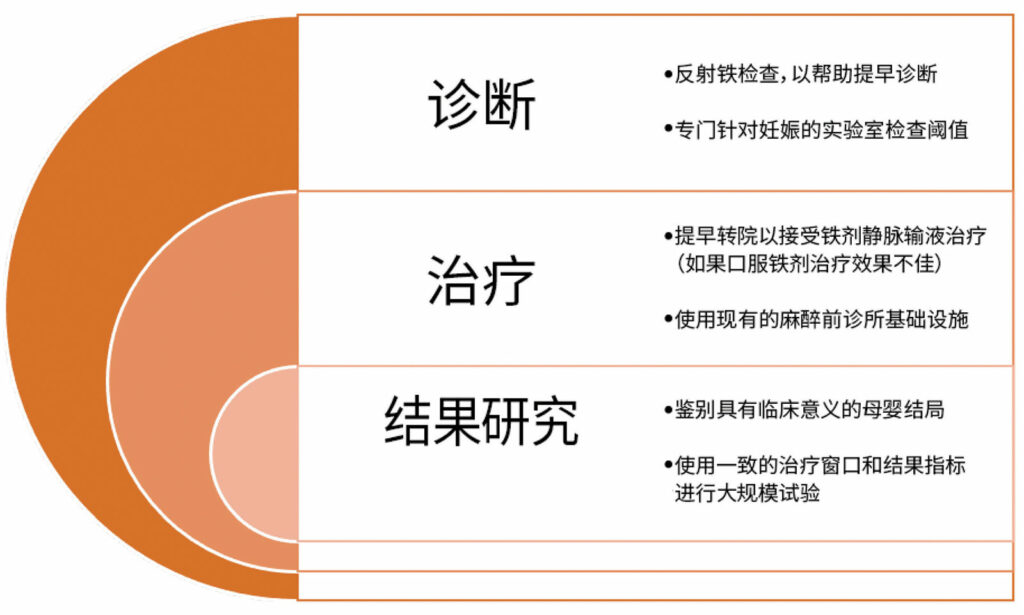
将这些策略整合在全面的患者血液管理项目中,可以帮助医疗机构规范妊娠早期贫血的治疗工作,从而减少不必要的输血量。其中的一个项目包括诊断的临床路径、教育材料、实验室方案和标准化的铁剂处方(图 1)。27 实施后,铁蛋白检测率提高了十倍,输血次数下降了 50%。类似的项目已经证明入院时的贫血发生率和输血发生率均有所降低。28,29 这些和其他类似的项目可能最终帮助医务人员认识到治疗产前缺铁在改善孕母婴结局方面的可能性。
产后贫血
尽管对产后贫血的研究相对较少,但它与许多孕产妇的不良结局有关,包括疲劳、抑郁和认知影响等。毫无疑问,产前贫血和产后出血是产后贫血的重要预测因素。30 与产前 IDA 不同,产后 IDA 通常是突然发生的,在分娩时或分娩前后,铁储备量会大量流失。使用口服铁剂治疗产后 IDA 与产前治疗一样,都存在依从性和耐受性问题。正因为如此,静脉输注铁剂疗法正在成为快速恢复分娩时铁流失的一线疗法,并且已经证明,与口服铁剂疗法相比,其能更快、更显著地提高血红蛋白水平。3
给予静脉注射铁剂可能有助于避免一些与输血有关的病状,因为有证据表明,在产后输注红细胞的病例中,有一部分可能是不适当的。31,32 即,最近的一项非劣性试验随机安排 500 多名无症状产后贫血的妇女接受红细胞输注或不干预。22 这项研究表明,输血妇女的疲劳评分只有轻微降低。未来,直接比较输血和静脉输注铁剂治疗可能有助于确定产后 IDA 的最佳治疗方法,同时尽量减少不必要的输血。
结论
围产期 IDA 仍然是一个常见且严重的问题,与妇女及其婴儿的各种不良临床结局有关。然而,研究并未完全证实补铁能改善这些结果。麻醉专业人员、产科医生和血液病医生之间的合作机会很多,利用围手术期之家这一工具可以为改善孕产妇和胎儿的临床结局开辟道路。同时,认识到围产期 IDA 的后果和治疗的安全问题对于负责照护这些患者的麻醉专业人员是至关重要的。
Jack M. Peace(医学博士)是天普大学 (Temple University) 的助理教授。
Jennifer Banayan(医学博士)是西北大学 (Northwestern University) 范伯格医学院麻醉医学系的副教授。
Jack Peace(医学博士)没有利益冲突。Jennifer Banayan (医学博士)是《APSF 新闻通讯》的编辑。
参考文献
- Prefumo F, Fichera A, Fratelli N, Sartori E. Fetal anemia: diagnosis and management. Best Pract Res Clin Obstet Gynaecol. 2019;58:2–14.
- Butwick AJ, McDonnell N. Antepartum and postpartum anemia: a narrative review. Int J Obstet Anesth. 2021:102985.
- Sultan P, Bampoe S, Shah R, et al. Oral vs intravenous iron therapy for postpartum anemia: a systematic review and meta-analysis. Am J Obstet Gynecol. 2019;221:19-29.e13.
- Abraha I, Bonacini MI, Montedori A, et al. Oral iron-based interventions for prevention of critical outcomes in pregnancy and postnatal care: an overview and update of systematic reviews. J Evid Based Med. 2019;12:155–166.
- Warner MA, Shore-Lesserson L, Shander A, et al. Perioperative anemia: prevention, diagnosis, and management throughout the spectrum of perioperative care. Anesth Analg. 2020;130:1364–1380.
- Stevens GA, Finucane MM, De-Regil LM, et al. Global, regional, and national trends in haemoglobin concentration and prevalence of total and severe anaemia in children and pregnant and non-pregnant women for 1995-2011: a systematic analysis of population-representative data. Lancet Glob Health. 2013;1:e16-25.
- Black RE, Victora CG, Walker SP, et al. Maternal and child undernutrition and overweight in low-income and middle-income countries. The Lancet. 2013;382:427–451.
- McLean E, Cogswell M, Egli I, et al. Worldwide prevalence of anaemia, WHO Vitamin and Mineral Nutrition Information System, 1993-2005. Public Health Nutr. 2009;12:444–454.
- Mohamed MA, Ahmad T, Macri C, Aly H. Racial disparities in maternal hemoglobin concentrations and pregnancy outcomes. J Perinat Med. 2012;40:141–149.
- Milman N. Anemia—still a major health problem in many parts of the world! Ann Hematol. 2011;90:369–377.
- VanderMeulen H, Strauss R, Lin Y, et al. The contribution of iron deficiency to the risk of peripartum transfusion: a retrospective case control study. BMC Pregnancy Childbirth. 2020;20:196.
- Drukker L, Hants Y, Farkash R, et al. Iron deficiency anemia at admission for labor and delivery is associated with an increased risk for cesarean section and adverse maternal and neonatal outcomes. Transfusion. 2015;55:2799–2806.
- Wiegersma AM, Dalman C, Lee BK, et al. Association of prenatal maternal anemia with neurodevelopmental disorders. JAMA Psychiatry. 2019;76:1294–1304.
- Cancelo-Hidalgo MJ, Castelo-Branco C, Palacios S, et al. Tolerability of different oral iron supplements: a systematic review. Curr Med Res Opin. 2013;29:291–303.
- Qassim A, Grivell RM, Henry A, et al. Intravenous or oral iron for treating iron deficiency anaemia during pregnancy: systematic review and meta-analysis. Med J Aust. 2019.
- Govindappagari S, Burwick RM. Treatment of iron deficiency anemia in pregnancy with intravenous versus oral iron: systematic review and meta-analysis. Am J Perinatol. 2019;36:366–376.
- Jose A, Mahey R, Sharma JB, et al. Comparison of ferric Carboxymaltose and iron sucrose complex for treatment of iron deficiency anemia in pregnancy-randomised controlled trial. BMC Pregnancy Childbirth. 2019;19:54.
- Woodward T, Kay T, Rucklidge M. Fetal bradycardia following maternal administration of low-molecular-weight intravenous iron. Int J Obstet Anesth. 2015;24:196–197.
- Okocha O, Dand H, Avram MJ, Sweitzer B. An effective and efficient testing protocol for diagnosing iron-deficiency anemia preoperatively. Anesthesiology. 2020;133:109–118.
- Spahn DR, Schoenrath F, Spahn GH, et al. Effect of ultra-short-term treatment of patients with iron deficiency or anaemia undergoing cardiac surgery: a prospective randomised trial. Lancet. 2019;393:2201–2212.
- Carson JL, Stanworth SJ, Roubinian N, et al. Transfusion thresholds and other strategies for guiding allogeneic red blood cell transfusion. Cochrane Database Syst Rev. 2016;10:Cd002042.
- Prick BW, Jansen AJ, Steegers EA, et al. Transfusion policy after severe postpartum haemorrhage: a randomised non-inferiority trial. BJOG. 2014;121:1005–1014.
- Management ASoATFoPB. Practice guidelines for perioperative blood management: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Blood Management. Anesthesiology. 2015;122:241–275.
- Carson JL, Guyatt G, Heddle NM, et al. Clinical practice guidelines from the AABB: red blood cell transfusion thresholds and storage. JAMA. 2016;316:2025–2035.
- Goucher H, Wong CA, Patel SK, Toledo P. Cell salvage in obstetrics. Anesth Analg. 2015;121:465–468.
- O’Brien KL, Shainker SA, Lockhart EL. Transfusion management of obstetric hemorrhage. Transfus Med Rev. 2018;32:249–255.
- Abdulrehman J, Lausman A, Tang GH, et al. Development and implementation of a quality improvement toolkit, iron deficiency in pregnancy with maternal iron optimization (IRON MOM): a before-and-after study. PLoS Med. 2019;16:e1002867.
- Flores CJ, Yong A, Knights E, et al. Maternity iron, anaemia and blood management in South Australia: a practice-based evidence for clinical practice improvement. Vox Sang. 2020;115:735–744.
- Guinn NR, Cooter ML, Maisonave Y, et al. How do I develop a process to effectively treat parturients with iron deficiency anemia? Transfusion. 2020;60:2476–2481.
- Butwick AJ, Walsh EM, Kuzniewicz M, et al. Patterns and predictors of severe postpartum anemia after Cesarean section. Transfusion. 2017;57:36–44.
- Butwick AJ, Aleshi P, Fontaine M, et al. Retrospective analysis of transfusion outcomes in pregnant patients at a tertiary obstetric center. Int J Obstet Anesth. 2009;18:302–308.
- Parker J, Thompson J, Stanworth S. A retrospective one-year single-centre survey of obstetric red cell transfusions. Int J Obstet Anesth. 2009;18:309–313.


 Issue PDF
Issue PDF