La céfazoline est une cause d’anaphylaxie souvent identifiée aux États-Unis, survenant dans 1 chirurgie sur 10 000. Cependant, elle est souvent négligée.1 En cas de suspicion d’anaphylaxie, il peut être utile de doser la tryptase sérique dans un délai de 2 heures afin d’identifier l’épisode ou de le différencier d’autres causes. La céfazoline fait partie des céphalosporines de première génération avec des radicaux R1 et R2 qui sont distincts d’autres bêta-lactames et la plupart des patients allergiques à la céfazoline peuvent tolérer les pénicillines et d’autres céphalosporines.
Comment se manifeste l’anaphylaxie à la céfazoline ? Un exemple concret
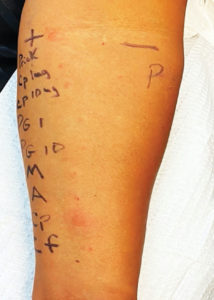
Figure 1 : Illustration d’un prick-test et de tests cutanés intradermiques positifs à la céfazoline (Cp) suite à deux épisodes distincts d’anaphylaxie provisoirement associée à la céfazoline deux mois auparavant. Le prick-test de contrôle à l’histamine (H) est positif. Le prick-test et les tests intradermiques de contrôle à une solution saline sont négatifs. Les tests cutanés intradermiques à d’autres agents réactifs comprenant l’ampicilline 25 mg/l, la benzylpénicilline 1000 et 10 000 IU/ml, un mélange de déterminants mineurs (MDM) et un déterminant majeur (Pre-pen) étaient négatifs.
Une femme de 50 ans d’origine afro-américaine s’est présentée à une clinique d’allergies et immunologie après deux épisodes distincts de suspicion d’anaphylaxie avant une intervention prévue pour la pose d’une prothèse de hanche dans un hôpital périphérique. Elle n’a signalé aucun autre antécédent médical significatif. Son traitement médicamenteux était notable avec une utilisation de longue date de rosuvastatine 20 mg par voie orale et d’acétaminophène 500 mg par voie orale en cas de besoin. La première fois, on lui a administré de la vancomycine 2 g et de la céfazoline 1 g avant la chirurgie programmée pour le remplacement de sa hanche. Aucune sédation ni aucun agent anesthésiant ne lui avait été administré. Quelques minutes après l’administration de céfazoline, elle a développé un érythème cutané, un œdème facial et labial et une hypotension. On lui a administré une seule dose d’épinéphrine 0,3 mg en intramusculaire, de la diphénhydramine 50 mg et de l’hydrocortisone 125 mg en intraveineux, puis elle a été transférée dans l’unité de soins intensifs pour observation pendant une journée supplémentaire. Dix jours plus tard, une nouvelle tentative de préparation de la chirurgie de sa prothèse de hanche a eu lieu et cette fois, il lui a été administré de la céfazoline 2 g (sans vancomycine) et en quelques minutes, elle a présenté un œdème facial et un érythème. Elle a immédiatement reçu de l’épinéphrine 0,3 mg en intramusculaire et de la diphénhydramine 50 mg en intraveineux et elle est restée en observation pendant plusieurs heures sans que le problème ne se reproduise. Deux mois plus tard, elle a consulté une clinique d’allergies, où elle a subi des prick-tests pour l’allergie à la céfazoline, suivis de tests intradermiques pour l’allergie aux pénicillines, à la céfazoline et à la ceftriaxone (Figure 1). Les tests cutanés étaient faiblement positifs pour la céfazoline avec les prick-tests et fortement positifs pour la céfazoline en intradermique, mais négatifs pour tous les autres molécules. Elle a toléré les tests de provocation à l’amoxicilline et à la céfalexine, toutes les deux à 250 mg par voie orale. D’après ces données, on a diagnostiqué une anaphylaxie à la céfazoline et elle a été informée qu’elle pouvait prendre des pénicillines et des céphalosporines en toute sécurité, hormis la céfazoline, ainsi que la vancomycine. Nous avons mis l’accent sur le fait que la céfazoline devait être clairement documentée comme provoquant une réaction grave (anaphylaxie) dans tous ses dossiers médicaux électroniques et pharmaceutiques et qu’elle devait porter un bracelet d’alerte médicale.
Comment Identifier l’Hypersensibilité Périopératoire ?
Les réactions d’hypersensibilité périopératoire (POH) sont des évènements inattendus et imprévisibles qui surviennent soudainement, sans avertir. La gravité des réactions peut aller de réactions légères à une anaphylaxie grave qui, dans certains cas, peuvent être fatales. L’incidence de la POH varie fortement et selon le pays d’origine, des études récentes suggèrent une incidence de 1 sur 10 000.2 On pense que la majorité des cas de POH ont une cause allergique, en raison d’une activation mastocytaire à médiation IgE. Cependant, les mécanismes qui ne dépendent pas des IgE et qui causent une activation mastocytaire peuvent également survenir en association avec de nombreux médicaments administrés en soins périopératoires. Récemment, il a été démontré que le récepteur couplé à la protéine G liée au max-X2 (MRGPRX2) était la cause de réactions à certains médicaments, tels que les curares, la vancomycine, les fluoroquinolones et les opiacés. Les produits de contraste utilisés en radiologie peuvent également causer une activation mastocytaire sans médiation IgE.
En règle générale, les réactions de POH sont accompagnées d’une atteinte cardiovasculaire et/ou respiratoire, y compris des signes d’hypotension, la tachycardie, le bronchospasme et l’arrêt cardiaque. Des réactions muquo-ocutanées telles qu’un érythème, un urticaire ou un œdème de Quincke peuvent également se produire, mais il est possible que le champ opératoire recouvrant le patient les masques. Les symptômes cardiorespiratoires ne sont pas spécifiques à la POH et peuvent survenir pour diverses raisons, telles que des médicaments, une hypovolémie, une maladie respiratoire sous-jacente et de multiples tentatives d’intubation. Récemment, un panel d’experts anesthésistes et allergologues a développé un système de notation clinique pour aider à déterminer la probabilité d’une réaction pouvant être due à une POH (Tableau 1).3 Une échelle pondérée avec des points pour ou contre une POH est reportée sous forme de tableau, en fonction des paramètres cliniques, produisant une note représentant la probabilité d’une réaction d’hypersensibilité immédiate. Ce système de notation a été validé en matière de contenu, de critères et de facteurs discriminants, mais n’a pas fait l’objet d’une validation externe indépendante.3
Tableau 1 : Système de notation clinique pour les suspicions de réactions d’hypersensibilité périopératoire.*
| Système cardiovasculaire (CVS) (Choisir hypotension, hypotension grave ou arrêt cardiaque le cas échéant, puis tout autre élément applicable) | Points |
| Hypotension grave | 6 |
| Hypotension | 4 |
| Arrêt cardiaque | 9 |
| Tachycardie | 2 |
| Une réponse mauvaise et une réponse éphémère de l’hypotension aux doses standard de sympathomimétiques utilisées pour traiter une hypotension pharmacologique pendant l’anesthésie (par exemple éphédrine, phényléphrine, métaraminol) | 2 |
| Une échocardiographie du site de soins indiquant un cœur hyperkinétique, se remplissant difficilement | 2 |
| Récurrence ou aggravation de l’hypotension après une nouvelle dose d’un médicament administré avant l’évènement initial | 1 |
| Variables cardiovasculaires confondantes (choisir toutes les valeurs applicables) | |
| Dose excessive d’anesthésique ou d’anesthésiques | -2 |
| Hypovolémie induite chirurgicalement ou hypovolémie relative causée par un jeûne/une déshydratation prolongé(e) | -1 |
| Une maladie aiguë prédisposant à l’hypotension | -1 |
| Des médicaments affectant les réponses cardiovasculaires pendant l’anesthésie | -2 |
| Une anesthésie loco-régionale neuraxiale (épidurale/spinale) | -1 |
| Le déclenchement de l’hypotension après une hausse de la pression de crête dans les voies aériennes pendant la ventilation mécanique des poumons | -2 |
| Système respiratoire (RS) (Choisir bronchospasme ou bronchospasme grave le cas échéant, puis tout autre élément applicable) | |
| Bronchospasme | 2 |
| Bronchospasme grave | 4 |
| Récurrence ou aggravation du bronchospasme après une nouvelle dose d’un médicament administré avant l’évènement initial | 1 |
| Bronchospasme survenant avant l’utilisation d’instruments sur les voies aériennes (après avoir exclu une obstruction des voies aériennes) | 2 |
| Variables respiratoires confondantes | |
| Maladie respiratoire associée à des voies aériennes réactives | -1 |
| Tentatives prolongées ou multiples d’intubation trachéale | -1 |
| Dose inappropriée de médicaments pour émousser la réponse des voies aériennes avant l’utilisation d’instruments sur les voies aériennes | -1 |
| Derme/muqueuses (D/M) (choisir tous les éléments applicables) | |
| Urticaire généralisé | 4 |
| Œdème de Quincke | 3 |
| Érythème généralisé | 3 |
| Une rougeur généralisée provoquant des démangeaisons chez le patient éveillé auquel il n’a pas été administré d’opiacés par voie épidurale/spinale | 1 |
| Derme/muqueuses/variable confondante | |
| L’œdème de Quincke chez un patient qui prend un inhibiteur de l’enzyme de conversion (ACE) | -3 |
| Associations (choisir un élément au maximum)** | |
| CVS>2 & RS > 2 | 5 |
| CVS>2 & D/M >2 | 5 |
| RS>2 & D/M >2 | 5 |
| CVS>2 & RS>2 & D/M >2 | 8 |
| Délais (choisir un élément au maximum) | |
| Déclenchement de problèmes cardiovasculaires ou respiratoires dans un délai de 5 min d’un déclencheur IV possible | 7 |
| Déclenchement de problèmes cardiovasculaires ou respiratoires dans un délai de 15 min d’un déclencheur IV possible | 3 |
| Déclenchement de problèmes cardiovasculaires ou respiratoires dans un délai de 60 min d’un déclencheur non-IV possible | 2 |
| Déclenchement de problèmes cardiovasculaires ou respiratoires plus de 60 min après un déclencheur non-IV possible | -1 |
| Probabilité de réaction d’hypersensibilité immédiate | Note totale (nette) |
| Quasiment certaine | >21 |
| Très probable | Entre 15 et 21 |
| Probable | Entre 8 et 14 |
| Peu probable | < 8 |
| *Tableau modifié de Hopkins PM, Cooke PJ, Clarke RC, et al. Notation clinique issue d’un consensus pour les suspicions de réactions immédiates d’hypersensibilité périopératoire. Br J Anaesth. 2019;123(1):e29–e37.
**Pour qu’une note de l’un des 3 systèmes d’organes (CVS, RS, D/M) contribue à la note totale, la note nette pour le système en question doit être supérieure à 2. La note totale est la somme des notes pour les caractéristiques positives moins la somme des notes pour les variables confondantes parmi les notes du système en question. |
|
L’essai en laboratoire le plus utile pour permettre de confirmer une réaction d’hypersensibilité immédiate est le niveau de tryptase sérique. La tryptase est une protéase produite par les cellules mastocytaires pendant une anaphylaxie et elle est caractéristique de l’activation mastocytaire. Dans l’idéal, il faut obtenir un niveau de tryptase dans les 2 heures qui suivent une réaction. Son dosage ne sera pas affecté par les médicaments utilisés pour traiter une réaction. Le niveau élevé de tryptase présente une valeur prédictive extrêmement positive (82–99 %) d’anaphylaxie dans les suspicions de réactions périopératoires.4 Cependant, les patients peuvent avoir une anaphylaxie sans que le niveau de tryptase soit élevé (> 11,4 ng/ml). Une tryptase supérieure à 7,35 ng/ml a une valeur prédictive positive de 99 % de POH chez les patients souffrant d’un collapsus cardiovasculaire grave ou d’un arrêt cardiaque. Un taux de tryptase sérique aigu, supérieur à ([1,2 x tryptase sérique de référence] + 2) peut permettre de confirmer l’anaphylaxie (en particulier chez les patients dont le niveau de tryptase sérique aigu est normal) et présente une valeur prédictive positive de la POH de 94 %. Des réactions graves peuvent survenir occasionnellement, même avec une activation mastocytaire sans médiation IgE, comme par exemple avec la vancomycine en injection rapide.5 Dans environ 10 % des cas, la tryptase sérique peut être élevée dans le cadre d’une activation mastocytaire sans médiation IgE.
Bien que la POH puisse avoir de nombreuses causes, les antibiotiques, les curares et les désinfectants font partie des causes les plus courantes documentées dans le monde.2 Aux États-Unis toutefois, la céfazoline est la cause la plus couramment identifiée de POH, qui serait associée à plus de 50 % des cas de POH, et pouvant survenir dès la première exposition à la céfazoline.6 La voie de sensibilisation à la céfazoline n’est pas déterminée. Il est important de reconnaître qu’actuellement, on pense que la plupart des épisodes d’anaphylaxie aux céphalosporines sont liés aux radicaux R1. Les radicaux R1 et R2 de la céfazoline sont distincts et ne sont pas communs à d’autres bêta-lactames utilisés en Amérique du Nord. Ainsi, les patients allergiques à la céfazoline ne sont pas généralement allergiques à la pénicilline ou à d’autres céphalosporines.6
Pourquoi est-il important de procéder à un dépistage dans le cadre de l’hypersensibilité périopératoire ?
Après une suspicion de réaction allergique dans le cadre périopératoire, il est important d’utiliser tous les outils de recherche et de diagnostic permettant d’identifier le médicament responsable. Premièrement, il est possible que l’évènement soit survenu avant la chirurgie et que la chirurgie ait été abandonnée au moment de la réaction allergique, mais qu’elle soit encore nécessaire ou recommandée. Deuxièmement, même si cette chirurgie spécifique a été réalisée malgré la réaction, il est certain que la plupart des patients subiront un jour une autre anesthésie. Les recommandations issues d’un consensus international d’un panel d’experts anesthésistes et allergologues préconisent une évaluation allergique complète, dans l’idéal dans le cadre d’une collaboration entre anesthésistes et allergologues, de tous les patients présentant des réactions allergiques périopératoires.7 Il est estimé que le moment idéal de l’évaluation allergique se situe environ 4 semaines après l’évènement. Cependant, aucune preuve scientifique n’étaye cette hypothèse et un dépistage survenant dans les 6 mois suivant l’évènement reste utile.8 Pour les patients allergiques aux céphalosporines, environ 60 à 80 % perdent la réactivité aux tests cutanés 5 ans après une anaphylaxie aiguë.9
Il est important que l’allergologue ait accès au dossier complet de l’anesthésie et aux notes opératoires, indiquant l’heure de l’administration et tous les autres détails relatifs à des expositions potentielles, notamment des désinfectants, du latex, des lubrifiants, des agents de contraste, des colorants, des éponges de gélatine hémostatiques, des corps étrangers et des anesthésiques locaux, ainsi que le délai écoulé entre l’exposition et l’évènement allergique concerné. Cela permettra d’orienter les évaluations nécessaires. Après un test cutané négatif, des provocations sous observation, autrement dit l’administration au patient d’une dose complète d’un médicament dans un cadre d’observation en 1 ou 2 étapes, sont réalisées pour tous les médicaments potentiellement responsables, dans la mesure du possible dans le contexte d’une hospitalisation ambulatoire. La majorité des cabinets d’allergologie ne réalisent pas de tests de provocation par voie intraveineuse et il est impossible de pratiquer en toute sécurité des tests de provocation aux opiacés, benzodiazépines, curares et propofol dans le cadre d’une consultation ambulatoire dans un cabinet d’allergologie. Par conséquent, un test cutané négatif à des agents que l’allergologue ne peut pas inclure dans son dépistage impose une « dose test », administrée immédiatement avant une anesthésie future. Les meilleures preuves factuelles à ce jour aux États-Unis suggèrent que nous pourrons identifier au moins un tiers des médicaments responsables grâce à cette stratégie, en dépistant les patients avec des tests cutanés positifs.8 Environ 9 patients sur 10 évalués par un(e) allergologue, que leur test cutané soit positif ou négatif, tolèreront une anesthésie future sans réaction allergique récurrente.8
De nombreux patients se présentant pour une chirurgie signalent des allergies aux pénicillines ou à la céfazoline sans évaluation allergique formelle. Par conséquent, les soignants périopératoires cherchent souvent d’autres antibiotiques prophylactiques pouvant être administrés à ces patients. Cependant, les antibiotiques périopératoires alternatifs pour prévenir les infections du site opératoire peuvent être associés à un risque accru d’échec de la prophylaxie et d’infection.10 En outre, la clindamycine et la vancomycine périopératoires sont associées à un risque accru de colite à Clostridium difficile et de lésions rénales aiguës. D’autre part, un patient avec une allergie documentée à la céfazoline dans son dossier médical électronique sans recommandation spécifique d’un(e) allergologue, peut éviter tous les antibiotiques bêta-lactame, pouvant avoir d’autres implications cliniques à l’avenir.11 Si la céfazoline est identifiée comme agent causal, la tolérance à d’autres bêta-lactames pourra être confirmée par des tests d’allergie spécialisés.
Aux États-Unis, la plupart des patients qui sont reconnus comme étant allergiques à la pénicilline signalent des antécédents de rougeurs bénignes, de réactions distantes ou inconnues. Les patients présentant ces antécédents associés à des risques faibles peuvent recevoir de la céfazoline en toute sécurité pour une prophylaxie chirurgicale.6 Récemment, un groupe multidisciplinaire à Emory University a développé un algorithme simple pour l’administration de la céfazoline ou du céfuroxime pour la prophylaxie antibiotique périopératoire de patients présentant des antécédents d’allergie à la pénicilline.12 Si les patients n’avaient pas d’antécédents de réactions allergiques graves aux médicaments, tels que le syndrome de Stevens-Johnson ou la nécrolyse épidermique toxique, une réaction aux médicaments avec des éosinophiles et des symptômes systémiques, des lésions hépatiques ou rénales, de l’anémie, de la fièvre ou de l’arthrite suite à la prise de pénicilline, ils étaient autorisés à recevoir de la céfazoline ou du céfuroxime. Après la mise en œuvre de cet algorithme simple, l’utilisation des céphalosporines a été multipliée quasiment par quatre chez les sujets allergiques à la pénicilline. Aucun des 551 patients allergiques à la pénicilline qui ont reçu des céphalosporines n’a eu une réaction allergique immédiate. Une autre étude a révélé que même chez des patients dont l’allergie à la pénicilline anaphylactique était confirmée, le risque d’allergie à la céfazoline était inférieur à 1 %.13
Pour les patients souffrant de POH, nous recommandons une approche standardisée qui optimise la sécurité des patients et inclut une collaboration entre les anesthésistes et un(e) allergologue/immunologue, afin d’identifier l’agent responsable et de proposer un plan logique pour les anesthésies futures, permettant de réduire au minimum le risque allergique, tout en tenant compte de l’importance des antibiotiques prophylactiques.1 Si l’anesthésiste n’a pas de collaboration établie avec un(e) allergologue, il pourra en trouver un(e) en s’adressant à une association professionnelle (https://allergist.aaaai.org/find/). En outre, avec l’expansion de la télémédecine qui a accompagné la pandémie de COVID-19, il est désormais possible d’obtenir un rendez-vous en téléconsultation avec les allergologues des plus grands centres médicaux universitaires, qui évaluent généralement ces patients, pour un triage formel et une stratification des risques avant des tests spécialisés.
En résumé, les réactions de POH sont des évènements rares, avec de nombreux agents potentiellement responsables, la céfazoline étant le plus fréquent aux États-Unis. La collaboration entre les anesthésistes et les allergologues peut aider à identifier l’agent responsable et à développer un plan pour l’administration future d’une anesthésie en toute sécurité. Alors que la plupart des patients reconnus comme étant allergiques à la pénicilline ne sont pas vraiment allergiques, la grande majorité des patients dont l’allergie à la pénicilline n’est pas reconnue peuvent recevoir de la céfazoline pour la prophylaxie chirurgicale sans risque accru de réaction allergique.
David A. Khan, MD, est professeur de médecine dans le Service allergies et immunologie du Centre médical Southwestern de l’Université du Texas, Dallas, TX.
Kimberly G. Blumenthal, MD, MPH, est professeure-assistante de médecine à Harvard Medical School, dans le Service de rhumatologie, allergies et immunologie du Massachusetts General Hospital, Boston, MA.
Elizabeth J. Phillips, MD, est professeur de médecine et titulaire de la chaire John A. Oates en recherche clinique du Département de médecine du Centre médical de l’Université Vanderbilt, Nashville, TN.
Les auteurs ne signalent aucun conflit d’intérêts.
Documents de référence
- Saager L, Turan A, Egan C, et al. Incidence of intraoperative hypersensitivity reactions: a registry analysis. Anesthesiology. 2015;122:551–559.
- Mertes PM, Ebo DG, Garcez T, et al. Comparative epidemiology of suspected perioperative hypersensitivity reactions. Br J Anaesth. 2019;123:e16–e28.
- Hopkins PM, Cooke PJ, Clarke RC, et al. Consensus clinical scoring for suspected perioperative immediate hypersensitivity reactions. Br J Anaesth. 2019;123:e29–e37.
- Volcheck GW, Hepner DL. Identification and management of perioperative anaphylaxis. J Allergy Clin Immunol Pract. 2019;7:2134–2142.
- Alvarez-Arango S, Yerneni S, Tang O, et al. Vancomycin hypersensitivity reactions documented in electronic health records. J Allergy Clin Immunol Pract. 2020.
- Khan DA, Banerji A, Bernstein JA, et al. Cephalosporin allergy: current understanding and future challenges. J Allergy Clin Immunol Pract. 2019;7:2105–2114.
- Garvey LH, Dewachter P, Hepner DL, et al. Management of suspected immediate perioperative allergic reactions: an international overview and consensus recommendations. Br J Anaesth. 2019;123:e50–e64.
- Banerji A, Bhattacharya G, Huebner E, et al. Perioperative allergic reactions: allergy assessment and subsequent anesthesia. J Allergy Clin Immunol Pract. 2020;S2213–2198.
- Romano A, Gaeta F, Valluzzi RL, et al. Natural evolution of skin-test sensitivity in patients with IgE-mediated hypersensitivity to cephalosporins. Allergy. 2014;69:806–809.
- Berríos-Torres SI, Umscheid CA, Bratzler DW, et al. Centers for Disease Control and prevention guideline for the prevention of surgical site infection, 2017. JAMA Surg. 2017;152:784–791.
- Blumenthal KG, Peter JG, Trubiano JA, Phillips EJ. Antibiotic allergy. Lancet. 2019;393:183–198.
- Kuruvilla M, Sexton M, Wiley Z, et al. A streamlined approach to optimize perioperative antibiotic prophylaxis in the setting of penicillin allergy labels. J Allergy Clin Immunol Pract. 2020;8:1316–1322.
- Romano A, Valluzzi RL, Caruso C, et al. Tolerability of cefazolin and ceftibuten in patients with IgE-mediated aminopenicillin allergy. J Allergy Clin Immunol Pract. 2020;8:1989–1993.e1982.


 Issue PDF
Issue PDF