O fiasco da gripe suína
 Em janeiro de 1976, um grupo de jovens militares saudáveis contraiu uma doença respiratória desconhecida em Fort Dix, centro de treinamento do exército dos EUA em Nova Jérsei. Vários foram hospitalizados. Um recruta, que se recusou a ser hospitalizado, morreu. Comprovou-se que a causa da doença era o vírus H1N1, a cepa de influenza responsável pela pandemia de 1918. Era considerada a forma mais perigosa de gripe, mas desde 1918 estava limitada principalmente aos que trabalhavam com porcos. Pela primeira vez em 58 anos, o H1N1 estava claramente se espalhando rapidamente por meio do contato entre humanos. De 500 jovens, 13 contraíram a doença ao longo de algumas semanas, sendo que um deles morreu.
Em janeiro de 1976, um grupo de jovens militares saudáveis contraiu uma doença respiratória desconhecida em Fort Dix, centro de treinamento do exército dos EUA em Nova Jérsei. Vários foram hospitalizados. Um recruta, que se recusou a ser hospitalizado, morreu. Comprovou-se que a causa da doença era o vírus H1N1, a cepa de influenza responsável pela pandemia de 1918. Era considerada a forma mais perigosa de gripe, mas desde 1918 estava limitada principalmente aos que trabalhavam com porcos. Pela primeira vez em 58 anos, o H1N1 estava claramente se espalhando rapidamente por meio do contato entre humanos. De 500 jovens, 13 contraíram a doença ao longo de algumas semanas, sendo que um deles morreu.
Os cientistas do Centro de Controle e Prevenção de Doenças (CDC) se sentiram como se estivessem vivendo um apocalipse de influenza. Armado com a tecnologia (vacinação) que não estava disponível em 1918 ou nas epidemias menores de gripe de 1957 e 1968, o CDC pressionou pela vacinação em massa. Em 24 de março de 1976, o presidente Gerald Ford, apoiado pelos Drs. Sabin e Salk, da famosa vacina contra a poliomielite, anunciou:
“Fui alertado que, a menos que tomemos medidas eficazes, existe uma possibilidade muito real de termos uma epidemia desta doença perigosa no próximo outono e inverno aqui nos Estados Unidos. Está bem claro neste momento que ninguém sabe exatamente a gravidade dessa ameaça. No entanto, não podemos arriscar a saúde de nossa nação. Assim, hoje estou anunciando as ações a seguir. Estou pedindo ao Congresso que destine US$ 135 milhões, antes do recesso de abril, para a produção de vacina suficiente para inocular todos os homens, mulheres e crianças nos Estados Unidos.”1
Os testes de campo para uma vacina começaram em abril. A imunização em massa começou em 1º de outubro de 1976. Onze dias depois, três pacientes idosos morreram em Pittsburgh quase imediatamente após a vacinação. O Departamento de Saúde do Condado de Allegheny suspendeu o programa de vacinação. Em Minnesota, as autoridades de saúde observaram vários casos de Guillain-Barré. Isso foi seguido por uma incidência crescente de mortes inexplicáveis e Guillain-Barré (uma complicação tanto da própria gripe quanto de outras vacinas contra a gripe).2 Quando nenhum caso de H1N1 apareceu no inverno, a relação risco-benefício percebida mudou para apenas riscos, e o programa de vacinação foi interrompido em dezembro.
Novos programas foram criados após o “fiasco da gripe suína” de 1976. Uma ironia considerável é que as pessoas que foram vacinadas em 1976 podem ter sido protegidas ao chegar à idade madura durante a pandemia de H1N1 de 2009.3 O programa de vacinação contra a gripe suína de 1976 também foi um prenúncio dos diversos desafios na comunicação dos benefícios da vacina em relação a sua segurança que vemos nos programas de vacinação atuais.
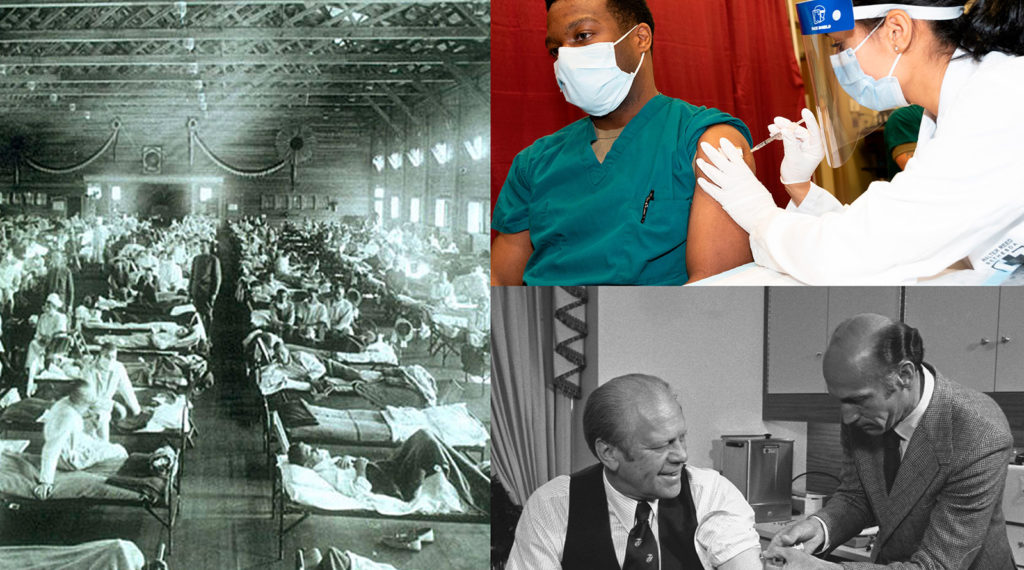
Painel esquerdo: pandemia de influenza de 1918, Museu Nacional de Saúde e Medicina, Instituto de Patologia das Forças Armadas, Washington, DC, Estados Unidos; painel superior direito: Capitão do Exército Dr. Isaiah Horton recebe vacina contra a COVID-19, Secretaria de Defesa dos EUA; painel inferior direito: o presidente dos Estados Unidos, Gerald Ford, recebendo vacina contra a gripe suína, Biblioteca Presidencial Gerald R. Ford.
Operação Warp Speed
Ao contrário do fiasco da gripe suína de 1976, quando nenhum caso subsequente de H1N1 foi visto após o surto inicial em Fort Dix, até 5 de abril de 2021 houve mais de 130 milhões de casos e 2,8 milhões de mortes em todo o mundo (figura 1) devido ao vírus SARS-CoV-2. Nos Estados Unidos, uma em cada 11 pessoas foi infectada pelo SARS-CoV-2 e um em aproximadamente cada 600 americanos morreu de COVID-19 (mais de 540.000 até março de 2021).
Projeção mundial em 5 de abril de 2021
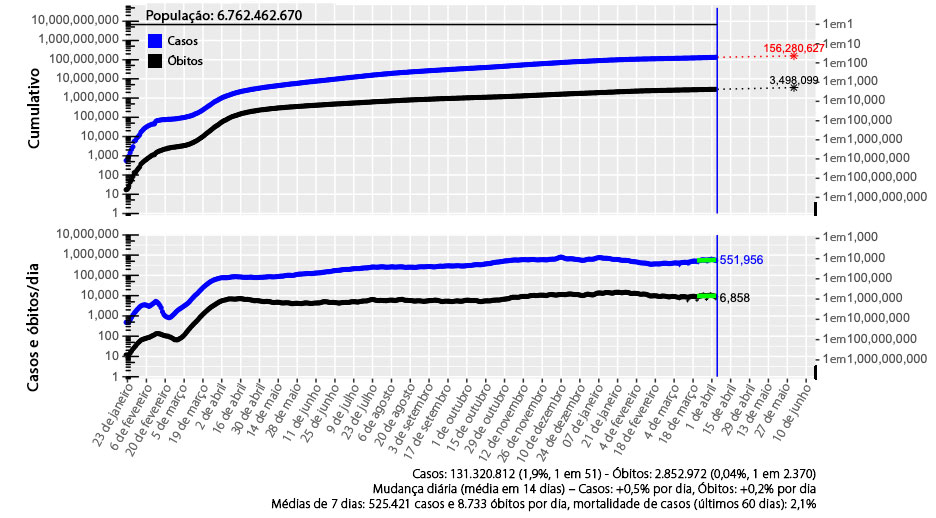
Figura 1: Projeção mundial em 5 de abril de 2021.32
Fonte: Atualização diária da COVID-19, usada com permissão do autor.
A epidemia de COVID concentrou o poder de fogo científico mundial como nunca antes. Nos Estados Unidos, a “Operação Warp Speed” foi uma parceria público-privada para fornecer apoio governamental quase ilimitado a empresas que pesquisam vacinas e outros tratamentos para a COVID-19. Programas semelhantes foram estabelecidos na Europa, Índia e China, com sucesso sem precedentes.
De acordo com a Organização Mundial da Saúde, atualmente existem 82 vacinas em desenvolvimento clínico (tabela 1).4 Destas, 13 estão atualmente aprovadas em pelo menos um país.5 Todas as vacinas demonstraram eficácia. A única preocupação séria de segurança que surgiu é a possibilidade extremamente pequena de trombose com a vacina AstraZeneca. Repetirei essa informação para destacá-la: a única preocupação séria de segurança que surgiu é a possibilidade muito baixa de trombose com a vacina AstraZeneca.
Tabela 1: Plataformas de vacinas em desenvolvimento.33
| Plataforma | Vacinas candidatas |
| Subunidade de proteína | 28 |
| Vetor viral (não replicante) | 12 |
| DNA | 10 |
| Vírus inativado | 11 |
| RNA | 11 |
| Vetor viral (replicante) | 4 |
| Partícula semelhante a vírus | 4 |
| Vírus vivo atenuado | 2 |
| Vetor viral replicante + célula apresentadora de antígeno | 2 |
| Vetor viral não replicante + célula apresentadora de antígeno | 1 |
As vacinas estimulam o sistema imunológico. Obviamente, esse é seu ponto principal! Você sabe o que vai sentir: fadiga, dor de cabeça, mialgias, letargia e sintomas generalizados semelhantes aos da gripe. Essas reações não são causadas pelo vírus per se, mas são simplesmente o que se sente quando o sistema imunológico é ativado. Como as vacinas ativam o sistema imunológico, qualquer uma delas pode fazer você se sentir mal por algumas horas a talvez um ou dois dias. Assim como é esperado sentir alguma dor no local da injeção, porque uma agulha foi enfiada em seu braço, você deve esperar sentir como se tivesse uma gripe, porque a injeção ativa seu sistema imunológico.
A questão de segurança é: que outros efeitos indesejáveis a vacina pode ter, além de fazer você se sentir como se tivesse uma infecção viral?
Segurança e eficácia das vacinas
1. A BNT162b2 é uma vacina de mRNA desenvolvida pela Pfizer e pela BioNTech. É a primeira vacina aprovada por meio de uma autorização de uso emergencial (AUE)* nos Estados Unidos. Em um estudo com 43.548 indivíduos, a vacina demonstrou uma eficácia notável de 95% e quase 100% de eficácia contra a doença grave.6 Isso é semelhante à eficácia da vacina tríplice. 7 Apenas um paciente que recebeu a vacina (dentre mais de 20.000) desenvolveu COVID-19 grave. Os eventos adversos comuns se limitaram a dor no local da injeção e sintomas semelhantes aos da gripe. A segurança e a eficácia demonstradas no estudo de fase 3 foram subsequentemente reproduzidas quando a vacina foi aplicada em grande escala em Israel.8
Pouco depois do lançamento do programa de vacinação com a BNT162b2, foram observados vários casos de anafilaxia.9 A avaliação mais recente é que o risco de anafilaxia é de aproximadamente 1 em 100.000.10 As vacinas de mRNA incorporam uma nanopartícula lipídica para facilitar a entrada do mRNA na célula. Atualmente, acredita-se que a nanopartícula lipídica seja responsável pelas raras reações alérgicas.11 O risco de anafilaxia foi mitigado através da introdução de monitoramento pós-vacinação imediato dos indivíduos por até 30 minutos, reduzindo o risco de lesão por anafilaxia para quase 0. O CDC estima que não haja mortes associadas à vacina BNT162b2.12
2. A mRNA-1273 é uma vacina de mRNA desenvolvida pela Moderna. É a segunda vacina com aprovada por AUE nos Estados Unidos. No estudo de fase 3 com 30.420 indivíduos, a vacina mRNA-1273 também demonstrou excelente eficácia de 94%. Para colocar isso em perspectiva, a FDA estabeleceu um limite de 50% de eficácia para a aprovação de vacinas.13
Os riscos da mRNA-1273 da Moderna são idênticos aos da Pfizer/BioNTech.14 Isso é esperado, pois ambas as vacinas usam as mesmas nanopartículas lipídicas para facilitar a entrada na célula.15 O risco de anafilaxia é de cerca de 1 em 200.000. Não houve mortes ou lesões graves, Mas as pessoas vacinadas com a mRNA-1273 devem esperar sentir-se levemente doentes, já que seu sistema imunológico se acelera.
3. A AD26.COV2.S não é uma vacina do tipo mRNA, mas uma vacina de vetor viral não replicante desenvolvida pela Johnson & Johnson. É a terceira vacina aprovada por AUE nos Estados Unidos. O estudo de fase 3 com 44.325 adultos encontrou uma eficácia de 72% nos Estados Unidos, 66% nos países latino-americanos e 57% na África do Sul.16 Nenhum paciente vacinado morreu de COVID-19. Os dados de segurança não foram publicados na literatura revisada por pares. No entanto, o perfil de segurança está bem descrito no documento informativo da FDA17: “A análise de segurança durante o corte de dados de 22 de janeiro de 2021 incluiu 43.783 participantes randomizados (1:1) ≥ 18 anos de idade com acompanhamento médio de 2 meses. A análise confirmou um perfil de segurança favorável, sem preocupações de segurança específicas identificadas que impediriam a emissão de uma AUE.” Não houve casos de anafilaxia no estudo, mas um indivíduo teve uma reação de hipersensibilidade dois dias após a vacinação que não foi classificada como anafilaxia.*
4. A AZD1222, também conhecida como ChAdOx1 nCoV-19, é uma vacina de vetor de adenovírus desenvolvida por uma parceria entre a Universidade de Oxford e a AstraZeneca. Ela foi aprovada em toda a Europa, Ásia e América do Sul. A AstraZeneca concluiu recentemente um estudo de fase 3 nos Estados Unidos e anunciou planos para buscar a aprovação de uma AUE nos EUA.
A AZD1222 parece ter sido amaldiçoada desde o início. No crucial estudo de fase 3, houve um erro de dosagem resultando em uma subpopulação de pacientes com uma dose mais baixa do que a pretendida. Surpreendentemente, esses pacientes tiveram uma resposta imunológica melhor, mas não está claro exatamente por que isso aconteceu. Em uma análise intermediária, a vacina foi 62% eficaz em pacientes que receberam a dose mais alta, conforme especificado no protocolo, e 90% eficaz em pacientes que receberam a dose mais baixa.18 Na análise final, a eficácia da vacina foi de 76% após uma única dose padrão.19 Nenhum paciente do grupo vacinado necessitou de hospitalização após 21 dias, e não houve mortes por COVID no grupo vacinado.
A análise de segurança identificou dois eventos adversos relativos: um caso de mielite transversa e um caso de febre inexplicada de 40 °C após a vacinação. Ambos os casos foram resolvidos. Foi relatado um caso subsequente de mielite transversa, posteriormente determinado pelo centro investigador como não relacionado.
Um artigo da África do Sul publicado no New England Journal of Medicine após a aprovação da AZD1222 mostrou que a vacina não funcionou contra a variante B.1.351 que se tornou a cepa predominante neste país.20
Em março de 2021, três pacientes da Noruega sofreram eventos trombóticos e um paciente morreu após receber a vacina AZD1222. A Noruega suspendeu o uso da vacina enquanto se aguarda a investigação. Vários eventos trombóticos adicionais foram relatados na Europa, incluindo 22 no Reino Unido.21 Um caso também foi relatado na Austrália.22 Um aspecto incomum nesses casos é sua associação a baixas contagens de plaquetas, sugerindo uma ligação mecanicista à trombocitopenia induzida por heparina.23 Em resposta, Dinamarca, Noruega, Islândia, Bulgária, Irlanda, Holanda, Alemanha, Itália, França, Espanha, Portugal, Suécia, Luxemburgo, Chipre e Letônia suspenderam o uso da vacina. Posteriormente, a Agência Europeia de Medicamentos, a Organização Mundial da Saúde,24 e a AstraZeneca25 determinaram que os casos de trombose não tinham relação com a vacina e recomendaram a continuação do uso.
Em 22 de março de 2021, a AstraZeneca anunciou os resultados do estudo de fase 3 nos Estados Unidos com 32.449 indivíduos.26 A vacina foi 79% eficaz e 100% eficaz na prevenção de doença grave. O comitê de monitoramento de dados e segurança analisou eventos trombóticos, incluindo trombose do seio venoso cerebral, e não encontrou evidências de risco aumentado. Nenhum caso de trombose do seio venoso cerebral ocorreu no ensaio clínico. No dia seguinte, o Comitê de Monitoramento de Dados e Segurança (CMDS) fez uma declaração, através do Instituto Nacional de Alergia e Doenças Infecciosas dos EUA, contestando o anúncio da AstraZeneca à imprensa. Em sua declaração, o CMDS afirma “ter expressado a preocupação de que a AstraZeneca pudesse ter incluído informações desatualizadas do ensaio clínico, que poderiam ter fornecido uma visão incompleta dos dados de eficácia”.27
Conforme mencionado, a AZD1222 parece ter sido amaldiçoada, criando polêmica primeiro com um erro de dosagem no ensaio clínico, prosseguindo com a descoberta de que doses mais baixas tiveram maior eficácia, seguida de preocupações com casos muito raros de mielite transversal, trombose e agora com questionamentos sobre a escolha seletiva de dados. Há uma excelente revisão das voltas e reviravoltas da ADZ1222 na Nature News.28 A Agência Reguladora de Medicamentos e Produtos de Saúde do Reino Unido publicou diretrizes para o diagnóstico e tratamento de trombose e citopenia após a vacinação.29
Eu tomaria a vacina AZD1222? Com certeza! A vacina foi aplicada em mais de 17 milhões de pessoas. Ocorreram cerca de 50 eventos embólicos, uma taxa de cerca de três por milhão. A mortalidade de casos para COVID-19 está atualmente em torno de 2,4%, e mais de 20% de todos os pacientes que pegam COVID-19 têm algum nível de sintomas persistentes. Um pouco de matemática básica: 17 milhões × 75% do limite de imunidade do rebanho × 2% de taxa de casos de mortalidade × 90% de eficácia na prevenção da morte = ~230.000 vidas já salvas por meio da vacinação com a AZC1222.
5. A Sputnik V é uma combinação de duas vacinas vetoriais de adenovírus, desenvolvida pelo Gamaleya Research Institute da Rússia e atualmente aprovada na Rússia e em vários países da Ásia, África, Oriente Médio e América do Sul. O estudo de fase 3 com 21.977 indivíduos encontrou uma eficácia de 92%.30 A vacina foi 100% eficaz contra doença grave e morte após 21 dias. Nenhum evento adverso sério foi relatado relacionado à vacinação.
6. A CoronaVac é uma vacina inativada do vírus SARS-CoV-2 desenvolvida pela Sinovac e atualmente aprovada na China e em vários países da Ásia e América do Sul. Os dados de grandes ensaios clínicos de fase 3, atualmente disponíveis apenas em comunicados à imprensa, sugerem que “a taxa de eficácia contra a COVID-19 foi de 51% para todos os casos, 84% para casos que requerem tratamento médico e 100% para hospitalizações, casos graves e fatais.”31
7. A BBIBP-CorV é uma vacina inativada do vírus SARS-CoV-2 desenvolvida pela Sinopharm e atualmente aprovada na China e em vários países da Ásia, América do Sul e Oriente Médio. Parece haver ainda menos dados de segurança e eficácia do que para a CoronaVac. Um artigo na Wikipedia sugere eficácia de 86% em um estudo no Bahrein, com eficácia de 100% na prevenção de doença grave. Esses dados não foram publicados.
Em resumo, as vacinas atualmente aprovadas parecem ser altamente eficazes na prevenção de infecções e quase 100% eficazes na prevenção de doença grave e morte. Existem alguns eventos excepcionalmente raros, como anafilaxia com as vacinas de mRNA e, possivelmente, casos muito raros de trombose da vacina AZD1222 da AstraZeneca. Devido a esse perfil e aos custos significativos de saúde, sociais e econômicos de uma pandemia não mitigada, a proporção entre benefício e risco é assintoticamente 1:0.
Steven Shafer, MD, é professor de Anestesiologia, Medicina Perioperatória e da Dor na Universidade de Stanford.
O autor não apresenta conflitos de interesse.
Referências
- Neustadt RE, Fineberg HV. The swine flu affair: decision-making on a slippery disease. Washington (DC): National Academies Press (US); 1978.
- Sivadon-Tardy V, Orlikowski D, Porcher R, et al. Guillain-Barré syndrome and influenza virus infection. Clin Infect Dis. 2009;48:48–56.
- Xie H, Li X, Gao J, Lin Z, et al. Revisiting the 1976 “swine flu” vaccine clinical trials: cross-reactive hemagglutinin and neuraminidase antibodies and their role in protection against the 2009 H1N1 pandemic virus in mice. Clin Infect Dis. 2011;53:1179–87.
- World Health Organization. Draft landscape and tracker of COVID-19 candidate vaccines. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. Accessed March 25, 2021.
- Regulatory Affairs Professionals Society. COVID-19 vaccine tracker. https://www.raps.org/news-and-articles/news-articles/2020/3/covid-19-vaccine-tracker. Accessed March 25, 2021.
- Polack FP, Thomas SJ, Kitchin N, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med. 2020;383:2603–2615.
- Henry O, Brzostek J, Czajka H, et al. One or two doses of live varicella virus-containing vaccines: efficacy, persistence of immune responses, and safety six years after administration in healthy children during their second year of life. Vaccine. 2018;36:381–387.
- Dagan N, Barda N, Kepten E, et al. BNT162b2 mRNA Covid-19 vaccine in a nationwide mass vaccination setting. N Engl J Med. 2021:NEJMoa2101765. doi: 10.1056/NEJMoa2101765. Epub ahead of print.
- CDC COVID-19 Response Team; Food and Drug Administration. Allergic reactions including anaphylaxis after receipt of the first dose of Pfizer-BioNTech COVID-19 vaccine – United States, December 14–23, 2020. MMWR Morb Mortal Wkly Rep. 2021;70:46–51. doi: 10.15585/mmwr.mm7002e1.
- Turner PJ, Ansotegui IJ, Campbell DE, et al. COVID-19 vaccine-associated anaphylaxis: a statement of the World Allergy Organization Anaphylaxis Committee. World Allergy Organ J. 2021;14:100517.
- Moghimi SM. Allergic reactions and anaphylaxis to LNP-based COVID-19 vaccines. Mol Ther. 2021;29:898–900.
- Gee J, Marquez P, Su J, Calvert GM, et al. First month of COVID-19 vaccine safety monitoring – United States, December 14, 2020–January 13, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:283-288.
- Development and Licensure of Vaccines to Prevent COVID-19 – Department of Health and Human Services, FDA Center for Biologics Evaluation and Research. June 2020
- CDC COVID-19 Response Team; Food and Drug Administration. Allergic reactions including anaphylaxis after receipt of the first dose of Moderna COVID-19 vaccine – United States, December 21, 2020–January 10, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:125–129.
- Cross R. Without these lipid shells, there would be no mRNA vaccines for COVID-19. Chemical & Engineering News. March 2021 (https://cen.acs.org/pharmaceuticals/drug-delivery/Without-lipid-shells-mRNA-vaccines/99/i8). Accessed March 25, 2021.
- Janssen Investigational COVID-19 Vaccine: interim analysis of Phase 3 clinical data released. National Institutes of Health News Release, January 29, 2021 (https://www.nih.gov/news-events/news-releases/janssen-investigational-covid-19-vaccine-interim-analysis-phase-3-clinical-data-released). Accessed March 25, 2021
- Janssen Ad26.COV2.S vaccine for the prevention of COVID-19. FDA Briefing Document. https://www.fda.gov/media/146217/download. Accessed March 25, 2021.
- Voysey M, Clemens SAC, Madhi SA, et al. Oxford COVID Vaccine Trial Group. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021 Jan 9;397(10269):99–111. doi: 10.1016/S0140-6736(20)32661-1. Epub 2020 Dec 8. Erratum in: Lancet. 2021 Jan 9;397(10269):98. PMID: 33306989; PMCID: PMC7723445.
- Voysey M, Clemens SAC, Madhi SA, et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials. Lancet. 2021;397:881–891.
- Madhi SA, Baillie V, Cutland CL, et al. Efficacy of the ChAdOx1 nCoV-19 Covid-19 vaccine against the B.1.351 variant. N Engl J Med. 2021. doi: 10.1056/NEJMoa2102214. Epub ahead of print.
- Medicines & Healthcare products Regulatory Agency. Research and analysis: Coronavirus vaccine – weekly summary of Yellow Card reporting. https://www.gov.uk/government/publications/coronavirus-covid-19-vaccine-adverse-reactions/coronavirus-vaccine-summary-of-yellow-card-reporting. Accessed April 5, 2021.
- Reuters. Australia to continue AstraZeneca vaccination despite blood clotting case. https://www.reuters.com/article/us-health-coronavirus-australia/australia-to-continue-astrazeneca-vaccination-despite-blood-clotting-case-idUSKBN2BQ06B. Accessed April 5, 2021.
- Greinacher A, Thiele T, Warkentin TE, et al. A prothrombotic thrombocytopenic disorder resembling heparin-induced thrombocytopenia following Coronavirus-19 vaccination. Research Square Preprint Server. DOI: 10.21203/rs.3.rs-362354/v1.
- World Health Organization. Statement of the WHO Global Advisory Committee on Vaccine Safety (GACVS) COVID-19 subcommittee on safety signals related to the AstraZeneca COVID-19 vaccine. https://www.who.int/news/item/19-03-2021-statement-of-the-who-global-advisory-committee-on-vaccine-safety-(gacvs)-covid-19-subcommittee-on-safety-signals-related-to-the-astrazeneca-covid-19-vaccine.Accessed March 25, 2021.
- AstraZeneca. Update on the safety of COVID-19 Vaccine AstraZeneca. March 14, 2021. https://www.astrazeneca.com/media-centre/press-releases/2021/update-on-the-safety-of-covid-19-vaccine-astrazeneca.html. Accessed March 25, 2021.
- AstraZeneca. AZD1222 US Phase III trial met primary efficacy endpoint in preventing COVID-19 at interim analysis. March 22, 2021. https://www.astrazeneca.com/media-centre/press-releases/2021/astrazeneca-us-vaccine-trial-met-primary-endpoint.html. Accessed March 25, 2021.
- National Institues of Health. NIAID statement on AstraZeneca vaccine. https://www.nih.gov/news-events/news-releases/niaid-statement-astrazeneca-vaccine. Accessed March 25, 2021.
- Mallapaty S, Callaway E. What scientists do and don’t know about the Oxford-AstraZeneca COVID vaccine. March 24, 2021. https://www.nature.com/articles/d41586-021-00785-7. Accessed March 25, 2021.
- Guidance produced from the Expert Haematology Panel (EHP) focussed on syndrome of thrombosis and thrombocytopenia occurring after coronavirus vaccination. https://b-s-h.org.uk/media/19498/guidance-version-07-on-mngmt-of-thrombosis-with-thrombocytopenia-occurring-after-c-19-vaccine_20210330_.pdf. Accessed April 6, 2021.
- Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021;397:671–681.
- Mallapaty, S. China COVID vaccine reports mixed results — what does that mean for the pandemic? Nature. January 15, 2021. https://www.nature.com/articles/d41586-021-00094-z. Accessed March 25, 2021.
- Source: Steve’s Daily COVID-19 update, distributed by the author daily except Sunday. The update is freely available. To be added to the distribution list just send me an e-mail ([email protected]). Case and death data are from the repository maintained by Johns Hopkins.
- World Health Organization. Draft landscape and tracker of COVID-19 candidate vaccines. April 6, 2021. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. Accessed April 6, 2021.
*Desde que este artigo foi enviado para publicação, houve indicações de que a vacina Johnson & Johnson pode estar associada à síndrome de trombose e plaquetas baixas (consulte https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/JJUpdate.html). A incidência parece ser de aproximadamente um caso por milhão de doses da vacina. O CDC recomendou pausar a administração enquanto a associação era estudada e os fatores de risco identificados. Em 23 de abril de 2021, o CDC e a FDA suspenderam a pausa para a administração da vacina Johnson & Johnson, citando que os benefícios potenciais superam os riscos.


 Issue PDF
Issue PDF