IOH가 좋지 않은 수술 후 결과와 상관관계가 있다는 점을 뒷받침하는 증거가 점점 쌓이고 있습니다. 특히 급성신부전(Acute Kidney Injury, AKI), 비심장수술 후 심근 손상, 사망과의 관련성이 부각됩니다. 최근 연구에서는 IOH와 섬망, 뇌졸중, 재입원 사이 연관관계도 밝혀졌습니다. IOH 관련 합병증은 환자와 의료 서비스 시스템에 지대한 영향을 미칩니다. IOH는 조정 가능한 위험이며, 이에 대한 접근방식은 우리가 계속 용납할 수 없는 유의한 진료 편차와 관련이 있습니다.
마취 전문가가 환자에게 흔히 받는 요청 사항은 “잘 부탁드립니다”라는 말입니다. “예, 그러겠습니다”라고 자신있게 답하겠지만, 많은 마취 전문가들이 수술 중 저혈압(IOH)과 환자 이환율 및 사망률에 관한 데이터가 점점 늘어나고 있다는 사실을 알지 못할 수 있습니다. IOH가 좋지 않은 수술 후 결과와 상관관계가 있다는 점을 뒷받침하는 증거가 점점 쌓이고 있습니다. 특히 급성신부전(Acute Kidney Injury, AKI), 비심장수술 후 심근 손상, 사망과의 관련성이 부각됩니다.1~9 최근 연구에서는 IOH와 섬망, 뇌졸중, 재입원 사이 연관관계도 밝혀졌습니다.1,4,9~11 IOH 관련 합병증은 환자와 의료 서비스 시스템에 지대한 영향을 미칩니다. 급성 신부전 자체만으로 뇌졸중, 심근 손상, 만성 신장 질환과 같은 추가적인 합병증 발병이나 병원 내 및 1년 내 사망률 양쪽 모두와도 관계가 있고, 입원 기간 증가, 의료 서비스 자원 활용, 의료 서비스 비용과도 연관성이 있습니다.4,12,13 마취 전문가는 특히 수술 후 결과 데이터를 받아보지 않는 경우, 이처럼 놀라운 결과를 전혀 모를 수도 있습니다. 증거 자료에 따르면 우리는 환자 피해를 막기 위해 반드시 IOH를 줄여야만 합니다.
수술 중 저혈압은 혈압(Blood Pressure, BP)이 “안전 임계값” 미만으로 떨어져 장기 관류 저하를 유발하는 현상으로 정의됩니다.1~9 IOH 발생은 어느 정의를 사용하느냐에 좌우되며, 여기에는 혈압 감소 정도와 감소 기간이 둘 다 연관될 수 있습니다. 한 연구에서 IOH와 AKI 및 심근 손상 사이 관계를 평가했습니다.2 여기에서는 기준치(예: 수술 전 BP 대비 20% 미만)로부터의 상대적 감소 및 절대적 임계값을 둘 다 사용하여 IOH를 정의해 평가를 실시했습니다. 연구 결과, 절대적 임계값과 상대적 임계값 둘 다 심근 손상이나 심부전이 발생한 환자와 없는 환자를 구분하는 데 비등한 역할을 할 수 있는 것으로 드러났으며, 따라서 절대적 임계값을 사용할 수 있다는 결론을 내렸습니다. 평균 동맥압(Mean Arterial Pressures, MAP)이 65mm Hg 미만으로 1분 지속되는 경우 AKI 및 심근 손상 위험이 커지는 것으로 나타났습니다.2 IOH 지속 기간이 길수록 AKI와 심근 손상이 발생할 위험도 커집니다.2 이 사실을 알게 되면서 IOH를 MAP가 65mm Hg 미만으로 1분 이상 지속되는 상태로 정의하게 되었습니다.2
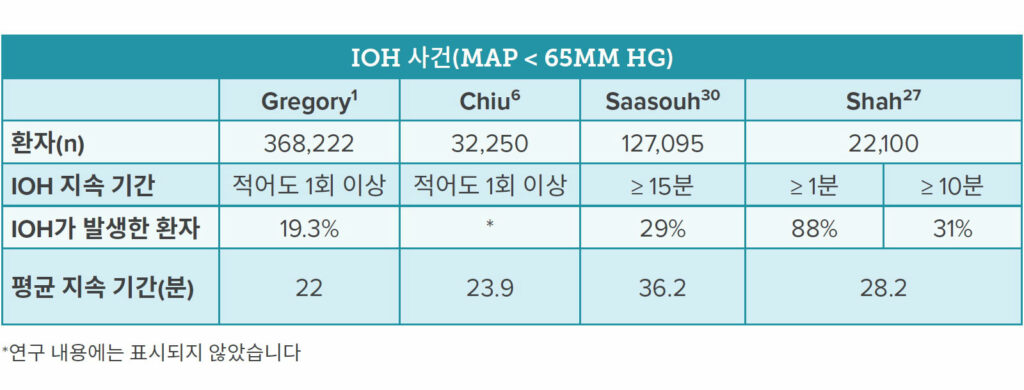
2017년부터 2022년 후반까지 시중에서 구할 수 있는 IOH 관련 발행물을 검토하고, 최근의 관련 연구와 취합한 결과 IOH의 가장 보편적인 정의는 65 mm Hg미만의 MAP1,4,6,10,14~18 또는 최소 1분간 65mm Hg 미만의 MAP로 나타났습니다.8,10,19~26 이러한 절대적 MAP 임계값을 사용하면, IOH는 놀랄 정도로 흔합니다. 최근 환자 22,000여 명을 대상으로 실시한 다기관 후향적 관찰연구에 따르면, 비심장 수술 환자 중 88%는 적어도 한 번 이상 IOH를 경험한 적이 있다고 합니다(평균 지속 기간 28.2분)(표 1 참조).27 이 연구의 연구진은 연구 대상 기관 11곳의 IOH 관리에 상당한 실무적 편차(practice variation)가 있다고 지적하여, 의료 서비스 제공자마다 IOH 허용치가 다르다는 사실을 암시했습니다.27
표 1. 4가지 연구에서 다룬 IOH 사건 비교
미국 의료보험 및 의료급여 서비스 센터(CMS)에서는 15분 이상 MAP < 65mmHg로 정의되는 새로운 IOH 측정 기준을 성과 기반 인센티브 지불 시스템(Merit-Based Incentive Payment System, MIPS)의 기준으로 인정합니다.28 전체 IOH 측정 점수가 낮으면 정의된 MAP 미만으로 감소한 시간이 짧다는 뜻입니다.28 MIPS 점수는 문제의 수준 (quality), 해결하고자 하는 중재 정도, 상호 운용성 추구 및 비용에 따른 성과 측정치 기반입니다. ePreop31 측정치는 MIPS 점수 중 수준 부분에 대해 제출할 수 있는 6가지 마취 측정치 중 하나입니다.28,29 최종 MIPS 점수에 따라 Medicare Part B 보험 클레임에 적용되는 지급금 조정분이 달라집니다.29 CMS MIPS에 따른 IOH 정의를 이용해 실시한 최근 연구 결과, 마취과 계열에서 IOH 발생률은 비심장 수술에서 29%에 달하는 것으로 나타났습니다.30 이 연구에서는 임상의마다 IOH 발생 건수가 각기 다른 것으로 나타나, IOH 관리 서비스 변이를 줄여야 한다는 주장을 뒷받침하는 방대한 증거에 힘을 실었습니다.14,30,31 이 연구의 연구진은 IOH를 조절할 수 있는 위험 요소로 보고, IOH 허용치를 줄이기 위한 품질 개선 이니셔티브를 추진해야 한다고 주장했습니다.30
IOH 정의와 무관한 공통된 주제는 저혈압 정도가 심하고 누적 저혈압 지속 기간이 길수록 환자의 이환률 및 사망률 증가와 관련성이 높다는 사실입니다. 많은 연구에서 MAP가 장기간 65mm Hg 미만으로 유지되거나, 한번이라도 MAP가 55mm Hg 이하로 유지되는 경우, 예후가 좋지 않을 위험이 큰 것으로 밝혀졌습니다.1~3,9,16,17,32 따라서 우리는 간단히 말해 반드시 IOH의 발생 건수, 심각도, 지속 기간을 최소한으로 줄여야 합니다.
IOH는 상완 커프를 사용하는 기존의 간헐적 진동 방식 혈압(intermittent oscillometric BP, IOBP) 모니터링으로는 줄이기 어려울 수 있습니다. IOBP 모니터링 방식에 따르는 우려 사항으로는 혈압 변동이나 저혈압 에피소드 감지가 늦어지거나 놓칠 가능성, 혈역학적으로 극단적인 경우 정확도가 떨어지고, 저혈압 발생 시 BP를 과대평가하여 생각보다 더 심각한 에피소드가 발생할 가능성 등이 있습니다.19,33 IOBP 모니터링 이용 시 저혈압 이벤트를 놓칠 가능성은 선택한 측정 빈도나 생명 징후 모니터의 기본 설정에 따라 달라질 수 있습니다.. 최근 한 연구에서는 IOBP 측정을 위해 선택하는 가장 보편적인 빈도는 2~5분 간격인 것으로 드러났습니다.25 빈도를 이렇게 설정하면 측정 간 탐지되지 않은 저혈압 기간(분)이 발생할 수 있고, 이 때문에 환자가 피해를 볼 위험이 커집니다. 또한 이 문제는 지속적인 모니터링으로 최소화할 수도 있었을 사안입니다.15,19,25
새로운 연구 다수에 따르면 지속적 BP 모니터링을 이용하는 것이 IOBP 대비 여러 가지 장점이 있습니다. 예를 들어 BP 가변성이 덜하고,16 혈역학적 안정성이 개선되며,33 IOBP로는 놓치는 저혈압 에피소드를 감지할 수 있고,19 IOH를 조기 인식하여 치료할 수 있으며,15,25 전반적으로 IOH를 줄이는 데 도움이 됩니다.15,19,25,33 지속적 BP 모니터링은 동맥 주사 BP 모니터링을 통해 침해적인 방식으로 실시할 수 있지만, 이 경우 감염, 신경 손상, 혈전, 거짓 동맥류가 발생할 위험이 있습니다.25 손가락 커프를 사용한 지속적, 비침습적 BP 모니터링을 사용하면 침습적 동맥 주사와 연관된 위험은 방지하면서 그와 비등한 MAP 값을 얻을 수 있습니다.25,33 이 기술의 한계로는 간헐적 진동 방식보다 비용이 많이 든다는 점, 그리고 고령 환자나 동맥 경화증 환자의 경우 정확도가 떨어질 가능성이 있다는 점이 있습니다.25,34,35 최근 연구에 설명된 비침해적 손가락 커프의 경우, 손가락 동맥에 다양한 커프 압력을 적용하는 볼륨 클램프 기술을 사용하여 일정한 볼륨을 유지합니다.25,33 손가락 동맥의 BP를 동맥 파형으로 재구성하여 맥파 분석을 실시할 수 있으며, 이를 통해 IOH의 원인을 판단하는 데 유용한 고급 혈역학 변수(예: 1회 박출량, 심박출량, 1회 박출량 변이 등)를 얻을 수 있습니다.25 비침해적 손가락 커프는 외과 수술 중에 동맥혈 샘플이 필요하지 않은 경우 지속적인 BP 모니터링에 적절한 옵션일 수 있습니다.33
임상의의 IOH 발생률, 심각도, 지속 기간 최소화 의무
수액 관리나 승압제 관리가 부적절하면 장기 관류 저하를 유발하여 장기 손상을 초래할 수 있습니다. 따라서 이러한 문제를 방지하기 위한 전략이 매우 중요합니다.1,3,6,7,12,32 어떤 논문에서는 IOH와 무관한, 승압제 사용량이 많은 경우 수술 후 AKI 발생과의 관련성을 설명했습니다.12 또 다른 한 연구에서는 ERAS 프로토콜과 함께 수액 제한을 시행한 것이 수술 후 저혈압 발생 건수가 대폭 증가한 것과 밀접한 관련이 있는 것 같다는 결론을 제시했습니다.31 이 연구에서는 수술 후 저혈압이 발생한 환자가 IOH도 경험한 경우가 많고, 수술 중 투입한 수액 전체 양도 적은 것으로 나타났습니다. 최근 다기관 수술 전후 결과 그룹(Multicenter Perioperative Outcomes Group, MPOG) 기관에서 32,000명 이상의 복부 수술 환자를 대상으로 실시한 5년간의 다기관 후향적 연구에서 전반적인 IOH 감소에도 불구하고 AKI 비율이 증가하는 것이 관찰되었습니다.6 또한 수술 중 수액 투입이 줄고 승압제 사용량이 늘어났는데, 이는 둘 다 AKI 발생 건수가 증가한 것과 연관성이 있습니다. 결정질 용액(crystalloid) 투약량을 시간당 킬로그램당 1mL에서 10mL로 늘리자(mL/kg/hr) AKI 위험성이 58% 감소했습니다. 이와 같은 가슴 아픈 조사 결과는 수액 투여를 최소한으로 제한하면서 BP를 유지하기 위해 승압제에 의존하면 이미 손상된 비장 및 신장 관류를 더욱 저해하고, 장폐색이나 수술 후 메스꺼움과 구토, 수술 부위 감염 및 AKI와 같은 의인성 피해를 초래할 가능성이 있다는 생리학적 개념을 뒷받침합니다.6,7,12,36
IOH의 원인은 다원적이며 심근 수축력 감소, 혈관 확장, 저혈량증, 느린맥, 심실 외부 압박(예: 심낭 삼출 또는 기흉 등)이나 여러가지 혈역학적 변화로 설명될 수 있는 “혼합 유형”이 대표적입니다.8,18 고급 혈역학적 변수(예: 1회 박출량, 심박출량, 1회 박출량 변이 등)를 제공하는 모니터를 사용하면 저혈압을 방지, 진단, 치료하는 데 유용할 가능성이 있습니다.8 그러면 단순히 생리적 모니터에 표시되는 MAP 수치를 개선하는 것이 아니라 목표 지향적 치료(Goal-directed therapy, GDT) 전략을 사용하여 IOH의 근본 원인을 겨냥한 개입을 할 수 있습니다.
GDT라는 용어는 고급 혈역학적 모니터를 사용해 가장 적절한 시기에 수액, 강심제 및 혈관수축제를 사용하는 최적의 투약 방법을 나타내는 포괄적인 용어로 개념화할 수 있습니다. GDT 전략 틀 안에서 구사하는 수술 중 개입 기법은 조직 산소 전달을 최적화하고 장기 관류 저하를 예방하기 위한 특정 종착점이나 목표를 지향합니다(그림 1 참조).5,17 혈역학적 모니터링은 이러한 개입 치료에 대한 환자의 반응성을 평가하는 데 사용됩니다. 목표 지향적 수액 치료(Goal-directed fluid therapy, GDFT)는 최신 GDT 개념 중 최초이자 가장 보편적인 버전입니다. 고급 혈역학 모니터는 전부하 의존도(preload dependence)를 파악하는 데 사용되어, 프랑크-스탈링 곡선에서 환자의 위치를 최적화하기 위한 수액 볼루스 치료법을 결정하는 데 보조 자료로 쓰이며, 이후 수액에 대한 반응성을 평가하는 데도 사용됩니다.7,17 수액 관리에 관한 2020년 수술 전후 품질 이니셔티브(Perioperative Quality Initiative, POQI) 치료 지침에서는 수액 요법의 지침으로 삼을 가장 안전하고 효과적인 방법은 수액 반응성 평가라는 사실을 확인했습니다.7 또한 수액으로 SV를 최적화하면 위장관류가 개선되고 합병증 발생이 줄어드는 것으로 확인되어, 적절한 순환 볼륨과 소화관 혈류의 중요성이 강조되었습니다.36 목표 지향적 혈역학적 치료(Goal-directed hemodynamic therapy, GDHT)는 GDT의 또 다른 구성 요소로, 프로토콜에 IOH가 발생하지 않도록 방지하기 위해 MAP 유지 관리를 포함하여 원래 GDFT 전략을 개선하는 기법입니다.17 GDT 전략에 혈역학적 최적화를 포함하면 사망률 대폭 감소와 밀접한 관련이 있습니다.5,11,32 그림 1에 최신 GDT 개념을 설명하였습니다. 우선 GDFT 버전이 생기고, 이후 혈류에 대한 포괄적인 전망을 포함한 GDHT를 포함한 구성 요소를 아우르는 개념입니다.
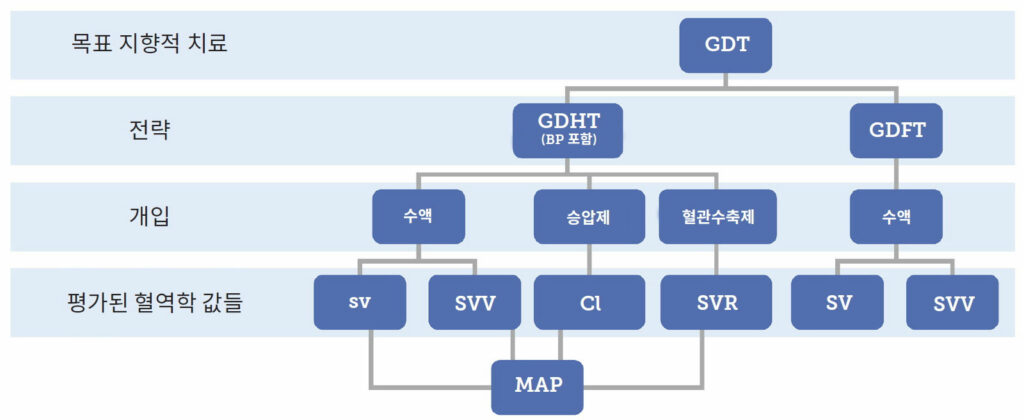
그림 1. GDT 전략의 구성 요소를 나타낸 그림. GDHT와 GDFT 전략을 개념적으로 병합하고, 구체적인 표적화 개입 요법의 지침으로 삼을 혈역학적 수치도 함께 적용.
GDT: 목표 지향적 치료(Goal-directed therapy), GDT: 목표 지향적 혈역학적 치료(Goal-directed hemodynamic therapy), GDHT: 목표 지향적 수액 치료(Goal-directed fluid therapy), GDFT: 1회 박출량(Stroke volume),
SV: 1회 박출량 변이(Stroke volume variation), SVV: 심장 박출 지수(Cardiac index), CI: 전신 혈관 저항(Systemic vascular resistance), SVR: 평균 동맥압(Mean arterial pressure), MAP
IOH의 원인별로 적절한 치료법을 결정하고 혈역학을 최적화하기 위해 고급 혈역학 모니터링과 GDT 프로토콜을 활용한 여러 연구에서 수술 후 합병증이 대폭 감소한 것으로 나타났습니다.5,11,24,32 한 연구에서는 GDHT 프로토콜을 사용한 결과 랜드마크 FEDORA 임상실험에서 위험성이 낮거나 중간인 환자의 합병증 및 입원 기간(Length Of Stay, LOS) 감소 효과가 있는 것으로 드러났습니다.5 중대한 외과 수술을 앞둔 고위험 환자를 대상군으로 포함한 또 다른 연구에서도 GDHT 프로토콜을 사용했습니다. 이 임상실험 결과 수술 후 장기 기능 장애 위험이 감소한 것으로 나타났습니다.32 후자로 언급된 이 연구의 한 가지 강점은 1회 박출량을 최적화하기 위한 수액 투약의 지침으로 프로토콜화한 혈역학 알고리즘을 사용했다는 것입니다. 이는 혈관 내 볼륨과 장기 혈류압을 유지하고, 관류 저하를 예방하는 효과가 있었습니다. 척추 수술을 받게 된 고령 환자를 대상으로 한 어느 연구에서는 GDT 프로토콜을 적용하자 대조군 대비 GDT 집단에서 IOH가 감소하고 수술 후 메스꺼움과 구토, 섬망 증세가 적게 발생한 것으로 나타났습니다.11 또한 GDT 프로토콜을 이용한 다른 여러 연구에서도 IOH가 감소한 것으로 보고되어, IOH 원인 표적화를 목표로 치료 지침으로서 이 프로토콜을 이용하는 것이 좋다는 근거가 마련되었습니다.21,23,24 GDT는 위험도가 낮음, 중간, 높음인 환자를 포함해 광범위한 환자에게 유익한 것으로 입증되었습니다.
IOH는 심각한 공중 보건 사안
IOH와 부정적 예후와의 관련성에 관한 2021년 논문에서, IOH는 “심각한 공중 보건 사안”이라고 설명되었으며, 어떠한 연령대에도, 어느 시점에도 절대 용납할 수 없다고 명시되었습니다.1 이 논문의 연구진은 IOH에 노출될 위험이 있는 인구집단의 규모가 워낙 크기 때문에, IOH 예방에 중점을 둔 향후 연구가 시급하다고 촉구했습니다. 기존 혈역학적 관리의 경우 IOH가 발생한 뒤에 이에 대응 치료를 적용하는 데 의존하는데, 이는 이미 장기 손상을 유발한 뒤이기 때문에 너무 늦습니다.20 2021년에 발간된 APSF 뉴스레터 기고문에서 Sessler는 인공 지능과 머신러닝에 기반한 첨단 기술로 IOH를 예측하면 유익할 것이라는 전망을 넌지시 언급했습니다.37 이후 무수히 많은 연구가 출간되어 IOH를 정확하게 예측하고 줄이는 데 신기술을 이용하는 것이 효용이 있다는 사실을 입증해 왔습니다.8,20~23,26 그와 같이 IOH가 발생할 임박한 가능성 유무와 그 근본 원인을 예측하는 데 이용할 수 있는 기술 중에 일명 저혈압 예측 지수(Hypotension Prediction Index, HPI)라는 변수를 활용하는 것이 있습니다. HPI를 이용하면 0~100의 척도로 단위 없는 수치가 제공되어 저혈압 이벤트가 발생할 확률을 얻을 수 있습니다.38 임박한 IOH의 근본 원인과 관련해 모니터에서 제공받은 정보를 활용하면 임상의가 표적화 치료법을 적용해 적절하게 개입할 수 있고, 따라서 IOH를 예방할 수 있습니다. IOH 감소를 위한 HPI의 기능을 평가하기 위해 실시한 무작위 배정 임상시험을 전체적으로 검토한 결과, 연구진은 HPI가 비심장 수술 중 IOH의 발생률, 지속 기간, 심각도를 낮출 잠재력이 있다고 명시했으나 이 기술을 이용할 때는 관리 방법을 프로토콜화하여 준수하는 것이 중요하다고 강조했습니다.22 이 조사 결과로 IOH 발생률을 낮추는 데 진료 편차를 줄이는 것이 중요한 역할을 한다는 사실을 뒷받침합니다.
마취 전문가는 환자를 위해 우수한 마취 치료를 제공하려고 노력하지만, 그들의 혈역학적 관리가 얼마나 치명적인 결과를 불러올 수 있는지는 인지하지 못할 수도 있습니다. Gregory와 동료 의료진이 강력하게 표명한 것과 같이, IOH는 “공공 안전과 관련된 사안”이며, 반드시 최소화해야 합니다.1 이 목표를 이루려면 단계별로 접근하는 것이 좋을 수 있습니다. 그림 2에 이 글의 필진이 제안하는 다음 단계를 목록으로 기재했습니다. 특히 최근에 발간된 권장 치료 지침과 APSF 모범 사례도 포함했으니 참조 바랍니다.39
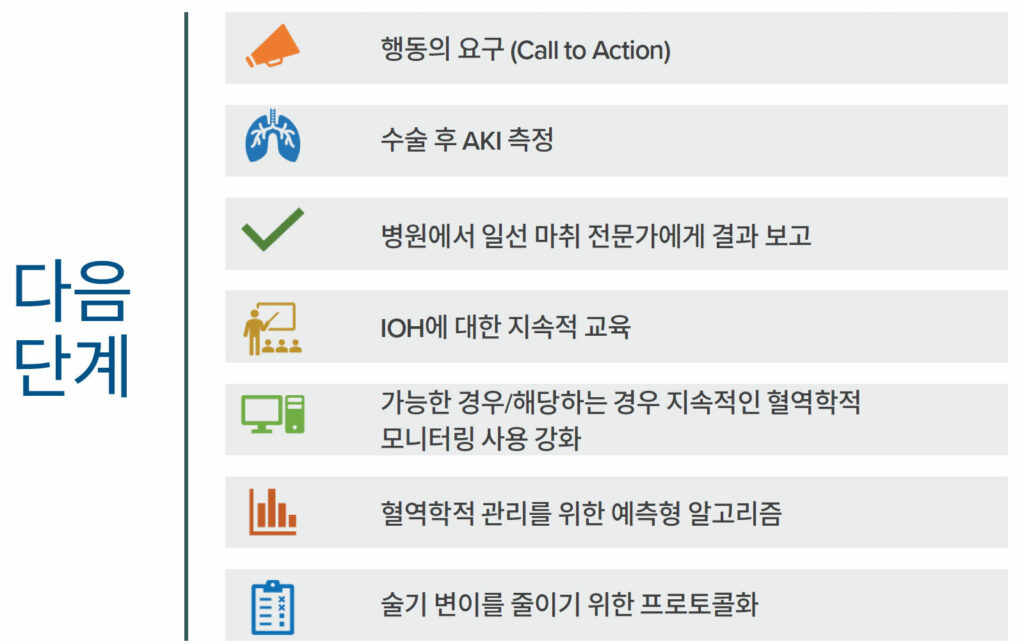
그림 2. 마취 전문가를 위한 다음 단계 제안. 그림에는 최근 출간된 권장 치료 지침 및 APSF 모범 사례도 포함하여 IOH 및 그와 관련된 환자 피해를 최소화한다는 목표의 실현을 돕고자 함.39
AKI: 급성 신부전(acute kidney injury) ,IOH: 수술 중 저혈압(Intraoperative Hypotension)
우리는 IOH가 보편적인 문제점임을 인정하고 교육을 통해, 그리고 AKI나 비심장 수술 후 심근 손상과 같은 수술 후 결과를 모니터링하고 추적함으로써 동료들 사이 인식을 제고해야 합니다. 환자의 IOH를 미처 감지하지 못하는 불상사를 막기 위해 고급 혈역학적 측정 기술을 활용해 지속적으로 모니터링해야 합니다. 승압제를 사용해 모니터에 표시된 수치대로 치료하기보다는 문제를 해결하기 위해 순환을 조절하여(예: GDT 프로토콜) 혈역학적으로 적절히 관리해야 합니다. IOH는 경감할 수 있는 위험 요소이며, 단적으로 말해 더 이상 용인해서는 안 됩니다.
Amy Yerdon은(DNP, MNA, CRNA, CNE, CHSE) 앨라배마주 버밍햄 앨라배마대학교 버밍햄 간호대학교 조교수 겸 마취 전문 간호사 프로그램(Nurse Anesthesia Program) 프로그램 디렉터 보조입니다.
Matthew Sherrer은(MD, MBA, FASA, FAACD) 앨라매바주 버밍햄 앨라배마대학교 마취 및 수술 전후 의학과 부교수입니다.
Desiree Chappell은(MSNA, CRNA, FAANA) 켄터키주 루이빌 NorthStar Anesthesia의 임상 품질부서 부사장(VP)입니다.
Amy Yerdon은(DNP, MNA, CRNA) Edwards Lifescience의 발언권자 위원회(Speakers’ Bureau) 위원입니다. D. Matthew Sherrer에게는(MD, MBA, FASA, FAACD) 이해 상충이 없습니다. Desiree Chappell은(MSNA, CRNA, FAANA).TopMedTalk의 편집장 겸 간판 앵커이며, Edwards Lifesciences and Medtronic의 발언권자 위원회(Speakers’ Bureau) 위원, Provation 자문위원회 위원입니다.
참고 문헌
- Gregory A, Stapelfeldt W, Khanna A, et al. Intraoperative hypotension is associated with adverse clinical outcomes after noncardiac surgery. Anesth Analg. 2021 ;132:1654–1665. PMID: 33177322.
- Salmasi V, Maheshwari K, Yang D, et al. Relationship between intraoperative hypotension, defined by either reduction from baseline or absolute thresholds, and acute kidney and myocardial injury after noncardiac surgery: a retrospective cohort analysis. Anesthesiology. 2017;126:47–65. PMID: 27792044.
- Wesselink E, Kappen T, Torn H, et al. Intraoperative hypotension and the risk of postoperative adverse outcomes: a systematic review. Br J Anaesth. 2018;121:706–721. PMID: 30236233.
- Stapelfeldt WH, Khanna AK, Shaw AD, et al. Association of perioperative hypotension with subsequent greater healthcare resource utilization. J Clin Anesth. 2021;75. PMID: 34536719.
- Calvo-Vecino JM, Ripollés-Melchor J, Mythen MG, et al. Effect of goal-directed haemodynamic therapy on postoperative complications in low–moderate risk surgical patients: a multicentre randomized controlled trial (FEDORA trial). Br J Anaesth. 2018;120:734–744.
- Chiu C, Fong N, Lazzaresch, D, et al. Fluids, vasopressors, and acute kidney injury after major abdominal surgery between 2015 and 2019: A multicentre retrospective analysis. Br J Anaesth. 2022;12:317–326. PMID: 29576114.
- Martin GS, Kaufman DA, Marik PE, et al. Perioperative Quality Initiative (POQI) consensus statement on fundamental concepts in perioperative fluid management: fluid responsiveness and venous capacitance. Perioper Med (Lond). 2020;9:1–12. PMID: 32337020.
- Ranucci M, Barile L, Ambrogi F, Pistuddi V. Surgical and Clinical Outcome Research (SCORE) Group. Discrimination and calibration properties of the hypotension probability indicator during cardiac and vascular surgery. Minerva Anestesiol. 2019;85:724–730. PMID: 30481996.
- Putowski Z, Czajka S, Krzych ŁJ. Association between intraoperative BP drop and clinically significant hypoperfusion in abdominal surgery: a cohort study. J Clin Med. 2021;10(21):5010. PMID: 34768530.
- Maheshwari K, Ahuja S, Khanna AK, et al. Association between perioperative hypotension and delirium in postoperative critically ill patients: a retrospective cohort analysis. Anesth Analg. 2020;130:636–643. PMID: 31725024.
- Zhang N, Liang M, Zhang D, et al. Effect of goal-directed fluid therapy on early cognitive function in elderly patients with spinal stenosis: a case-control study. Int J Surg. 2018;54:201–205. PMID: 29678619.
- Ariyarathna D, Bhonsle A, Nim J, et al. Intraoperative vasopressor use and early postoperative acute kidney injury in elderly patients undergoing elective noncardiac surgery. Ren Fail. 2022;44:648–659. PMID: 35403562.
- French WB, Shah PR, Fatani YI, et al. Mortality and costs associated with acute kidney injury following major elective, non-cardiac surgery. J Clin Anesth. 2022;82:110933. PMID: 35933842.
- Christensen AL, Jacobs E, Maheshwari K, et al. Development and evaluation of a risk-adjusted measure of intraoperative hypotension in patients having nonemergent, noncardiac surgery. Anesth Analg. 2021;133:445–454. PMID: 33264120.
- Maheshwari K, Khanna S, Bajracharya GR, et al. A randomized trial of continuous noninvasive BP monitoring during noncardiac surgery. Anesth Analg. 2018;127:424–431. PMID: 29916861.
- Park S, Lee HC, Jung CW, et al. Intraoperative arterial pressure variability and postoperative acute kidney injury. Clin J Am Soc Nephrol. 2020;15:35–46. PMID: 31888922.
- French WB, Scott M. Fluid and hemodynamics. Anesthesiol Clin. 2022;40:59–71. PMID: 35236583.
- Kouz K, Brockmann L, Timmermann LM, et al. Endotypes of intraoperative hypotension during major abdominal surgery: a retrospective machine learning analysis of an observational cohort study. Br J Anaesth. 2023;130:253–261. PMID: 36526483.
- Kouz K, Weidemann F, Naebian A, et al. Continuous finger-cuff versus intermittent oscillometric arterial pressure monitoring and hypotension during induction of anesthesia and noncardiac surgery: the DETECT Randomized Trial. Anesthesiology. 2023;139:298–308. PMID: 37265355.
- Frassanito L, Giuri PP, Vassalli F, et al. Hypotension Prediction Index with non-invasive continuous arterial pressure waveforms (ClearSight): clinical performance in gynaecologic oncologic surgery. J Clin Monit Comput. 2022;36:1325–1332. PMID: 34618291.
- Grundmann CD, Wischermann JM, Fassbender P, et al. Hemodynamic monitoring with Hypotension Prediction Index versus arterial waveform analysis alone and incidence of perioperative hypotension. Acta Anaesthesiol Scand. 2021;65:1404–1412. PMID: 34322869.
- Li W, Hu Z, Yuan Y, Liu J, Li K. Effect of hypotension prediction index in the prevention of intraoperative hypotension during noncardiac surgery: a systematic review. J Clin Anesth. 2022;83:110981. PMID: 36242978.
- Schneck E, Schulte D, Habig L, et al. Hypotension Prediction Index based protocolized haemodynamic management reduces the incidence and duration of intraoperative hypotension in primary total hip arthroplasty: a single centre feasibility randomised blinded prospective interventional trial. J Clin Monit Comput. 2020;34:1149–1158. PMID: 31784852.
- Wijnberge M, Geerts BF, Hol L, et al. Effect of a machine learning-derived early warning system for intraoperative hypotension vs standard care on depth and duration of intraoperative hypotension during elective noncardiac surgery: the HYPE randomized clinical trial. JAMA. 2020;323:1052–1060. PMID: 32065827.
- Wijnberge M, van der Ster B, Vlaar APJ, et al. The effect of intermittent versus continuous non-invasive BP monitoring on the detection of intraoperative hypotension, a sub-study. J Clin Med. 2022;11:4083. PMID: 35887844.
- Kouz K, Monge García MI, Cercutti E, et al. Intraoperative hypotension when using hypotension prediction index software during major noncardiac surgery: a European multicentre prospective observational registry (EU HYPROTECT). BJA Open. 2023;6:100140. PMID: 37588176.
- Shah N, Mentz G, Kheterpal S. The incidence of intraoperative hypotension in moderate to high risk patients undergoing non-cardiac surgery: a retrospective multicenter observational analysis. J Clin Anesth. 2020;66:1–12. PMID: 32663738.
- Provation. ePreop 31: Intraoperative hypotension (IOH) among non-emergent noncardiac surgical cases. 2020. https://www.provationmedical.com/wp-content/uploads/2022/08/ePreop-Provation_IOH_Specifications.pdf . Accessed March 2024.
- U.S. Centers for Medicare & Medicaid Services (CMS). Traditional MIPS overview. CMS Quality Payment Program. https://qpp.cms.gov/mips/traditional-mips. Accessed January 3, 3024.
- Saasouh W, Christensen AL, Xing F, et al. Incidence of intraoperative hypotension during non-cardiac surgery in community anesthesia practice: a retrospective observational analysis. Perioper Med (Lond). 2023;12:29. Published 2023 Jun 24. PMID: 37355641.
- Anolik RA, Sharif-Askary B, Hompe E, et al. Occurrence of symptomatic hypotension in patients undergoing breast free flaps: is enhanced recovery after surgery to blame? Plast Reconstr Surg. 2020;145:606–616. PMID: 32097291.
- Futier E, Lefrant JY, Guinot PG, et al. Effect of individualized vs standard BP management strategies on postoperative organ dysfunction among high-risk patients undergoing major surgery. JAMA. 2017;318:1346. PMID: 28973220.
- Meidert AS, Nold JS, Hornung R, et al. The impact of continuous non-invasive arterial BP monitoring on BP stability during general anaesthesia in orthopaedic patients: a randomised trial. Eur J Anaesthesiol. 2017;34:716–722. PMID: 28922340.
- Klose P, Lorenzen U, Berndt R, et al. Continuous noninvasive monitoring of arterial pressure using the vascular unloading technique in comparison to the invasive gold standard in elderly comorbid patients: a prospective observational study. Health Sci Rep. 2020;3:e204. PMID: 33204849.
- Maheshwari K, Buddi S, Jian Z, et al. Performance of the Hypotension Prediction Index with non-invasive arterial pressure waveforms in non-cardiac surgical patients. J Clin Monit Comput. 2021;35:71–78. PMID: 31989416.
- Davies SJ, Mythen M. Hemodynamic and intestinal microcirculatory changes in a phenylephrine corrected porcine model of hemorrhage. Anesth Analg. 2021;133:1060–1069. PMID: 33755645.
- Sessler D. Perioperative hypotension. APSF Newsletter. 2021;36:89–94. https://www.apsf.org/article/perioperative-hypotension/ . Accessed March 2024.
- Edwards Lifesciences. Acumen IQ sensor: minimally-invasive predictive decision support. https://www.edwards.com/healthcare-professionals/products-services/predictive-monitoring/acumen-iq-sensor. Accessed March 27, 2023.
- Scott MJ, and the APSF Hemodynamic Instability Writing Group. Perioperative patients with hemodynamic instability: consensus recommendations of the Anesthesia Patient Safety Foundation. Anesth Analg. 2024;138:713–724. PMID: 38153876.


 Issue PDF
Issue PDF