 患者が大きな非心臓手術を終えて麻酔後回復室に辿り着くと、その家族は患者が周術期の最も危険な部分を自然に乗り越えたものと思い込む。それは間違っている。手術後30日での死亡率は、術中死亡率の100倍以上である。1,2 実際に、術後1ヵ月間を疾患であるとみなした場合、米国における死因の第3位を占める。3
患者が大きな非心臓手術を終えて麻酔後回復室に辿り着くと、その家族は患者が周術期の最も危険な部分を自然に乗り越えたものと思い込む。それは間違っている。手術後30日での死亡率は、術中死亡率の100倍以上である。1,2 実際に、術後1ヵ月間を疾患であるとみなした場合、米国における死因の第3位を占める。3
術後死亡率の4分の3は、最初の入院中、つまり、最高レベルの施設で直接治療を受けているときに発生する。4 非心臓手術後30日間で最多の死因は大量出血と心筋損傷である。5,6
心筋傷害
心筋梗塞は、第4版ユニバーサル定義によると、トロポニンの上昇および心筋虚血の症状または徴候があることである。7 非心臓手術後の心筋傷害(Myocardial injury after non-cardiac surgery, MINS)は、虚血由来と思われるトロポニン上昇があることと定義され、30日8 および1年9 の死亡率と深く関連している。MINSには、心筋梗塞および心筋梗塞の定義を満たさないその他の虚血性心筋傷害が含まれる。
非心臓手術周術期の心筋傷害は、一般にタイプ2の事象であり、主に酸素需要供給ミスマッチが原因である。したがって、MINSおよび周術期の心筋梗塞は、通常はプラークの破裂に起因する非手術的梗塞とは異なる。周術期の心筋事象による死亡率は、非手術的梗塞よりも高いため、かなりの注意が必要である。10,11
トロポニンスクリーニング
MINSとMIの90%以上が術後2日以内に発生し、その90%以上が無症候性である。12 無症候性のトロポニン上昇を擬陽性として却下することは魅力的だが、死亡率は無症候性でも症候性とほぼ同じである(図1)。したがって、MINSも古典的な症候性梗塞と同様に深刻に捉える必要がある。
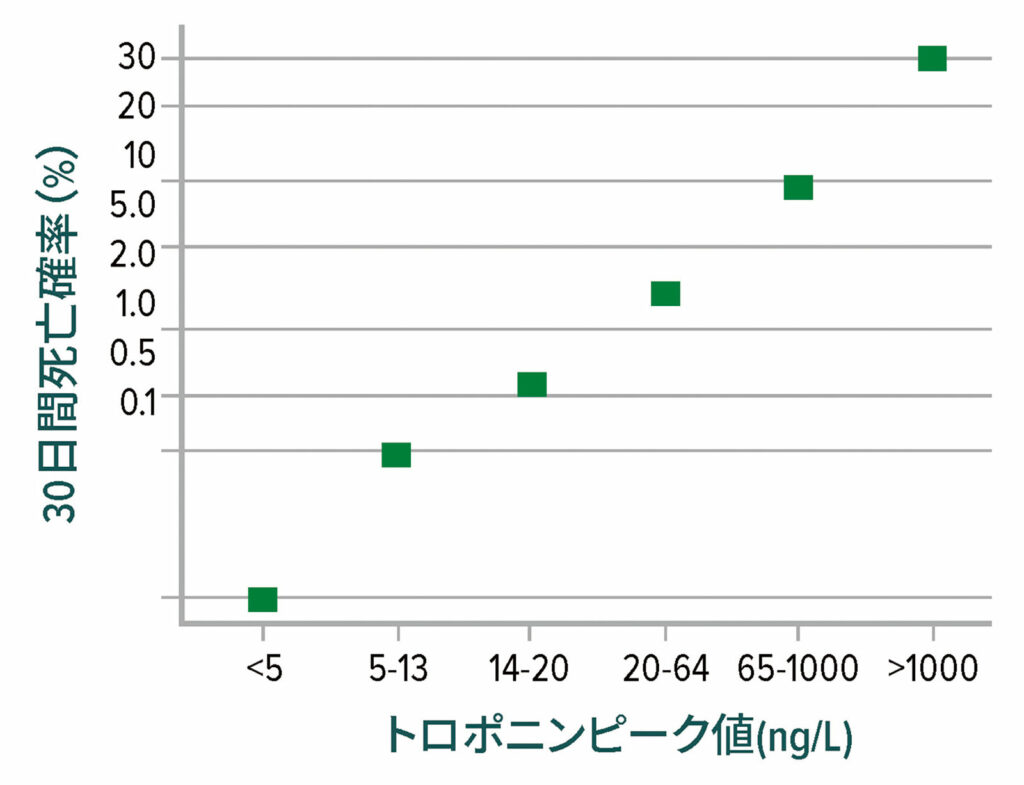
図 1:術後の高感度トロポニンTピーク値の関数としての30日間死亡率。死亡率は、トロポニンT濃度が5ng/L未満の場合の0.1%からトロポニンTが1,000ng/Lを超える場合の30%まで著しく増加する。
VISION試験責任医師の執筆委員会(Writing Committee for the Vision Study Investigators)からのデータ:非心臓手術を受けた患者における術後高感度トロポニンレベルと心筋傷害および30日間死亡率との相関関係。12
この図は、参考文献12に示されているデータをから転用している。
定期的なトロポニンスクリーニングがない場合、ほとんどの心筋傷害は見落とされる。合理的な戦略は、術前および術後最初の3日間トロポニンを測定することである。MINSの閾値は、アッセイの世代と種類によって異なる。
- 非高感度(第4世代)トロポニンT≥0.03ng/ ml4;
- 高感度トロポニンT≥65ng/L; または高感度トロポニンT = 20–64ng/Lおよびベースラインから5ng/L以上の増加12;
- 3.高感度トロポニンI(アボットアッセイ [アボットパーク、IL])≥60ng/L13;
- 4.高感度トロポニンI(Siemensアッセイ [ミュンヘン、ドイツ])≥75ng/L(Borges、未発表);
- トロポニンI(他のアッセイ)の局所的99パーセンタイルが少なくとも2倍
- 術前の高感度トロポニン濃度が項目2〜5の関連閾値の80%を超える患者では、少なくとも20%の増加
低血圧
MINSとMIはどちらも、年齢、糖尿病、心血管系の病歴など、多くの修正不可能なベースライン特性と強く関連している。大規模なランダム化試験(n = 7,000–10,000)によると、ベータ遮断薬14 、亜酸化窒素の回避15、クロニジン16 、アスピリン17 によってMIが安全に予防できないことが示されている。最近の大規模な試験では、MINSを発症した7人に1人の患者が、術後17か月以内に主要な血管事象(主に再梗塞)を発症した。11
術中低血圧はMINSとMIに関連しており、有害閾値は平均動脈圧(MAP)≈65mmHgである(図2)。18,19術後低血圧は、術中低血圧とは独立して心筋梗塞に関連している(図3)。20,21
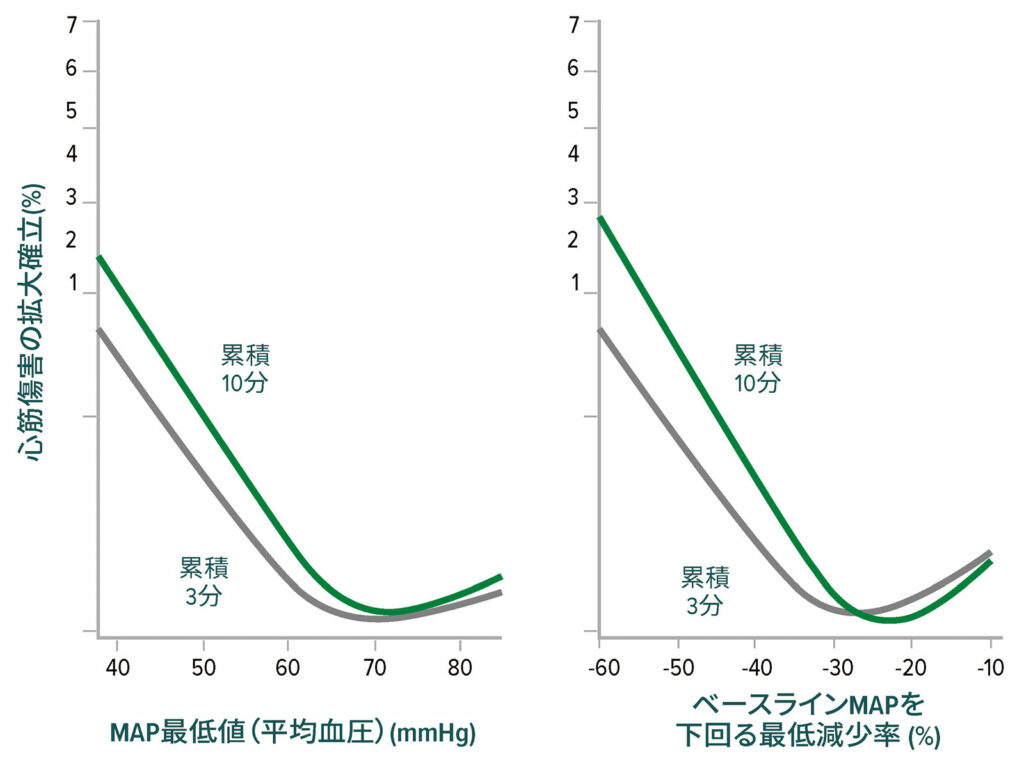
図2:非心臓手術後の心筋損傷に対する最低平均動脈圧(MAP)の閾値。左のグラフは3分間および10分間の最低累積絶対平均動脈圧と心筋損傷の関係を示したもの。右のグラフは3分間および10分間の最低累積相対平均動脈圧と心筋損傷の関係を示したもの。両グラフともにベースライン特性を調整した多変量ロジスティック回帰分析である。18
許可を得て改変転載。Salmasi V, Maheshwari K, Yang D, Mascha EJ, Singh A, Sessler DI, Kurz A. ベースラインまたは絶対値からの低下によって定義される術中低血圧と非心臓手術後の急性腎および心筋損傷との関係:後ろ向きコホート分析。Anesthesiology.2017;126:47–65.
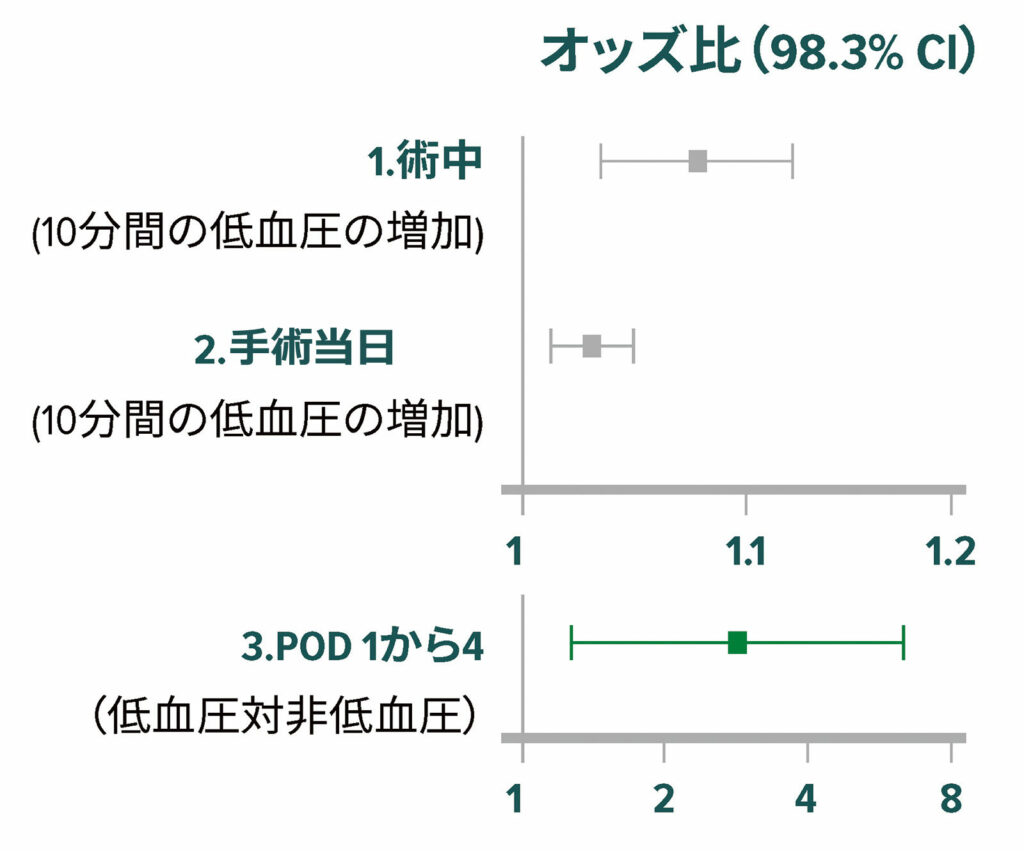
図3:3つの周術期期間(術中、麻酔後回復室後の手術当日、術後入院4日間)における30日心筋梗塞・死亡率(主要複合評価項目)に対する平均相対効果のオッズ比。多重比較のCIはボンフェローニ補正によって調整した。これに応じて、平均相対効果は、P<0.017(0.05/3)の場合を有意であるとみなした。図中の箱はオッズ比、ひげはCIを表す。POD =術後日数20
許可を得て改変転載。Sessler DI, Meyhoff CS, Zimmerman NM, Mao G, Leslie K, Vasquez SM, Balaji P, Alvarez-Garcia J, Cavalcanti AB, Parlow JL, Rahate PV, Seeberger MD, Gossetti B, Walker SA, Premchand RK, Dahl RM, Duceppe E, Rodseth R, Botto F, Devereaux PJ.非心臓手術中および手術後4日間の低血圧と心筋梗塞および死亡の複合との間の期間依存性の相関関係:POISE-2試験のサブスタディ。Anesthesiology. 2018;128:317–327.
VISIONコホートの結果は、術後低血圧が一般的であり(図4)、主要な血管事象と強く関連していることを示している。術後低血圧は、術中低血圧よりも心筋梗塞および/または死亡とより強く関連している(図5)。22周術期低血圧も脳卒中と関連しているが、14,22-25、一貫性はない。26
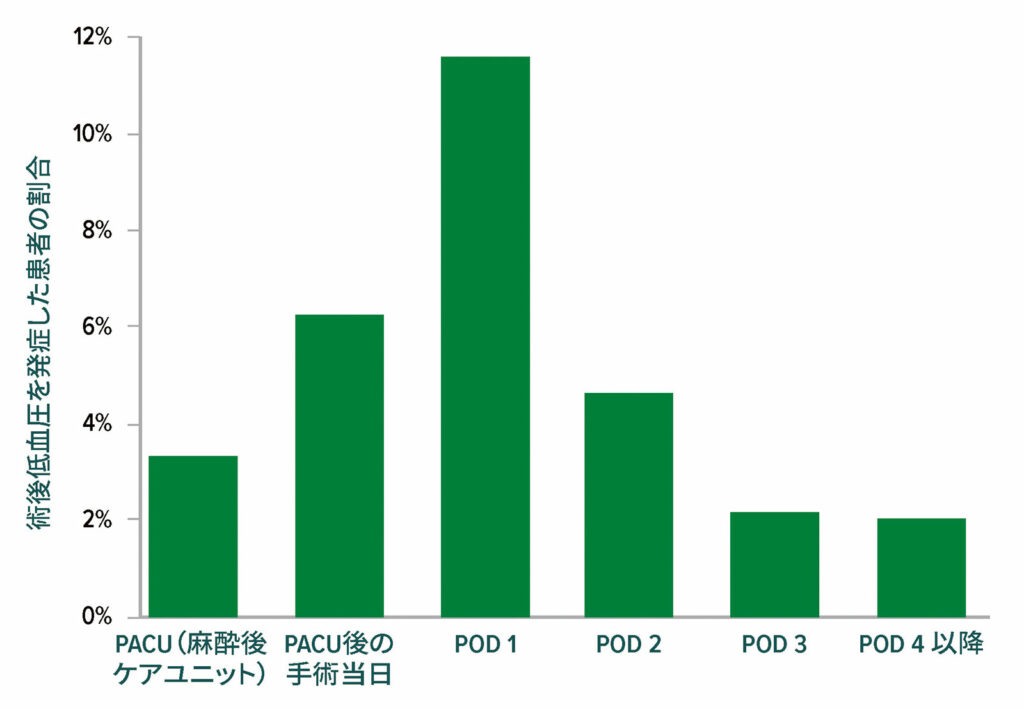
図 4:臨床的に意味のある低血圧(収縮期血圧<90および介入を要する。合計で、14,687人の患者のうち2,860人(19.5%)が、手術後に臨床的に意味のある低血圧発作を少なくとも1回発症した。そのうちの2,728人(95.4%)は、術後3日目までに低血圧発作を発症した。OR =手術室; PACU =麻酔後ケアユニット。22
許可を得て改変転載。Roshanov PS、Rochwerg B、Patel A、他非心臓手術前のアンギオテンシン変換酵素阻害薬またはアンギオテンシンII受容体遮断薬の差し控えと継続:非心臓手術患者コホート評価前向きコホートにおける血管イベントの分析。Anesthesiology. 2017;126:16–27.
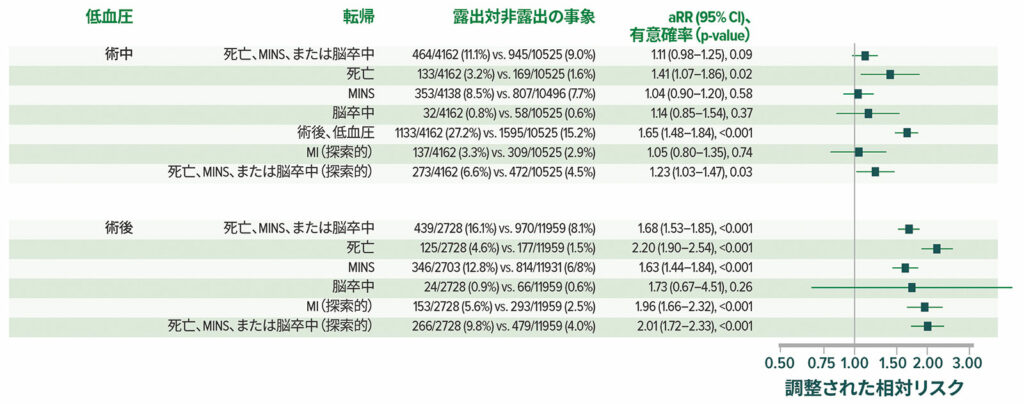
図 5:14,687人の患者全員における低血圧と術後死亡および血管イベントとの間の調整された関連。 aRR =調整された相対リスク。22
許可を得て改変転載。Roshanov PS、Rochwerg B、Patel A、他非心臓手術前のアンギオテンシン変換酵素阻害薬またはアンギオテンシンII受容体遮断薬の差し控えと継続:非心臓手術患者コホート評価前向きコホートにおける血管イベントの分析。Anesthesiology. 2017;126:16–27.
その他因子
最近の2つの研究では、ベースラインの患者特性と術前貧血を調整した後でも、28 術後貧血と心筋傷害27 および梗塞との間にきわめて強い関連性があることが確認された。一方、最大100/分の心拍数と最大200mmHgの収縮期高血圧は、術後の心筋障害の重要な危険因子ではない。29 低酸素血症は一般病床でよく見られ、重篤で長期化する。30 しかし、低酸素血症が心筋傷害に寄与するかどうかは不明のままである。幸いなことに、低血圧と低酸素血症の合併は、需要供給障害を引き起こす可能性があるが、稀である。
急性腎障害
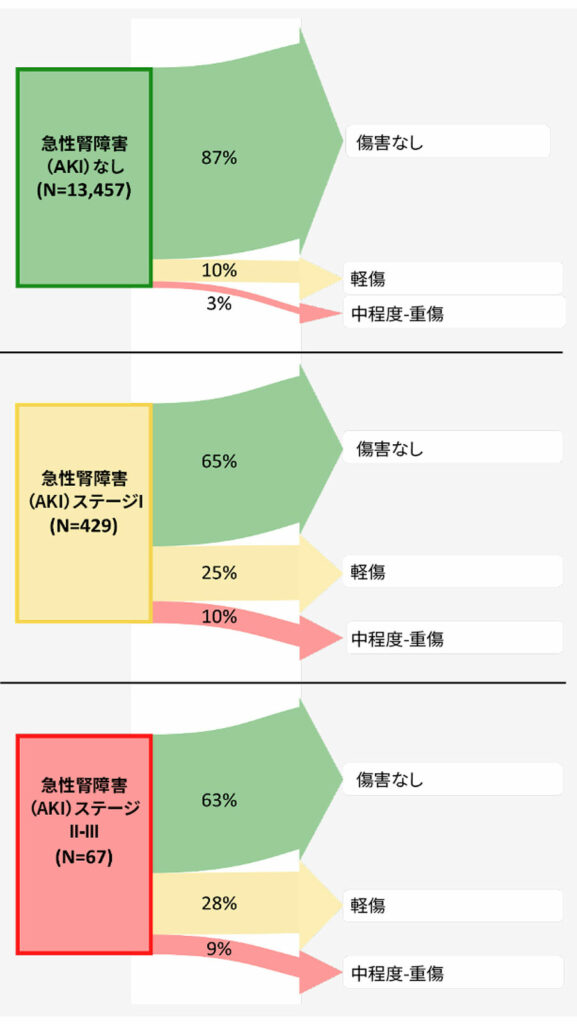
図6:手術の1~2年後の術後急性腎障害ステージ別腎臓転帰。矢印の幅は、各暴露群で各ステージの長期腎障害を発症した患者の割合を表す。37 術後腎障害ステージI患者(クレアチニン増加が≧0.3mg/dLまたはベースライン値の1.5~1.9倍)の4分の1は1~2年後も軽度障害を有し、10%はステージがさらに高かった。したがって、腎障害ステージI患者の3分の1は、手術の1~2年後も腎障害を有していたことになる。その結果、術後腎障害ステージIの患者は、術後腎障害のない患者と比較して、長期腎障害のオッズ比(95%CI)が2.3(1.8、2.9)であった。したがって、非心臓手術後の成人では、ステージIの腎障害に相当する血漿クレアチニンの軽度の術後増加でさえ、手術後1〜2年の腎転帰の悪化と関連するため、臨床的に重要な周術期転帰と見なされるべきであると結論付ける。
許可を得て改変転載。Turan A, Cohen B, Adegboye J, Makarova N, Liu L, Mascha EJ, Qiu Y, Irefin S, Wakefield BJ, Ruetzler K, Sessler DI. 非心臓手術後の軽度の急性腎障害は、長期の腎機能障害と関連している:後ろ向きコホート研究。Anesthesiology. 2020;132:1053–1061.
新たに発症する急性腎障害(AKI)は、非心臓手術後によく見られ、ステージ2〜3は患者の最大1%で発生し、31、ステージ1のAKIを含めると患者の最大7.4%で発生する。32現在、AKIを予測する信頼できる方法はない。33AKIの低血圧による有害閾値は、おそらく腎臓の代謝率が高いため、心筋傷害の閾値と同じか、わずかに高めである。18,32,34
特に、MAPカットオフ値をより厳密に55mmHg未満、この血圧を下回るのは5分未満とすると、AKIのリスクが18%増加する。34他の分析でも、同様の関連性について報告されている。35 これらの研究を併せて考えると、周術期低血圧の程度および期間とAKIの間には堅牢な関連性があることが確認できるため、低血圧を定量化する際は、期間と変動の両方を考慮することが重要である。
周術期AKIの影響は、過去の発端となる入院を超えて広がる。1,869例の患者を対象に周術期AKIと1年死亡率の関連性を検証した観察コホート研究では、AKIと死亡の調整ハザード比3の間に関連性が認められた。36 最後に、AKIの程度がさらに軽度であっても、その影響は継続する。ステージ1のAKIの37%は、非心臓手術後1〜2年持続する、または悪化する(図6)。37
せん妄
せん妄は、心臓手術の一般的な合併症であり、罹患率と死亡率に関連する。38-42 大きな非心臓手術後のせん妄発生率は約10%と報告されており、患者の年齢が65歳を超えると著しく増加する。43 せん妄の病態生理は多因子的だが、おそらく平均動脈圧が自己調節の下限よりも低い場合に生じる不十分な脳灌流が一因と考えられる。44-46
脳の自動調節の閾値は依然不明だが、患者間で大きく異なることが予想され、一部の患者では85mmHgにもなる可能性がある。47,48 この理論と一致して、低血圧はせん妄と認知機能低下に関連するが49-51(図7)、一貫性はない。52-54 せん妄が低血圧に起因することを示す限られたランダム化データ(n = 199)が存在する。55
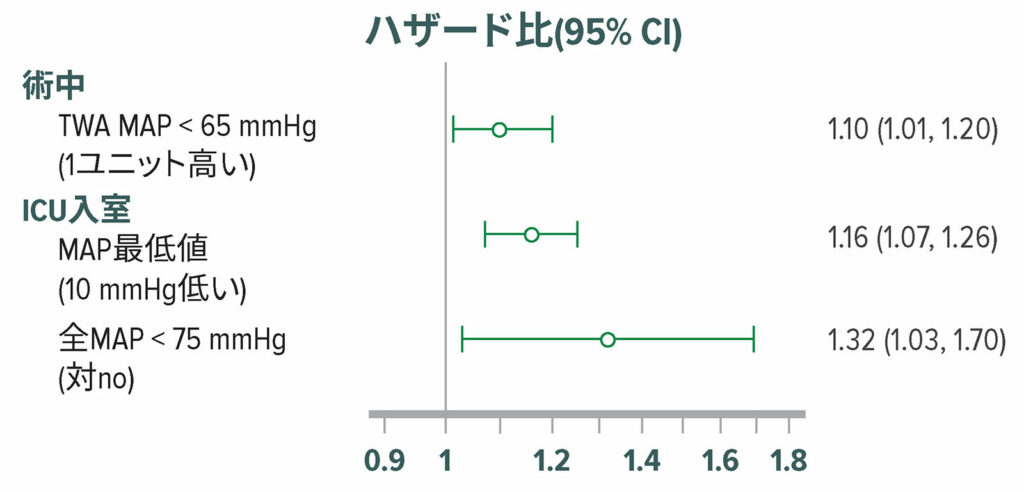
図7:手術室から外科集中治療室に直接入室した908人の術後患者におけるせん妄の調整ハザード比。せん妄は、12時間間隔でCAM-ICUで評価した。316人(35%)の患者は、外科集中治療室で術後最初の5日以内にせん妄を発症した。MAP <65 mmHgの術中低血圧は、術後せん妄のオッズが高いことと有意に関連していた。50 TWA=Time Weighted Average:時間加重平均値。
許可を得て改変転載。Maheshwari K、Ahuja S、Khanna AK、Mao G、他。術後重症患者における周術期低血圧とせん妄との関連:後ろ向きコホート分析。Anesth Analg. 2020;130:636–643.
術後にせん妄を発症する患者は、他の患者よりも、長期的な認知機能障害を発症する確率がはるかに高い。56 ただし、その関連性に因果関係があるかどうかは不明のままである。低血圧はまた、せん妄と強く関連する顕在性脳卒中、あるいはさらに一般的な潜在性脳卒中を惹起する可能性がある。57
血圧管理
術中低血圧は、患者基本特性または外科的処置から確実に予測することはできない。58 周術期低血圧を予防および治療する最善の方法は不明なままである。術中の心係数と血圧の間には相関関係はほとんどなく、適切な血管量を維持することで低血圧を防ぐという仮定は正確ではないようだ。さらに、ある研究では、術中低血圧の3分の1が麻酔導入から外科的切開までの間に発生しため、体液の移動ではなく麻酔薬に起因していたことが明らかである。執刀前の低血圧は、その後の低血圧と同じくらい臓器損傷と強く関連している。59
継続的な血圧モニタリングは、5分間隔での測定よりも多くの低血圧を検出できる。60,61 したがって、臨床医はより早く介入することができる。61近年、動脈波形に基づいて将来の低血圧を予測できる魅力的なアルゴリズムが開発された。62 小規模な試験では、心係数に基づく管理により低血圧が減少したことが報告されたが、63 大規模な試験では、そのような利益は認められなかった。64 その差は、治療アルゴリズムの違いによって発生した可能性が高いため、堅牢な治験が必要であることは明らかである。
フェニレフリンやノルエピネフリンなどの昇圧薬は、手術中の低血圧の治療に一般的に使用される。フェニレフリンは、米国で群を抜いて最も一般的に使用されている昇圧薬である。65 一方、ノルエピネフリンは一般的に他の国々で好まれる。フェニレフリンは、全身の血管抵抗を増加させることによって血圧を上昇させる純粋なアルファアゴニストであり、通常は心拍出量の代償的な減少を伴う。66対照的に、ノルエピネフリンは強力なa-アドレナリン作動性と弱いb-アドレナリン作動性を組み合わせ、心拍出量の維持を補助する。その結果、血圧はいずれも昇圧薬も同等に維持されるが、67 フェニレフリンは内臓血流と酸素供給量を減少させる。68 臨床医は敗血症性ショックの患者では、フェニレフリンを避けるべきである。69
ノルエピネフリンの使用による心拍出量の維持と内臓灌流の理論的利点にもかかわらず、外科患者の転帰改善を示すエビデンスは限られている。70 その結果、フェニレフリンとノルエピネフリンの両方が、主に臨床医の好みと可用性に基づいて、臨床診療で広く使用されている。術中の低用量の昇圧薬使用が有害であるという明確な証拠はなく、昇圧薬の使用を避けるために低血圧を許可することはおそらく賢明ではない。ノルエピネフリンは中心静脈カテーテルまたは末梢から安全に投与できる。71 14,328人の患者を対象とした最近の研究では、血管外漏出発症は5件のみであり、局所組織損傷を経験した患者は1人もいなかった。72
一般病棟における低血圧は、よく見られ、遷延しかつ重症である。周術期低血圧による臓器損傷の大半は、術中ではなく術後に発生する傾向がある。課題は、血圧測定が通常間欠的であることだ。4時間間隔でも、潜在的に重篤な低血圧の約半分が見落とされる。73(病棟における低酸素血症の大半も同様に、間欠的モニタリングにより見過ごされている。30)病棟の低血圧を確実に検出して治療するには、継続的なバイタルサインの監視が必要となる。同時に、手術当日にアンジオテンシン変換酵素阻害薬とアンジオテンシン受容体拮抗薬を回避することは、22 明らかに必要な場合にのみ長期的に投与されている降圧薬を再開するのと同様に役立つ。
相関関係と因果関係
術中低血圧は一般的である。定義と対象にもよるが、外科患者の4分の1以上が手術中の平均動脈圧が65mmHg未満である。術後低血圧もよく見られ、潜在的に重篤なエピソードの約半分だけが、4時間間隔で日常的なバイタルサイン測定によって検出される。73 術後低血圧はしばしば長引き、多くの、あるいはほとんどの心筋損傷および腎障害が、術後に発症する可能性が高いようである。
現在、低血圧とMINSおよびAKIとの関連に因果関係があるという証拠は希薄である。しかし、小規模のランダム化試験(n = 292)では、術中低血圧を予防することで、主要な合併症のリスクが25%減少することが示されている。これは、生物学的に妥当である。74 以下2つの大規模な試験では、観察された関係性のどの部分(存在する場合)が因果関係にあるかを特定しようとしている。POISE-3(n = 10,000、NCT03505723)はほぼ終了し、GUARDIAN(n = 6,250、NCT保留中)が開始されようとしている。
まとめ
術中および術後の低血圧は、心筋および腎障害に関連している。その関連性は、さまざまな閾値と分析方法を使用した多様な集団で一貫して報告されており、既知のベースライン因子を調整しても存在が認められる。(ベースライン因子との相関関係は低血圧よりもはるかに強力であるが、低血圧は修正可能であるという点で異なる。)低血圧とせん妄の相関関係も報告されているが、証拠は弱いままである。
現在、観察された関連性にどの程度因果関係が認められるかを特性評価したランダム化データはほとんどない。大規模な試験が進行中であるが、結果はしばらくの間利用できない。問題は、それまでの間血圧をどのように管理するかである。
とりわけ、2つの要素が注目に値する。1つ目は、低血圧と臓器損傷の因果関係はどの程度あるのかということだ。確かに、観察された相関関係の多くは、観察されていない交絡に起因するか、修正可能というより予測的である。しかし、少なくとも一部が因果関係にあり、介入が可能であると考えられる。考慮すべき2番目の因子は、術中の平均動脈圧を65mmHgまたは同様の閾値以上に維持することがどれほど難しいか、ということである。一般に、術中の血圧を明らかな有害閾値よりもはるかに高く保つことは難しくない(または高額ではない)。多くの場合、麻酔薬の投与を控えめにし、熟練した体液管理するだけで十分である。場合によっては、低用量または中用量の昇圧薬が必要となる。低用量の昇圧薬の投与が有害であるという説得力のある証拠はない。術後低血圧の予防ははるかに困難であるが、1つの有用なアプローチは明らかに必要になるまで長期的に使用されてきた降圧薬の再開を遅らせることである。
血圧、特に低血圧の予防は、心血管系の合併症を軽減する可能性のある修正可能な因子である。堅牢な試験の結果が出るまで、周術期低血圧を回避するための妥当な努力は賢明であるように思われる。
Daniel I. Sessler, MDは、米国オハイオ州クリーブランドにあるAnesthesiology InstituteのDepartment of Outcomes ResearchにおけるMichael Cudahy教授・主任です。
著者は、Edwards Lifesciences(カリフォルニア州アーバイン)のコンサルタントであり、Sensifree(カリフォルニア州クパチーノ)とPerceptive Medical(カリフォルニア州ニューポートビーチ)の諮問委員会のメンバーで株式の持分を有する。
参考文献
- Li G, Warner M, Lang BH, et al. Epidemiology of anesthesia-related mortality in the United States, 1999-2005. Anesthesiology. 2009;110:759–765.
- Pearse RM, Moreno RP, Bauer P, et al. European Surgical Outcomes Study group for the Trials groups of the European Society of Intensive Care M, the European Society of A: mortality after surgery in Europe: a 7 day cohort study. Lancet. 2012;380:1059–1065.
- Bartels K, Karhausen J, Clambey ET, et al. Perioperative organ injury. Anesthesiology. 2013;119:1474–1489.
- The Vascular Events In Noncardiac Surgery Patients Cohort Evaluation (VISION) Study Investigators: association between postoperative troponin levels and 30-day mortality among patients undergoing noncardiac surgery. JAMA. 2012;307:2295–2304.
- Vascular Events in Noncardiac Surgery Patients Cohort Evaluation Study Investigators: association between complications and death within 30 days after noncardiac surgery. CMAJ. 2019;191:E830–E837.
- Devereaux PJ, Sessler DI. Cardiac complications in patients undergoing major noncardiac surgery. N Engl J Med. 2015;373:2258–2269.
- Thygesen K, Alpert JS, Jaffe AS, et al. Fourth Universal Definition of Myocardial Infarction (2018). J Am Coll Cardiol. 2018;72:2231–2264. doi: 10.1016/j.jacc.2018.08.1038. Epub 2018 Aug 25.
- The Vascular Events in Noncardiac Surgery Patients Cohort Evaluation (VISION) Study Investigators: association between complications and death within 30 days after noncardiac surgery. Can Med Assoc J. 2019;191:E830–E837.
- Beattie WS, Wijeysundera DN, Chan MTV, et al. Anzca Clinical Trials Network for the ENIGMA-II Investigators: implication of major adverse postoperative events and myocardial injury on disability and survival: a planned subanalysis of the ENIGMA-II trial. Anesth Analg. 2018;127:1118–1126.
- Eikelboom JW, Connolly SJ, et al. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med. 2017;377:1319–1330.
- Devereaux PJ, Duceppe E, Guyatt G, et al. Dabigatran in patients with myocardial injury after non-cardiac surgery (MANAGE): an international, randomised, placebo-controlled trial. Lancet. 2018;391:2325–2334.
- Writing Committee for the Vision Study Investigators, Devereaux PJ, Biccard BM, Sigamani A, et al. Association of postoperative high-sensitivity troponin levels with myocardial injury and 30-day mortality among patients undergoing noncardiac surgery. JAMA. 2017;317:1642–1651.
- Duceppe E, Borges FK, Tiboni M, et al. Association between high-sensitivity troponin I and major cardiovascular events after non-cardiac surgery (abstrract). J Am Coll Cardiol. 2020;75.
- Devereaux PJ, Yang H, Yusuf S, et al. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): a randomised controlled trial. Lancet. 2008;371:1839–1847.
- Myles PS, Leslie K, Chan MT, et al. Anzca Trials Group for the ENIGMA-II investigators: the safety of addition of nitrous oxide to general anaesthesia in at-risk patients having major non-cardiac surgery (ENIGMA-II): a randomised, single-blind trial. Lancet. 2014;384:1446–1454.
- Devereaux PJ, Sessler DI, Leslie K, et al. Poise-2 Investigators: clonidine in patients undergoing noncardiac surgery. N Engl J Med. 2014;370:1504–1513.
- Devereaux PJ, Mrkobrada M, Sessler DI, et al. Poise-2 Investigators: aspirin in patients undergoing noncardiac surgery. N Engl J Med. 2014;370:1494–1503.
- Salmasi V, Maheshwari K, Yang D, et al. Relationship between intraoperative hypotension, defined by either reduction from baseline or absolute thresholds, and acute kidney and myocardial injury after noncardiac surgery: a retrospective cohort analysis. Anesthesiology. 2017;126:47–65.
- Mascha EJ, Yang D, Weiss S, Sessler DI. Intraoperative mean arterial pressure variability and 30-day mortality in patients having noncardiac surgery. Anesthesiology. 2015;123:79–91.
- Sessler DI, Meyhoff CS, Zimmerman NM, et al. Period-dependent associations between hypotension during and for four days after noncardiac surgery and a composite of myocardial infarction and death: a substudy of the POISE-2 trial. Anesthesiology. 2018;128:317–327.
- Liem VGB, Hoeks SE, Mol K, et al. Postoperative hypotension after noncardiac surgery and the association with myocardial injury. Anesthesiology. 2020;133:510–522.
- Roshanov PS, Rochwerg B, Patel A, et al. Withholding versus continuing angiotensin-converting enzyme inhibitors or angiotensin II receptor blockers before noncardiac surgery: an analysis of the vascular events in noncardiac surgery patients cohort evaluation prospective cohort. Anesthesiology. 2017;126:16–27.
- Bijker JB, Gelb AW. Review article: The role of hypotension in perioperative stroke. Can J Anaesth. 2013;60:159–167.
- Bijker JB, Persoon S, Peelen LM, et al. Intraoperative hypotension and perioperative ischemic stroke after general surgery: A nested case-control study. Anesthesiology. 2012;116:658–664.
- Sun LY, Chung AM, Farkouh ME, et al. Defining an intraoperative hypotension threshold in association with stroke in cardiac surgery. Anesthesiology. 2018;129:440–447.
- Hsieh JK, Dalton JE, Yang D, et al. The association between mild intraoperative hypotension and stroke in general surgery patients. Anesth Analg. 2016;123:933–939.
- Turan A, Cohen B, Rivas E, et al. Association between postoperative haemoglobin and myocardial injury after noncardiac surgery: a retrospective cohort analysis. Br J Anaesth. 2021;126:94–101.
- Turan A, Rivas E, Devereaux PJ, et al. Association between postoperative haemoglobin concentrations and composite of non-fatal myocardial infarction and all-cause mortality in noncardiac surgical patients: post hoc analysis of the POISE-2 trial. Br J Anaesth. 2021;126:87–93.
- Ruetzler K, Yilmaz HO, Turan A, et al. Intra-operative tachycardia is not associated with a composite of myocardial injury and mortality after noncardiac surgery: A retrospective cohort analysis. Eur J Anaesthesiol. 2019;36:105–113.
- Sun Z, Sessler DI, Dalton JE, et al. Postoperative hypoxemia is common and persistent: a prospective blinded observational study. Anesth Analg. 2015;121:709–715.
- Kheterpal S, Tremper KK, Heung M, et al. Development and validation of an acute kidney injury risk index for patients undergoing general surgery: results from a national data set. Anesthesiology. 2009;110:505–515.
- Walsh M, Garg AX, Devereaux PJ, et al. The association between perioperative hemoglobin and acute kidney injury in patients having noncardiac surgery. Anesth Analg. 2013;117:924–931.
- Whitlock EL, Braehler MR, Kaplan JA, et al. Derivation, validation, sustained performance, and clinical impact of an electronic medical record-based perioperative delirium risk stratification tool. Anesth Analg. 2020;131:1901–1910.
- Walsh M, Devereaux PJ, Garg AX, et al. Relationship between intraoperative mean arterial pressure and clinical outcomes after noncardiac surgery: toward an empirical definition of hypotension. Anesthesiology. 2013;119:507–515.
- Sun LY, Wijeysundera DN, Tait GA, et al. Association of intraoperative hypotension with acute kidney injury after elective noncardiac surgery. Anesthesiology. 2015;123:515–523.
- O’Connor ME, Hewson RW, Kirwan CJ, et al. Acute kidney injury and mortality 1 year after major non-cardiac surgery. Br J Surg. 2017;104:868–876.
- Turan A, Cohen B, Adegboye J, et al. Mild acute kidney injury after noncardiac surgery is associated with long-term renal dysfunction: a retrospective cohort study. Anesthesiology. 2020;132:1053–1061.
- Hakim SM, Othman AI, Naoum DO. Early treatment with risperidone for subsyndromal delirium after on-pump cardiac surgery in the elderly: a randomized trial. Anesthesiology. 2012;116:987–997.
- Maldonado JR, Wysong A, van der Starre PJ, et al. Dexmedetomidine and the reduction of postoperative delirium after cardiac surgery. Psychosomatics. 2009;50:206–217.
- Royse CF, Saager L, Whitlock R, et al. Impact of methylprednisolone on postoperative quality of recovery and delirium in the Steroids in Cardiac Surgery Trial: a randomized, double-blind, placebo-controlled substudy. Anesthesiology. 2017;126:223–233.
- Shehabi Y, Grant P, Wolfenden H, et al. Prevalence of delirium with dexmedetomidine compared with morphine based therapy after cardiac surgery: a randomized controlled trial (DEXmedetomidine COmpared to Morphine-DEXCOM Study). Anesthesiology. 2009;111:1075–1084.
- Turan A, Duncan A, Leung S, et al. Dexmedetomidine for reduction of atrial fibrillation and delirium after cardiac surgery (DECADE): a randomised placebo-controlled trial. Lancet. 2020;396:177–185.
- Gou RY, Hshieh TT, Marcantonio ER, et al. One-year medicare costs associated with delirium in older patients undergoing major elective surgery. JAMA Surg. 2021;156:430–442.
- Hayhurst CJ, Pandharipande PP, Hughes CG. Intensive care unit delirium: a review of diagnosis, prevention, and treatment. Anesthesiology. 2016;125:1229–1241.
- Daiello LA, Racine AM, Yun Gou R, et al. Postoperative delirium and postoperative cognitive dysfunction: overlap and divergence. Anesthesiology. 2019;131:477–491.
- Pan H, Liu C, Ma X, et al. Perioperative dexmedetomidine reduces delirium in elderly patients after non-cardiac surgery: a systematic review and meta-analysis of randomized-controlled trials. Can J Anaesth. 2019;66:1489–1500.
- Ono M, Arnaoutakis GJ, Fine DM, et al. Blood pressure excursions below the cerebral autoregulation threshold during cardiac surgery are associated with acute kidney injury. Crit Care Med. 2013;41:464–471.
- Ono M, Brady K, Easley RB, et al. Duration and magnitude of blood pressure below cerebral autoregulation threshold during cardiopulmonary bypass is associated with major morbidity and operative mortality. J Thorac Cardiovasc Surg. 2014;147:483–489.
- Feng X, Hu J, Hua F, et al. The correlation of intraoperative hypotension and postoperative cognitive impairment: a meta-analysis of randomized controlled trials. BMC Anesthesiol. 2020;20:193.
- Maheshwari K, Ahuja S, Khanna AK, et al. Association between perioperative hypotension and delirium in postoperative critically ill patients: a retrospective cohort analysis. Anesth Analg. 2020;130:636–643.
- Hori D, Brown C, Ono M, et al. Arterial pressure above the upper cerebral autoregulation limit during cardiopulmonary bypass is associated with postoperative delirium. Br J Anaesth. 2014;113:1009–1017.
- Hirsch J, DePalma G, Tsai TT, et al. Impact of intraoperative hypotension and blood pressure fluctuations on early postoperative delirium after non-cardiac surgery. Br J Anaesth. 2015;115:418–426.
- Wesselink EM, Kappen TH, van Klei WA, et al. Intraoperative hypotension and delirium after on-pump cardiac surgery. Br J Anaesth. 2015;115:427–433.
- Langer T, Santini A, Zadek F, et al. Intraoperative hypotension is not associated with postoperative cognitive dysfunction in elderly patients undergoing general anesthesia for surgery: results of a randomized controlled pilot trial. J Clin Anesth. 2019;52:111–118.
- Brown CH 4th, Neufeld KJ, Tian J, et al. Effect of targeting mean arterial pressure during cardiopulmonary bypass by monitoring cerebral autoregulation on postsurgical delirium among older patients: A nested randomized clinical trial. JAMA Surg. 2019;154:819–826.
- Brown CH 4th, Probert J, Healy R, et al. Cognitive decline after delirium in patients undergoing cardiac surgery. Anesthesiology. 2018;129:406–416.
- Mrkobrada M, Chan MTV, Cowan D, et al. Perioperative covert stroke in patients undergoing non-cardiac surgery (NeuroVISION): a prospective cohort study. Lancet. 2019; 394:1022–1029.
- Sessler DI, Khan MZ, Maheshwari K, et al. Blood pressure management by anesthesia professionals: evaluating clinician skill from electronic medical records. Anesth Analg. 2021;132:946–956.
- Maheshwari K, Turan A, Mao G, et al. The association of hypotension during non-cardiac surgery, before and after skin incision, with postoperative acute kidney injury: a retrospective cohort analysis. Anaesthesia. 2018;73:1223–1228.
- Naylor AJ, Sessler DI, Maheshwari K, et al. Arterial catheters for early detection and treatment of hypotension during major noncardiac surgery: a randomized trial. Anesth Analg. 2020;131:1540–1550.
- Maheshwari K, Khanna S, Bajracharya GR, et al. A randomized trial of continuous noninvasive blood pressure monitoring during noncardiac surgery. Anesth Analg. 2018;127:424–431.
- Davies SJ, Vistisen ST, Jian Z, et al. Ability of an arterial waveform analysis-derived hypotension prediction index to predict future hypotensive events in surgical patients. Anesth Analg. 2020;130:352–329.
- Wijnberge M, Geerts BF, Hol L, et al. Effect of a machine learning-derived early warning system for intraoperative hypotension vs standard care on depth and duration of intraoperative hypotension during elective noncardiac surgery: the HYPE randomized clinical trial. JAMA. 2020;323:1052–1060.
- Maheshwari K, Shimada T, Yang D, et al. Hypotension prediction index for prevention of hypotension during moderate- to high-risk noncardiac surgery. Anesthesiology. 2020;133:1214–1222.
- Farag E, Makarova N, Argalious M, et al. Vasopressor infusion during prone spine surgery and acute renal injury: a retrospective cohort analysis. Anesth Analg. 2019;129:896–904.
- Ducrocq N, Kimmoun A, Furmaniuk A, et al. Comparison of equipressor doses of norepinephrine, epinephrine, and phenylephrine on septic myocardial dysfunction. Anesthesiology. 2012;116:1083–1091.
- Morelli A, Ertmer C, Rehberg S, et al. Phenylephrine versus norepinephrine for initial hemodynamic support of patients with septic shock: a randomized, controlled trial. Crit Care. 2008;12:R143.
- Reinelt H, Radermacher P, Kiefer P, et al. Impact of exogenous beta-adrenergic receptor stimulation on hepatosplanchnic oxygen kinetics and metabolic activity in septic shock. Crit Care Med. 1999;27:325–331.
- Dellinger RP, Levy MM, Carlet JM, et al. International Surviving Sepsis Campaign Guidelines C, American Association of Critical-Care N, American College of Chest P, American College of Emergency P, Canadian Critical Care S, European Society of Clinical M, Infectious D, European Society of Intensive Care M, European Respiratory S, International Sepsis F, Japanese Association for Acute M, Japanese Society of Intensive Care M, Society of Critical Care M, Society of Hospital M, Surgical Infection S, World Federation of Societies of I, Critical Care M: Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med. 2008;36:296–327.
- Mets B: Should norepinephrine, rather than phenylephrine, be considered the primary vasopressor in anesthetic practice? Anesth Analg. 2016;122:1707–1714.
- Owen VS, Rosgen BK, Cherak SJ, et al. Adverse events associated with administration of vasopressor medications through a peripheral intravenous catheter: a systematic review and meta-analysis. Crit Care. 2021;25:146.
- Pancaro C, Shah N, Pasma W, et al. Risk of major complications after perioperative norepinephrine infusion through peripheral intravenous lines in a multicenter study. Anesth Analg. 2019;131:1060–1065.
- Turan A, Chang C, Cohen B, et al. Incidence, severity, and detection of blood pressure perturbations after abdominal surgery: a prospective blinded observational study. Anesthesiology. 2019;130:550–559.
- Futier E, Lefrant JY, Guinot PG, et al. Effect of individualized vs standard blood pressure management strategies on postoperative organ dysfunction among high-risk patients undergoing major surgery: a randomized clinical trial. JAMA. 2017;318:1346–1357.


 Issue PDF
Issue PDF