Reproducido y modificado con permiso. Lee LA, Caplan RA, Stephens LS, Posner KL, Terman GW, Voepel-Lewis T, Domino KB. Depresión respiratoria postoperatoria inducida por opioides: análisis de las reclamaciones cerradas. Anestesiología 2015;122:659-65.
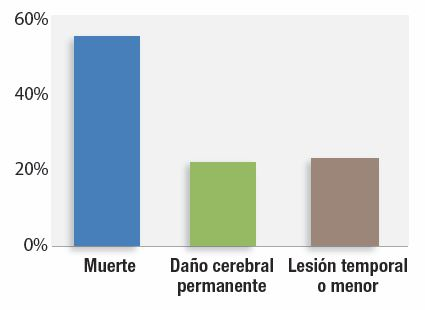
Figura 1: Gravedad de los daños en 92 reclamaciones asociadas a disfunción ventilatoria inducida por opioides postoperatorios del Closed Claims Project.
La disfunción ventilatoria postoperatoria inducida por opioides (OIVI) es una causa prevenible de daños de alta gravedad en los pacientes, y muchas organizaciones se han centrado en este problema de seguridad del paciente en las dos últimas décadas. El progreso ha sido lento en este campo porque la baja incidencia de estos episodios dificulta la investigación del desenlace en intervenciones concretas. El Anesthesia Closed Claims Project, para estudiar estos infrecuentes episodios, examina rigurosamente los factores asociados a las reclamaciones cerradas de negligencia en la anestesia, de aseguradoras de responsabilidad profesional que cubren aproximadamente a un tercio de los anestesistas de EE. UU. Dicho proyecto identificó 92 reclamaciones por OIVI.1 Su metodología no identificó los casos en que: no hubo daños derivados de una incidencia respiratoria y no se presentó reclamación (p. ej., un rescate y rápido con naloxona); se diagnosticó erróneamente la causa de la muerte o de la lesión cerebral; los abundantes casos que no se consideraron en un contexto medicolegal,2 ni los cubiertos por aseguradoras de responsabilidad profesional ajenas al Closed Claims Project. En más de 3/4 de estas 92 reclamaciones por OIVI se produjeron muerte o lesión cerebral permanente (Figura 1).1
Dada la gravedad de las lesiones relacionadas con esta complicación, muchas organizaciones institucionales, profesionales y de establecimiento de normas han elaborado pautas de mejor control postoperatorio de los pacientes de alto riesgo que reciben opioides en el postoperatorio. Estas pautas incluyen intervenciones como controles de evaluación más intensos a intervalos más cortos, capnografía y/o pulsioximetría continuas con alarmas centralizadas y tecnologías recientes, como la impedancia eléctrica para controlar la ventilación/minuto.3,4 Estas recomendaciones son un comienzo lógico para este complejo problema; sin embargo, no es fácil identificar a todos los pacientes con alto riesgo de OIVI. Los estudios publicados sobre este tema, con diferentes metodologías y bases de datos, identifican numerosos factores de riesgo de OIVI postoperatoria, como edad avanzada, sexo femenino, obesidad, bajo peso, apnea del sueño, insuficiencia renal, afecciones cardiacas, EPOC, afecciones neurológicas, diabetes, hipertensión, uso crónico preoperatorio de opioides y cirugía de las vías aéreas.5-9 2/3 de las 92 reclamaciones asociadas con la depresión respiratoria inducida por opioides postoperatorios en el Closed Claims Project se asociaron a la obesidad, aunque en un 63 % se clasificaron como relativamente sanos con estado físico ASA 1-2.1 Cada vez se identifican y se asocian a la OIVI más polimorfismos genéticos concretos que alteran el metabolismo y el transporte de los opioides.7,10,11 Claramente, muchos de estos factores de riesgo quedan sin diagnosticar, lo que reduce la precisión de cualquier lista de control de los posibles factores de riesgo. Además, las complicaciones postoperatorias que pueden surgir, como la sepsis, la lesión renal aguda, la neumonía, el delirio, etc. pueden influir en la susceptibilidad del paciente a la OIVI.
Los factores de riesgo exógenos de esta complicación dependen de las prácticas y normas de los profesionales y las instituciones, y son tan importantes como las condiciones preexistentes de los pacientes. Los factores de riesgo citados incluyen la anestesia general en comparación con la neuroaxial, la administración preoperatoria de oxicodona o gabapentina de acción prolongada, la infusión continua de opioides en el postoperatorio, la administración concomitante de otros sedantes no opioides, múltiples tratantes postoperatorios y la formación inadecuada del proveedor de atención sobre indicios y síntomas de la OIVI.1,12-14 Estos factores de riesgo exógenos dependen en gran medida de la habilidad, la experiencia y la formación de los profesionales implicados en la atención del paciente durante su ingreso, así como de la integración y comunicación entre todos los profesionales, sobre todo cuando se instituyen nuevas directrices. Los recursos institucionales, como la proporción entre personal de enfermería y pacientes en planta, la formación continuada en los indicios y síntomas de la OIVI de todos los profesionales, la informatización de los pedidos, el control electrónico mejorado con alarmas centralizadas y las políticas institucionales sobre gestión del dolor son otras variables que pueden influir en la incidencia de esta complicación.
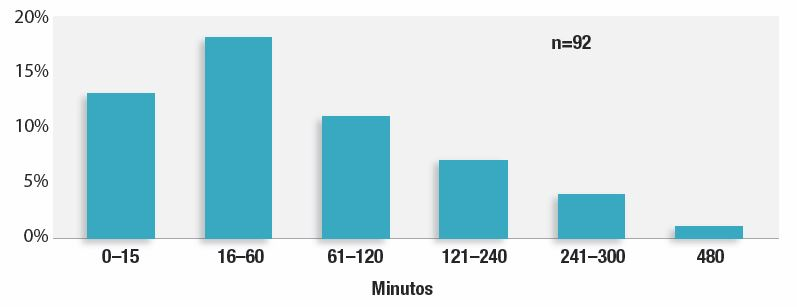
Dada esta extensa lista de factores conocidos y desconocidos que influyen en la OIVI postoperatoria, los profesionales e instituciones no pueden identificar con precisión a todos los pacientes que puedan sufrirla. A medida que envejece la población, aumentan la obesidad y el consumo de opioides y en los hospitales se tratan enfermedades más graves que en el pasado, es probable que la mayoría de los pacientes presente al menos uno de estos factores de riesgo de OIVI. La recomendación de la APSF y otras organizaciones de controlar electrónica y continuamente a todos los pacientes a los que se administren opioides postoperatorios mitigaría el daño atribuible a los factores de riesgo sin diagnosticar del paciente y a los variables del profesional e institucionales.15 Evitaría confusiones en la identificación de pacientes de alto riesgo y fomentaría la estandarización de la atención postoperatoria de todos los pacientes. Como el personal de enfermería atiende a más pacientes, el control electrónico continuo con alarmas centralizadas resultaría más objetivo y continuado. Nuestro estudio demostró que en casi un 1/3 de las 92 reclamaciones asociadas a la OIVI postoperatoria, la OIVI crítica se produjo en un plazo de una hora tras el último control de enfermería, y en el 42 %, en un plazo de dos horas (Figura 2).1 Las condiciones cambiantes del paciente y la formación inadecuada del personal en los indicios y síntomas de la OIVI contribuyeron a estos hallazgos. El breve tiempo transcurrido demuestra que las evaluaciones físicas de enfermería en planta no bastan para detectar la OIVI cuando se atiende a más de un paciente a la vez.
Reproducido y modificado con permiso. Lee LA, Caplan RA, Stephens LS, Posner KL, Terman GW, Voepel-Lewis T, Domino KB. Depresión respiratoria postoperatoria inducida por opioides: análisis de las reclamaciones cerradas. Anestesiología 2015;122:659-65.
Figura 2: Tiempo transcurrido entre el último control de enfermería y el descubrimiento de la disfunción ventilatoria inducida por opioides en 92 reclamaciones.No se muestran las reclamaciones con intervalo desconocido o no aplicable (3, en domicilio). Tiempo transcurrido entre el último control de enfermería y el descubrimiento de la disfunción ventilatoria inducida por opioides en 92 reclamaciones.No se muestran las reclamaciones con intervalo desconocido (39) o no aplicable (3, en domicilio).
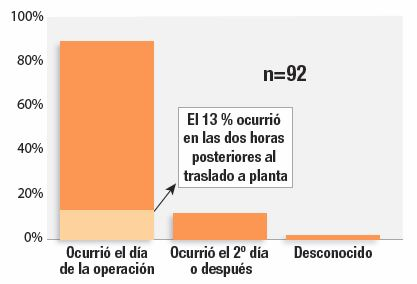
El periodo crítico del control postoperatorio electrónico continuo consta principalmente de las 24 horas siguientes a la cirugía, ya que los datos del Closed Claims Project demuestran que el 88 % de estos episodios ocurrió dentro de ese intervalo (Figura 3).1 El paso de la zona más ruidosa y de alta estimulación de la sala de recuperación, con una relación de personal de enfermería y pacientes 1:1 o 1:2, a la planta, donde los pacientes tendrán menos estimulación y un control menos intenso, es un periodo de alto riesgo. Nuestro estudio reveló que el 13 % de estas OIVI ocurrieron en las dos horas posteriores al traslado a planta. Estos hallazgos coinciden con los de otros estudios, que determinan que las 24 horas iniciales son el periodo de mayor riesgo de OIVI postoperatoria.16-18
Reproducido y modificado con permiso. Lee LA, Caplan
RA, Stephens LS, Posner KL, Terman GW, Voepel-Lewis T, Domino KB. Depresión respiratoria postoperatoria inducida por opioides: análisis de las reclamaciones cerradas. Anestesiología 2015;122:659-65.
Figura 3: Intervalo postoperatorio de la depresión respiratoria inducida por opioides en 92 reclamaciones del Closed Claims Project.
Por último, el control electrónico continuo con alarmas centralizadas podría teóricamente alertar de otras complicaciones postoperatorias en ciernes que pueden alterar las frecuencias cardiopulmonares y la saturación de oxígeno, como la sepsis, el shock hipovolémico, la neumonía y otras enfermedades. Taenzer y su equipo lograron demostrar este concepto al instituir el control electrónico con pulsioximetría continua y alarmas centralizadas.19,20 Observaron una notable reducción en los traslados de planta a UCI del 50 %, una reducción de los rescates del 60 % respecto a la media y una menor mortalidad asociada a los opioides. El rendimiento de la inversión también fue considerable, con un ahorro estimado de $1,48 millones por la reducción de las transferencias a UCI en su unidad de estudio inicial.21 Esta cifra no incluye la reducción potencial de los gastos de por vida de los pacientes derivada de la reducción de la morbilidad, ni de la defensa medicolegal institucional. Los datos de las 24 horas y posteriores podrían emplearse para determinar cuándo desconectar a un paciente del control electrónico continuo.
En resumen, la estratificación del riesgo de OIVI es importante para la gestión perioperatoria de anestésicos y medicación, pero no es posible con alta fiabilidad. La consideración exclusiva de enfermedades y dolencias preexistentes del paciente para asignarle control electrónico continuo postoperatorio demuestra lo erróneo del énfasis que da el entorno de atención (profesionales e instituciones) a la desigual clasificación de los pacientes por propensión a la OIVI. Un control electrónico continuo de la oxigenación y/o ventilación de todos los pacientes postoperatorios que reciben opioides durante al menos las primeras 24 horas simplificaría y estandarizaría la atención postoperatoria, y podría reducir tanto la incidencia de OIVI postoperatoria como otras complicaciones. En instituciones de recursos limitados, los esfuerzos control para la detección de la OIVI pueden centrarse en los factores de riesgo del paciente, pero las organizaciones deben aspirar a controlar a todos los pacientes que reciben opioides postoperatorios.
La Dra. Lee pertenece al consejo editorial del Boletín informativo de APSF y es anestesióloga de plantilla de Premier Anesthesia en Kadlec Regional Medical Center en Richland, WA.
La Dra. Posner ocupa actualmente la cátedra de Research, y Laura Cheney, la de Anesthesia Patient Safety, en el Department of Anesthesiology and Pain Medicine de la University of Washington (Seattle, WA).
La Dra. Domino es catedrática de Anesthesiology en la University of Washington (Seattle, WA).
Referencias
- Lee LA, Caplan RA, Stephens LS, et al. Depresión respiratoria postoperatoria inducida por opioides: análisis de las reclamaciones cerradas. Anesthesiology 2015;122:659–65.
- Localio AR, Lawthers AG, Brennan TA, et al. Relation between malpractice claims and adverse events due to negligence. Results of the Harvard Medical Practice Study III. N Engl J Med 1991;325:245–51.
- Joint Commission Enhances Pain Assessment and Management Requirements for Accredited Hospitals. The Joint Commission Perspectives 2017;37:1-4. Available at https://www.jointcommission.org/assets/1/18/Joint_Commission_Enhances_Pain_Assessment_and_Management_Requirements_for_Accredited_Hospitals1.PDF Accessed Dec 3, 2017.
- Center for Clinical Standards and Quality/Survey & Certification Group. Memorandum for requirements for hospital medication administration, particularly intravenous (IV) medications and post-operative care of patients receiving IV opioids. Center for Medicare and Medicaid Services. March 14, 2014. https://www.cms.gov/Medicare/Provider-
Enrollment-and-Certification/SurveyCertificationGenInfo/Downloads/Survey-and-Cert-Letter-14-15.pdf. Accessed Dec 3, 2017. - Gupta K, Prasad A, Nagappa M, et al. Risk factors for opioid-induced respiratory depression and failure to rescue: a review. Curr Opin Anaesthesiol 2018;31:110-119.
- Khelemsky Y, Kothari R, Campbell N, et al. Incidence and demographics of post-operative naloxone administration: a 13-year experience at a major tertiary teaching institution. Pain Physician 2015;18:E827–9.
- Niesters M, Overdyk F, Smith T, et al. Opioid-induced respiratory depression in paediatrics: a review of case reports. Br J Anaesth 2013;110:175–82.
- Chidambaran V, Olbrecht V, Hossain M, et al. Risk predictors of opioid-induced critical respiratory events in children: naloxone use as a quality measure of opioid safety. Pain Med 2014;15:2139–49.
- Pawasauskas J, Stevens B, Youssef R, et al. Predictors of naloxone use for respiratory depression and oversedation in hospitalized adults. Am J Health Syst Pharm 2014;71:746–50.
- Chidambaran V, Venkatasubramanian R, Zhang X, et al. ABCC3 genetic variants are associated with postoperative morphine-induced respiratory depression and morphine pharmacokinetics in children. Pharmacogenomics J 2017;17:162–169.
- Sadhasivam S, Chidambaran V, Zhang X, et al. Opioid-induced respiratory depression: ABCB1 transporter pharmacogenetics. Pharmacogenomics J2015;15:119–26.
- Weingarten TN, Jacob AK, Njathi CW, et al. Multimodal analgesic protocol and postanesthesia respiratory depression during phase 1 recovery after total joint arthroplasty. Reg Anesth Pain Med 2015;40:330–6.
- Cavalcante AN, Sprung J, Schroeder DR, et al. Multimodal analgesic therapy with gabapentin and its association with postoperative respiratory depression. Anesth Analg 2017;125:141–146.
- George JA, Lin EE, Hanna MN, et al. The effect of intravenous opioid patient-controlled analgesia with and without background infusion on respiratory depression: a meta-analysis. J Opioid Manag 2010;6:47–54.
- Stoelting RK and Overdyk FJ for the Anesthesia Patient Safety Foundation. Conclusions and Recommendations from the June 8, 2011, Conference on Electronic Monitoring Strategies (Essential Electronic Monitoring Strategies to Detect Clinically Significant Drug-Induced Respiratory Depression in the Postoperative period). Available at https://www.apsf.org/initiatives.php?id=10 (last accessed Dec 3, 2017).
- Taylor S, Kirton OC, Staff I, et al. Postoperative day one: a high risk period for respiratory events. Am J Surg 2005; 190:752–6.
- Ramachandran SK, Haider N, Saran KA, et al. Life-threatening critical respiratory events: a retrospective study of postoperative patients found unresponsive during analgesic therapy. J Clin Anesth 2011;23:207–13.
- Weingarten TN, Herasevich V, McGlinch MC, et al. Predictors of delayed postoperative respiratory depression assessed from naloxone administration. Anesth Analg 2015;121:422–9.
- Taenzer AH, Pyke JB, McGrath SP, et al. Impact of pulse oximetry surveillance on rescue events and intensive care unit transfers: a before-and-after concurrence study. Anesthesiology 2010;112:282–7.
- McGrath SP, Taenzer AH, Karon N, et al. Surveillance Monitoring management for general care units: strategy, design, and implementation. Jt Comm J Qual Patient Saf 2016;42:293–302.
- Taenzer AH, Blike GT. Postoperative monitoring—the Dartmouth experience. APSF Newsletter 2012;27:1. Available at https://www.apsf.org/newsletters/html/2012/spring/01_postop.htm. Accessed Dec 4, 2017.


 Issue PDF
Issue PDF