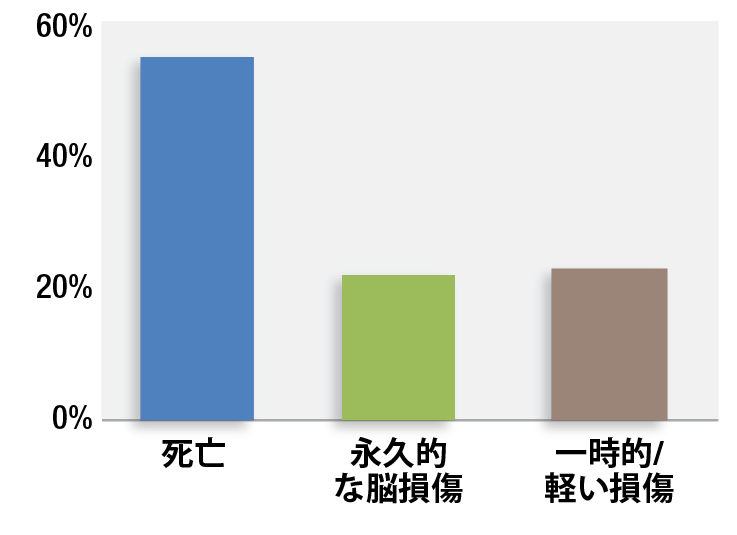
許可を得て改変、掲載。Lee LA, Caplan RA, Stephens LS, Posner KL, Terman GW, Voepel-Lewis T, Domino KB. Postoperative opioid-induced respiratory depression: a closed claims analysis. Anesthesiology 2015;122:659-65。
図 1:クローズドクレームプロジェクトからの術後オピオイド誘発性換気障害に関連した92件の傷害の重症度。
術後オピオイド誘発性換気障害(OIVI)は患者の重度障害の原因となるが予防可能であり、多くの機関がこの20年間、この患者安全の問題に取り組んできた。しかし、OIVIのような事象の発生率は低いため特定の介入に関するアウトカム研究が難しく、その取り組みは進展が遅れている。麻酔クローズドクレームプロジェクトは米国の麻酔科医の約3分の1をカバーしている專門職業賠償責任保険会社における解決済み麻酔過誤訴訟の申し立てに関連する要因を厳密に調査することによりこれらのまれな事象について研究するという手法をとっている。そのクローズドクレームプロジェクトによると92件のOIVI関連の申し立てがあった。1このプロジェクトの方法では患者に害が及ばなかった呼吸器系イベントやクレームが提出されなかった場合(例、ナロキソンによる迅速な救助が成功した)、死因や脳障害の原因に関する誤診、法医学的に追求されなかった多数の事象、2もしくはそのクローズドクレームプロジェクト外の專門職業賠償責任保険会社によりカバーされた事象は含まれない。これらの92件のOIVIの4分の3以上が死亡及び永久的な脳損傷と関与していた。(図1)1
OIVIに関連する傷害の重篤度は高いため、多くの機関、職業団体、また基準を作成する団体が術後オピオイド治療を受けているハイリスク患者の術後モニタリング強化を推奨するガイドラインを作成している。これらのガイドラインには、より短い間隔でのアセスメントチェックを増やす、集中管理されたアラーム付きの持続的なカプノグラフィーやパルスオキシメトリ、あるいはその両方の使用、電気インピーダンスにより分時換気量をモニターする機械などの新しい技術の使用などが含まれている。3,4ガイドラインのこれらの推奨事項はこの複雑な問題に対する論理的な出発点である。しかし、OIVIのハイリスク患者を同定することは簡単ではない。この話題に関する研究では異なる方法とデータベースを用いたものがあるが、術後OIVIのリスク因子として、高齢、女性、肥満、低体重、閉塞性睡眠時無呼吸症候群、腎障害、心疾患、慢性閉塞性肺疾患、神経疾患、糖尿病、高血圧、術前の慢性オピオイド使用、気道手術などが特定された。5-9クローズドクレームプロジェクトにおけるOIVI関連の92件のクレームのうちの3分の2が肥満と関連していたが、その63%がASA physical status(ASA-PS)1-2の比較的健康な患者であると分類されていた。1オピオイドの代謝及び輸送を変化させる特定の遺伝子多型は特定が進みOIVIとの関連が指摘されている。7,10,11これらのリスク要因の多くが未診断であることは明らかであり、リスクファクターのチェックリストの精度を低下させている。さらに、敗血症、急性腎障害、肺炎、せん妄などの悪化していく可能性がある術後合併症が患者のOIVIに対する感受性に影響を与える可能性もある。
外因性のリスクファクターは医療従事者と施設の治療方針に関連しており、既存の患者状態と同様に重要である。挙げられている外因性リスクファクターには脊髄くも膜下麻酔・硬膜外麻酔と比べ全身麻酔の使用、長時間作用性オキシコドン・ガバペンチンの術前投与、術後オピオイドの持続投与、非オピオイド性の鎮静薬の同時使用、術後の処方を行うものが複数いる場合、そしてOIVIの兆候や症状に関して医療従事者への不充分な教育などがある。1,12-14これらの外因性リスクファクターは、特に新しくケアガイドラインが制定された際に、入院中の患者のケアに関わる各ヘルスケア専門家のスキル、経験、教育、また全ての医療従事者間の連携とコミュニケーションに大きく依存している。この合併症の発生率に影響する可能性のある他の重要な変数として、病棟での患者と看護師の比率、全てのOIVIの兆候や症状に関する医療従事者への教育、コンピューターでの指示入力、集中管理アラーム付き電子モニタリングの強化のような施設リソースや疼痛管理の施設方針が挙げられる。
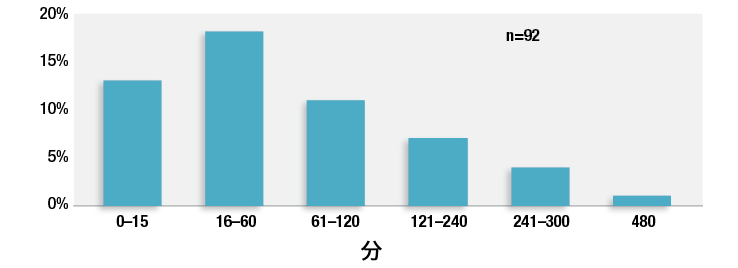
この術後OIVIの既知及び未知の寄与因子の膨大なリストをもってしても、医療従事者および医療施設はOIVIを発症する患者を全て正確に特定することはできない。集団の高齢化、肥満化、オピオイド使用の蔓延が進行し続け、病院では以前よりも重症度の高い患者の治療を行っている現在では、患者の大多数がこれらのOIVIリスク要因を1つ以上有する可能性は高い。APSFやその他の機関による、術後オピオイド治療を受けている全ての患者に対する継続的な電子的モニタリングの実施の推奨によって、診断されていない患者のリスクファクター、様々な医療従事者や施設に起因するリスクファクターが原因のOIVIの発生は低減されるだろう。15こういった推奨により、ハイリスク患者の同定を行う必要がなくなり、また全ての患者に対し術後ケアの標準化が促進されるはずだ。看護師がより多くの患者をケアするようになってきていることから、集中管理アラーム付きの電子的な持続モニタリング装置を使用することによって、より客観的で継続的な患者モニタリングが可能になるであろう。私達の研究において、術後OIVIに関連した92件の申し立てのほぼ3分の1で最後の看護師によるチェックから1時間以内に重篤なOIVI事象が発見されており、最後の看護師によるチェックから2時間以内のものが42%であるとわかった。(図2)1 患者の状態の変動やOIVIの兆候や症状に関しての看護師に対する不十分な教育のためこのような結果となった。この一時間以内という時間から、病棟で看護師が一人で複数の患者に同時にケアを行っていると患者の身体的看護アセスメントを行ってもOIVIを発見するのが難しいということがわかる。
許可を得て改変、掲載。Lee LA, Caplan RA, Stephens LS, Posner KL, Terman GW, Voepel-Lewis T, Domino KB。Postoperative opioid-induced respiratory depression: a closed claims analysis。Anesthesiology 2015;122:659-65。
図2:92件の申し立てにおける、最後の看護師によるチェックとオピオイド誘発性換気障害の発見までの間の時間について。タイミングが不明であるクレーム(n = 39)と該当なし(自宅, n = 3)は含まない。
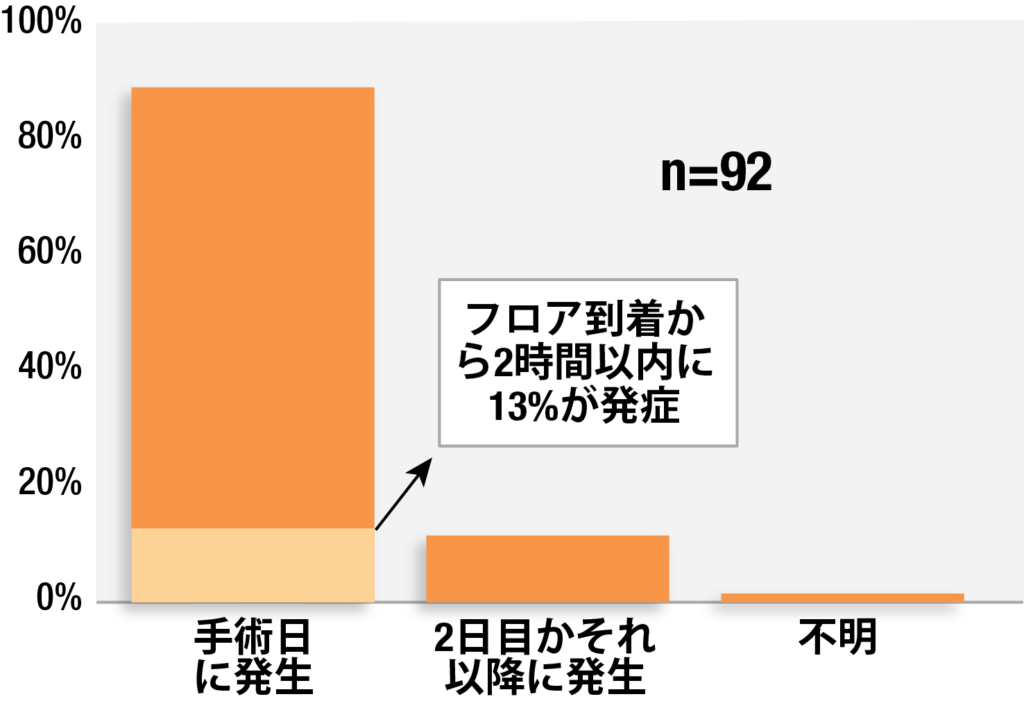
術後の電子モニタリングの継続使用を行うのに重要な期間は主に術後24時間以内であり、クローズドクレームプロジェクトによればOIVIの88%がその期間内に発生している。(図3)1 看護師患者比率が1:1あるいは1:2であり、より騒がしく刺激の強い回復室エリアから、患者が受ける刺激が低くモニタリングも不十分な病棟への移動する頃合いがハイリスクである。私達の研究ではこれらのOIVI事象の13%が病棟への移動から2時間以内に発生している。これらの所見は、最初の24時間が術後患者のOIVIの最も高いリスク期間である、という他の研究とも一致している。16-18
許可を得て改変、掲載。Lee LA, Caplan RA, Stephens LS, Posner KL, Terman GW, Voepel-Lewis T, Domino KB。Postoperative opioid-induced respiratory depression: a closed claims analysis。Anesthesiology 2015;122:659-65。
図3:クローズドクレームプロジェクトからの92件の申し立てにおけるオピオイド誘発性呼吸抑制の術後タイミング。
最後に、集中管理アラーム付きの持続的電子モニタリングは理論的に、敗血症、血液量減少ショック、肺炎、その他の疾患のような、呼吸、心拍数、酸素飽和度を変化させる可能性のある術後合併症を医療従事者に警告する事が可能である。Taenzerらは集中管理アラーム付き継続パルスオキシメトリを用いた電子サーべイランスを行い、この概念の実証に成功した。19,20その研究では、病棟からのICU転棟が50%低減し、救急救命イベントにおいてはベースラインから60%も減少させ、オピオイド関連の原因による死亡率は減少した。 医療経済的な効果も非常に高く、彼らの当初の研究の範囲内だけでもICU転送減少により1.48万ドルの節約が見込まれている。21この数字は罹患率の減少による患者の生涯にかかる費用の潜在的削減、また医療機関の被訴訟率減少による費用削減を考慮していない。最初の24時間とその後のデータを使用することでいつ患者の持続的電子モニタリングの程度を下げていくのかを決定する事ができる。
要約すると、OIVIのリスク階層化は周術期の麻酔薬およびその他の服用薬の管理にとって重要であるが、それを行うには高い信頼性が必要である。どの患者が術後に持続的電子モニタリングを必要としているかを特定するのに既存の患者状態と疾患のみを利用する、という考え方は、OIVI発症において医療提供の状況(医療従事者や施設)が患者に与える重要な影響は様々であるということを否定するものである。オピオイド治療を受けた全ての術後患者に対する少なくとも最初の24時間の酸素供給または換気、あるいはその両方の持続的な電子モニタリングを行うことが術後ケアを簡素化、標準化し、術後OIVIの発症とその他の合併症を低減する可能性がある。リソースが限られた施設でのOIVI患者モニタリングを促進する初期の取り組みは患者のリスクファクターに焦点を当てる可能性があるが、ガイドラインを定める機関としては術後オピオイド治療を受ける全ての患者をモニタリングするという究極の目標を目指すべきである。
Dr. LeeはAPSF ニュースレターの編集委員メンバーでありワシントン州リッチランドのカドレックリージョナルメディカルセンターのプレミア麻酔の麻酔科医スタッフである。
Dr. Posnerは現在、研究教授であり、ワシントン州シアトルのワシントン大学の麻酔科疼痛医学科の麻酔患者安全の Laura Cheney 教授である。
Dr. Dominoはワシントン州シアトルのワシントン大学の麻酔学教授である。
参考文献
- Lee LA, Caplan RA, Stephens LS, et al.Postoperative opioid-induced respiratory depression: a closed claims analysis. Anesthesiology 2015;122:659–65.
- Localio AR, Lawthers AG, Brennan TA, et al.Relation between malpractice claims and adverse events due to negligence.Results of the Harvard Medical Practice Study III. N Engl J Med 1991;325:245–51.
- Joint Commission Enhances Pain Assessment and Management Requirements for Accredited Hospitals.The Joint Commission Perspectives 2017;37:1-4.Available at https://www.jointcommission.org/assets/1/18/Joint_Commission_Enhances_Pain_Assessment_and_Management_Requirements_for_Accredited_Hospitals1.PDF Accessed Dec 3, 2017.
- Center for Clinical Standards and Quality/Survey & Certification Group.Memorandum for requirements for hospital medication administration, particularly intravenous (IV) medications and post-operative care of patients receiving IV opioids. Center for Medicare and Medicaid Services. March 14, 2014. https://www.cms.gov/Medicare/Provider- Enrollment-and-Certification/SurveyCertificationGenInfo/Downloads/Survey-and-Cert- Letter-14-15.pdf. Accessed Dec 3, 2017.
- Gupta K, Prasad A, Nagappa M, et al. Risk factors for opioid-induced respiratory depression and failure to rescue: a review. Curr Opin Anaesthesiol 2018;31:110-119.
- Khelemsky Y, Kothari R, Campbell N, et al. Incidence and demographics of post-operative naloxone administration: a 13-year experience at a major tertiary teaching institution. Pain Physician 2015;18:E827–9.
- Niesters M, Overdyk F, Smith T, et al. Opioid-induced respiratory depression in paediatrics: a review of case reports. Br J Anaesth 2013;110:175–82.
- Chidambaran V, Olbrecht V, Hossain M, et al. Risk predictors of opioid-induced critical respiratory events in children: naloxone use as a quality measure of opioid safety. Pain Med 2014;15:2139–49.
- Pawasauskas J, Stevens B, Youssef R, et al. Predictors of naloxone use for respiratory depression and oversedation in hospitalized adults. Am J Health Syst Pharm 2014;71:746–50.
- Chidambaran V, Venkatasubramanian R, Zhang X, et al.ABCC3 genetic variants are associated with postoperative morphine-induced respiratory depression and morphine pharmacokinetics in children. Pharmacogenomics J 2017;17:162–169.
- Sadhasivam S, Chidambaran V, Zhang X, et al. Opioid-induced respiratory depression: ABCB1 transporter pharmacogenetics. Pharmacogenomics J2015;15:119–26.
- Weingarten TN, Jacob AK, Njathi CW, et al. Multimodal analgesic protocol and postanesthesia respiratory depression during phase 1 recovery after total joint arthroplasty. Reg Anesth Pain Med 2015;40:330–6.
- Cavalcante AN, Sprung J, Schroeder DR, et al. Multimodal analgesic therapy with gabapentin and its association with postoperative respiratory depression. Anesth Analg 2017;125:141–146.
- George JA, Lin EE, Hanna MN, et al.The effect of intravenous opioid patient-controlled analgesia with and without background infusion on respiratory depression: a meta-analysis. J Opioid Manag 2010;6:47–54.
- Stoelting RK and Overdyk FJ for the Anesthesia Patient Safety Foundation.Conclusions and Recommendations from the June 8, 2011, Conference on Electronic Monitoring Strategies (Essential Electronic Monitoring Strategies to Detect Clinically Significant Drug-Induced Respiratory Depression in the Postoperative period).Available at https://www.apsf.org/initiatives.php?id=10 (last accessed Dec 3, 2017).
- Taylor S, Kirton OC, Staff I, et al. Postoperative day one: a high risk period for respiratory events. Am J Surg 2005; 190:752–6.
- Ramachandran SK, Haider N, Saran KA, et al. Life-threatening critical respiratory events: a retrospective study of postoperative patients found unresponsive during analgesic therapy. J Clin Anesth 2011;23:207–13.
- Weingarten TN, Herasevich V, McGlinch MC, et al. Predictors of delayed postoperative respiratory depression assessed from naloxone administration. Anesth Analg 2015;121:422–9.
- Taenzer AH, Pyke JB, McGrath SP, et al. Impact of pulse oximetry surveillance on rescue events and intensive care unit transfers: a before-and-after concurrence study. Anesthesiology 2010;112:282–7.
- McGrath SP, Taenzer AH, Karon N, et al. Surveillance Monitoring management for general care units: strategy, design, and implementation. Jt Comm J Qual Patient Saf 2016;42:293–302.
- Taenzer AH, Blike GT. Postoperative monitoring—the Dartmouth experience. APSF Newsletter 2012;27:1. Available at https://www.apsf.org/newsletters/html/2012/spring/01_postop.htm.Accessed Dec 4, 2017.


 Issue PDF
Issue PDF