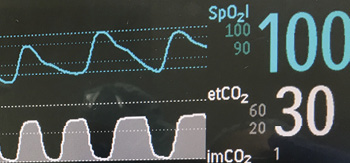
Figure 1: Representaciones de ondas continuas de pulsioximetría y capnografía
En 2006 y 2011, la Anesthesia Patient Safety Foundation (APSF) convocó conferencias multidisciplinarias para abordar el grave problema para la seguridad del paciente de la disfunción ventilatoria inducida por opioides (OIVI).1 Dada la importancia del problema, y que no existe un mejor control para la detección de episodios adversos asociados a la OIVI, en el congreso de 2011 se acordó recomendar, hasta que existan controles mejores, la pulsioximetría continua (preferiblemente con alarmas centralizadas y sistemas de aviso) para controlar a los pacientes que no reciban oxígeno suplementario, y el control de ventilación (capnografía), para aquellos pacientes que la reciban.
A 2017, y en el contexto del debate nacional en torno a la crisis de los opioides, es más relevante que nunca revisar el estado actual del control preventivo de la OIVI y proporcionar recomendaciones empíricas actualizadas.
Incidencia de la disfunción ventilatoria inducida por opioides
Desde hace mucho, supone un desafío medir con precisión la incidencia de OIVI y la ventaja de seguridad de un nuevo protocolo o tecnología de control. La taxonomía incoherente de la depresión respiratoria en la literatura dificulta los estudios comparativos.2 Las diferentes definiciones utilizadas para identificar la depresión respiratoria obstaculizan la determinación de la incidencia real. Entre los nombres alternativos de la depresión respiratoria se encuentran hipoxemia, hipopnea, hipoventilación hipercápnica, reducción de la frecuencia respiratoria y baja ventilación/minuto.2 La caracterización de la hipoxemia en la literatura varía del 80 al 94 % de SpO2.3 Con el obstáculo de la variedad de mediciones de la depresión respiratoria, la incidencia de OIVI se encuentra entre el 0,15 y el 1,1 % de los pacientes posquirúrgicos.3-8 Aunque las estimaciones de la incidencia de OIVI varían según la definición empleada, los estudios recientes continúan cifrando su incidencia en este mismo intervalo.2 Parece evidente que es necesario estandarizar la taxonomía y las mediciones del desenlace de la depresión respiratoria para que la investigación centrada en la reducción del riesgo pueda avanzar significativamente. Además de determinar qué controlar, debemos decidir cuándo realizar el control (tratado en un artículo complementario, en la página Debemos centrarnos en cuándo y a quién controlar en busca de disfunción ventilatoria inducida por opioides (OIVI) postoperatoria, así como las herramientas apropiadas para reducir la incidencia de OIVI.
Cuándo realizar el control
La somnolencia y la sedación son los precursores más habituales de la OIVI.2,9 El control periódico por parte del personal de enfermería es actualmente el principal control de este fenómeno. Para determinar la frecuencia necesaria de la evaluación de enfermería se debe hallar un equilibrio entre los mínimos de interrupción del paciente, interferencia con el flujo de trabajo de enfermería y gastos de personal. En los pacientes postoperatorios, las cuatro primeras horas tras la salida de la UCPA son el periodo asociado a las tasas más altas de sedación, y en las 12 primeras horas tras la cirugía se da más de la mitad de los episodios de OIVI. Además, el 75 % de los episodios de OIVI ocurren en las 24 horas siguientes a la cirugía.2 Dado el margen temporal de la OIVI postoperatoria, es probable que un mayor énfasis en el control en las primeras 24 horas sea útil para reducir los episodios adversos de los opioides.
En 2014, los Centros de Servicios de Medicare y Medicaid (CMS) actualizaron sus recomendaciones de administración hospitalaria de opioides para incluir series de evaluación de enfermería con tensión arterial, temperatura, pulso, frecuencia respiratoria, nivel de dolor, estado respiratorio y nivel de sedación.10 Sin embargo, no se establece la frecuencia óptima de las evaluaciones y probablemente dependa de diversos factores como el tipo de dolor y la adecuación de su alivio inicial, la presencia de efectos secundarios, la comorbilidad y los cambios en el estado clínico. Para los pacientes que reciben opioides neuroaxiales, la American Society of Anesthesiologists Task Force on Neuraxial Opioids y la American Society of Regional Anesthesia and Pain Medicine sugieren controlar c/ hora durante las 12 primeras, c/ 2 horas durante las 12 siguientes y c/ 4 horas después, si no ocurren complicaciones relacionadas con los opioides.11 En contraste, un panel de expertos respaldado por los CMS recomendó para cualquier administración de opioides el control c/ 2,5 horas (margen de retrasos en la documentación) las primeras 24 horas y c/ 4,5 horas después. Sin embargo, durante una encuesta de los hospitales de los CMS, solo el 8,4 % de los pacientes con opioides IV dosificados por el paciente (PCA) cumplía el criterio de c/ 2,5 horas, y solo el 26,8 %, el menos estricto, c/ 4,5 horas.12 Dadas las variaciones en las recomendaciones de control en función de cada organización, de los factores de riesgo del paciente, de los planes de anestesia, del tratante, de la formación del personal de enfermería en OIVI y de la proporción entre personal y pacientes, es probable que el control electrónico continuo postoperatorio de todos los pacientes que reciban opioides simplifique la atención y mejore la detección de la OIVI.
Cómo controlar a los pacientes: Sistemas de control y alerta
Independientemente del sistema de control electrónico empleado para detectar la OIVI, se debe considerar el método de alertar a los profesionales cuando ocurran estos episodios para garantizar un sistema eficaz. Es imprescindible establecer alertas de control de base empírica útiles para detectar la OIVI. Unos umbrales de alerta inadecuados provocan la fatiga por exceso de alarmas, la irritación del paciente y el personal, y la complacencia; combinados pueden hacer ineficaz el mejor sistema de control.2
Lo idóneo es que los sistemas de control combinen múltiples parámetros para detectar cualquier indicio de depresión respiratoria que surja y emplear combinaciones de medidas para identificar exactamente la inminencia del episodio. Antes, las alarmas de umbral eran simplistas y propensas a errores.
La pulsioximetría es el control de depresión respiratoria más utilizado actualmente en los sistemas hospitalarios. Sin embargo, las alarmas de umbral de la pulsioximetría suelen ser las más problemáticas. Un umbral demasiado alto conduce a falsos positivos frecuentes, y demasiado bajo, a respuestas tardías a la depresión respiratoria. La administración de oxígeno suplementario dificulta el control, ya que puede retrasar la detección de la depresión ventilatoria y deprimir aún más el impulso respiratorio hipóxico.13
La capnografía aislada también tiene limitaciones. La capnografía suele ser cualitativa y no cuantitativa en pacientes no intubados, con lo que indica la presencia de dióxido de carbono durante la ventilación normal, los cambios relativos en el dióxido de carbono exhalado y cierta información sobre la RR. Sin embargo, la detección de aumentos o reducciones en los valores de CO2 puede ser problemática e inexacta. Aun así, la capnografía puede ser útil para controlar la frecuencia respiratoria, ya que la periodicidad de la exhalación de CO2 y la caída a cero en la inhalación delimitan claramente el ciclo respiratorio. Los umbrales superiores de la frecuencia respiratoria también se pueden usar con capnografía para detectar la hiperventilación.
La combinación de la frecuencia respiratoria con la oximetría y la capnografía proporciona información adicional para detectar la OIVI y otros procesos mórbidos (Figura 1). Curry et al.14 describen tres patrones de depresión respiratoria resultantes en muerte inesperada. El tipo I es una disnea compensada por hiperventilación (p. ej., por sepsis, embolia pulmonar o insuficiencia cardiaca congestiva). En el tipo I, los pacientes empiezan con una saturación de oxígeno estable y una disminución de PaCO2 a medida que se produce la acidosis metabólica y comienza la hiperventilación compensatoria. La frecuencia respiratoria (RR) alta es característica de este tipo de insuficiencia respiratoria. Finalmente, una desaturación lenta precede a una reducción precipitada de SpO2 cuando falla la respuesta ventilatoria al empeoramiento de la acidosis. Casi todos los controles actuales tienen alarmas de RR baja, pero no necesariamente de RR alta, o bien el ajuste alto detecta el fallo respiratorio demasiado tarde. El tipo II de depresión respiratoria es una hipoventilación unidireccional progresiva o un episodio de narcosis de CO2 . En este caso, frecuentemente por la sobredosis de opioides u otro sedante, aumenta el nivel de PaCO2 (y EtCO2), por la disminución inicial de la ventilación/minuto, a menudo mientras la SpO2 es aún >90 %. El tipo III de depresión respiratoria es una FF rápida o una reducción de la saturación de oxígeno con caída precipitada del SpO2 que se puede observar en pacientes con apnea del sueño. En esta situación, el paciente depende de la estimulación para mantener la oxigenación. Si fracasa la estimulación, durante la apnea se desarrolla una hipoxemia precipitada que puede provocar una parada repentina.
Actualmente no existe un sistema de control único ni unos umbrales de alarma que detecten todos los patrones respiratorios que resultan en episodios de muerte inesperados. La sensibilidad general a los episodios inminentes se puede aumentar mediante múltiples controles para detectar patrones cambiantes.
Nuevas tecnologías de control y algoritmos de alerta
Como se expone anteriormente, los profesionales se enfrentan a muchas limitaciones en el control frecuente y constante necesario para detectar con precisión los eventos adversos, y las alarmas de un solo control son limitadas. Se están realizando esfuerzos para desarrollar y homologar nuevos controles con sistemas de alerta inteligentes.
Los algoritmos que combinan parámetros fisiológicos para producir un único umbral de “superfusión” pueden aumentar la sensibilidad de los sistemas de umbral y evitar falsas alarmas. Un ejemplo es Modified Early Warning Score (MEWS).14 MEWS es una alarma de umbral aditiva simple que combina varios controles en un solo número para documentación y alertas. Los futuros algoritmos inteligentes deberán analizar los patrones de cambio con combinaciones de signos vitales en lugar de sumar umbrales de diversos controles. Estos sistemas deben predecir la depresión respiratoria inminente antes del episodio, lo que permite respuestas tempranas y menor morbilidad.
Los sistemas integrados de control y administración de fármacos, como la capnografía y la pulsioximetría en combinación con dispositivos de PCA IV, aúnan control y respuesta.15 Un control que puede integrar múltiples sensores y, mediante un algoritmo de reconocimiento de patrones, detectar indicios tempranos de depresión respiratoria, puede bloquear la administración de opioides y alertar al personal médico.16
La RR se puede medir durante la capnografía con cambios en el flujo de aire de la línea de muestreo de CO2 . Sin embargo, también se han evaluado métodos alternativos para detectar la RR. El control acústico, al no exigir contacto directo con el paciente, resulta atractivo, Particularmente en pediatría, ya que puede ser difícil mantener una línea de muestreo en un niño.17 Sin embargo, en el control acústico actual abundan los errores que causan fatiga por exceso de alarmas.18 Se están evaluando sistemas de radar que controlan la ventilación mediante un sistema de detección instalado en la pared o el techo, pero también están limitados por errores de movimiento y falsas alarmas.19
La bioimpedancia utiliza los cambios en la conductancia eléctrica del pecho, obtenidos con electrodos de superficie, para calcular la RR, la ventilación/minuto, el volumen tidal y los episodios de apnea. Los estudios demuestran que este control del volumen respiratorio (RVM) detecta los cambios en la ventilación/minuto y la depresión respiratoria inminente más deprisa y en mayor grado que la capnografía aislada.20 Un estudio estableció que el RVM puede detectar la aparición de depresión respiratoria más de 12 minutos antes de la desaturación.21 En particular, muchos pacientes que recibieron oxígeno suplementario mostraron indicios de baja ventilación/minuto con RVM sin ninguna alarma de desaturación. Uno de los principales problemas de los controles actuales de bioimpedancia es que los electrodos de superficie adheridos al paciente deben estar conectados físicamente a un dispositivo que analiza el movimiento. Además, los movimientos no respiratorios, como la tos u otros, pueden crear señales falsas. Por último, el movimiento de la pared torácica sin intercambio de aire, como ocurre en la obstrucción de las vías respiratorias, también puede engañar a algunos dispositivos de bioimpedancia (Tabla 1).17
Tabla 1: Pros y contras del control electrónico continuo
| CONTROL | PARÁMETROS | VENTAJAS | CONTRAS |
| Pulsioximetría | SpO2 HR |
|
|
| Capnografía | EtCO2
RR |
|
|
| Combinado Umbral (MEWS) | RR HR (SBP UOP Temp Est. neur.) |
|
|
| Dispositivos integrados de administración y control | SpO2 EtCO2 RR |
|
|
| Acústico Control | RR |
|
|
| Control de radar | RR |
|
|
| Bioimpedancia | RR TV MV |
|
|
| Pletismografía de inductancia con audiometría | RR SpO2 Vía aérea Permeabilidad |
|
|
| SpO2 : saturación periférica de oxígeno HR: frecuencia cardiaca EtCO2 : dióxido de carbono al final de la espiración RR: frecuencia respiratoria PAS: tensión arterial sistólica |
UOP: producción de orina TV: volumen tidal MV: ventilación/minuto UCI: unidad de cuidados intensivos |
Los sistemas integrados más complejos, que combinan pletismografía de inductancia respiratoria con audiometría y pulsioximetría, son muy sensibles para detectar la depresión respiratoria, pero actualmente son aparatosos y difíciles de usar, detectan movimientos espurios y tienen limitaciones similares a otros dispositivos de bioimpedancia con los movimientos falsos de la pared torácica, como la tos o el llanto.17
Conclusiones: Un futuro ideal
En un futuro ideal, ningún paciente sufrirá OIVI postoperatoria. Para lograr este objetivo necesitaremos analgésicos alternativos tan eficaces como los opioides pero que no causen depresión respiratoria. Hasta entonces debemos mitigar el riesgo de los opioides que usamos actualmente. Esto se logrará mediante el uso inteligente de recursos de enfermería combinados con sistemas avanzados de control sensibles para detectar episodios respiratorios inminentes. Con vistas a este futuro, los implicados deben contribuir a delinear una taxonomía de los eventos adversos relacionados con los opioides, incluida la depresión respiratoria, con las directrices y las medidas de desenlace correspondientes.
El Dr. Gupta es profesor asociado de Anesthesiology en el Vanderbilt University Medical Center (Nashville, TN).
El Dr. Edwards es profesor asociado de Anesthesiology, Neurological Surgery en el Vanderbilt University Medical Center (Nashville, TN).
Ninguno de los autores tiene conflictos de intereses que revelar en relación con este artículo.
Referencias
- Weinger M, Lee LA. No patient shall be harmed by opioid-induced respiratory depression. APSF Newsletter 2011;26:21. Available at https://www.apsf.org/newsletters/html/2011/fall/01_opioid.htm. Accessed December 9, 2017.
- Jungquist CR, Smith K, Nicely KLW, et al. Monitoring hospitalized adult patients for opioid-induced sedation and respiratory depression. Am J Nurs 2017;117:S27–S35.
- Sun Z, Sessler DI, Dalton JE, et al. Postoperative hypoxemia is common and persistent: a prospective blinded observational study. Anesth Analg 2015;121:709–15.
- Wheatley RG, Somerville ID, Sapsford D, et al. Postoperative hypoxaemia: comparison of extradural, i.m. and patient-controlled opioid analgesia. Br J Anaesth1990;64:267–75.
- Overdyk FJ, Carter R, Maddox RR, et al. Continuous oximetry/capnometry monitoring reveals frequent desaturation and bradypnea during patient-controlled analgesia. Anesth Analg 2007;105:412–8.
- Dahan A, Aarts L, Smith TW. Incidence, reversal, and prevention of opioid-induced respiratory depression. Anesthesiology 2010;112:226-38.
- Stites M, Surprise J, McNiel J, et al. Continuous capnography reduces the incidence of opioid-induced respiratory rescue by hospital rapid resuscitation team. J Patient Saf 2017 Jul 20. doi: 10.1097/PTS.0000000000000408. [Epub ahead of print].
- Cavalcante AN, Sprung J, Schroeder DR, et al. Multimodal analgesic therapy with gabapentin and its association with postoperative respiratory depression. Anesth Analg 2017;125:141–6.
- Lee LA, Caplan RA, Stephens LS, et al. Postoperative opioid-induced respiratory depression: a closed claims analysis. Anesthesiology 2015;122:659–65.
- https://www.cms.gov/Medicare/Provider-Enrollment-and-Certification/SurveyCertificationGenInfo/Downloads/Survey-and-Cert-Letter-14-15.pdf. Accessed 12/15/17.
- Horlocker TT, Burton AW, Connis RT, et al. American Society of Anesthesiologists task force on neuraxial opioids. Practice guidelines for the prevention, detection, and management of respiratory depression associated with neuraxial opioid adminstration. Anesthesiology 2009;110:218–30.
- Jungquist CR, Correll DJ, Fleisher LA, et al. Avoiding adverse events secondary to opioid-induced respiratory depression: implications for nurse executives and patient safety. J Nurs Adm 2016;46:87–94.
- Niesters M, Mahajan RP, Aarts L, et al. High-inspired oxygen concentration further impairs opioid-induced respiratory depression. Br J Anaesth 2013;110:837–41.
- Curry JP, Lynn LA. Threshold Monitoring, Alarm fatigue, and the patterns of unexpected hospital death. APSF Newsletter 2011;26:32–5. https://www.apsf.org/newsletters/html/2011/fall/07_threshold.htm.
- Maddox RR, Williams CK. Clinical experience with capnography monitoring for pca patients. APSF Newsletter 2012; 26:47–50.
- Weininger S, Jaffe MB, Rausch T, et al. Capturing essential information to achieve safe interoperability. Anesth Analg 2017;124:83–94.
- Miller KM, Kim AY, Yaster M, et al. Long-term tolerability of capnography and respiratory inductance plethysmography for respiratory monitoring in pediatric patients treated with patient-controlled analgesia. Paediatric anaesthesia.2015;25:1054–9.
- Görges M, West NC, Christopher NA, et al. An ethnographic observational study to evaluate and optimize the use of respiratory acoustic monitoring in children receiving postoperative opioid infusions. Anesth Analg 2016;122:1132–40.
- van Loon K, Breteler MJM, van Wolfwinkel L, et al. Wireless non-invasive continuous respiratory monitoring with FMCW radar: a clinical validation study. J Clin Monit Comput 2016;30:797–805.
- Williams GW, George CA, Harvey BC, et al. A comparison of measurements of change in respiratory status in spontaneously breathing volunteers by the ExSpiron Noninvasive Respiratory Volume Monitor versus the Capnostream Capnometer.Anesth Analg 2017;124:120–6.
- Galvagno SM, Duke PG, Eversole DS, et al. Evaluation of respiratory volume monitoring (RVM) to detect respiratory compromise in advance of pulse oximetry and help minimize false desaturation alarms. J Trauma Acute Care Surg 2016;81:S162–70.


 Issue PDF
Issue PDF