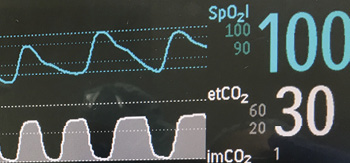
Figura 1: Representações gráfica das ondas da oximetria contínua de pulso e da capnografia.
Em 2006 e 2011, a Anesthesia Patient Safety Foundation (APSF) convocou conferências multidisciplinares para discutir o grave problema de segurança do paciente que é o Comprometimento Ventilatório Induzido por Opioides (OIVI).1 Dada a importância do problema e a inexistência de monitor ideal para a detecção de eventos adversos associados a OIVI, as recomendações de consenso dos participantes da conferência de 2011 foram de que, até existirem monitores melhores, o oxímetro de pulso contínuo (de preferência com alarmes centralizados e sistemas de chamadas) deve ser usado para monitorar pacientes que não estão recebendo oxigênio suplementar, e monitores de ventilação (capnografia) são sugeridos para aqueles que estiverem recebendo oxigênio suplementar.
Em 2017, e, no contexto da discussão nacional em torno da crise de opioides, nunca foi tão relevante rever o estado atual da monitorização para a detecção de OIVI e fornecer recomendações atualizadas baseadas em evidências.
Incidência de comprometimento ventilatório induzido por opioides
Há muito tempo tem sido um desafio medir com precisão a incidência de OIVI e, em seguida, medir a margem de segurança de um novo protocolo de monitorização ou tecnologia. A nomenclatura inconsistente da depressão respiratória na literatura dificulta estudos comparativos.2 As diferentes definições utilizadas para os parâmetros substitutos que identificam a depressão respiratória tornam difícil o cálculo da sua real incidência. Alguns parâmetros substitutos para definir depressão respiratória incluem hipoxemia, hipopneia, hipoventilação hipercápnica, diminuição da frequência respiratória e ventilação minuto, entre outras.2 Os valores de SpO2 usados na literatura para caracterizar hipoxemia variam de 80 a 94%.3 Com a ressalva de que muitos parâmetros diferentes são usados para medir depressão respiratória, a incidência relatada de OIVI varia entre 0,15% e 1,1% em pacientes pós-cirúrgicos.3-8 Embora as estimativas de incidência de OIVI variem com base nas definições utilizadas, estudos recentes continuam relatando a incidência de OIVI dentro desse mesmo intervalo.2 Parece claro que a nomenclatura e os parâmetros de desfecho para a depressão respiratória devem ser padronizados para que pesquisas orientadas para a redução do risco possam fazer avanços relevantes. Além de determinar “o que monitorar”, devemos decidir quando a monitorização é necessária (abordado no artigo complementar Devemos nos concentrar em “quando” e “quem” monitorar para detectar o comprometimento ventilatório induzido por opioides no pós-operatório), bem como as ferramentas apropriadas para reduzir a incidência de OIVI.
Quando a monitorização é necessária
Sonolência e sedação são os precursores mais comuns que levam ao OIVI.2,9 O acompanhamento regular pela equipe de enfermagem é atualmente o principal meio de monitorar OIVI. Determinar a frequência necessária de avaliação da enfermagem exige um equilíbrio entre a minimização de interrupções ao paciente, interferência no fluxo de trabalho dos enfermeiros e gasto com os funcionários. Para os pacientes no pós-operatório, as primeiras quatro horas após a alta da sala de recuperação pós-anestésica (SRPA) caracterizam o período de tempo associado às maiores taxas de sedação, e as primeiras 12 horas após a cirurgia são quando ocorrem mais da metade dos eventos de OIVI. Além disso, 75% de todos os eventos de OIVI ocorrem nas primeiras 24 horas após a cirurgia.2 Com base na distribuição temporal de OIVI no pós-operatório, a maior ênfase na monitorização das primeiras 24 horas provavelmente será útil na redução dos eventos adversos dos opioides.
Em 2014, os Centros de Serviços Medicare e Medicaid (CMS) atualizaram suas recomendações de administração hospitalar de opioides para incluir avaliações de enfermagem em série de pressão arterial, temperatura, pulso, frequência respiratória, nível de dor, estado respiratório e nível de sedação.10 Entretanto, a frequência ideal de avaliações não foi estabelecida e provavelmente depende de uma variedade de fatores, inclusive tipo de dor, adequação do alívio inicial da dor, presença de efeitos colaterais, comorbidades e alterações no quadro clínico. Para os pacientes que estão recebendo opioides neuroaxiais, a Força-Tarefa da Sociedade Americana de Anestesiologistas sobre Opioides Neuroaxiais e a Sociedade Americana de Anestesia Regional e Medicina da Dor sugerem monitorar a cada 1 hora nas primeiras 12 horas, a cada 2 horas nas 12 horas seguintes e a cada 4 horas posteriormente, caso não ocorram complicações relacionadas aos opioides.11 Em contraste, um painel de especialistas com apoio dos CMS recomendou, para qualquer administração de opioides, uma frequência de monitorização a cada 2,5 horas (para permitir atrasos de documentação) nas primeiras 24 horas e a cada 4,5 horas posteriormente. No entanto, durante um levantamento nos hospitais dos CMS, apenas 8,4% dos pacientes com PCA opioide IV alcançaram o padrão de a cada 2,5 horas e apenas 26,8% alcançaram o padrão mais flexível de a cada 4,5 horas.12 Devido à variação nas recomendações de monitorização de diferentes organizações, diferentes fatores de risco do paciente, diferentes técnicas anestésicas, educação variável da equipe de enfermagem e do médico prescritor em relação a OIVI e razão enfermeiro-paciente variável, é provável que a monitorização eletrônica contínua no pós-operatório de todos os pacientes que recebem opioides simplifique o atendimento e melhore a detecção de OIVI.
Como os Pacientes devem ser Monitorados — Sistemas de Monitorização e Alerta
Independentemente do sistema particular de monitorização eletrônica empregado para detectar OIVI, o método para alertar os profissionais de saúde quando da ocorrência desses eventos deve ser abordado para garantir um sistema eficaz. Estabelecer uma base de evidências de monitorização de alertas úteis para detectar OIVI é uma necessidade crítica. Limites de alerta ajustados de forma inadequada levam à fadiga de alarme, irritação do paciente e da equipe e à acomodação. Tudo isso pode tornar até mesmo o melhor sistema de monitorização completamente ineficaz na obtenção do desfecho desejado.2
Idealmente, os sistemas de monitorização devem usar múltiplos parâmetros em conjunto para detectar qualquer indicador de depressão respiratória que possa surgir primeiro e empregar combinações de parâmetros para identificar um evento iminente com precisão. No passado, os alarmes de limites eram bastante simples e propensos a erros.
Atualmente, a oximetria de pulso é o monitor de depressão respiratória mais frequentemente disponível em sistemas hospitalares. Os limites de alarmes para oximetria de pulso são, no entanto, frequentemente os mais problemáticos. Definir um limite muito alto leva a resultados falso-positivos frequentes, enquanto ajustar o limite muito baixo pode resultar em respostas e atendimento tardios à depressão respiratória. A administração de oxigênio suplementar dificulta a monitorização, pois pode retardar a detecção da ventilação deprimida e prejudicar ainda mais o impulso respiratório hipóxico.13
A capnografia usada sozinha também tem limitações. Em pacientes não entubados, a capnografia é tipicamente qualitativa e não quantitativa, e indica, portanto, a presença de dióxido de carbono durante a ventilação normal, alterações relativas no dióxido de carbono exalado e algumas informações sobre a frequência respiratória. No entanto, a detecção de alterações nos valores de CO2, seja a redução ou elevação, pode ser problemática e imprecisa. Ainda assim, a capnografia pode ser útil como monitor de frequência respiratória, pois a natureza periódica da exalação de CO2 e a queda para zero durante a inspiração oferecem uma demarcação clara do ciclo respiratório. Os limites superiores da frequência respiratória também podem ser usados com a capnografia para detectar hiperventilação.
A combinação da frequência respiratória com oximetria e capnografia ajuda a fornecer informações adicionais para a detecção de OIVI, bem como outros processos patológicos (Figura 1). Três padrões de depressão respiratória que resultaram em óbito inesperado foram descritos por Curry et al.14 O Tipo I é um desconforto respiratório compensado por hiperventilação (proveniente de sepse, embolia pulmonar ou insuficiência cardíaca congestiva, por exemplo). No Tipo I, os pacientes inicialmente apresentam uma saturação de oxigênio estável, e a PaCO2 começa a diminuir à medida que a acidose metabólica se instala e ocorre o início da hiperventilação compensatória. A frequência respiratória rápida é uma característica desse tipo de insuficiência respiratória. Por fim, dessaturação lenta precede um declínio acentuado na SpO2 quando há falha na resposta ventilatória à piora da acidose. A maioria dos atuais monitores tem alarmes para frequência respiratória baixa, mas isso não significa que alarmes para FR rápida ou configuração alta necessariamente detectem a insuficiência respiratória tarde demais. A depressão respiratória Tipo II é uma Hipoventilação Unidirecional Progressiva ou um evento de narcose por CO2. Nesse caso, os pacientes frequentemente apresentam aumento na PaCO2 (e EtCO2) devido à superdosagem de opioides ou outros sedativos, inicialmente por diminuição da Ventilação Minuto, e frequentemente enquanto a SpO2 ainda é >90%. A depressão respiratória Tipo III é um evento sentinela do fluxo aéreo rápido/saturação de oxigênio reduzida associado a queda vertiginosa da SpO2 que pode ser observada em pacientes com apneia obstrutiva do sono. Nessa situação, o paciente depende do despertar para manter a oxigenação. Se houver falha no despertar, ocorre hipoxemia vertiginosa durante a apneia, o que pode levar a uma parada súbita.
Não existe atualmente um único sistema de monitorização comprovado ou um conjunto de limites de alarme capazes de detectar todos os padrões respiratórios que resultem em óbitos inesperados. A sensibilidade geral a eventos iminentes pode ser aumentada através do uso de vários monitores para detectar padrões de alterações.
Tecnologias de monitorização e algoritmos de alerta mais recentes
Conforme discutido acima, a força de trabalho frequentemente apresenta limitações para alcançar a monitorização consistente e de alta frequência necessária para detectar com precisão eventos adversos, e os alarmes de monitores individuais tem capacidade limitada. Estão sendo desenvolvidos esforços para desenvolver e validar monitores mais avançados com sistemas de alerta mais inteligentes.
Algoritmos que combinam múltiplos parâmetros fisiológicos individuais para produzir um único limite de “superfusão” podem aumentar a sensibilidade dos sistemas de limites e ainda evitar alarmes falsos. Um exemplo é o Índice de Alarme Precoce Modificado (Modified Early Warning Score, MEWS).14 O MEWS é um alarme de limite simples que combina vários monitores em um único número para documentação e alertas. Algoritmos inteligentes futuros devem analisar padrões de alterações com combinações de sinais vitais, em vez de simplesmente adicionar limites de monitores únicos. Esses sistemas devem prever a trajetória em direção à depressão respiratória antes que ocorra um evento, permitindo respostas precoces e menor morbidade.
Sistemas integrados de administração de medicamentos e monitorização, como capnografia e oximetria de pulso associadas a dispositivos de PCA IV, permitem que a monitorização e a resposta sejam interligadas.15 Um monitor que possa integrar múltiplos sensores e, através do uso de um algoritmo de reconhecimento de padrões, detectar sinais precoces de depressão respiratória, pode bloquear funcionalmente o fornecimento adicional de opioide, enquanto alerta a equipe médica.16
A frequência respiratória pode ser medida durante a capnografia com alterações no fluxo de ar da linha de amostragem de CO2. Por outro lado, métodos alternativos de detecção da frequência respiratória também foram avaliados. A monitorização acústica é interessante, uma vez que pode ser realizada sem contato direto com o paciente. Esse método é particularmente interessante para crianças, já que manter a linha de amostragem em uma criança pode ser difícil.17 A monitorização acústica, entretanto, tem apresentado muitos erros que levam à fadiga de alarme.18 Sistemas de radar que monitoram a ventilação através da montagem de um sistema de detecção na parede ou no teto da sala estão sendo avaliados, mas também são limitados por erros de movimento e alarmes falsos.19
A bioimpedância é uma tecnologia que utiliza alterações na condutância elétrica do tórax obtidas com eletrodos de superfície para estimar frequência respiratória, ventilação minuto, volume corrente e eventos de apneia. Estudos mostraram que esse tipo de monitor de volume respiratório (RVM) pode detectar alterações na ventilação minuto e na depressão respiratória iminente mais rapidamente e em maior grau do que a capnografia isolada.20 Um estudo verificou que o RVM pode detectar o início da depressão respiratória mais de 12 minutos antes do início da dessaturação.21 Em particular, os pacientes que receberam oxigênio suplementar apresentaram com frequência sinais de baixa ventilação minuto usando o RVM sem acionar o alarme de dessaturação. Um dos principais problemas com as implementações atuais dos monitores de bioimpedância é a necessidade dos eletrodos de superfície colocados no paciente serem conectados fisicamente a um dispositivo que analisa o movimento. Além disso, movimentos não respiratórios, como tosse ou movimentação na cama, podem criar sinais falsos. Por fim, o movimento da parede torácica sem troca de ar, como ocorre na obstrução das vias aéreas, também pode enganar alguns aparelhos de bioimpedância (Tabela 1).17
Tabela 1: Prós e contras de monitores eletrônicos contínuos
| MONITOR | PARÂMETROS | PRÓS | CONTRAS |
| Oximetria de pulso | SpO2 FC |
|
|
| Capnografia | EtCO2
FR |
|
|
| Limite combinado (MEWS) | FR FC (PAS Débito Urinário Temp. estado neurológico) |
|
|
| Dispositivos integrados de monitorização e administração | SpO2 EtCO2 FR |
|
|
| Monitor acústico | FR |
|
|
| Monitor de radar | FR |
|
|
| Bioimpedância | FR VC VM |
|
|
| Pletismografia e audiometria de indutância | FR SpO2 Permeabilidade da via aérea |
|
|
| SpO2 – saturação periférica de oxigênio FC — frequência cardíaca EtCO2 — dióxido de carbono expirado FR — frequência respiratória PAS — pressão arterial sistólica |
UOP — débito urinário VC — volume corrente VM — ventilação minuto UTI — unidade de terapia intensiva |
Sistemas integrados mais complexos que combinam pletismografia de indutância respiratória com audiometria e oximetria de pulso são muito sensíveis na detecção de depressão respiratória. Os sistemas atuais, entretanto, são muito incômodos, difíceis de serem usados pelo paciente, e estão sujeitos a artefatos de movimento, apresentando limitações semelhantes nos movimentos falsos da parede torácica, como tosse ou choro, assim como ocorre com outros dispositivos de bioimpedância.17
Conclusões: Um futuro ideal
Em um futuro ideal, nenhum paciente será afetado por OIVI no pós-operatório. Para alcançar essa meta, precisaremos de analgésicos alternativos que sejam tão eficazes quanto os opioides, mas que não causem depressão respiratória. Até lá, precisamos reduzir o risco dos opioides que usamos atualmente. Isso será feito através do uso inteligente dos recursos de enfermagem combinados com sistemas avançados de monitorização, sensíveis na detecção de eventos respiratórios iminentes. Para facilitar esse futuro, as principais partes interessadas devem ajudar a delinear uma nomenclatura para eventos adversos relacionados a opioides, incluindo depressão respiratória, com diretrizes e medidas de desfechos.
O Dr. Gupta é professor associado de Anestesiologia do Vanderbilt University Medical Center em Nashville, TN.
O Dr. Edwards é professor assistente de Anestesiologia, Cirurgia Neurológica do Vanderbilt University Medical Center em Nashville, TN.
Nenhum dos autores tem qualquer conflito de interesses a declarar referente a este artigo.
Referências
- Weinger M, Lee LA. No patient shall be harmed by opioid-induced respiratory depression. APSF Newsletter 2011;26:21. Available at https://www.apsf.org/newsletters/html/2011/fall/01_opioid.htm. Accessed December 9, 2017.
- Jungquist CR, Smith K, Nicely KLW, et al. Monitoring hospitalized adult patients for opioid-induced sedation and respiratory depression. Am J Nurs 2017;117:S27–S35.
- Sun Z, Sessler DI, Dalton JE, et al. Postoperative hypoxemia is common and persistent: a prospective blinded observational study. Anesth Analg 2015;121:709–15.
- Wheatley RG, Somerville ID, Sapsford D, et al. Postoperative hypoxaemia: comparison of extradural, i.m. and patient-controlled opioid analgesia. Br J Anaesth1990;64:267–75.
- Overdyk FJ, Carter R, Maddox RR, et al. Continuous oximetry/capnometry monitoring reveals frequent desaturation and bradypnea during patient-controlled analgesia. Anesth Analg 2007;105:412–8.
- Dahan A, Aarts L, Smith TW. Incidence, reversal, and prevention of opioid-induced respiratory depression. Anesthesiology 2010;112:226-38.
- Stites M, Surprise J, McNiel J, et al. Continuous capnography reduces the incidence of opioid-induced respiratory rescue by hospital rapid resuscitation team. J Patient Saf 2017 Jul 20. doi: 10.1097/PTS.0000000000000408. [Epub ahead of print].
- Cavalcante AN, Sprung J, Schroeder DR, et al. Multimodal analgesic therapy with gabapentin and its association with postoperative respiratory depression. Anesth Analg 2017;125:141–6.
- Lee LA, Caplan RA, Stephens LS, et al. Postoperative opioid-induced respiratory depression: a closed claims analysis. Anesthesiology 2015;122:659–65.
- https://www.cms.gov/Medicare/Provider-Enrollment-and-Certification/SurveyCertificationGenInfo/Downloads/Survey-and-Cert-Letter-14-15.pdf. Accessed 12/15/17.
- Horlocker TT, Burton AW, Connis RT, et al. American Society of Anesthesiologists task force on neuraxial opioids. Practice guidelines for the prevention, detection, and management of respiratory depression associated with neuraxial opioid adminstration. Anesthesiology 2009;110:218–30.
- Jungquist CR, Correll DJ, Fleisher LA, et al. Avoiding adverse events secondary to opioid-induced respiratory depression: implications for nurse executives and patient safety. J Nurs Adm 2016;46:87–94.
- Niesters M, Mahajan RP, Aarts L, et al. High-inspired oxygen concentration further impairs opioid-induced respiratory depression. Br J Anaesth 2013;110:837–41.
- Curry JP, Lynn LA. Threshold Monitoring, Alarm fatigue, and the patterns of unexpected hospital death. APSF Newsletter 2011;26:32–5. https://www.apsf.org/newsletters/html/2011/fall/07_threshold.htm.
- Maddox RR, Williams CK. Clinical experience with capnography monitoring for pca patients. APSF Newsletter 2012; 26:47–50.
- Weininger S, Jaffe MB, Rausch T, et al. Capturing essential information to achieve safe interoperability. Anesth Analg 2017;124:83–94.
- Miller KM, Kim AY, Yaster M, et al. Long-term tolerability of capnography and respiratory inductance plethysmography for respiratory monitoring in pediatric patients treated with patient-controlled analgesia. Paediatric anaesthesia.2015;25:1054–9.
- Görges M, West NC, Christopher NA, et al. An ethnographic observational study to evaluate and optimize the use of respiratory acoustic monitoring in children receiving postoperative opioid infusions. Anesth Analg 2016;122:1132–40.
- van Loon K, Breteler MJM, van Wolfwinkel L, et al. Wireless non-invasive continuous respiratory monitoring with FMCW radar: a clinical validation study. J Clin Monit Comput 2016;30:797–805.
- Williams GW, George CA, Harvey BC, et al. A comparison of measurements of change in respiratory status in spontaneously breathing volunteers by the ExSpiron Noninvasive Respiratory Volume Monitor versus the Capnostream Capnometer.Anesth Analg 2017;124:120–6.
- Galvagno SM, Duke PG, Eversole DS, et al. Evaluation of respiratory volume monitoring (RVM) to detect respiratory compromise in advance of pulse oximetry and help minimize false desaturation alarms. J Trauma Acute Care Surg 2016;81:S162–70.


 Issue PDF
Issue PDF