오피오이드(Opioid)로 인한 호흡 기능 저하는 어린이 환자의 경우 예방이 가능한데도 생명을 위협할 수 있는 합병증입니다. 오피오이드로 인한 호흡 기능 저하가 발생할 위험이 큰 환자를 미리 파악하여 더 안전한 방법을 생각하는 것이 매우 중요합니다. 예를 들어 오피오이드를 줄이는 데 도움이 되는 보조제를 사용하거나 진정 상태를 자주 평가하고 면밀하게 모니터링하는 것이 대표적입니다. 안타깝게도 현재 어린이 환자의 오피오이드로 인한 호흡 기능 저하 위험을 예측하기 위해 고안된 모델은 따로 없습니다. 다만 여러 가지 보완적인 모니터링을 잘 활용하면 심각한 오피오이드 관련 사안을 줄일 수 있을지 모릅니다.
 수술 후, 호흡 억제는 여러 가지 이유로 발생할 수 있으며, 이는 잠재적으로 치명적인 합병증을 초래할 수 있습니다.1 수술 후 호흡 억제의 반복적인 원인 중 하나는 수술 전후에 사용되는 오피오이드입니다.2 이에 따라, 마취 환자 안전 재단(APSF)을 포함한 기관과 전문 학회는 환자 모니터링에 관한 권고 사항을 개발하였으며, 3,4 수술 후 모니터링의 적절한 수준에 대한 결정은 수술 전 환자의 특정 위험 요소를 평가하여 안내받아야 한다고 주장하는 기사를 발표하였습니다.5 성인과 마찬가지로, 소아 환자에서도 수술 전후 호흡 합병증이 발생하며, 이는 수술 후 부작용의 흔한 원인이 됩니다.6 다만, 어린이는 “작은 어른”이 아닙니다. 따라서 이전에 출간된 지침과 연구 내용을 주의해서 받아들여야 합니다.
수술 후, 호흡 억제는 여러 가지 이유로 발생할 수 있으며, 이는 잠재적으로 치명적인 합병증을 초래할 수 있습니다.1 수술 후 호흡 억제의 반복적인 원인 중 하나는 수술 전후에 사용되는 오피오이드입니다.2 이에 따라, 마취 환자 안전 재단(APSF)을 포함한 기관과 전문 학회는 환자 모니터링에 관한 권고 사항을 개발하였으며, 3,4 수술 후 모니터링의 적절한 수준에 대한 결정은 수술 전 환자의 특정 위험 요소를 평가하여 안내받아야 한다고 주장하는 기사를 발표하였습니다.5 성인과 마찬가지로, 소아 환자에서도 수술 전후 호흡 합병증이 발생하며, 이는 수술 후 부작용의 흔한 원인이 됩니다.6 다만, 어린이는 “작은 어른”이 아닙니다. 따라서 이전에 출간된 지침과 연구 내용을 주의해서 받아들여야 합니다.
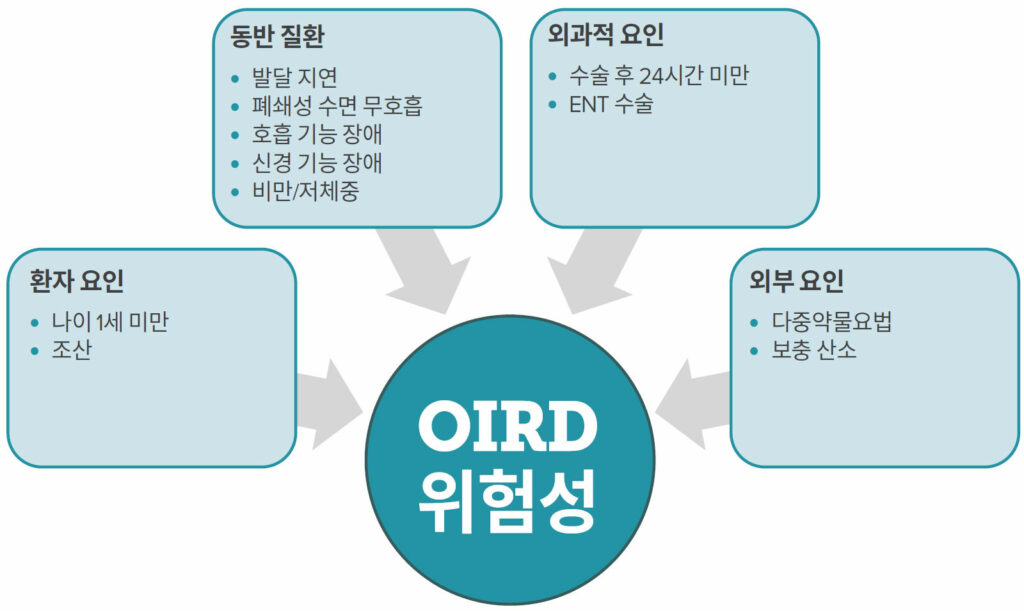
소아 환자에서의 오피오이드로 인한 호흡 억제의 위험 요인
소아에서의 오피오이드로 인한 호흡 억제 위험 요인을 다루는 문헌은 많지 않습니다. 성인의 경우, 당뇨병과 심장 질환과 같은 동반 질환이 주사형 오피오이드 요법 후에 중대한 호흡 사건의 위험 요인으로 작용하지만,7,8 어린이의 경우 발생률이 낮기 때문에 주요 위험 요인이 아닐 가능성이 큽니다. 대신, 환자 감사 및 날록손의 투여 데이터 추적을 통해 OIRD의 대리 지표로서 위험 요인을 식별할 수 있었습니다 (그림 1 참조). 예를 들어, 기저 호흡기 질환과 발달 지연은 소아 OIRD의 위험을 증가시킬 수 있는 동반 질환으로 확인되었습니다.9~11
소아에서 OIRD의 또 다른 위험 요인은 어린 나이입니다. 중증 호흡기 이벤트 때문에 날록손을 투약해야 했던 소아과 환자를 대상으로 실시한 후향적 검토 결과, 발생 빈도가 어린 나이와 조산과 연관이 있었습니다.10 이 위험 증가의 원인은 젊은 영아와 나이가 많은 어린이 및 성인 간의 오피오이드 대사 및 배설에 대한 생리적 차이 때문일 수 있습니다. 예를 들어 신생아의 경우, 모르핀의 반감기가 긴 편이고 청소율(clearance)이 낮습니다. 따라서 투여 용량에 따라 월령이 1개월 미만인 영아는 나이 많은 어린이 및 성인에 비해 혈청 농도가 더 높고 감소 속도가 느려져, 높은 위험에 처할 수 있습니다.12
소아 환자의 경우, 폐쇄성 수면 무호흡증(OSA)과 관련된 수술 후 호흡 억제의 위험이 커진다는 사실도13 보고되었습니다. 편도선 절제술 후, 중증 OSA를 가진 어린이는 모르핀 유도 호흡 억제에 더 민감하며, 경증 수면 무호흡증을 가진 어린이보다 적은 모르핀을 필요로 합니다.14 OSA는 소아에서 비교적 흔한 편으로, 전체 어린이의 1~5%에게서 발생합니다.15 다만, 수술 전 스크리닝이 다소 까다롭습니다. 진단 시 수면다원검사가 최적의 표준방법이지만, 대부분의 소아 환자에게는 이용할 수 없습니다. 모든 연령대의 소아에 적용 가능한 유효한 위험 평가 설문지는 없으나, 소아에서의 OSA 관련 위험 요소와 증상은 보고되었습니다.16
소아 비만도 날록손 투약 시 위험 요인입니다.10 이것은 비만과 OSA 사이 밀접한 관련이 있어서일 수도 있고, 비만과 관련해 투여 용량이 잘못된 것을 반영한 결과일 수도 있습니다. 성인과 달리, 많은 소아 약물에서 체중 기반 용량 조정이 일반적인 방법이지만, 총 체중에 따라 오피오이드 용량을 조정하면 위험한 호흡 억제를 초래할 수 있습니다. 따라서 투여 용량은 이상 체중이나 제지방 체중을 기준으로 해야 합니다.17 흥미롭게도, 소아에서 저체중도 호흡 사건의 위험 요인으로 작용합니다.10
대부분의 어린이에서 오피오이드 관련 합병증이 발생하기 전에 과도한 진정이 관찰되었습니다.4 오피오이드 무경험 환자에게 오피오이드 투여 시 진정 효과는 잘 알려져 있지만, 항불안제, 근이완제, 항경련제 및 기타 진정제를 동반 투약하는 경우 중추 신경계(CNS) 기능 저하를 악화할 수 있습니다. 이러한 조합은 생명을 위협하는 호흡 사건을 초래하고 날록손 개입의 위험을 증가시킬 수 있습니다.10 이는 특히 중요하며, 오피오이드와 다른 CNS 억제제를 병용하는 경우가 소아 진료에서 흔하다는 보고가 있습니다. 2010년 소아 통증 관리 실태 조사에서는 응답자의 40% 이상이 이러한 약물의 병용 투여를 허용한다고 답했습니다.18 이후 십 년간 진료 현황은 달라졌을지 몰라도, 최근 다중 모달 진통 요법을 통한 오피오이드 절감에 대한 관심이 높아진 점을 고려할 때, 이러한 약물 병용이 극적으로 줄어들었을 가능성은 낮습니다.
수술 후 호흡 억제 위험이 가장 큰 시기는 수술 후 첫날입니다. 실제로, 날록손을 투여받은 소아 환자의 75%가 수술 후 첫 24시간 내에 중대한 호흡 사건을 경험했습니다. 이러한 이벤트는 정맥 주사, 경구, 신경축 경로를 통해 오피오이드를 투약받은 환자에게서 발생했으며, 어떠한 투약 방법도 본질적으로 위험이 없지는 않다는 사실을 시사합니다.10
소아과 환자 모니터링에 관한 현행 권장 사항
전문 의료진은 오피오이드 치료를 받는 소아과 환자의 경우, 수술 후 최소 24시간 이상 산소 공급 및 환기 상태를 계속 모니터링해야 한다고 주장
호흡 억제의 위험을 최소화하기 위해, APSF는 보충 산소를 제공할 때 산소화와 환기를 지속적으로 전자 모니터링하여 오피오이드 유도 호흡 억제를 사전 식별하고 예방할 것을 오랫동안 권장해 왔습니다.3 소아 환자에 대해서만 구체적으로 모니터링 요구 사항을 구분한 연구는 따로 없지만, 소아 마취 학회(Society for Pediatric Anesthesia)에서 옹호하는 치료 지침에 따르면 몇몇 환자를 관리할 때 각별히 경계해야 한다고 되어 있습니다. 예를 들어 신생아, OSA 환아, 기저 신경 근육질환이나 인지기능 장애가 있는 환자 등이 대표적으로, 이런 질환은 호흡기 근육 기능을 저해하고/거나 환자의 통증 수준 또는 의식 수준을 평가하는 데 방해가 되기 때문입니다. 또한, 오피오이드 요법을 시작하는 소아 환자, 특히 초기 수술 후 기간에 있는 환자, 주사형 오피오이드의 용량이 증가하는 환자, 그리고 다른 CNS 억제제와 함께 오피오이드를 받는 환자는 더욱 신중한 관리가 필요하다고 여겨집니다.4
전문가 견해 또한 비경구로 오피오이드를 처음 투약하는 소아과 환자나 자가 조절 진통(PCA), 대리 PCA(PCA by proxy) 및/또는 연속 주입으로 투약하는 환자는 첫 24시간 동안 지속적으로 호흡수를 모니터링하고 맥박 산소 측정을 실시하는 것이 좋다고 구체적으로 권장하고 있습니다(단, 환자가 깨어 있고 계속 관찰 중인 경우는 예외).4,12 이전 연구에서도 소아는 지속적인 모니터링을 더 자주 활용해야 한다는 주장을 뒷받침합니다. 2010년에 실시한 소아과 통증 조절 설문조사에서, 응답자는 PCA 오피오이드를 제공하는 경우 지속적인 맥박 산소 측정이 보편적이라고 답했습니다.18 하지만 지속적인 호흡수 모니터링은 덜 일관되게 사용되었습니다.(그림 2 참조).
![그림 2: 소아 환자에게 오피오이드를 투약하는 경우 사용되는 환자 모니터링 유형. (질문에 답변한 응답자 전체 수 149명, 환자 조절 무통주사 [IVPCA]를 대신 제공한 응답자 전체 수 95명) 응답자의 90%가 환자에게 PCA를 투약했을 때 맥박 산소 측정을 사용했다고 보고했습니다. 심전도 모니터링과 호기말 이산화탄소 분압 측정을 맥박 산소 측정과 항상 동반 사용했으며, 인덕턴스 호흡 감시 장치(Respitrace)는 거의 항상 맥박 산소 측정과 함께 제공되었으나(> 90%) 유일한 모니터링 유형으로 사용된 경우도 있습니다.<sup>17</sup> Anesthesia & Analgesia 및 Wolters Kluwer Health, Inc. Nelson KL, Yaster M, Kost-Byerly S, Monitto CL의 허가를 받아 재인쇄했습니다. 미국 소아 마취과 의사 전국 설문 조사: 소아과 급성 통증 평가에서 자가조절진통 및 여타 정맥주사 형태의 오피오이드 요법. Anesth Analg. 2010;110:754–760.<sup>18</sup>](https://www.apsf.org/wp-content/uploads/newsletters/2024/0702-ko/figure2-monitoring-ko-1024x732.jpg)
그림 2: 소아 환자에게 오피오이드를 투약하는 경우 사용되는 환자 모니터링 유형. (질문에 답변한 응답자 전체 수 149명, 환자 조절 무통주사 [IVPCA]를 대신 제공한 응답자 전체 수 95명) 응답자의 90%가 환자에게 PCA를 투약했을 때 맥박 산소 측정을 사용했다고 보고했습니다. 심전도 모니터링과 호기말 이산화탄소 분압 측정을 맥박 산소 측정과 항상 동반 사용했으며, 인덕턴스 호흡 감시 장치(Respitrace)는 거의 항상 맥박 산소 측정과 함께 제공되었으나(> 90%) 유일한 모니터링 유형으로 사용된 경우도 있습니다.17 Anesthesia & Analgesia 및 Wolters Kluwer Health, Inc. Nelson KL, Yaster M, Kost-Byerly S, Monitto CL의 허가를 받아 재인쇄했습니다. 미국 소아 마취과 의사 전국 설문 조사: 소아과 급성 통증 평가에서 자가조절진통 및 여타 정맥주사 형태의 오피오이드 요법. Anesth Analg. 2010;110:754–760.18
소아과 호흡기 모니터링 및 그와 관련된 문제점
환자에게 산소 제공 시 산소 포화도 저하는 호흡 부전에 대한 뒤늦은 경고 신호일 가능성 존재
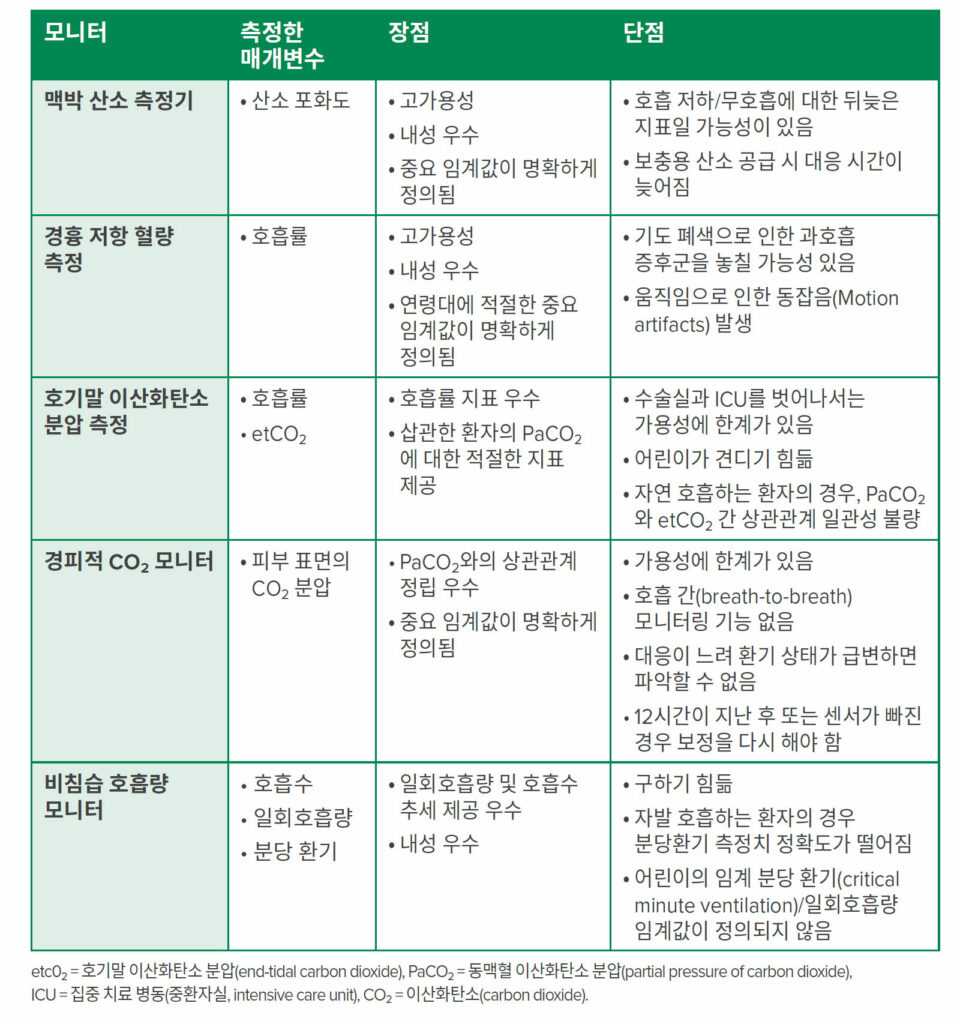
성인 환자와 마찬가지로, 어린이 호흡기 모니터링 또한 OIRD를 미리, 적시에 식별하여 중대한 이벤트가 발생하지 않도록 개입하여 방지하는 것이 옳습니다. 호흡기 모니터링을 통해 산소 공급, 호흡수, 이산화탄소(CO2) 장력 및 공기 흐름 등을 끊임없이, 정확하게 측정하는 것이 가장 이상적입니다. 지금도 각 매개변수를 추적하는 모니터가 있지만, 각 모니터는 임박한 호흡 부전을 예측하는 데 한계가 있습니다(표 1 참조).
표 1: OIRD 감지를 위한 호흡기 모니터링 방식 요약.2,4,6,7,20~23
소아 진료에서 가장 흔한 모니터링 방법은 지속적인 맥박 산소측정과 경흉부 임피던스 측정입니다. 1980년대 소아 진료에 도입된 이후, 맥박 산소측정은 영아와 어린이의 산소화 적절성에 대한 중요한 정보를 제공해 왔습니다. 맥박 산소측정 모니터링은 소아 병동에서 자주 사용되며, 모든 연령대의 환자들이 잘 견딜 수 있습니다. 다만 산소 포화도 저하는 호흡 부전에 대한 뒤늦은 경고 신호일 가능성이 있습니다. 특히, 환자가 보충용 산소를 공급받는 경우 더 위험합니다.4 안타깝게도 여러 연구에서 수술 후 산소 공급을 적절한 수준으로 유지하려면 보충용 산소가 필요한 경우가 많다고 하는데, 그 이유는 수술 난이도, 환자 동반 이환이나 진통제 투여 등일 수 있습니다.11,18 이러한 필요는 무호흡/저호흡과 산소 포화도 감소 사이의 시간을 증가시켜, 소아 환자가 인지되지 않은 저환기 상태의 위험에 처할 수 있습니다.
경흉부 임피던스 측정법을 이용한 호흡수 모니터링은 무호흡과 저호흡을 식별할 수 있는 기술로, 오피오이드가 뇌간 호흡 중추에 미치는 영향을 나타내는 주요 지표로 널리 사용되며 잘 견딜 수 있습니다. 다만, 연령대별로 적절한 호흡기 매개변수를 이용하도록 주의를 기울여야 합니다. 불행히도, 이 기술을 사용한 호흡수 모니터링은 최적이 아닌 ECG 전극 배치, 운동 아티팩트, 기침과 울음과 같은 가슴벽 움직임을 유발하는 생리적 사건으로 인해 부정확할 수 있습니다. 또한, 진단되지 않은 기도 폐쇄가 있는 상황에서는 호흡 부전을 식별하지 못할 수 있습니다.
동맥혈 이산화탄소 분압(arterial PaCO2)을 측정하면 검증된 방식으로 환기를 평가할 수 있지만, 그러려면 동맥에 접근해야 하고 지속적인 정보를 제공하지는 않습니다. 비침습적 대리 이산화탄소 분압(PaCO2) 측정법 중 지속적인 데이터를 제공하는 것도 있습니다. 경피적 및 호기말 이산화탄소 분압(PCO2)(etCO2) 모니터링이 대표적인 예입니다. 경피적 가스 모니터링은 1980년대에 인기가 떨어졌습니다. 신생아에게 사용하면 피부에 화상이 발생할 위험이 있는 등 기술적인 문제가 있었기 때문입니다. 다만 기술 발전으로 인해 요즘에는 경피적 PCO2 모니터링이 임상적으로 실현 가능해졌으며, 안전하다고 평가받습니다. 이러한 모니터는 소아 인구에서 평가되었으나,20 수술 후 오피오이드 약물을 받는 영아와 어린이에서는 연구된 바가 없습니다. 안정상태의 PaCO2와는 좋은 상관관계를 보이나, 반응 시간이 급격한 환기 변화의 신속한 식별을 방해하여 초기 경고 모니터로서의 유용성이 제한됩니다.
오피오이드 치료 중인 수술 후 환자가 보충용 산소를 사용하는 경우 호기말 이산화탄소 분압 측정이 적절
그 대신, 호기말 CO2(etCO2) 모니터링을 사용하면 삽관했거나, 마취했거나, 깊은 진정 요법을 실시한 환자를 모니터링할 때 조기에 믿을 수 있는 환기 부족 경고를 얻을 수 있습니다. 비강 및 경구 샘플링을 사용한 호기말 이산화탄소 분압 측정의 경우, 삽관하지 않고 PCA2,7를 받는 성인 환자를 대상으로 연구된 적이 있으며, 산소 포화도 모니터링보다 호흡 손상을 예민하게 알아채는 지표이므로 호기말 이산화탄소 분압 측정을 임박한 호흡 기능 저하에 대한 조기 경고 모니터로 사용할 가능성이 있습니다. APSF에서는 이러한 소견을 근거로, 오피오이드를 투약한 수술 후 환자에게 보조 산소를 제공하는 경우 호흡 모니터링을 위해 호기말 이산화탄소 분압 측정을 사용하도록 권장해 왔습니다. 그러나 적절한 사용을 위해서는 환자가 입과 코에서 배출되는 낮은 호흡량을 감지하기 위해 특별히 설계된 호기말 이산화탄소 분압 측정 캐뉼라를 장기간 착용하는 것이 필요합니다. 이러한 캐뉼라는 불편할 수 있으며, 식사나 대화와 같은 활동을 방해할 수 있어 환자의 협조를 저하시킬 수 있습니다. 실제로 비삽관, 비진정 상태의 수술 후 소아 환자에서 호기말 이산화탄소 분압 측정은 사실 바로 이런 이유 때문에 환자가 견디기 힘들어해 소아 모니터링 패러다임에서는 시행에 한계가 있었습니다.21
호기말 이산화탄소 분압 측정 모니터링이 제공하는 정보를 명확히 이해하는 것이 무엇보다 중요합니다. 호기말 이산화탄소 분압 측정은 호흡수를 정확하게 측정하기는 하지만, etCO2 값의 의미는 자연 호흡 또는 인공 호흡하는 환자 간 큰 차이를 보일 수 있습니다. PRODIGY 임상시험에서 지적한 바와 같이, 모니터링한 환자 중 60% 이상이 etCO2 가 15mm Hg 미만(50% 이상은 etCO2 농도가 낮고 호흡률이 낮음)인 증상을 경험했지만, etCO2가 60mm Hg를 넘는 환자는 없었습니다.7 이러한 결과를 보면 대다수의 경우 etCO2 값이 PaCO2를 반영하는 것이 아니라, 오히려 인식되지 않은 기도 폐쇄로 인한 불량한 기류의 대리 지표일 수 있음을 시사합니다.
신기술인 비침습적 호흡 용적 모니터링은 기류, 특히 호흡량과 분당 환기량에 대해 더 민감한 평가를 제공할 수 있습니다. 이러한 모니터는 성인과 전신 마취하에 기계 환기를 받는 영아 및 어린이에서 검증되었습니다.6,22 단, 자발 호흡하는 성인의 경우 호흡량과 호흡수의 추세는 좋았지만, 최적 표준인 폐활량 측정법에 비하면 분간 환기 측정치 정확도는 떨어졌습니다.23 그렇다고 해도, 이러한 장치가 제공하는 추세 모니터링은 향후 모니터링 전략을 지원하는 용도로 사용될 수 있습니다. 후방 척추 융합술을 받고 PCA 오피오이드 요법을 실시한 청소년 환자를 대상으로한 파일럿 연구의 초기 데이터는 (그림 3 참조), 이러한 모니터를 청소년 환자가 견딜 수 있는 것으로 나타났으므로(C. Monitto의 개인적 커뮤니케이션) 소아 모니터링 분야에서도 현실적으로 사용이 가능할 것으로 시사됩니다. 그럼에도 불구하고, 임박한 호흡 부전 예측이나 현재 인식되지 않은 호흡 부전을 감지하는 데 사용할 수 있는 중요한 환기 임계값은 아직 소아에서 명확히 정의되지 않았습니다.
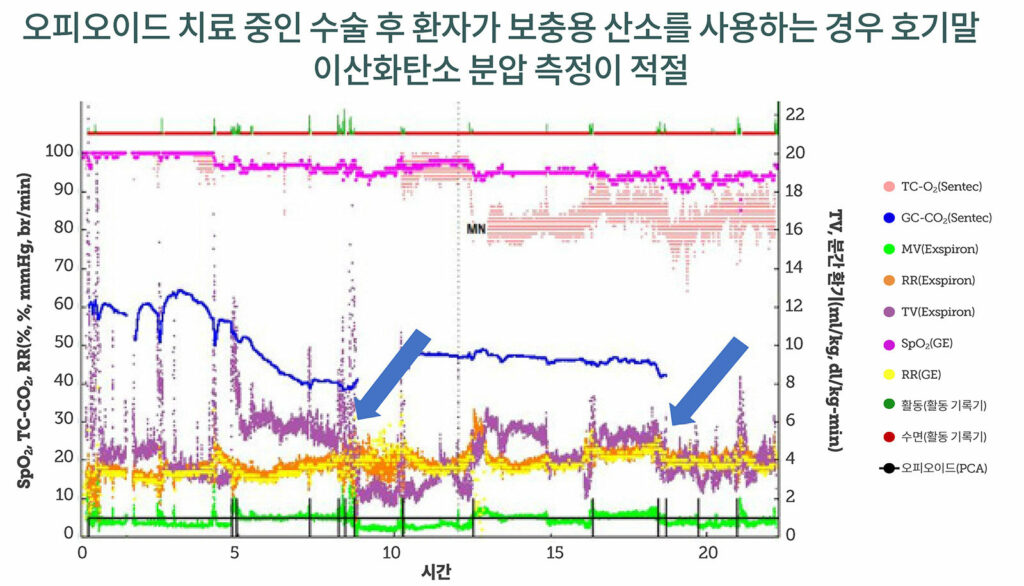
그림 3: 후방 척추 융합술(Posterior Spinal Fusion, SPF) 수술 후 청소년 환자의 산소 포화도, 호흡수, 경피적 CO2, 분당 환기, 일회호흡량, 활동기록기 및 PCA 오피오이드 사용에 관한 24시간 데이터 스트림 PCA 볼루스 사용 후 일회호흡량(Tidal Volume, TV)이 떨어진 것을 파란색 화살표로 표시했습니다. MN은 자정(midnight)이라는 뜻입니다. (미출간 데이터 제공: Constance Monitto).
결론적으로, 현재 소아에서 오피오이드로 인한 호흡 부전 위험을 예측하기 위해 설계된 모델은 존재하지 않습니다. 위험 요소를 계층화할 때, 성인 대상의 연구로부터 결과를 추론할 것이 아니라 소아에게 특화된 환자 특정 요인을 포함해야 합니다. 소아의 경우 지속적인 전자 호흡기 모니터링이 성인에서보다 보편적으로 활용되는 것으로 알려져 있지만, 자연 호흡하는 환자의 모니터링을 위한 종합적인 솔루션을 제공하는 한 가지 기술은 없습니다. 앞으로는 여러 상호 보완적인 모니터를 사용하고, 소아 특화된 임계값 알람 매개변수를 포함한 양식과 함께 사용하면 이 취약한 집단에서 호흡 부전 에피소드를 더 일찍 식별할 수 있을 것입니다.
Tricia Vecchione(MD, MPH)는 메릴랜드주 볼티모어 존스 홉킨스 의과대학교 마취과 조교수입니다.
Constance L. Monitto(MD)는 메릴랜드주 볼티모어 존스 홉킨스 의과대학교 마취과 부교수입니다.
저자들은 이해관계 상충이 없습니다.
참고 문헌
- Lee LA, Caplan RA, Stephens LS, et al. Postoperative opioid-induced respiratory depression: a closed claims analysis. Anesthesiology. 2015;122:659–665. PMID: 25536092.
- Overdyk FJ, Carter R, Maddox RR, et al. Continuous oximetry/capnometry monitoring reveals frequent desaturation and bradypnea during patient-controlled analgesia. Anesth Analg. 2007;105:412–418. PMID: 17646499.
- Weinger MB, Lee LA. “No patient shall be harmed by opioid-induced respiratory depression.” APSF Newsletter. 2011;26:21–40. https://www.apsf.org/article/no-patient-shall-be-harmed-by-opioid-induced-respiratory-depression/. Accessed February 28, 2024.
- Cravero JP, Agarwal R, Berde C, et al. The Society for Pediatric Anesthesia recommendations for the use of opioids in children during the perioperative period. Paediatr Anaesth. 2019;29:547–571. PMID: 30929307.
- Weingarten TN. Opioid-induced respiratory depression–beyond sleep disordered breathing. APSF Newsletter. 2023;38:2,42–45. https://www.apsf.org/article/opioid-induced-respiratory-depression-beyond-sleep-disordered-breathing/. Accessed February 28, 2024.
- Gomez-Morad AD, Cravero JP, Harvey BC, et al. The evaluation of a noninvasive respiratory volume monitor in pediatric patients undergoing general anesthesia. Anesth Analg. 2017;125:1913–1919. PMID: 28759491.
- Khanna AK, Bergese SD, Jungquist CR, et al. PRediction of Opioid-induced respiratory Depression In patients monitored by capnoGraphY (PRODIGY) group collaborators. prediction of opioid-induced respiratory depression on inpatient wards using continuous capnography and oximetry: an international prospective, observational trial. Anesth Analg. 2020;131:1012–1024. PMID: 32925318.
- Ramachandran SK, Haider N, Saran KA, et al. Life threatening critical respiratory events: a retrospective study of postoperative patients found unresponsive during analgesic therapy. J Clin Anesth. 2011;23:207–213. PMID: 21570616.
- Morton NS, Errera A. APA national audit of pediatric opioid infusions. Paediatr Anaesth. 2010;20:119–125. PMID: 19889193.
- Chidambaran V, Olbrecht V, Hossain M, et al. Risk predictors of opioid-induced critical respiratory events in children: naloxone use as a quality measure of opioid safety. Pain Med. 2014;15:2139–2149. PMID: 25319840.
- Voepel-Lewis T, Marinkovic A, Kostrzewa A, et al. The prevalence of and risk factors for adverse events in children receiving patient-controlled analgesia by proxy or patient-controlled analgesia after surgery. Anesth Analg. 2008; 107:70–75. PMID: 18635469.
- Monitto CL, George JA, Yaster M: Pediatric acute pain management. In: Davis PJ, Cladis FP (eds). Smith’s anesthesia for infants and children. 10th edition. Elsevier, Philadelphia, PA, 481–518, 2022.
- Chung F, Liao P, Elsaid H, et al. Factors associated with postoperative exacerbation of sleep-disordered breathing. Anesthesiology. 2014;120:299–311. PMID: 24158050.
- Brown KA, Laferriere A, Moss IR. Recurrent hypoxemia in young children with obstructive sleep apnea is associated with reduced opioid requirement for analgesia. Anesthesiology. 2004;100:806–810. PMID: 15087614.
- Marcus CL, Brooks LJ, Draper KA, et al. Diagnosis and management of childhood obstructive sleep apnea syndrome. Pediatrics. 2012;130:576–584. PMID: 22926173.
- Coté CJ, Posner KL, Domino KB. Death or neurologic injury after tonsillectomy in children with a focus on obstructive sleep apnea: Houston, we have a problem! Anesth Analg. 2014;118:1276–1283. PMID: 23842193.
- Mortensen A, Lenz K, Abildstrom H, Lauritsen TL. Anesthetizing the obese child. Paediatr Anaesth. 2011;21:623–629. PMID: 21429056.
- Nelson KL, Yaster M, Kost-Byerly S, Monitto CL. A national survey of American pediatric anesthesiologists: patient-controlled analgesia and other intravenous opioid therapies in pediatric acute pain management. Anesth Analg. 2010;110:754–760. PMID: 20185654.
- Quinlan-Colwell A, Thear G, Miller-Baldwin E, Smith A. Use of the Pasero Opioid-induced Sedation Scale (POSS) in pediatric patients. J Pediatr Nurs. 2017;33:83–87. PMID: 28209260.
- Berkenbosch JW, Tobias JD. Transcutaneous carbon dioxide monitoring during high-frequency oscillatory ventilation in infants and children. Crit Care Med. 2002;30:1024–1027. PMID: 12006797.
- Miller KM, Kim AY, Yaster M, et al. Long-term tolerability of capnography and respiratory inductance plethysmography for respiratory monitoring in pediatric patients treated with patient-controlled analgesia. Paediatr Anaesth. 2015; 25:1054–1059. PMID: 26040512.
- Atkinson DB, Sens BA, Bernier RS, et al. The evaluation of a noninvasive respiratory volume monitor in mechanically ventilated neonates and infants. Anesth Analg. 2022; 134:141–148. PMID: 33929346.
- Gatti S, Rezoagli E, Madotto F, et al. A non-invasive continuous and real-time volumetric monitoring in spontaneous breathing subjects based on bioimpedance-ExSpiron®Xi: a validation study in healthy volunteers. J Clin Monit Comput. 2024;38:539–551. PMID: 38238635.


 Issue PDF
Issue PDF