Dernière mise à jour : 24 avril 2020

Contributeurs : Jeffrey Feldman, MD, Professeur d’anesthésie et Président du Comité sur la technologie de l’APSF ; Robert « Butch » Loeb, MD, Professeur d’anesthésie de l’université FL ; James Philip, MD, Professeur d’anesthésie Brigham & Women’s

Informations sur les fabricants et les caractéristiques des filtres viraux pour circuits respiratoires
Clause de non-responsabilité : nous avons pour objectif de présenter nos recommandations et un forum destiné à poser des questions. Étant donnée la nouveauté du COVID-19, les meilleures preuves cliniques disponibles sont appuyées par des rapports anecdotiques provenant de Chine, de Corée du Sud, d’Italie et d’épidémies précédentes, telles que le SARS et le MERS. L’APSF ne soutient et ne se porte garant d’aucun produit, équipement ou technique déposé en particulier. Nous recommandons fortement le respect des directives de vos organes directeurs et de vos organismes, tels que les CDC, l’OMS, l’ASA, l’AANA et l’AAAA. Ces directives se fondent sur l’avis de cliniciens expérimentés en matière d’utilisation d’appareils d’anesthésie de courte durée dans les blocs opératoires. Elles sont régulièrement mises à jour, en se basant sur l’expérience des utilisateurs des appareils d’anesthésie de longue durée destinés à la ventilation en soins intensifs. Les données et les documents inclus ne sont fournis qu’à des fins informatives et éducatives et ne doivent être interprétés ni comme un avis médical ou légal ni comme une norme des soins. Les lecteurs sont invités à se renseigner auprès de leurs établissements et de leurs conseillers en matière médicale ou juridique.
La FAQ suivante et les informations qu’elle contient sont destinées à fournir les meilleurs conseils possibles pour des pratiques sûres pendant la pandémie de COVID-19. Les conditions locales dicteront sans aucun doute certaines modifications. Il faut espérer que les informations seront suffisantes pour doter les soignants des outils nécessaires afin de prendre les bonnes décisions et assurer leur propre sécurité, ainsi que celle de leurs patients et de leurs collègues.
- Quelle est la meilleure stratégie pour protéger l’appareil d’anesthésie de la contamination par un patient potentiellement infecté ?
- Quel type de filtre de circuit respiratoire est susceptible de prévenir la transmission du virus SARS COV-2 du patient à l’appareil d’anesthésie ?
- Dois-je m’inquiéter de la transmission du virus SARS COV-2 de l’appareil d’anesthésie à un patient ?
- Le gaz prélevé doit-il être retourné au circuit respiratoire ou dirigé vers un système d’évacuation ?
- Dois-je remplacer le piège à eau du prélèvement de gaz après chaque patient ?
- Quelle est la méthode de nettoyage appropriée de l’appareil d’anesthésie entre patients qui ne sont pas des cas confirmés de COVID-19 ou qui font l’objet d’investigations (PUI) ?
- Quelle est la méthode de nettoyage appropriée de l’appareil d’anesthésie entre patients qui ont été testés positifs au COVID-19 ou qui font l’objet d’investigations (PUI) ?
- Quelle est la méthode de stérilisation des parties internes de l’appareil ?
- Un appareil d’anesthésie peut-il être utilisé comme ventilateur de soins intensifs ?
- Quelles sont les recommandations pour le transport des patients intubés vers et depuis le bloc opératoire ?
- Comment le tube endotrachéal peut-il être débranché en toute sécurité du circuit respiratoire de l’appareil d’anesthésie pour le transport, l’aspiration ou l’administration de médicaments par nébuliseur ?
- Nous allons manquer de lames de laryngoscope/GlidescopeTM. Comment pouvons-nous les nettoyer et les stériliser ?
Quelle est la meilleure stratégie pour protéger l’appareil d’anesthésie de la contamination par un patient potentiellement infecté ?
Réponse brève :
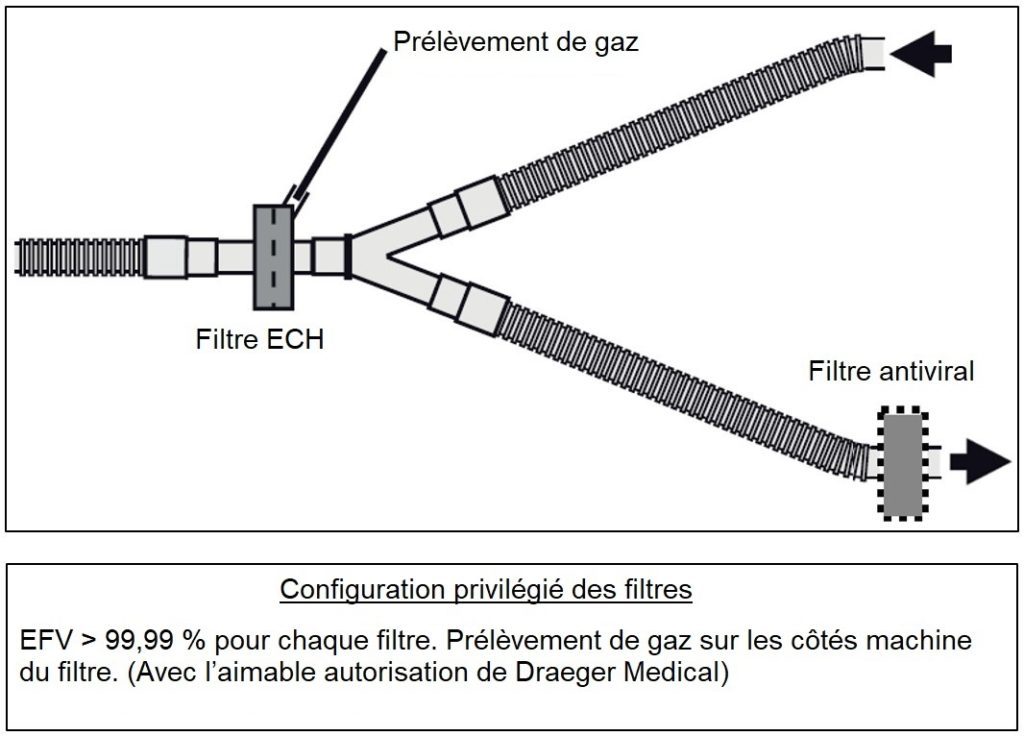
- Placer un filtre viral « haute efficacité » entre le circuit respiratoire et la sonde d’intubation du patient avec la capacité de prélever le gaz sur le côté machine du filtre.
- Un filtre ECH est préférable pour préserver l’humidification.
- Si un filtre est utilisé seul, la réduction du débit de gaz frais est une stratégie importante pour préserver l’humidité. (1-2 L/min ou moins)
- Placer un deuxième filtre à l’extrémité de la branche expiratoire, au branchement sur l’appareil d’anesthésie.
- Les conditions locales en matière de disponibilité des filtres détermineront les dispositifs à employer. Des alternatives sont proposées ci-après.
- Les circuits respiratoires doivent être mis au rebut après chaque patient.
(Voir la prochaine FAQ pour des détails sur les dispositifs de filtration à utiliser et les facteurs à prendre en compte pour les patients pédiatriques)
Il y a deux raisons pour lesquelles il faut protéger l’appareil d’anesthésie de la contamination par un patient potentiellement infecté. Premièrement, si les pathogènes sont autorisés à pénétrer dans les parties internes de l’appareil, ils pourraient être transmis à un autre patient. Deuxièmement, les gaz respiratoires prélevés pour analyse peuvent transmettre des pathogènes à d’autres patients ou au personnel soignant après leur sortie de l’analyseur de gaz en cas d’erreur de manipulation.
La bonne nouvelle, c’est que les mêmes précautions peuvent être appliquées à tous les patients. La stratégie ne varie pas en fonction du risque d’infection du patient. Un filtre « haute efficacité » placé entre le circuit respiratoire et la sonde d’intubation du patient protège l’appareil de la contamination et aussi les gaz prélevés pour analyse. Les filtres échangeurs de chaleur et d’humidité (filtres ECH) sont un bon choix, car ils préservent l’humidité des voies aériennes et sont conçus de manière à filtre le gaz prélevé avant son entrée dans l’analyseur de gaz (remarque : les ECH sans filtre ne fournissent aucune protection de l’appareil d’anesthésie, ni de l’analyseur de gaz). Il est possible d’utiliser, uniquement la sonde d’intubation, un filtre qui n’est pas aussi un échangeur de chaleur et d’humidité, toutefois les stratégies telles que l’anesthésie à faible débit doit être utilisée pour préserver l’humidité. Si un filtre seul est utilisé à la sonde d’intubation, il est souhaitable que le débit de gaz frais soit plus faible (1-2 L/min ou moins) pendant le maintien de l’anesthésie pour préserver l’humidité dans le circuit.
Bien qu’un filtre haute efficacité placé à la sonde d’intubation protège à la fois le gaz prélevé et l’appareil d’anesthésie, il existe des raisons d’envisager l’ajout d’un second filtre à l’extrémité de la branche expiratoire. Le filtre placé à la sonde d’intubation se salit et perd en efficacité et chez les patients pédiatriques, les filtres placés à la sonde d’intubation sont conçus pour réduire l’espace mort et ils sont donc généralement moins efficaces. Le second filtre est non seulement une protection supplémentaire raisonnable de la machine contre des particules qui traverseraient le premier filtre, mais il amplifie aussi considérablement l’efficacité du premier filtre.
Que puis-je faire si l’option à deux filtres n’est pas possible en raison d’un stock limité ?
- Puis-je changer les filtres moins souvent ?
La fréquence de changement des filtres dépendra du type de filtre et de son usage clinique. Les filtres montés à la sonde d’intubation sont susceptibles de faire l’objet d’une occlusion progressive par les sécrétions et il faudra éventuellement les changer si la résistance au débit et aux pressions des voies aériennes devient trop grande. Il est moins probable que les filtres à la branche expiratoire nécessitent un remplacement en raison d’une occlusion. En règle générale, les fabricants ont recommandé des intervalles de temps maximums entre les changements de filtre. Il convient de respecter ces recommandations sauf si des pénuries rendent le remplacement difficile ou impossible, auquel cas la poursuite de l’utilisation du filtre vaut mieux que rien. Tant que le filtre n’est pas souillé, l’efficacité de filtration virale devrait être maintenue.- Le filtre monté à la sonde d’intubation devra être changé entre chaque patient. Le côté patient du filtre contient les particules expirées par le patient, y compris si le virus est présent.
- Le filtre de la branche expiratoire semble être une option pour garder le filtre à sa place entre les patients si l’alimentation du filtre est restreinte en raison du flux directionnel du gaz depuis le patient. La durée d’utilisation possible du filtre avant le déclin de ses performances n’est pas connue. Il est prudent de changer le filtre aussi souvent que le permettent les stocks disponibles, conformément aux recommandations du fabricant. La surface externe doit être essuyée entre chaque patient.
- La réutilisation des tubes du circuit respiratoire est potentiellement plus problématique parce que le tube inspiratoire distal peut être contaminé malgré le flux unidirectionnel et la surface externe du circuit est difficile à nettoyer de manière fiable.
- Il peut s’avérer nécessaire d’utiliser un seul filtre. Malheureusement, nous ne possédons aucun donnée quantitative minimale de l’efficacité de filtration qui sera protectrice (voir FAQ suivante). Une solution unique pourrait être que le filtre monté à la sonde d’intubation pourrait être suffisant s’il s’agit d’un filtre haute efficacité. Un seul filtre à l’extrémité de la branche expiratoire protègera l’appareil d’anesthésie mais pas le gaz prélevé, ce qui peut ne pas être un problème si le gaz prélevé ne retourne pas au circuit respiratoire.
Est-ce que je dois filtrer les gaz prélevés pour analyse ?
Cela dépend de la conception de l’appareil d’anesthésie. La plupart des appareils acheminent le gaz jusqu’au système de récupération alors que d’autres l’acheminent jusqu’au circuit respiratoire.
Si les gaz prélevés finissent dans le système d’évacuation, il n’est pas nécessaire de filtrer. Si vous utilisez un analyseur de gaz qui n’est pas intégré à l’appareil d’anesthésie, il est facile de suivre le gaz expulsé et il doit être acheminé vers un système d’évacuation actif (pas passif), et pas dans la pièce. Pour les analyseurs de gaz intégrés, les connecteurs sont généralement dissimulés. Le tableau suivant indique la destination de la sortie de l’analyseur de gaz intégré par le fabricant :
GE : Aisys CS2 équipé de la version logicielle 11 est le seul appareil que nous équipons en usine du retour du gaz de prélèvement à l’appareil respiratoire. Toutes ces machines peuvent être remontées sur le terrain pour réacheminer le gaz de prélèvement au système d’évacuation. Il faudrait faire appel à du personnel formé pour retirer le carter et procéder à la modification.
| Modèle d’anesthésie GE | Mesure des gaz intégrée ou modulaire | Gaz de prélèvement acheminé vers | Le retour du gaz prélevé peut-il être modifié par le client ? |
| Aestiva | Non | RAS | RAS |
| Aespire | Non | RAS | RAS |
| Avance | Oui | Système d’évacuation | Technicien de terrain |
| Aisys | Oui | Système d’évacuation | Technicien de terrain |
| Carestation 600 | Oui | Système d’évacuation | Technicien de terrain |
| Avance CS2 | Oui | Système d’évacuation | Technicien de terrain |
| Aisys CS2 | Oui | Système d’évacuation | Technicien de terrain |
| Aisys CS2 équipé de la version logicielle 11 (Remarque) | Oui | Circuit patient | Technicien de terrain |
Draeger
| Appareils d’anesthésie dotés d’un analyseur de gaz intégré | Destination de la sortie de l’analyseur de gaz |
| Apollo | Retour au circuit respiratoire |
| Perseus | Retour au circuit respiratoire |
| Fabius/Tiro/Fabius MRI – analyse de gaz non intégrée | Système d’évacuation |
- Si les gaz prélevés sont retournés au circuit respiratoire, il faut les filtrer. Les pièges à eau sont dotés d’un filtre et l’efficacité de filtration virale (EFV) détermine leur efficacité. Les pièges à eau GE Dfend Pro sont équipés d’un filtre 0,2 micron avec une EFV de 99,999 %. Draeger utilise un filtre de 0,2 micron dans le piège à eau mais l’EFV reste à déterminer. S’il est impossible de disposer de l’option d’un filtre à la sonde d’intubation et de confirmer l’EFV du piège à eau, il est possible de placer un filtre d’injection de 0,2 micron, semblable à celui utilisé dans les kits épiduraux, au piège à eau et de l’utiliser entre les patients après en avoir essuyé la surface.
- Si le gaz prélevé est acheminé jusqu’au système d’évacuation, une filtration supplémentaire ne sera peut-être pas nécessaire, grâce aux normes de gestion des risques biologiques dans le système d’aspiration central ou le système d’évacuation des gaz anesthésiques (WAG). Consulter le responsable des installations pour confirmer les risques biologiques dans le système d’aspiration.
- Il ne faut pas évacuer les gaz prélevés non filtrés directement dans l’environnement du bloc opératoire ou dans un système d’évacuation passive.
Est-ce que j’ai besoin d’un filtre sur la branche inspiratoire ?
L’ajout d’un filtre entre la machine et la branche inspiratoire se fait parfois mais n’est pas nécessaire pour protéger le patient si la machine reste propre. Le filtre monté à la sonde d’intubation et/ou les filtres de la branche inspiratoire ont déjà cette fonction. La raison principale pour ajouter un filtre sur la branche inspiratoire est l’élimination de la probabilité d’erreur en plaçant une seule branche filtrée sur le port inspiratoire plutôt que sur le port expiratoire. En cas de crainte de contamination des parties internes de l’appareil, il est important de poser un filtre haute efficacité sur la branche inspiratoire.
Si les stocks de filtres sont limités, quelle est l’approche la plus conservatrice pour la réutilisation des fournitures ?
Le protocole suivant du Dr Jan Hendrickx, OLV Hospital, Aalst Belgique explique combien de composants du circuit peuvent être réutilisés après avoir soigné des patients à faible risque.
- Protecting the Anesthesia station – A strategy for reusing supplies [PDF]
- ARC Medical – Circuit conçu pour être réutilisé avec les patients qui ne sont PAS positifs au COVID-19 ou PUI (https://www.arcmedical.com/products/circuitguardtrade.php)
Quel type de filtre de circuit respiratoire est susceptible de prévenir la transmission du virus SARS COV-2 du patient à l’appareil d’anesthésie ?
Réponse brève :
- L’efficacité minimale de filtration virale (EFV) nécessaire pour garantir que le virus SARS COV-2 n’est pas transmis du patient à l’appareil d’anesthésie est inconnue.
- Les filtres mécaniques (plissés) donnent de meilleurs résultats que les filtres électrostatiques et sont moins affectés par la vapeur d’eau.
- En règle générale, les deux types de filtres et les filtres ECH procurent un taux d’EFV de 99,99 % et devraient donc fournir une bonne protection.
- Le volume respiratoire minimum nominal du dispositif placé à la sonde d’intubation doit être pris en compte pour réduire au minimum l’impact de l’espace mort sur la ventilation. La règle de base consiste à multiplier par trois le volume interne du dispositif pour obtenir le volume respiratoire minimum.
Il n’existe aucune donnée relative à des tests d’efficacité des filtres pour circuit respiratoire permettant d’éviter la transmission du SARS COV-2 aux soignants ou aux patients. Tous les filtres pour circuit respiratoire réduisent la transmission virale, toutefois nous ne connaissons pas les caractéristiques minimales en termes de performances qui seront protectives. Les informations présentées ici s’appuient sur les meilleurs documents de référence actuellement disponibles. Les filtres plissés (mécaniques) sont préférables aux filtres électrostatiques, car ces derniers peuvent perdre en efficacité avec l’humidité. Les ECH et filtres électrostatiques sont couramment utilisés et peuvent être « suffisamment efficaces », toutefois ils ne sont pas recommandés par certaines sources dans le cadre d’un système circulaire ou avec une humidification active. Les filtres mécaniques sont plus grands et offrent moins de résistance à la respiration, toutefois l’espace mort augmente, ce qui peut être un problème pour les patients pédiatriques.* Il n’existe aucun filtre mécanique dont le volume respiratoire minimum recommandé est inférieur à 150 ml.
Les performances des filtres conçus pour protéger des virus sont mesurées à partir de l’efficacité de filtration virale ou EFV et sont signalées pour tous les filtres commerciaux. L’EFV est déterminée à l’aide de tests normalisés conformément à la norme ASTM F2101. La taille des particules testée est de l’ordre de 3 microns, acceptée comme étant proche d’une particule virale suspendue dans une gouttelette. Une EFV de 99,99 % signifie qu’une seule particule sur 10 000 (104) traversera le filtre dans des conditions d’essai standard d’évaluation du débit. Le débit généralement utilisé dans le cadre des conditions d’essais pour des adultes est de 30 L/minute. Un débit plus grand réduit l’EFV.
L’EVV nécessaire pour garantir que les particules virales ne sont pas transmises d’un patient infecté à l’appareil d’anesthésie n’est pas connue. L’association de filtres en série augmente considérablement l’EFV et est une autre raison convaincante de l’utilisation de deux filtres décrite ci-dessus. Si chaque filtre est capable de filtrer toutes les particules sauf 1 sur 104 (EFV=99,99 %), l’efficacité des filtres associés est donc de 1 sur 108. Les filtres haute efficacité qui ont une EFV de 99,99 % ou plus sont faciles à obtenir.
L’APSF ne fait pas la promotion d’un produit ou d’un fabricant en particulier. Pour information, les sources suivantes fournissent des filtres qui remplissent les critères susmentionnés. D’autres fournisseurs seront ajoutés au fur et à mesure que les informations seront connues.
- Tableur récapitulatif des options de filtres – Liste non exhaustive : Cliquer ici.
EXEMPLES DE FABRICANTS DE FILTRES
- Arc Medical : https://www.arcmedical.com/products/circuitguardtrade.php
- Draeger Medical : Guide des filtres respiratoires/ECH [PDF]
- MEDLINE : https://www.medline.com/category/HMEs-and-Filters/Z05-CA05_11_01
- Medtronic :
- PALL : https://medical.pall.com/en/mechanical-ventilation/coronavirus.html
- Pall Ultipor 25
- Pall Ultipor 100
- TELEFLEX : https://www.apsf.org/wp-content/uploads/patient-safety-resources/covid-19/TELEFLEX-Gibeck-Filters.pdf
- Westmed : https://westmedinc.com/hmes-and-filters/
*REMARQUE CONCERNANT LES PATIENTS PÉDIATRIQUES :
En règle générale, les filtres utilisés pour les patients pédiatriques sont les ECH qui réduisent l’espace mort et fournissent humidification et filtration. Ce sont tous des filtres électrostatiques dont le taux d’EFV n’est pas aussi satisfaisant que les filtres mécaniques (plissés) plus grands. D’autre part, l’EFV est dégradée par l’humidité. L’utilisation d’un ECH est souhaitable pour maintenir l’humidification, toutefois, le degré d’augmentation du risque de transmission virale causée par la baisse d’EFV n’est pas connu. En particulier, le gaz prélevé depuis l’ECH peut ou pas être protégé de la transmission virale à l’équipement et il est possible qu’il soit nécessaire de le filtrer séparément s’il est retourné au circuit respiratoire. L’appareil d’anesthésie doit être protégé en plaçant un filtre viral mécanique haute efficacité entre l’extrémité de la branche expiratoire et l’appareil. Le taux minimum de ce filtre viral en l’absence d’un filtre fiable à la sonde d’intubation est inconnu, mais les filtres de qualité avec un taux d’EFV de 99,999 % et plus sont disponibles et devraient être utilisés dans la mesure du possible. L’installation du filtre à l’extrémité de la branche expiratoire n’a aucune incidence sur l’espace mort.
Recommandation pour les patients pédiatriques pour lesquels l’espace mort imposé par un filtre à la sonde d’intubation est source d’inquiétudes.
- Utiliser un ECH procurant un espace mort acceptable aux voies aériennes pour assurer l’humidification. En règle générale, l’espace mort avec les dispositifs disponibles est de 10 ml et le volume respiratoire minimum est de 30 ml (patient de 5 kg).
- Placer un filtre viral à l’extrémité de la branche expiratoire avec une EFV de 99,999 % ou plus. Changer aussi souvent que possible en fonction des stocks et essuyer la surface s’il n’est pas changé entre les patients.
- Si l’EFV du filtre dans le piège à eau est confirmée comme étant efficace, les gaz prélevés des voies aériennes n’ont pas besoin d’une filtration supplémentaire (voir ci-dessus). Sinon, placer un filtre à injection de 0,2 micron à l’entrée du piège à eau pour bénéficier d’une mesure de protection supplémentaire. Il s’agit du même type de filtres que ceux qui sont utilisés dans un kit épidural pour la filtration des injections épidurales. Le filtre d’injection doit être changé entre les patients.
Documents de référence :
- Wilkes, A. R. (2002). Measuring the filtration performance of breathing system filters using sodium chloride particles. Anaesthesia, 57(2), 162–168.
- Wilkes, A. R. (2010). Heat and moisture exchangers and breathing system filters: their use in anaesthesia and intensive care. Part 1 – history, principles and efficiency. Anaesthesia, 66(1), 31–39.
- Wilkes, A. R. (2010). Heat and moisture exchangers and breathing system filters: their use in anaesthesia and intensive care. Part 2 – practical use, including problems, and their use with paediatric patients. Anaesthesia, 66(1), 40–51.
- Fehr, A. R., & Perlman, S. (2015). Coronaviruses: An Overview of Their Replication and Pathogenesis. In Coronaviruses(Vol. 1282, pp. 1–23). New York, NY: Springer New York.
- Sprung, C. L., Zimmerman, J. L., Christian, M. D., Joynt, G. M., Hick, J. L., Taylor, B., et al. (2010). Recommandations pour les préparatifs des services de réanimation et des hôpitaux dans le cadre d’une épidémie de grippe ou d’une catastrophe de grande ampleur : rapport de synthèse du groupe de travail de la European Society of Intensive Care Medicine pour le triage dans un service de réanimation dans le cadre d’une épidémie de grippe ou d’une catastrophe de grande ampleur. Intensive Care Medicine, 36(3), 428–443.
Dois-je m’inquiéter de la transmission du virus SARS COV-2 de l’appareil d’anesthésie à un patient ?
Réponse brève : À condition que l’appareil soit protégé à chaque utilisation au moyen de filtres haute efficacité, comme indiqué dans les FAQ précédentes, le risque pour les patients suivants est inexistant.
Aucun des fabricant ne recommande de procédures de nettoyage des parties internes de l’appareil, à condition d’utiliser des filtres haute efficacité pour chaque patient, avec d’éviter que le virus exhalé ne pénètre dans l’appareil, et que les tubes de prélèvement des gaz soient connectés du côté machine du filtre.
L’expérience clinique ne suggère pas que la transmission de pathogènes de l’appareil au patient soit un risque élevé. L’APSF a déjà fourni des conseils sur ce thème par le passé. (1,2) Les pathogènes doivent passer à travers l’environnement caustique de l’absorbant de CO2, survivre à la faible humidité de gaz frais qui pénètre dans le circuit et traverser les circuits du côté inspiratoire du ventilateur et du circuit respiratoire. Cela dit, une étude indique que les pathogènes bactériens sont capables de traverser l’espace entre les granules absorbants. (3) D’autre part, personne ne pourrait envisager en toute tranquillité de brancher une machine contaminée par un pathogène à un autre patient sans nettoyage adapté. Les fabricants sont la meilleure source d’information en ce qui concerne les procédures de nettoyage d’appareils spécifiques. (Pour des informations complémentaires de nettoyage des appareils, consulter le site suivant : https://www.asahq.org/-/media/files/spotlight/anesthesia-machines-as-icu-ventilators413.pdf?la=en&hash=0A7251BF688103326957E48A504B42E27D8E9701)
En l’absence de données, les recommandations des fabricants pour le nettoyage peuvent être excessivement restrictives en raison des préoccupations médico-légales. L’insertion d’un filtre haute efficacité sur la branche inspiratoire, qui peut être réutilisé entre les patients, est une solution viable qui permet de remettre rapidement une machine en service après avoir suivi les procédures de stérilisation.
Documents de référence :
- Discussion de 2009 de l’APSF à ce sujet : https://www.apsf.org/article/cross-contamination-via-anesthesia-equipment/
- Discussion de 2009 de l’APSF sur la contamination des gaz de prélèvement : https://www.apsf.org/article/cross-contamination-via-gas-sampling-lines/
- Dryden, G. E. (1969). Risk of contamination from the anesthesia circle absorber: an evaluation. Anesthesia & Analgesia, 48(6), 939–943.
Le gaz prélevé doit-il être retourné au circuit respiratoire ou dirigé vers un système d’évacuation ?
Réponse brève :
- Le gaz prélevé du côté machine d’un filtre ECH n’est pas contaminé et peut être retourné au circuit respiratoire ou au système d’évacuation.
- Le gaz prélevé sans le bénéfice d’un filtre fiable peut être contaminé. Il ne doit pas être retourné au circuit respiratoire mais au système d’évacuation. Les procédures locales de gestion de la charge bactérienne dans l’aspiration centrale doivent être confirmées. Les normes actuelles de l’aspiration de qualité médicale tiennent compte des risques infectieux.
- Un filtre d’injection de 0,2 micron (par ex. du type épidural) peut être placé au branchement sur le piège à eau mais il doit être changé entre les patients. La capnographie est possible mais la qualité du capnogramme peut être affectée et doit être confirmée avant une utilisation clinique.
Les gaz inspirés et expirés doivent faire l’objet de prélèvements réguliers pendant l’anesthésie afin de mesurer les concentrations. Les filtres et ECH haute efficacité couramment disponibles sont dotés d’un port pour le prélèvement des gaz sur le côté machine (protégé) du filtre. Le gaz peut ensuite traverser l’analyseur de gaz pour aller vers le circuit respiratoire ou le système d’évacuation, sans aucun risque de contamination. Le retour vers le circuit respiratoire présente l’avantage de réduire le gaspillage.
Si la ligne de prélèvement de gaz est connectée à un coude ou filtrée autrement, par exemple pour obtenir un meilleur capnogramme, les gaz potentiellement contaminés pénètrent dans l’analyseur de gaz, généralement à travers un piège à eau. Le piège à eau est doté d’un filtre et certains d’entre eux peuvent être très efficaces pour bloquer les virus. Les pièges à eau GE Dfend Pro sont équipés d’un filtre 0,2 micron avec une EFV de 99,999 %. Draeger utilise un filtre de 0,2 micron dans le piège à eau mais l’EFV reste à déterminer. Si le gaz prélevé contourne le filtre ECH, il est recommandé de ne pas le retourner au système respiratoire sauf s’il est possible de confirmer l’EFV du filtre du piège à eau ou si le gaz est retourné à un système d’évacuation conçu pour gérer la charge bactérienne en toute sécurité. Un filtre d’injection de 0,2 micron (par ex. du type épidural) peut être placé au branchement sur le piège à eau et il peut apporter une certaine protection supplémentaire, mais il doit être changé entre les patients. La capnographie est possible avec un filtre à injection, mais la qualité du capnogramme peut être affectée.
Documents de référence :
- Conseils de 2009 de l’APSF à ce sujet : https://www.apsf.org/article/cross-contamination-via-gas-sampling-lines/
Dois-je remplacer le piège à eau du prélèvement de gaz après chaque patient ?
Réponse brève : Oui, s’il est utilisé avec un patient positif au COVID-19 ou un patient potentiellement infecté. Non, si le gaz prélevé a traversé un filtre viral haute efficacité.
Le piège à eau permet un flux de gaz continu du patient à l’appareil. Si ce gaz a été filtré au moyen d’un filtre viral haute efficacité, le piège à eau n’est pas contaminé et il n’est pas nécessaire de le changer. Il est recommandé de changer le tube de prélèvement du gaz et d’essuyer la surface externe du piège à eau entre les patients.
Si le piège à eau est utilisé avec un patient positif au COVID-19 ou un patient potentiellement infecté, il faut le changer.
Bien entendu, les pièges à eau doivent être changés en respectant le calendrier recommandé.
Quelle est la méthode de nettoyage appropriée de l’appareil d’anesthésie entre patients qui ne sont pas des cas confirmés de COVID-19 ou qui font l’objet d’investigations (PUI) ?
Réponse brève : Les procédures de nettoyage sont identiques à celles utilisées pour tous les patients qui ne sont pas des cas confirmés de COVID-19 ou PUI. Selon la prépondérance locale de la maladie ou les ressources en matière de dépistage, tous les patients doivent être traités comme étant positifs au COVID-19. Il faut utiliser des filtres viraux haute efficacité pour protéger la machine. Entre les patients, jeter les éléments jetables : circuit respiratoire, sac-réservoir, masque du patient, tube de prélèvement de gaz, filtres placés à la sonde d’intubation et ailleurs si les stocks sont suffisants. Essuyer toutes les surfaces exposées. Les recommandations de nettoyage du fabricant de chaque appareil sont utiles.
Il faudra décider au plan local s’il est possible de faire subir un test de dépistage fiable aux patients avant une procédure afin d’éliminer la possibilité qu’ils soient positifs au COVID-19. Certains établissements utilisent les résultats de tests négatifs pour orienter l’utilisation des précautions standard et préserver le stock d’EPI pour les patients connus dont le statut COVID est inconnu. Comme indiqué précédemment, un filtre viral haute efficacité permet de protéger de la contamination les parties internes de l’appareil d’anesthésie. Les éléments à usage unique doivent être mis au rebut et ne doivent pas être réutilisés. Si les tests de dépistage ne peuvent pas être réalisés ou si les normes locales incluent le traitement de tous les patients comme s’ils avaient été testés positifs au COVID-19, voir la FAQ suivante relative au nettoyage après les patients testés positifs au COVID-19. En règle générale, la pratique de l’utilisation d’un ECH et la réutilisation du circuit respiratoire d’un patient à un autre n’est pas souhaitable, en partie parce que la décontamination des surfaces externes du circuit est virtuellement impossible. En Europe, certains praticiens réutilisent les circuits en changeant simplement le filtre de la sonde d’intubation après un usage sur des patients à faible risque d’une infection au COVID-19. En règle générale, les fabricants donnent des recommandations de nettoyage sûr et efficace à effectuer entre les patients. Les pratiques habituelles de nettoyage des surfaces sont acceptables.
Quelle est la méthode de nettoyage appropriée de l’appareil d’anesthésie entre patients qui ont été testés positifs au COVID-19 ou qui font l’objet d’investigations (PUI) ?
Réponse brève : Pour des conseils spécifiques à ce sujet, consulter le site suivant : https://www.asahq.org/-/media/files/spotlight/anesthesia-machines-as-icu-ventilators413.pdf?la=en&hash=0A7251BF688103326957E48A504B42E27D8E9701.
Les recommandations pour l’utilisation de filtres viraux haute efficacité sont destinées à éliminer le risque de contamination interne de l’appareil d’anesthésie, afin que le recours à une procédure de nettoyage spéciale ne soit pas nécessaire. Bien qu’il soit peu probable que la machine soit contaminée et puisse infecter un patient suivant, il n’existe aucune donnée objective indiquant que les pratiques recommandées peuvent absolument prévenir l’infection croisée des patients. D’autre part, si la machine est utilisée à long terme pour la ventilation en soins intensifs d’un patient testé positif au COVID-19, il est raisonnable de présumer que le risque de contamination interne de la machine est accru. En cas de soupçon de contamination interne de la machine, il faut suivre les recommandations de nettoyage et de stérilisation du fabricant. Cette procédure peut être chronophage et lourde en termes de main d’œuvre, l’appareil restant hors service pendant plus longtemps qu’on ne le souhaiterait.
Les recommandations des fabricants peuvent être trop restrictives en raison des préoccupations médico-légales. Par exemple, Draeger et Mindray recommandent la mise en quarantaine de l’appareil pendant 21 à 28 jours avant de le réutiliser. Il n’existe aucune donnée pour étayer cette recommandation ou une modification de celle-ci. Heureusement, de nombreux appareils sont conçus de sorte à permettre la stérilisation des éléments internes. Il est préférable d’utiliser des appareils présentant cette possibilité, en particulier avec des patients testés positifs au COVID-19 et PUI. Il est aussi possible d’envisager la stérilisation des éléments internes conformément aux procédures des fabricants, puis d’installer un filtre viral haute efficacité sur la branche inspiratoire. Voir https://www.asahq.org/-/media/files/spotlight/anesthesia-machines-as-icu-ventilators413.pdf?la=en&hash=0A7251BF688103326957E48A504B42E27D8E9701 pour plus d’informations.
Quelle est la méthode de stérilisation des parties internes de l’appareil ?
Réponse brève : Suivre les recommandations du fabricant.
Tous les fabricants fournissent des informations de référence et une assistance client pour répondre aux questions relatives aux procédures de nettoyage pour des appareils spécifiques.
Documents de référence :
- GE HEALTHCARE : assistance téléphonique 24 h/24 et 7 j/7 au 800 345 2700
- DRAEGER Medical : 1 800 437 2437
- MINDRAY : 800.288.2121 ou 877.913.9663
- GETINGE
Un appareil d’anesthésie peut-il être utilisé comme ventilateur de soins intensifs ?
L’APSF et l’ASA ont collaboré dans le cadre des recommandations sur l’utilisation des appareils d’anesthésie comme ventilateurs en soins intensifs. Cliquer ici : https://www.asahq.org/ventilators
Réponse brève : En règle générale, les appareils d’anesthésie sont des ventilateurs extrêmement efficaces, qui devraient répondre aux besoins de la grande majorité des patients souffrant de maladies pulmonaires qui nécessitent une assistance respiratoire mécanique. Les anesthésistes devraient apporter leurs conseils et leur soutien afin de s’assurer que des anesthésiques ne sont pas administrés par erreur et que les réglages des ventilateurs sont gérés correctement.
On s’attend à ce que les pénuries de ventilateurs de soins intensifs deviennent un problème si le nombre de personnes infectées présentant des défaillances respiratoires dépasse le nombre de ventilateurs disponibles. L’utilisation d’un appareil d’anesthésie comme ventilateur de soins intensifs est considérée comme un usage non indiqué, mais elle devrait en aucun doute être envisagée comme moyen d’intervention pour sauver des vies. Chaque établissement devra déterminer le meilleur moyen d’utiliser de manière logistique les appareils d’anesthésie pour une ventilation mécanique à long terme. Les procédures existantes relatives aux ventilateurs de soins intensifs au titre de l’humidification et du remplacement des filtres et des circuits respiratoires doivent être appliquées dans la mesure du possible. Les anesthésistes doivent être impliqués dans les procédures de modification et apporter leur assistance à la gestion de l’utilisation de l’appareil. Au moment de la rédaction du présent article, GE et Draeger ont publié des conseils supplémentaires à ce sujet. Veuillez les contacter directement pour obtenir ces conseils si vous devez utiliser vos appareils d’anesthésie comme ventilateurs de soins intensifs.
- Conseils de Mindray : Système d’anesthésie Série A de Mindray : recommandations d’utilisation comme ventilateur de réanimation
Quelles sont les recommandations pour le transport des patients intubés vers et depuis le bloc opératoire ?
Réponse brève : Conserver à tout instant un filtre ECH ou autre filtre haute efficacité à la sonde d’intubation. Clamper le tube endotrachéal à chaque déconnexion du filtre pour maintenir un circuit fermé. Les systèmes Mapleson D peuvent éliminer les craintes liées à l’espace mort imposé par le filtre, si le filtre est placé sur le côté appareil du flux de gaz frais.
Le transport du patient est un aspect courant dans la pratique de l’anesthésie et sera sans aucun doute nécessaire lorsque les patients positifs au COVID-19 devront subir une intervention urgente au bloc opératoire. Les établissements devront mettre en place des directives au plan local pour les itinéraires privilégiés et l’utilisation des EPI pour le patient et les soignants pendant le transport. Les patients intubés devront bénéficier d’une ventilation continue pendant le transport. Les ventilateurs de transport et les insufflateurs auto-gonflables devront être utilisés avec un filtre viral haute efficacité monté à la sonde d’intubation. En règle générale, les ventilateurs évacuent le gaz expiré dans l’environnement immédiat. Par conséquent, une protection supplémentaire devrait comprendre la pose d’un filtre viral haute efficacité à l’extrémité de la branche expiratoire.
Chez les patients pour lesquels l’espace mort imposé par le filtre est une préoccupation, un circuit de transport de type Mapleson D élimine les craintes liées à l’impact de l’espace mort supplémentaire SI le filtre est placé sur le côté appareil de l’admission de gaz frais et que le débit est réglé de sorte à dépasser une ventilation minime.
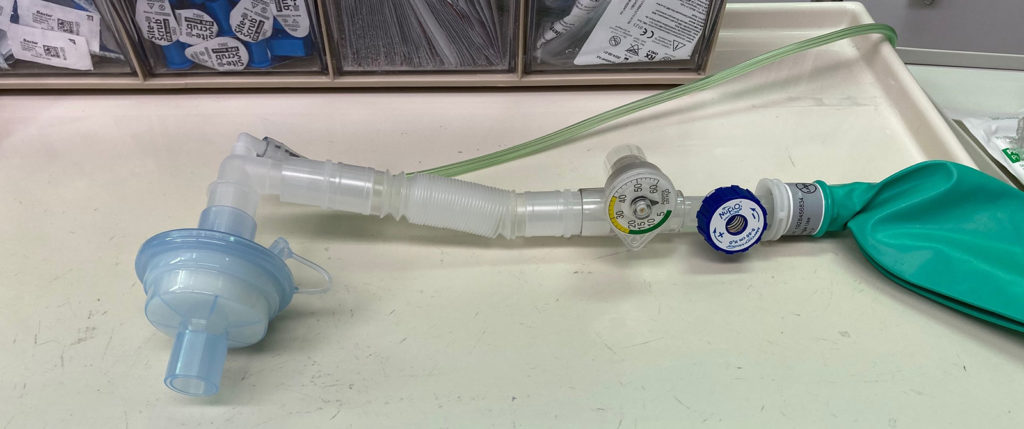
NON – un filtre ECH impose un espace mort supplémentaire lorsqu’il est posé du côté patient de l’admission de gaz frais.
Comment le tube endotrachéal peut-il être débranché en toute sécurité du circuit respiratoire de l’appareil d’anesthésie pour le transport, l’aspiration ou l’administration de médicaments par nébuliseur ?
Réponse brève : Avant le transport, laisser le filtre viral à sa place sur le tube endotrachéal et connecter le filtre à l’appareil de ventilation de transport. Utiliser des dispositifs d’aspiration et de nébulisation autonomes. Clamper le tube endotrachéal à chaque déconnexion du filtre pour maintenir un circuit fermé.
Une fois qu’un filtre viral « haute efficacité » est en place sur le tube endotrachéal, le circuit respiratoire peut être déconnecté du filtre pendant le déplacement d’un patient ou reconnecté à un autre appareil de ventilation. Le filtre est fiable pour empêcher que les virus exhalés par le patient contamine la salle.
L’aspiration du tube endotrachéal ou l’administration de médicaments nébulisés pose une autre problématique. Si l’aspiration est envisagée, un système d’aspiration en circuit fermé (comme ceux qui sont utilisés en soins intensifs) devra être placé entre le tube endotrachéal et le filtre dès l’insertion du tube endotrachéal. Les nébuliseurs autonomes devront être placés côté patient du filtre pour une administration efficace des médicaments. Si l’aspiration en circuit fermé n’est pas encore en place ou s’il faut un adaptateur de nébuliseur autonome, le ventilateur devra être mis en pause et le tube endotrachéal devra être clampé à chaque fois qu’il sera déconnecté du filtre ECH.
Nous allons manquer de lames de laryngoscope/GlidescopeTM. Comment pouvons-nous les nettoyer et les stériliser ?
Nous n’avons aucune recommandation sur le traitement des laryngoscopes individuels ou sur les procédures de désinfection avancée. À notre connaissance, aucun des quatre principaux fabricants américains de lames de vidéo-laryngoscopes jetables ne recommande le nettoyage ou la stérilisation de leurs produits jetables afin de pouvoir les réutiliser. Toutefois, un certain nombre de centres médicaux américains utilisent diverses techniques pour traiter et réutiliser ces lames. L’ASA et l’APSF recommandent l’utilisation de vidéo-laryngoscopes plutôt que des laryngoscopes classiques, afin que le visage des anesthésistes reste plus éloigné des voies aériennes/de la bouche des patients pendant la pandémie. Ces centres médicaux qui retraitent les lames de leurs vidéo-laryngoscopes jetables tentent de conserver les lames en anticipation des pénuries, en raison des stocks limités ou des problèmes d’approvisionnement.
Les exemples ci-dessous sont des techniques utilisées par les centres médicaux pour traiter les lames après usage. Ni l’ASA, ni l’APSF ne se porte garante d’une société ou d’une technique en particulier. Ces exemples sont fournis uniquement à titre indicatif.
- Certains centres médicaux emploient des techniques couramment utilisées pour nettoyer les endoscopes (par ex. http://www.medivators.com/products-and-services/endoscope-reprocessing). Ce type d’équipement peut être considéré comme un super lave-vaisselle médical. Plusieurs centres qui ont utilisé cette technique ont signalé qu’ils n’avaient pas constaté que leurs lames jetables étaient endommagées.
- Certains centres médicaux utilisent du peroxyde d’hydrogène vaporisé (par ex. https://www.steris.com/healthcare/knowledge-center/sterile-processing/hydrogen-peroxide-sterilization). Il s’agit d’un processus de stérilisation basse température. Plusieurs centres qui ont utilisé ce processus ont aussi signalé qu’ils n’avaient pas constaté que les lames jetables étaient endommagées.
- Certains centres médicaux utilisent le nettoyage manuel et des autoclaves (par ex. https://www.cdc.gov/infectioncontrol/guidelines/disinfection/sterilization/steam.html) et ont signalé n’avoir constaté aucun endommagement des lames jetables.
Pour préserver l’équipement de vidéo-laryngoscopie, ne pas oublier qu’il est possible d’utiliser des équipements courants sur des patients présentant des voies aériennes faciles au score de Mallampati 1 et 2. Quel que soit le choix, veuillez consulter les réglementations des CDC et de la FDA sur le site : https://www.cdc.gov/infectioncontrol/guidelines/disinfection/reuse-of-devices.html
Nous vous recommandons également de contacter le fabricant afin de demander ses conseils de nettoyage en cas de pénuries. Vous pouvez également consulter des recommandations récentes sur la prévention des infections dans l’espace dédié à l’anesthésie au sein du bloc opératoire de la Society for Healthcare Epidemiology of America (SHEA).